猬裂头蚴27kD半胱氨酸蛋白酶基因的克隆、表达及生物信息学分析
2017-03-16焦梦涵刘艳丹李金福
焦梦涵,刘艳丹,陈 艳,李金福
猬裂头蚴27kD半胱氨酸蛋白酶基因的克隆、表达及生物信息学分析
焦梦涵,刘艳丹,陈 艳,李金福
目的 克隆、表达猬裂头蚴27 kDa半胱氨酸蛋白酶(Cysteine protease ,CP)基因,并分析其生物学特性。方法 提取蛇源猬裂头蚴总RNA,逆转录合成cDNA,PCR扩增27kDa半胱氨酸蛋白酶(27kDa CP)基因,克隆入pMD-19T载体,测序正确后将27kDa-CP基因亚克隆入表达载体pET-28a(+),构建pET-28a(+)-27kDa-CP重组质粒,转入大肠埃希菌Transetta(DE3)中,经IPTG诱导,表达目的蛋白27kDa CP。用镍离子柱亲和层析法纯化目的蛋白。表达产物用SDS-PAGE及Western Blotting进行分析,并运用NCBI和ExPASy等有关的生物信息学分析工具,对27 CP基因及其编码蛋白进行预测和分析。结果 CP基因序列的开放阅读框长为1 011 bp,去除信号肽序列长954 bp,登录到GenBank,获得登录号ANA52569。该基因编码一个含317个氨基酸的蛋白多肽,属于Peptidase_C39_like超家族,理论分子量约35 669.9 Da,等电点5.92。pET-28a(+)-27kDa-CP重组质粒经IPTG诱导后,蛋白在大肠埃希菌中成功表达,经纯化后的蛋白利用Western blotting 检测,证明与预期大小相符,且与猬裂头蚴感染阳性血清有较好的结合反应。结论 成功克隆、表达了猬裂头蚴27kDa CP基因,获知CP基因及其编码的氨基酸序列和生物信息学。
猬迭宫绦虫;裂头蚴;半胱氨酸蛋白酶基因;原核表达;生物信息学
猬裂头蚴病(plerocercoidosis)是猬迭宫绦虫中绦期裂头蚴寄生人体引起,是重要的食源性寄生虫病。全球约有1 400例病例的报道,而我国病例的报道已有千余例,包括27个省(区、市)[1]。不仅影响人、兽健康,而且蛙、蛇、猪等经济饲养动物的培育、饲养及产量均会受到制约,因而受到人们的高度重视[2]。
半胱氨酸蛋白酶是寄生虫的主要“消化酶”,对寄生虫半胱氨酸蛋白酶的研究主要涉及该酶参与虫体营养吸收、入侵组织细胞、免疫逃避、生长发育及生殖等方面[3-12]。研究发现,裂头蚴有3种分子量(53 kDa、21 kDa和27 kDa)的半胱氨酸蛋白酶,其中最重要的参与虫体入侵及营养吸收的是27 kDa半胱氨酸蛋白酶[13-15]。
Kong Y[16]等对猬迭宫绦虫27 kDa半胱氨酸蛋白酶基因在虫体不同发育阶段的差异表达进行了研究,结果显示,该酶基因在钩球蚴和裂头蚴中有表达,而在未成熟卵和成虫中不表达,推测27 kDa半胱氨酸蛋白酶与虫体的生长及移行有关。
目前,有关猬迭宫绦虫半胱氨酸蛋白酶的研究鲜见报到,克隆、表达27 kDa半胱氨酸蛋白酶基因,分析其生物学特性,再将其亚克隆入原核表达载体pET-28a(+),并诱导表达重组蛋白,为进一步讨论其功能和免疫筛选蛋白奠定基础。
1 材料与方法
1.1 材料
1.1.1 裂头蚴 裂头蚴检获于贵州安顺地区野生王锦蛇,通过形态学及分子生物学鉴定为猬迭宫绦虫裂头蚴。
1.1.2 实验动物 昆明小鼠10只,20~25 g,雄性,购自贵阳医学院实验动物中心,清洁级,合格证号:SCXK(黔)2002-0001。
1.1.3 质粒和菌株 pET-28a(+)购置于大连宝生物工程有限公司;pMD-19T克隆载体,购置于大连TaKaRa公司;E.coliDH5α,由贵州医科大学病原生物学实验室常规保存;Transetta(DE3) Chemically Competent Cell,购置于上海生物技术有限公司。
1.1.4 主要试剂 RNAiso Reagent (Total RNA提取试剂)、逆转录试剂盒、DNA分子量标准DL2000、PrimeScriptTMOne Step RT-PCR Kit、DNA凝胶回收试剂盒、ExTaq酶、T4DNA连接酶、DNA快速提取试剂盒、抗His标签抗体、羊抗兔IgG/HRP、异丙基-β-D-硫代半乳糖苷(IPTG)、十二烷基硫酸钠(SDS)均购自宝生物大连TaKaRa公司;羊抗小鼠HRP-IgG购自北京中衫金桥生物技术有限公司;Ni-IDA Agarose His标签蛋白纯化试剂盒(cat No:69670)为美国Novagen公司产品;其他试剂为国内分析纯。
1.2 方法
1.2.1 猬裂头蚴总RNA提取及cDNA合成 总RNA的抽提按照TAKARA公司RNAiso PLUS的说明书进行操作。总RNA经电泳检测,测定A260/280比值及浓度,以1 μg总RNA为模板,按照cDNA合成试剂盒说明书合成cDNA。
1.2.2 引物的设计及基因扩增 根据NCBI中公布的猬裂头蚴27 kDa半胱氨酸蛋白酶基因(D63670)序列,运用Premier 5.0 和DNAClub软件设计引物,引物由上海生工生物工程股份有限公司合成。引物如下:SEP-CP-F: 5′-CCGGAATTCTCGACTGAAAGTGA-3,带EcoRI酶切位点(下画线处);SEP-CP-R:5′-CGGAAGCTTTTACACGGTTGGAT-3′,带HindⅢ酶切位点(下画线处)。以贵州蛇源的猬裂头蚴总RNA逆转录合成的cDNA 为模板,进行目的基因扩增。
PCR扩增条件:94 ℃预变性5 min,94 ℃ 30 s、 59 ℃ 90 s、72 ℃ 60 s,35个循环,72 ℃延伸10 min。1.0%琼脂糖凝胶电泳鉴定,凝胶回收试剂盒回收DNA。
1.2.3 构建重组质粒pMD-19T-27kDa-CP 回收27kDa-CP基因的PCR产物,克隆入pMD-19T载体,连接转化E.coliDH5α感受态菌,筛选阳性菌落。将PCR鉴定阳性的菌液按照质粒抽提试剂盒抽提,提取的重组质粒送上海生工生物技术有限公司测序。所得序列与NCBI D63670序列进行BLAST比对,确定其同源性。
1.2.4 构建表达载体pET-28a(+)-27kDa-CP 将测序正确的pMD-19T-27kDa-CP质粒和pET-28a(+)表达载体用限制性内切酶EcoRI和HindⅢ进行双酶切,回收目的片段,用T4DNA连接酶连接。连接产物转入E.coliDH5α感受态菌中,用含氨苄青霉素的LB平板筛选阳性菌落,PCR和双酶切鉴定后,送上海生工生物技术有限公司测序,测序正确的重组子命名为pET-28a(+)-27kDa-CP。
1.2.5 目的蛋白的诱导表达 挑取重组菌接种于5 mL LB液体培养基(卡那霉素,终浓度100 μg/mL)中,于37 ℃,200 r/min 振荡培养至OD600=0.6,加入IPTG(终浓度为0.1 mmol/L)进行诱导,在37 ℃、200 r/min条件下摇振诱导表达5 h。将上述处理的1 000 mL菌液于4 ℃,12 000 r/min,离心2 min,收集菌体,弃去上清。裂解缓冲液重悬菌体(4 mL/g湿菌),反复冻融3次后,超声裂解,4 ℃ 13 000 r/min离心15 min,分别收集上清和沉淀。用SDS-PAGE鉴定目的蛋白表达情况。
1.2.6 目的蛋白的纯化透析 沉淀经含2 mol/L和4 mol/L尿素的洗涤缓冲液反复洗涤后,按1 mL 加入1.5 mL含8 mol/L尿素的平衡洗涤缓冲液,重悬,3 h或冰浴过夜,4 ℃,16 000 r/min,离心30 min,收集上清。按Ni-IDA Agarose 纯化试剂盒纯化,用镍离子柱亲和层析法纯化目的蛋白。收集镍柱纯化后的洗脱液,在PBS缓冲液中4 ℃透析20以上,其间更换4~5次透析液,用12%SDS-PAGE鉴定目的蛋白表达情况。
1.2.7 感染小鼠血清制备 用检获的猬裂头蚴经口感染小鼠10只,每只感染裂头蚴5条,于感染2周后眼球取血,血置于离心管中室温下放置2 h,再置4℃冰箱过夜,待血液凝固收缩后,4 000×g离心10 min,即获感染小鼠血清,-20 ℃保存备用。
1.2.8 重组蛋白的Western blotting分析 一抗采用兔来源的抗His 标签的单抗(1∶1 000),二抗为辣根过氧化物酶标记的羊抗兔IgG 抗体(1∶2 000)。将重组蛋白27kDa-CP经12%SDS-PAGE后,转移到PVDF膜,进行Western blotting 分析。一抗为猬裂头蚴感染小鼠血清(1∶100),二抗为羊抗小鼠HRP-IgG(1∶2 000),二氨基联苯胺(DAB)显色后单蒸水终止反应。
1.2.9 生物信息学分析 利用瑞士生物信息学研究所的蛋白分析专家系统(Expert Protein Analysis System, ExPASy, http://ca.expasy.org/)提供的生物信息学工具分析猬迭宫绦虫裂头蚴CP基因的特点;运用NCBI Blast对cNDA序列进行同源比对,用ProtParam分析蛋白等电点、分子质量;ProtScale分析蛋白质的疏水性;利用EMBL-EBI的在线分析工具InterProScan分析蛋白保守结构域以及活性位点。
2 结 果
2.1 目的基因的PCR扩增 扩增获得的27kDa-CP基因长约1 000 bp,与预期大小基本相符,见图1。
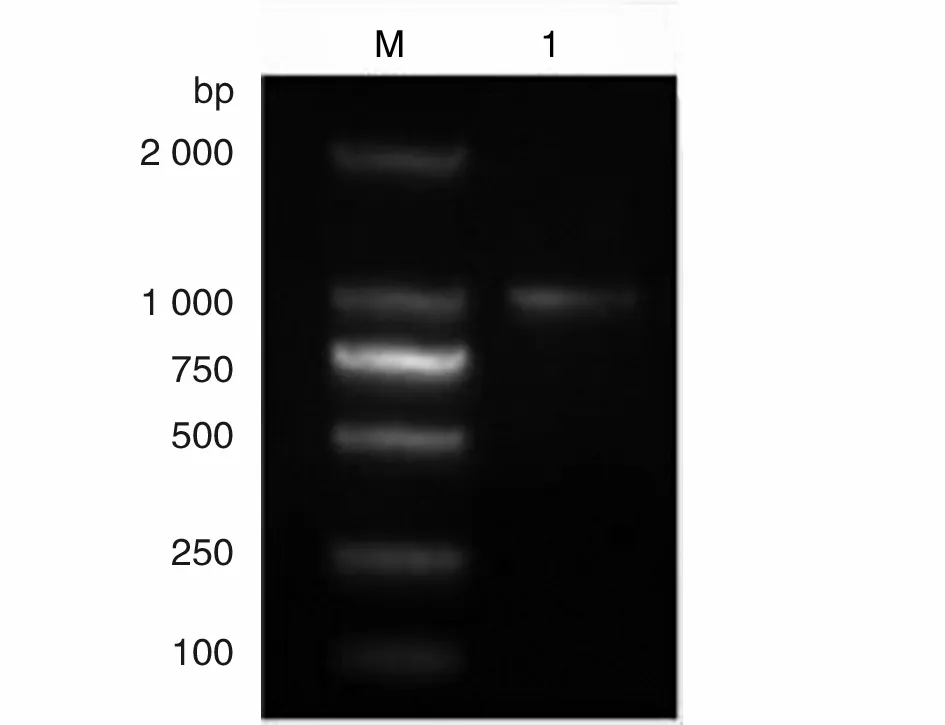
M:DNA标志物(DL2000);1:27kDa-CP PCR 产物M: DNA marker(DL2000); 1: PCR product of 27kDa-CP 图1 猬迭宫绦虫裂头蚴27kDa-CP基因的PCR产物Fig.1 PCR product of 27 kDa-CP gene of Spirometra erinacei pleroceroid
2.2 重组质粒的PCR和酶切鉴定 pET-28a(+)27kDa-CP重组质粒的PCR产物,以及酶切产物经鉴定,条带与理论值完全吻合(见图2)。重组质粒测序显示,相应的插入序列与目的基因cDNA序列一致,有3个位点突变,即96、277、296位氨基酸,表明重组质粒构建成功。将测序后的序列登陆到GenBank,获得的登录号ANA52569。

M:DNA标志物(DL2000);1:27kDa-CP PCR 产物;2:27kDa-CP PCR 产物(去信号肽);3:pET-28a(+);4:pET-28a(+)-27kDa-CP PCR 产物;5:pET-28a(+)-27kDa-CP单酶切;6:pET-28a(+)-27kDa-CP双酶切(EcoRI和HindⅢ)M: DNA marker (DL2000); 1: PCR Product of 27kDa-CP; 2: PCR Product of 27kDa-CP (no signal peptide); 3: pET-28a(+); 4: PCR product of recombinant pET-28a(+)-27kDa-CP; 5: pET-28a(+)-27kDa-CP digested by single enzyme; 6: pET-28a(+)-27kDa-CP digested by EcoRI and HindⅢ图2 重组质粒pET-28a(+)27kDa-CP的PCR和酶切鉴定Fig.2 Identification of pET-28a(+)27kDa-CP by PCR and digestion with restriction enzymes
2.3 重组蛋白的诱导表达 重组菌经IPTG诱导,在相对分子质量(Mr)约35 kDa处出现一明显的蛋白条带,而重组菌在诱导前,空载菌在诱导前、后均未出现该蛋白条带。蛋白既有可溶性表达,也有包涵体表达,主要是包涵体表达(见图3)。将洗脱液透析后浓缩,测得纯化产物的蛋白浓度为0.065 mg/mL。

M:蛋白质标志物;1:pET-28a(+)未诱导;2:pET-28a(+)诱导;3: pET-28a(+)-27kDa-CP未诱导;4: pET-28a(+)-27kDa-CP诱导;5:pET-28a(+)-27kDa-CP诱导后上清;6:pET-28a(+)-27kDa-CP诱导后沉淀;7:纯化后的重组蛋白(箭头)M:Protein marker; 1:pET-28a(+) without IPTG induction; 2:pET-28a(+) with IPTG induction; 3:pET-28a(+)-27kDa-CP without IPTG induction; 4:pET-28a(+)-27kDa-CP with IPTG induction;5:Supernatant of pET-28a(+)-27kDa-CP with IPTG induction; 6:Precipitation of pET-28a(+)-27kDa-CP with IPTG induction; 7:Purification recombinant protein(arrow)图3 重组蛋白27kDa-CP的SDS-PAGE分析Fig.3 SDS-PAGE analysis of recombinant protein 27 kDa-CP
2.4 纯化蛋白的Western blotting分析 Western blotting结果显示,重组菌诱导后在Mr约为35 kDa处有被组氨酸(His)单克隆抗体识别的条带。重组蛋白可被猬裂头蚴感染的小鼠血清识别,在Mr35 kDa处出现特异条带(图4)。
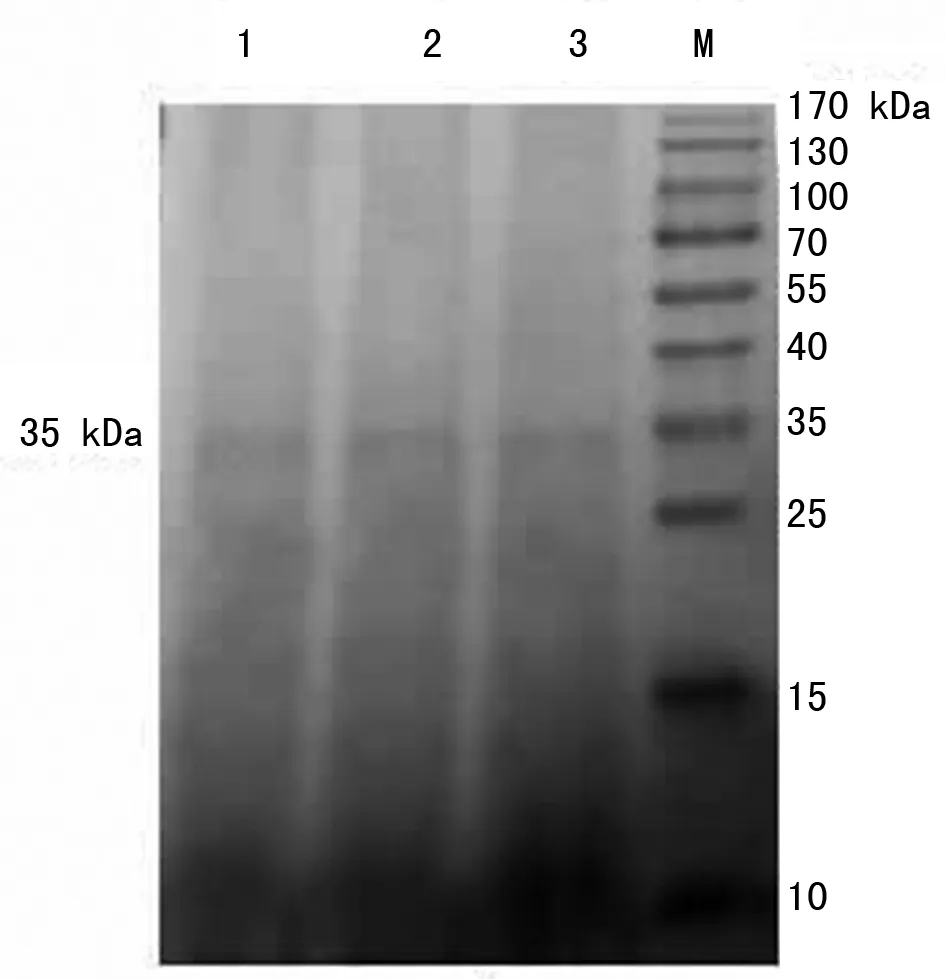
M:蛋白质标志物;1、2、3:猬裂头蚴鼠抗血清M:Protein marker;1、2、3:Mouse antiserum of Spirometra erinacei plerocercoid图4 重组蛋白27kDa-CP 的Western blotting分析Fig.4 Western blotting analysis of recombinant protein 27 kDa-CP
2.5 生物信息学分析
2.5.1 基本理化性质 用DNAMAN分析软件对猬裂头蚴27 kDa CP的去信号肽编码cDNA序列进行分析,该序列长度为954 bp,编码317个氨基酸,理论分子量约为35 669.9 Da,等电点约为5.92,属于酸性蛋白。蛋白不稳定指数为33.64,低于域值40,说明该蛋白质在溶液中性质稳定。疏水数为71.07,总亲水性-0.454,蛋白质总体疏水性较高。
2.5.2 27 kDa CP的编码cDNA序列的TA克隆及测序序列比对分析 将所得PCR产物纯化后进行TA克隆,挑选阳性单克隆测序。运用NCBI Blast对测序后的cDNA序列与NCBI(D63670)序列进行BLAST比对,结果显示同源性为99%,有13个碱基突变,与目的基因序列基本一致。
2.5.3 BLAST分析 通过NCBI的Blastn在线分析工具比对分析,结果显示27 kDa CP的编码cDNA属于Peptidase_C39_like超家族,见图5。
2.5.4 结构域预测 利用ExPASy中InterProScan在线分析预测,27 kDa CP功能结构域有2个分别位于第13位到第73氨基酸和第102位到第316位氨基酸之间的序列,Peptidase C1A家族的功能结构域一般在第10位到第317位氨基酸之间,见图6。
图5 Blastn中27 kDa-CP基因同源性分析Fig.5 Homology analysis of 27 kDa-CP gene in Blastn

图6 27kDa-CP结构域预测Fig.6 Domains prediction for 27 kDa-CP
3 讨 论
半胱氨酸蛋白酶广泛地存在于人类、寄生虫等多种动物体内。在寄生虫生活史中起关键作用,目前研究主要涉及该酶参与虫体的入侵、移行、营养吸收和免疫逃避等多个方面。
Sogorb MA等通过对卫氏并殖吸虫的研究发现,CP能降解结缔组织的主要成分,表明CP有利于虫体对宿主组织的破坏和易于虫体的入侵及移行[17]。Berasain P等证明了肝片吸虫组织蛋白酶L半胱氨酸蛋白酶1,2能通过降解宿主细胞外基质和基底膜分子,促进寄生虫自身移动[18]。Kong Y等[13]研究发现猬迭宫绦虫裂头蚴分泌的27 kDa CP通过将IgG裂解成Fab和Fc片段参与该虫的免疫逃避。最近,余长茂对广州管圆线虫3种半胱氨酸蛋白酶(Ac-CathB-1、Ac-CathB-2、Ac-Hem)进行了组织定位研究,发现Ac-CathB-1和Ac-CathB-2在一期幼虫到成虫的消化系统均有分布,其中在成虫肠道上皮微绒毛层的分布更为集中,推测Ac-CathB-1 和Ac-CathB-2可能参与虫体的营养摄取[19]。
本研究通过NCBI的Blastn在线分析,27 kDa CP的编码cDNA属于Peptidase_C39_like超家族。Peptidase_C39_like超家族在细菌、古生菌、原生动物、真菌、植物、动物及病毒中均有发现。Peptidase C1A家族包含许多肽链内切酶和一些外肽酶,催化类型和半胱氨酸蛋白酶一致,而27 kDa CP基因的结构预测与Peptidase C1A家族的蛋白结构类似,说明27 kDa CP可能具有半胱氨酸蛋白酶的催化活性。
对猬迭宫绦虫27 kDa CP进行克隆表达和纯化,所获重组蛋白的分子量与理论值相似。分子量约为35 kDa,与从虫体提取纯化得到的天然半胱氨酸蛋白酶(27 kDa)在分子量上不一致,其原因可能是在原核表达时,未发生真核体内表达的基因转录后加工过程,产生的重组蛋白实际上是半胱氨酸蛋白酶前体[20]。
前期研究发现,猬裂头蚴皮层可溶性蛋白经SDS-PAGE共分离出12条蛋白带,相对分子质量(Mr)范围在98~178 kDa,其中Mr24.5、35、50、170 kDa为高丰度蛋白区带。经Wester Blotting分析,2条带(Mr15和35 kDa)为猬裂头蚴皮层特异性蛋白条带,能被感染小鼠血清识别。本次重组蛋白经Western blotting分析,也在Mr35 kDa处出现特异蛋白条带,可被裂头蚴感染血清识别。推测猬裂头蚴皮层是半胱氨酸蛋白酶主要表达的部位,这与裂头蚴的入侵、移行和营养的摄取等有一定的关系。另外,实验的结果将为进一步研究猬裂头蚴半胱氨酸蛋白酶的功能及寻找猬裂头蚴的诊断抗原奠定了基础。
[1] Chen Y. Hazards and controls of food-brone parasitic diseases[M].Guiyang: Guizhou Science and Technology Publishing House, 2010:216. (in Chinese)
陈艳. 食源性寄生虫病的危害与防治[M]. 贵阳:贵州科技出版社,2010:216.
[2] Chen Y. Hazards and controls of food-brone sparagnosis [M].Guiyang: Guizhou Science and Technology Publishing House, 2013:1. (in Chinese)
陈艳. 食源性裂头绦虫病的危害与防治[M]. 贵阳:贵州科技出版社,2013:1.
[3] Cheng M, Yang X, Li ZY, et al. Cloning and characterization of a novel cathepsinB-like cysteine proteinase fromAngiostrongyluscantonensis[J]. Parasitol Res, 2012, 110(6): 2413-2422. DOI: 10.1007/s00436-011-2780-y
[4] Sako Y, Nakaya K, Ito A.Echinococcusmultilocularis: Identification and functional characterization of cathepsin B-like peptidases from metacestode[J]. Exp Parasitol, 2011, 127(3): 693-701. DOI: 10.1016/j.exppara.2010.11.005
[5] Lee JY, Kim JH, Sohn HJ, et al. Novel cathepsin B and cathepsin B-like cysteine protease ofNaegleriafowleriexcretory-secretory proteins and their biochemical properties[J]. Parasitol Res, 2014, 113(8): 2765-2776. DOI: 10.1007/s00436-014-3936-3
[6] Guiliano DB, Hong X, Mckerrow JH, et al. A gene family of cathepsin L-like proteases offilarialnematodesare associated with larval molting and cuticle and eggshell remodeling[J]. Mol Biochem Parasitol, 2004, 136(2): 227-242. DOI: 10.1016/j.molbiopara.2004.03.015
[7] Loukas A, Selzer PM, Maizels RM. Characterisation of Tc-cpl-1, a cathepsin L-like cysteine protease fromToxocaracanisinfective larvae[J]. Mol Biochemic Parasitol, 1998, 92(2): 275-289. DOI:10.1016/S0166-6851(97)00245-4
[8] Park H, Kim S, Hong KM, et al. Characterization and classification of five cysteine proteinases expressed byParagonimuswestermaniadult worm[J]. Exp Parasitol, 2002, 102(3): 143-149. DOI: 10.1016/S0014-4894(03)00036-5
[9] Estrela A, Seixas A, Termignoni C. A cysteine endopeptidase from tick (Rhipicephalus(Boophilus)microplus) larvae with vitellin digestion activity[J].Comp Biochem Physiol B Biochem Mol Biol, 2007, 148(4): 410-416. DOI: 10.1016/j.cbpb.2007.07.009
[10] Liu LN, Cui J, Qi X, et al. Theinvitroexpression conditions ofSpirometramansonicysteine protease[J]. J Pathog Biol,2015,10(8):717-720. (in Chinese)
刘莉娜,崔晶,祁欣,等. 曼氏迭宫绦虫半胱氨酸蛋白酶体外表达条件的优化[J]. 中国病原生物学杂志,2015,10(8):717-720.
[11] Jiang WC, Xu XZ, Shen MX, et al. Evaluation on effect of detecting Clonorchiasis with ELISA coated by the antigen of cysteine protease[J].J Pathog Biol,2013,8(11):1011-1013. (in Chinese)
江文才,徐祥珍,沈明学,等. 华支睾吸虫半胱氨酸蛋白酶ELISA检测方法的建立及其应用效果评价[J]. 中国病原生物学杂志,2013,8(11):1011-1013.
[12] Hu DD, Cui J, Wang L, et al. A Study of antigens for early diagnosis of infection withSpirometramansonispargana[J]. J Pathog Biol,2013,8(11):993-996. (in Chinese)
胡丹丹,崔晶,王莉,等. 曼氏迭宫绦虫裂头蚴感染早期诊断抗原的研究[J]. 中国病原生物学杂志,2013,8(11):993-996.
[13] Kong Y, Chung YB, Cho SY, et al. Cleavage of immunoglobulin G by excretory-secretory cathepsin S-like protease ofSpirometramansoniplerocercoid[J]. Parasitology, 1995, 109(Pt 5)(4): 611-621. DOI:10.1017/S0031182000076496
[14] Song CY, Chappell CL. Purification and partial characterization of cysteine proteinase fromSpirometramansoniplerocercoids[J]. J Parasitol,1993, 79(4): 517-524.
[15] Kong Y, Kang SY, Kim SH, et al. A neutral cysteine protease ofSpirometramansoniplerocercoid invoking an IgE response[J]. Parasitology,1997,114(Pt3):263-271.DOI: 10.1017/S0031182096008529
[16] Kong Y, Yun DH, Cho SY, et al. Differential expression of the 27 kDa cathepsin L-like cysteine protease in developmental stages ofSpirometraerinacei[J]. Korean J Parasitol, 2000, 38(3): 195-199. DOI: 10.3347/kjp.2000.38.3.195
[17] Sogorb MA, Bas S, Gutierrez LM, et al. Critical roles for excretory-secretory cysteine proteases during tissue invasion ofParagonimuswestermaninewly excysted metacercariae[J]. Cell Microbiol, 2006, 8(6): 1034-1046. DOI: 10.1111/j.1462-5822.2006.00685.x
[18] Berasaín P, Goni F, McGonigle S, et al. Proteinases secreted byFasciolahepaticadegrade extracellular matrix and basement membrane components[J]. J Parasitol, 1997, 83(1): 1-5.
[19] Yu CM. Immunofluorescence of three kinds of Cathepsins in of each stage ofAngiostrongyluscantonensis[D].Xiamen: Xiamen University, 2013.(in Chinese)
余长茂. 广州管圆线虫三种半胱氨酸蛋白酶在其各期虫体中的免疫荧光[D]. 厦门:厦门大学,2013.
[20] Liu DW, Kato H, Nakamura T, et al. Molecular cloning and expression of the gene encoding a cysteine proteinase ofSpirometraerinacei[J]. Mol Biochem Parasitol,1996,76(1/2):11-21. DOI: 10.1016/0166-6851(95)02522-7
Cloning, expression and bioinformatics analysis of 27 kDa cysteine protease gene ofSpirometraerinaceiplerocercoid
JIAO Meng-han, LIU Yan-dan, CHEN Yan, LI Jin-fu
(DepartmentofParasitology,GuizhouMedicalUniversity,Guiyang550004,China)
To clone and express 27 kDa cysteine protease (CP) gene ofSpirometraerinaceiplerocercoid, and analyze the biology characteristics, a total of RNA was extracted from the plerocercoids and reversely transcribed into cDNA. The 27kDa-CP gene was amplified by PCR and cloned into pM-19T vector for sequencing. The accurate sequence was subcloned into the expression vector pET-28a (+). The recombinant plasmid was transformed into Transetta (DE3) and the expression protein induced by IPTG. The recombinant protein was purified by Ni2+ affinity chromatography, and analyzed by SDS-PAGE and Western blotting. The 27 kDa CP gene and its expression protein were predicted and analyzed by bioinformatics analysis tools such as NCBI and ExPASy. Results showed that the ORF length of 27 kDa CP gene sequence was 1 011 bp, and the removed signal peptide sequence was 954 bp with the submission number of ANA52569 in GenBank. The whole sequence of 27 kDa CP (Mr 35 669.9, pI 5.92) was 317 amino acids conferred from cDNA, which belongs to the Peptidase_C39_like superfamily. The pET-28a (+)-27kDa-CP was expressed under the induction of IPTG. Western blotting analysis showed that the purified protein reach expectancy, and had better response with positive serum ofSpirometraerinaceiplerocercoid infection. In conclusion, the 27 kDa CP gene ofSpirometraerinaceiplerocercoid is successfully cloned and expressed and knowing coded sequences and bioinformatic.
Spirometraerinacei; pleroceroid; cysteine protease gene; prokaryotic expression; bioinformatics
Chen Yan, Email: chenyan757@sina.com
10.3969/j.issn.1002-2694.2017.02.006
,陈艳,Email:chenyan757@sina.com
贵州医科大学人体寄生虫学教研室,贵阳 550004
R383
A
1002-2694(2017)02-0120-06
2016-07-28 编辑: 李友松
贵州省科技厅社会发展攻关项目(No.20143024)资助
Supported by the Science and Technology Department of Guizhou Province (No. 2014-3024)
