辽宁省朝阳市细粒棘球病的基因型分析
2017-03-16王晓黎李金慧李亚彩安春丽
王晓黎,李 飞,李金慧,刘 静,李亚彩,白 杨,安春丽
辽宁省朝阳市细粒棘球病的基因型分析
王晓黎1,李 飞2,李金慧1,刘 静1,李亚彩1,白 杨1,安春丽3
目的 分析本院分离到的人源性棘球蚴的基因型,为辽宁省棘球蚴病的分子流行病学提供资料。方法 经外科手术方法从患者肝内获取棘球蚴囊,将囊内容物离心沉淀提取DNA,以细粒棘球绦虫线粒体细胞色素氧化酶(cox1)基因为靶基因设计引物进行PCR扩增,对PCR产物进行测序,测序结果应用Blast进行分析,并与GenBank数据库中序列进行比对。结果cox1扩增产物及测序的结果提示,本例样本与细粒棘球幼的cox1基因型(AF297617)高度相似,差异性为0.1%,基因型属于G1亚型。并与其他国家的25个分离株序列一致。结论 线粒体基因组的cox1基因分析是棘球蚴病诊断和分型的有力工具。辽宁地区首次报道了细粒棘球绦虫的基因型为G1亚型,其序列与国内外的多个分离株保持一致,为棘球蚴病的分子流行病学补充了资料。
细粒棘球蚴;cox1基因;基因型;分子流行病学
棘球蚴病(echinococciosis)是一种流行广泛,危害人类、家畜及野生动物的人兽共患蠕虫病。据世界卫生组织(WHO)报告,细粒棘球绦虫流行在南美,东欧,俄罗斯,中东和中国等广大地区流行严重,已经成为一个严重的世界性公共卫生问题[1-4]。我国为棘球蚴病发病率高发的国家之一,目前已有25个省、自治区有病例报道,其中四川、新疆、青海、西藏的牧区发病率最高[5]。在长期的进化演变过程中,棘球蚴病流行区地理气候多样性及其中间宿主多样性,使寄生虫在与宿主之间的互相适应中发生着变异。各地区人及动物体内分离到的棘球蚴的基因型有差异[6-8]。不同基因型不仅在形态学,发育过程有差异,而且对宿主特异性、人类感染力及致病性等方面都相差很大[9]。了解棘球绦虫的物种分类及基因型,可以促进其地理分布,寄主范围,防治策略以及对人类健康的影响等方面的研究。我国西北及中西部流行区人及动物的流行株及其基因型已有报道[10],东北黑龙江地区的流行株及基因型也有描述[11]。但辽宁地区流行的基因型尚未见报道,本文就中国医科大学附属第一医院收治并分离到的棘球蚴进行了基因型分析。
1 材料方法
1.1 标本来源 患者,女,57岁,辽宁省朝阳市居民,20年前曾居住朝阳农村(非牧区),无确切动物接触史。2015年6月因自觉右上腹不适,时有牵拉隐痛等症状就诊于中国医科大学第一临床学院肝胆外科,肝胆CT检查发现肝脏右叶肿物,约10×10 cm,影像呈多囊性蜂房样(参照WHO CT分型为CE2型),诊断为肝包虫病并行手术切除治疗。患者签署知情同意书,医院伦理委员会同意本研究项目。1.2 病原学鉴定 将手术切除的完整囊性肿物在安全保护下切一小口,抽取囊内容物置于10 mL离心管内,自然沉淀后,取沉淀物显微镜检查,以查到典型的棘球蚴典型的原头节为病原学鉴定依据。1.3 DNA提取 将上述包含原头节的组织命名为分离株SY-1,用QIAamp DNA Mini Kit(51304)试剂盒,按照组织标本说明书方法提取DNA,置4 ℃保存。
1.4 引物设计及PCR扩增 根据参考文献[12]报道的细粒棘球蚴cox1基因的引物序列:上游引物(cox1-F):5′-TTGTTAGGTGGTTTGTCTGA-3′下游引物(cox1-R):5′-GGCCATCACAAATAAACA-3′由生工生物工程(上海)股份有限公司合成,扩增片段为895 bp,包含了常用于cox1基因型分析的部分片段。PCR反应体系:总体积为25 μL,2×TaqPCRMasterMix 12.5 μL,引物cox1-F、cox1-R(10 pmol/μL)各1 μL,模板DNA 1 μL,ddH2O 9.5 μL。扩增条件:94℃预变性5 min;94℃变性1 min,51 ℃复性1 min,72 ℃延伸1 min,共35个循环;最后72℃延伸10 min。反应结束后,取5 μL PCR产物进行1.2%琼脂糖凝胶电泳检测。
1.5 测序及基因型分析 PCR产物由生工生物工程(上海)股份有限公司,按目的要求进行测序。应用DNAman软件对测序结果与GenBank中的cox1[Echinococcusgranulosus](Gene ID:4097469)序列进行比较分析。
2 结 果
2.1 标本形态学及病理学鉴定 患者经肝胆脾CT扫描显示肝右叶囊性病变,胆胰管MR水成像提示肝内囊性占位。经手术切除肿物,病理学检查发现纤维囊壁组织,符合包虫病的病理所见。

A.原头蚴(顶突外翻);B.囊内容物中可见大量棘球蚴特征性的小钩A.Evaginated protoscolex; B. Characteristic hookets of hedatid图1 棘球蚴的病原学鉴定Fig.1 Pathogenic identification of E.granulosus
2.2 病原学鉴定 囊内容的沉淀物经光学显微镜检查,发现典型的原头节,即原头蚴(图1A)和大量棘球蚴特征性的小钩(图1B),病原学鉴定为棘球蚴。2.3 PCR扩增结果 如图2所示,在1 000 bp左右处出现特异条带,符合目的基因片段的大小。

M:DL-2 000分子量标记;S:病例样本(1 000 bp处出现特异条带);N:为阴性对照M:DL-2 000 marker;S:sample of patient(specific band at 1 000 bp);N:negative control 图2 分离株SY-1的cox1基因PCR产物电泳结果Fig.2 Electrophoresis result of E. granulosus cox1 gene PCR product
2.4 测序及基因型分析 将分离株SY-1的测序结果应用pubmed的Blast工具分析(https://blast.ncbi.nlm.nih.gov),发现147条同源序列(E value=0,相似度99%~100%),均为细粒棘球绦虫种属。应用DNAman软件将测序结果与GenBank中细粒棘球绦虫(E.granulosus)线粒体基因组(AF297617)中的cox1基因 (Gene ID:4097469)序列进行比较分析,900 bp中仅有1 bp不同,为位于第855位碱基T→C,对应编码285位氨基酸丝氨酸无变化(AGT/AGC),变异率为0.1%。分离株SY-1的核苷酸序列与GenBank数据库中的来源于不同国家的25条单倍体序列完全一致,见表1、图3。
表1 GenBank中与分离株SY-1序列一致的分离株来源
Tab.1 Strains whose sequences are consistent with SY-1 in GenBank
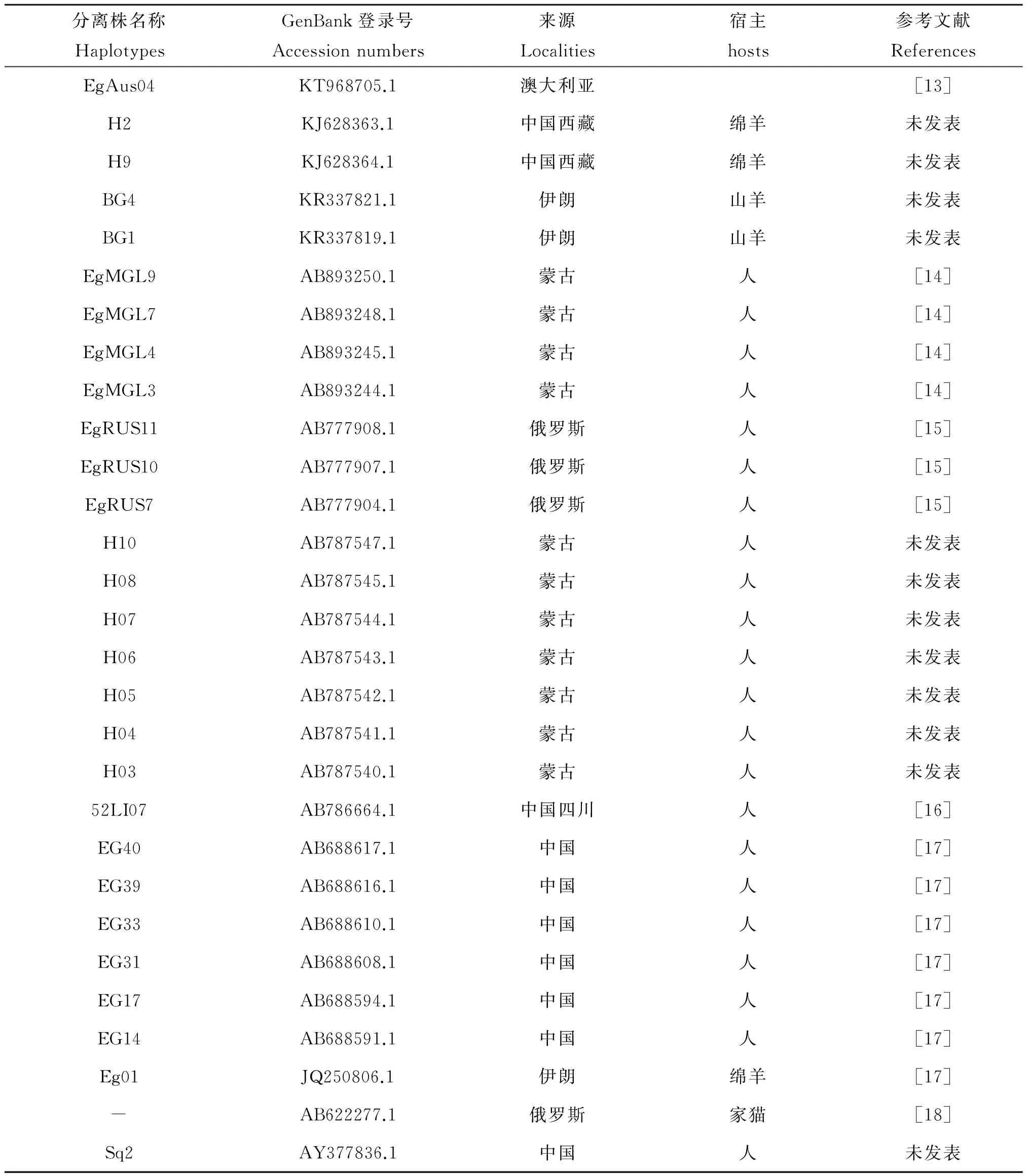
分离株名称HaplotypesGenBank登录号Accessionnumbers来源Localities宿主hosts参考文献ReferencesEgAus04KT968705.1澳大利亚[13]H2KJ628363.1中国西藏绵羊未发表H9KJ628364.1中国西藏绵羊未发表BG4KR337821.1伊朗山羊未发表BG1KR337819.1伊朗山羊未发表EgMGL9AB893250.1蒙古人[14]EgMGL7AB893248.1蒙古人[14]EgMGL4AB893245.1蒙古人[14]EgMGL3AB893244.1蒙古人[14]EgRUS11AB777908.1俄罗斯人[15]EgRUS10AB777907.1俄罗斯人[15]EgRUS7AB777904.1俄罗斯人[15]H10AB787547.1蒙古人未发表H08AB787545.1蒙古人未发表H07AB787544.1蒙古人未发表H06AB787543.1蒙古人未发表H05AB787542.1蒙古人未发表H04AB787541.1蒙古人未发表H03AB787540.1蒙古人未发表52LI07AB786664.1中国四川人[16]EG40AB688617.1中国人[17]EG39AB688616.1中国人[17]EG33AB688610.1中国人[17]EG31AB688608.1中国人[17]EG17AB688594.1中国人[17]EG14AB688591.1中国人[17]Eg01JQ250806.1伊朗绵羊[17]-AB622277.1俄罗斯家猫[18]Sq2AY377836.1中国人未发表

图3 分离株SY-1的COX1基因与细粒棘球绦虫线粒体基因组(AF297617)进行对比结果Fig.3 Comparison of COX1 gene between SY-1 strain and mitochondrial genomes of E.granulosus (AF297617)
3 讨 论
研究表明,不同种属及不同基因型绦虫的地理分布,流行特征以及对宿主特异性、对人类感染力及致病性等方面都具有很大相差[6-9]。了解棘球绦虫的基因型,可以促进其地理分布,寄主范围,防治策略以及对人类健康的影响等方面的研究。因此,有关棘球绦虫种属及种下分类一直备受关注。以前普遍认为棘球绦虫只有细粒棘球绦虫(E.granulosus)和多房棘球绦虫(E.multilocularis)两种。并根据形态学将两种绦虫的中绦期(metacestode)幼虫引起的棘球蚴病分为单房(囊型)棘球蚴病(cystic echinococcosis,即包虫病)和多囊(泡状)棘球蚴病(Alveolar hydatid disease)[19]。其间,E.granulosus曾被视为是一个具有基因型和表型多态性的单一物种,并按基因序列将其分为10个基因型(G1-G10)[20-21]。然而,近年来依据进化系统发育学(phylogenetic systematics)建立起来的棘球绦虫分类方法已经替代并修正了传统的形态学分类标准。如,Nakao等[22]研究认为导致囊型包虫病的细粒棘球绦虫其实是一个隐含了多个虫种的复杂的神秘物种;并且将原来的两种棘球绦虫重新分为9个有效种。Spotin[23]等基于系统发育学和地理株理论,对棘球绦虫的线粒体和核糖核DNA基因进行系统研究,结果认为原先的广义细粒棘球绦虫至少包括4个有效种:即E.granulosus(狭义细粒棘球绦虫,基因型G1-G3)、E.equinus(G4)、E.ortleppi(G5)和E.canadensis。其中E.canadensis具有高度异质性,包括有骆驼株(基因型G6)、猪株(基因型G7)和两个鹿株(基因型G8和G10)。G9基因型的有效性受到质疑。其中G1基因型绦虫分布最广泛,呈世界性流行,羊是其最常见的中间宿主。全球绝大多数(88.44%)囊型包虫病是由基因型G1所致;全球大约11.07%的人体包虫病由与G1亲缘关系密切的G6和G7基因型感染所致。其中,7.34%囊型包虫病例属于G6基因型,主要分布于非洲和亚洲,中间宿主主要是骆驼和山羊。3.73%属于G7型,其中间宿主为猪,主要流行于东欧国家。人体包虫病罕见由G5、G8和G10型引起。尚未发现有G4感染人类的报道。我国西北及中西部,如青海省、甘肃省和新疆维吾尔自治区等地流行株主要以G1为主[10,24-27],东北的黑龙江发现有G1和G7基因型病例报道[11]。
线粒体DNA(mtDNA) 结构简单、稳定、以母系方式遗传,核苷酸歧异度大、进化速度快,在种内、种间、群体间和群体内具有广泛的多态性,可以作为一个可靠的遗传标记。根据对基因的全序列变异分析,可以更全面、准确地了解包虫病的流行特征,并对该病的预防和控制提供理论支持。本研究首次对中国辽宁省西部朝阳地区的1例患者肝内囊性占位病变进行了病原学鉴定,在确诊细粒棘球蚴病的基础上,通过分子生物学的基因分析,确定为细粒棘球绦虫G1型,变异率为0.1%,变异核苷酸并未影响到编码氨基酸序列。并且该序列与澳大利亚、俄罗斯、伊朗、蒙古以及国内其他地区的分离株单倍体序列相同,为我国包虫病的病原流行病学提供了新的资料。
[1] Pakala T, Molina M, Wu GY. Hepatic echinococcal cysts: A review[J]. J Clin Transl Hepatol, 2016, 4(1): 39-46.
[2] Rossi P, Tamarozzi F, Galati F, et al. The first meeting of the european register of cystic echinococcosis (ERCE)[J]. Parasit Vectors.2016, 28; 9:243.
[3] Cadavid Restrepo AM, Yang YR, McManus DP, et al. The landscape epidemiology of echinococcosis[J]. Infect Dis Poverty, 2016, 5: 13.
[4] van Cauteren D, Millon L, de Valk H, et al. Retrospective study of human cystic echinococcosis over the past decade in France, using a nationwide hospital medical information database[J]. Parasitol Res, 2016, 115(11): 4261-4265.
[5] Wen H, Tuerganaili A, Shao YM, et al. Achievements and challenges for echinococcosis control[J]. Chin J Parsitol Paraist Dis, 2015,33(6): 466-471. (in Chinese)
温浩,吐尔干戈力·阿吉,邵英梅等. 棘球蚴病防治成就及面临的挑战[J]. 中国寄生虫病防治杂志, 2015,33(6):466-471 .
[6] Ito A, Nakao M, Lavikainen A, et al. Cystic echinococcosis: Future perspectives of molecular epidemiology[J]. Acta Trop, 2016, pii: S0001-706X(16)30242-X.
[7] Romig T, Ebi D, Wassermann M. Taxonomy and molecular epidemiology ofEchinococcusgranulosussensu lato[J]. Vet Parasitol, 2015, 213(3/4): 76-84.
[8] McManus DP. Current status of the genetics and molecular taxonomy ofEchinococcusspecies[J]. Parasitology, 2013, 140(13): 1617-1623.
[9] Alvarez Rojas CA, Romig T, Lightowlers MW.Echinococcusgranulosussensu lato genotypes infecting humans-review of current knowledge[J]. Int J Parasitol, 2014, 44(1): 9-18.
[10] Hu D, Song X, Wang N. et al. Molecular identification ofEchinococcusgranulosuson the Tibetan Plateau using mitochondrial DNA markers[J]. Genet Mol Res, 2015, 14(4): 13915-13923.
[11] Zhang T, Yang D, Zeng Z, et al. Genetic characterization of human-derived hydatid cysts ofEchinococcusgranulosussensulato in Heilongjiang Province and the first report of G7 genotype ofE.canadensisin humans in China[J]. PLoS One, 2014, 9(10): e109059.
[12] Yu JF, Li B, Liu XS, et al. Cloning and sequence analysis of the partialCO1 gene with in mitochondria DNA ofEchinococcusgranulosus[J]. Chin J Zoonoses, 2015, 31(6): 532-536. (in Chinese)
于晶峰, 李滨, 刘晓松, 等.细粒棘球蚴线粒体CO1基因的克隆与序列分析[J]. 中国人兽共患病学报, 2015, 31(6): 532-536.
[13] Alvarez Rojas CA, Ebi D, Gauci CG, et al. Microdiversity ofEchinococcusgranulosussensu stricto in Australia[J]. Parasitology, 2016, 143(8): 1026-1033.
[14] Ito A, Dorjsuren T, Davaasuren A, et al. Cystic echinococcoses in Mongolia: molecular identification, serology and risk factors[J]. PLoS Negl Trop Dis, 2014, 8(6): e2937.
[15] Konyaev SV, Yanagida T, Nakao M, et al. Genetic diversity ofEchinococcusspp. in Russia[J]. Parasitology, 2013, 140(13): 1637-1647.
[16] Nakao M, Yanagida T, Konyaev S, et al. Mitochondrial phylogeny of the genusEchinococcus(Cestoda: Taeniidae) with emphasis on relationships amongEchinococcuscanadensisgenotypes[J]. Parasitology, 2013, 140(13): 1625-1636.
[17] Yanagida T, Mohammadzadeh T, Kamhawi S, et al. Genetic polymorphisms ofEchinococcusgranulosussensu stricto in the Middle East[J]. Parasitol Int, 2012, 61(4): 599-603.
[18] Konyaev SV, Yanagida T, Ivanov MV, et al. The first report on cystic echinococcosis in a cat caused byEchinococcusgranulosussensu stricto (G1) [J]. J Helminthol, 2012, 86(4): 391-394.
[19] Pakala T, Molina M, Wu GY. Hepatic echinococcal cysts: A review[J]. J Clin Transl Hepatol, 2016, 4(1): 39-46.
[20] Bowles J, Blair D, McManus DP. Genetic variants within the genusEchinococcusidentified by mitochondrial DNA sequencing[J]. Mol Biochem Parasitol, 1992, 54: 165-173.
[21] Bowles J, McManus D, Donald P. Molecular variation inEchinococcus[J]. Acta Trop, 1993, 53: 291-305.
[22] Nakao M, Lavikainen A, Yanagida T, et al. Phylogenetic systematics of the genusEchinococcus(Cestoda: Taeniidae) [J]. Int J Parasitol, 2013, 43(12/13): 1017-1029.
[23] Spotin A, Mahami-Oskouei M, Harandi MF, et al. Genetic variability ofEchinococcusgranulosuscomplex in various geographical populations of Iran inferred by mitochondrial DNA sequences[J]. Acta Trop, 2016, pii: S0001-706X(16)30092-4.
[24] Yang YR, Rosenzvit MC, Zhang LH, et al. Molecular study ofEchinococcusin west-central China[J]. Parasitology, 2005, 131(Pt 4): 547-555.
[25] Wang N, Gu XB, Wang T, et al. Genetic variability ofEchinococcusgranulosusdetermined by the mitochondrial cytochrognme coxidase subunit 1 gene in the Tibet plateau of China[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(3): 453-460. (in Chinese)
王凝, 古小彬, 汪涛, 等. 基于COX1基因对中国青藏高原地区细粒棘球绦虫遗传多态性的研究[J]. 畜牧兽医学报,2015,46(3):453-460.
[26] Yang JK, Jia WZ, Jing T, et al. Analysis ofE.granulosusgene variation in three provinces in china[J]. Chin J Vet Sci Technol, 2004, 34(9): 12-16. (in Chinese)
杨俊克,贾万忠,景涛,等.我国三省区细粒棘球绦虫基因的变异分析[J].中国兽医科技,2004,34(9):12-16.
[27] Cao DP, Fan HN, Wu DF, et al. Phylogeny of Qinghai plateauEchinococcusgranulosusisolates inferred by cytochromeoxidase 1 gene sequences[J]. Chin J Zoonoses, 2014, 30(10): 1048-1051. (in Chinese)
曹得萍,樊海宁,毋德芳,等.利用细胞色素氧化酶亚单位Ⅰ分析青海藏区细粒棘球绦虫系统发育学[J]. 中国人兽共患病学报[J], 2014,30(10):1048-1051.
Genetic analysis ofEchinococcusgranulosusstrain in Liaoning Province, China
WANG Xiao-li1, LI Fei2, LI Jin-hui1, LIU Jing1, LI Ya-cai1, BAI Yang1,An chun-li3
(1.DepartmentofEndocrinologyandMetabolism,InstituteofEndocrinology,KeyLaboratoryofEndocrineDiseasesofLiaoningProvince,theFirstAffiliatedHospital,ChinaMedicalUniversity,Shenyang110001,China; 2.DepartmentofGastroenterologyandEndocrinology,HospitalofTacheng,ChinaMedicalUniversity,Tacheng834799,China;
3.DepartmentofMicrobiologyandParasitology,CollegeofBasicMedicalScience,ChinaMedicalUniversity,Shenyang, 110001,China
To analyze the genotype ofEchinococcusgranulosusfound in Liaoning Province, hydatid cyst was taken from the patient's liver, DNA of cyst was isolated and mitochondrialcox1 gene was sequenced substantially. Sequence results was analyzed by Blast and compared with similar strains in GenBank. Results showed that molecular analysis confirmed the echinococcosis by identical sequence of our strain withE.granulosus(AF297617) G1 genotype, with 0.1% difference. And the sequence of our strain was consistent with 25 other strains in different countries. In conclusion, genotyping of mitochondrial genecox1 is a very useful tool for diagnosis of echinococcosis. We first reported a strain ofE.granulosusin Liaoning Province, which provide novel molecular epidemiological data of this zoonosis.
Echinococcusgranulosus; Cox1 gene; genotype; molecular epidemiology
Wang Xiao-li, Email: wlittlepear@163.com
10.3969/j.issn.1002-2694.2017.02.004
国家自然科学基金(No.81370189)和国家自然科学基金青年基金(No.81302271)联合资助
,安春丽,Email: cmucl@126.com
1.中国医科大学附属第一医院内分泌科,内分泌研究所,辽宁省内分泌疾病重点实验室,沈阳 110001; 2.中国医科大学塔城医院消化内分泌科,塔城 834799; 3.中国医科大学基础医学院病原生物学教研室,沈阳 110001
R383
A
1002-2694(2017)02-0110-05
2016-09-05 编辑:梁小洁
Supported by the National Natural Science Foundation of China (No. 81370189)
