Ras信号通路在HIV-1 Tat诱导ZO-1及脑啡肽酶破坏的作用
2017-03-16蒋文琳陈艳兰彭定越陈德斌
蒋文琳, 黄 文, 陈艳兰, 彭定越, 陈德斌, 邹 敏
Ras信号通路在HIV-1 Tat诱导ZO-1及脑啡肽酶破坏的作用
蒋文琳1, 黄 文1, 陈艳兰2, 彭定越1, 陈德斌1, 邹 敏1
目的 探讨Ras信号传导通路在人类免疫缺陷病毒-1型反式转录激活因子(HIV-1 transactivator of transcription,HIV-1 Tat)诱导血脑屏障(BBB)中紧密连接蛋白Zonula Occludens(ZO)-1及脑啡肽酶(Neprilysin,NEP)破坏的作用。方法 以不同浓度Ras信号传导通路抑制剂法尼基硫代水杨酸(farnesylthiosalicylic acid,FTS)刺激培养好的人脑微血管内皮细胞(human cerebral microvascular endothelium cells,HBEC-5i),并设立对照组,观察其对细胞活力的影响。分别予以HIV-1 Tat、FTS刺激细胞,以蛋白免疫印迹法及实时反转录聚合酶链式反应(real-time reverse transcription polymerase chain reaction,RT-PCR )检测HIV-1 Tat诱导的紧密连接蛋白ZO-1及NEP(脑内降解β淀粉样蛋白Amyloid-beta,Aβ的限速酶)的蛋白和mRNA表达的变化。结果 FTS在20 μmol/L(0.35±0.06)以下时对HBEC-5i活力无明显影响(P>0.05),HIV-1 Tat能抑制HBEC-5i的ZO-1、NEP蛋白(0.53±0.07,P<0.01;0.40±0.04,P<0.05)与mRNA(0.42±0.10,P<0.05;0.31±0.09,P<0.05)的表达。用FTS阻断Ras信号通路后可显著增加ZO-1、NEP蛋白(1.20±0.22,P<0.01;0.58±0.03,P<0.05)及mRNA(1.10±0.19,P<0.05;0.97±0.38,P<0.05)的表达。结论 HIV-1 Tat可促进紧密连接蛋白ZO-1蛋白和mRNA下调而导致血脑屏障破坏,同时诱导脑内脑啡肽酶NEP蛋白和mRNA下调,可能导致Aβ在脑内沉积增加。阻断Ras信号传导通路可抑制HIV-1 Tat诱导的ZO-1和NEP破坏,可能减少Aβ在脑内的沉积。
HIV-1 Tat; Ras信号通路; ZO-1; NEP
HIV-1流行病学显示,感染人类免疫缺陷病毒(human immunodeficiency virus-1,HIV-1)的老年人口不断增加,成为一个新兴发展的感染人群[1]。已证实,HIV-1感染者大脑一个显著特点是脑内β淀粉样蛋白(Amyloid-beta,Aβ)沉积增加[2~4]。老年人感染HIV-1病毒后更易发展为HIV-1相关性痴呆(HIV-associated dementia,HAD)[3,5]。HIV-1反式转录因子(HIV transactivator of transcription,HIV-1 Tat)能轻易进入脑血管内皮细胞,刺激炎症反应,改变紧密连接蛋白的表达[6]。有研究证实HIV-1 Tat可通过激活Ras信号通路而影响脑血管内皮细胞[1]。HIV-1 Tat蛋白能抑制脑啡肽酶(neprilysin,NEP),抑制小神经胶质细胞吞噬Aβ,损害神经细胞,促使Aβ斑块形成[7],导致神经功能紊乱[8]。NEP是主要的内源性Aβ降解酶[9],NEP对脑中Aβ1-40的降解部分通过血脑屏障的流出转运[10]。我们既往研究发现HIV-1 Tat能破坏人脑微血管细胞中的紧密连接蛋白Occludin,促进晚期糖基化终产物受体(RAGE)过表达[11]并下调脂蛋白受体相关蛋白(LRP1),而阻断Rho/ROCK信号通路可有效抑制HIV-1 Tat对脑微血管细胞的不利影响,从而可能减少Aβ在脑微血管细胞中的沉积[12]。本研究以人脑微血管内皮细胞系(HBEC-5i)体外培养作为血脑屏障(BBB)模型,观察Ras信号通路抑制剂法尼基硫代水杨酸(farnesylthiosalicylic acid,FTS)对HIV-1 Tat诱导紧密连接ZO-1蛋白破坏和NEP表达的影响,探讨Ras信号通路在HIV-1 Tat诱导Aβ脑内沉积的作用机制,为临床防治HIV-1相关性痴呆提供新的思路及依据。
1 材料与方法
1.1 实验试剂 内皮细胞培养基(DMEM:F12 Medium)、0.1%明胶溶液、内皮细胞生长添加剂(endothelial growth supplement,ECGS)均购自ATCC公司,胎牛血清(FBS)购自Gibco公司,法尼基硫代水杨酸(FTS)、四甲基偶氮唑盐(MTT)购自Sigma公司,重组HIV-1 Tat clade-B购自ProSpec公司,二喹啉甲酸(Bicinchoninic acid,BCA)蛋白浓度测定试剂盒购自碧云天生物技术研究所,ZO-1抗体、NEP抗体购自abcam公司,GAPDH内参蛋白抗体购自Proteintech公司,荧光二抗购自LI-COR公司,TRIzol、逆转录试剂盒、Taq PCR Master Mix kit均购自Takara公司。
1.2 主要试剂配制 DMEM:F12完全培养基的配制:100 ml DMEM:F12中需加入10%(体积分数)胎牛血清、40 μg/ml内皮细胞生长添加剂(ECGS)、1%青霉素-链霉素。HIV-1 Tat配制:HIV-1 Tat短暂离心后于超净工作台中用超纯水完全溶解,制成100 μg/ml储存液,分装后于-80℃保存,HIV-1 Tat能与血清结合,HIV-1 Tat干预实验都在无血清条件下进行。FTS配制:FTS短暂离心后于超净台中用二甲基亚砜(DMSO)完全溶解,制成0.1 mol/L储存液,分装后于-20 ℃保存。
1.3 细胞培养 人脑微血管内皮细胞系(HBEC-5i)来源于人脑微血管内皮细胞,购自ATCC公司。将人脑微血管内皮细胞系(HBEC-5i)种植于0.1%明胶溶液(ATCC)包被过的25 cm2培养瓶(Corning)内,加入3~4 ml DMEM:F12完全培养基,置于37 ℃、5%CO2培养箱内培养,根据培养基颜色及细胞生长情况,1~2 d换液一次,待细胞达80%以上融合即可传代。
1.4 实验分组及处理 (1)FTS对细胞活力影响的检测:用不同浓度梯度的FTS(0、5、10、20、30、40、50 μmol/L)处理HBEC-5i细胞24 h,四甲基偶氮唑盐(MTT法)检测细胞活力;(2)蛋白免疫印迹法检测HBEC-5i中ZO-1、NEP蛋白的表达:实验分为4组:对照组(0.01%DMSO)、1 μg/ml HIV-1 Tat处理组、5 μmol/L FTS干预组、5 μmol/L FTS干预+1 μg/ml HIV-1 Tat处理组,处理细胞24 h后收集细胞提取细胞总蛋白;(3)实时反转录聚合酶链式反应(RT-PCR法)检测HBEC-5i中ZO-1、NEP的mRNA表达:实验分组同上,处理细胞12 h后收集细胞提取总RNA。FTS预处理细胞3 h后再加入HIV-1 Tat[13]。
1.5 四甲基偶氮唑盐(MTT法)检测细胞活力 对数生长期HBEC-5i细胞达80%~90%融合时,用0.25%胰蛋白酶消化,离心后重悬,以每孔1×104个细胞接种于96孔板(Corning),每个浓度梯度设6个复孔,置于培养箱中培养12 h,待细胞贴壁生长良好,在无血清条件下以不同浓度FTS(0 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L、50 μmol/L)处理细胞24 h,每孔加入20 μl MTT(5 mg/ml)放入培养箱中继续培养,4 h后轻柔吸弃上清,每孔加入150 μl二甲基亚砜(DMSO),振荡10 min使结晶充分溶解,用酶标仪测定吸光度值(波长570 nm)。
1.6 Western blot法检测HBEC-5i中ZO-1、NEP蛋白的表达量 将HBEC-5i接种于六孔板(JET BIOFIL),按实验方案处理后,用预冷的1×磷酸盐缓冲液(PBS)清洗细胞3次,冰上用RIPA裂解液提取细胞总蛋白,4 ℃ 12000 r/min离心15 min,收集上清液,BCA蛋白定量试剂盒测定总蛋白浓度,每道上样20 μg蛋白,在8%或5%SDS聚丙酰胺凝胶电泳分离蛋白后转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,用5%脱脂奶粉封闭30 min,分别加入ZO-1一抗(1∶400)、NEP一抗(1∶400)、内参GAPDH(1∶5000),4 ℃孵育过夜,次日用1×三乙醇胺缓冲盐水加吐温20溶液(Tris Buffered Saline,with Tween-20,TBST)缓冲液洗膜5 min×4次后加入荧光二抗,室温摇床孵育1 h,1×TBST缓冲液洗膜5 min×4次,用荧光扫膜仪扫膜,用Image-J图像分析软件对电泳条带进行分析,以ZO-1、NEP灰度值与内参GAPDH灰度值的比值反映ZO-1、NEP蛋白相对表达量。
1.7 实时反转录聚合酶链式反应(RT-PCR法)检测HBEC-5i中ZO-1、NEP的mRNA表达 将HBEC-5i接种于六孔板,按实验方案处理细胞,用TRIzol法提取细胞总RNA,按逆转录试剂盒说明书逆转录合成cDNA,应用StepOne Plus序列检测系统进行PCR扩增,程序为:95 ℃预变性30 s,然后进行PCR反应95 ℃ 5 s、60 ℃ 30 s,20 μl体系共进行40个循环。引物序列分别为:ZO-1:5’-GACCAATAGCTGATGTTGCCAGAG-3’和5’-TGCAGGCGAATAATGCCAGA-3’;NEP:5’-TAAGCAGCCTCAGCCGAACC-3’和5’-TTGACATAGTTTGCACAACGTCTCC-3’;GAPDH:5’-GCACCGTCAAGGCTGAGAAC-3’和5’-TGGTGAAGACGCCAGTGGA-3’。每组实验结果取至少3个复孔的均值作为一次独立实验结果,取3次独立实验结果做统计学分析,以2-△△Ct法计算mRNA相对表达量。每个样品通过管家基因GAPDH作为内参使目标基因标准化。

2 结 果
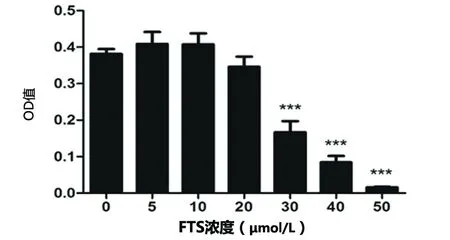
2.1 不同浓度FTS对人脑微血管内皮细胞活力的影响 不同浓度梯度FTS处理HBEC-5i 24 h后,以空白组为对照(0.38±0.03),当FTS浓度大于20 μmol/L(0.35±0.06)时,对HBEC-5i有明显的抑制作用,且随着FTS浓度增高,其对HBEC-5i活性的抑制作用增强。因此,选择FTS5 μmol/L(0.41±0.07,P>0.05)作为后续实验的处理浓度(见图1)。
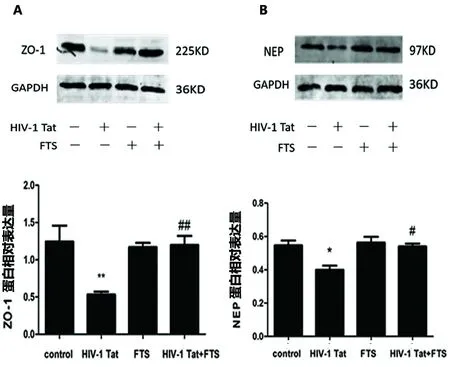
2.2 不同处理对HBEC-5i中ZO-1、NEP蛋白水平的影响 与对照组(1.24±0.37,0.55±0.05)相比,HIV-1 Tat组ZO-1蛋白(0.53±0.07,P<0.01)、NEP蛋白(0.40±0.04,P<0.05)水平显著降低;与HIV-1 Tat组相比,FTS预处理组ZO-1蛋白(1.20±0.22,P<0.01)、NEP蛋白(0.58±0.03,P<0.05)水平显著增加(见图2)。
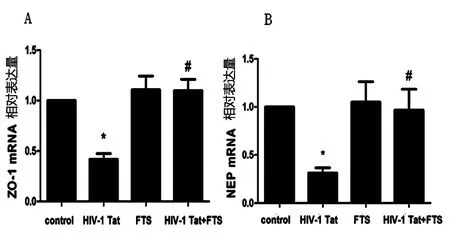
2.3 不同处理对HBEC-5i中ZO-1、NEP mRNA水平的影响 与对照组(1.00±0.00)相比,HIV-1 Tat组的ZO-1(0.42±0.10,P<0.05)、NEP(0.31±0.09,P<0.05)的mRNA显著降低;与HIV-1 Tat组相比,FTS预处理组的ZO-1(1.10±0.19,P<0.05)、NEP(0.97±0.38,P<0.05)mRNA水平显著增加(见图3)。
与对照组相比*P<0.05,**P<0.01,***P<0.001
图1 MTT法检测不同浓度FTS对HBEC-5i细胞活力的影响(n=4,F=46.311)
与对照组相比*P<0.05,**P<0.01;与HIV-1 Tat组相比#P<0.05,##P<0.01
图2 不同处理对人脑微血管内皮细胞HBEC-5i中ZO-1、NEP蛋白表达的影响(A:n=3,F=6.816;B:n=3,F=12.25)
与对照组相比*P<0.05;与HIV-1 Tat组相比#P<0.05
图3 不同处理对人脑微血管内皮细胞HBEC-5i中ZO-1、NEP mRNA表达的影响(A:n=3,F=12.95;B:n=3,F=5.108)
3 讨 论
血脑屏障由脑微血管内皮细胞、星形胶质细胞终足和周细胞构成,紧密连接是其必不可少的组成部分,在血脑屏障完整性的调节中紧密连接是主要的结构和功能基础[14]。正常情况下,脑血管内皮细胞与内皮细胞间的紧密连接相结合形成一层无孔的内皮使血脑屏障能选择性渗透外围蛋白质和其他分子,紧密连接提供了高跨内皮细胞电阻(transendothelial electrical resistance,TEER),进一步限制多种类型的大分子物质通透[15]。
ZO-1作为支架分子调节跨膜紧密连接与肌动蛋白细胞骨架之间的联系,在维持血脑屏障的重要属性包括阻力和渗透率中起着重要作用[16]。HIV-1 Tat蛋白是一种转录调节因子,对病毒的生命周期至关重要,能诱导炎症、毒性以及损伤多种细胞类型包括神经元、星形胶质细胞、单核细胞和脑血管内皮细胞[17]。
血脑屏障在HIV-1感染与淀粉样变性中都有很重要的作用,调节血源性淀粉样蛋白进入脑内以及大脑对淀粉样蛋白的清除[4]。血脑屏障被认为在艾滋病相关性痴呆(HAD)的发展中发挥重要作用,有研究显示,相比于非痴呆艾滋病患者或对照组患者,艾滋病相关性痴呆患者中血脑屏障破坏更常见[18]。Tat蛋白不仅具有神经毒性,也已被证明能够破坏血脑屏障的完整性[19]。Lei Chen等人研究观察到HIV-1 Tat时间依赖性地提高小鼠血脑屏障(BBB)通透性,在人脑微血管内皮细胞中也同样观察到HIV-1 Tat诱导的血脑屏障(BBB)通透性增加及白细胞的黏附与迁移增加[5]。
本研究也观察到,HIV-1 Tat刺激HBEC-5i后ZO-1蛋白和mRNA的表达量下降(见图2A、图3A),从而验证了HIV-1 Tat在转录和翻译水平可诱导ZO-1蛋白和mRNA表达的下调,进而影响HBEC-5i细胞间的紧密连接形成。
脑啡肽酶(neprilysin,NEP)也称为CD10,是一种细胞表面含锌的金属内切酶,能够降解小分子肽如缓激肽、P物质、脑啡肽等[20,21]。近年来,NEP在Aβ分解代谢中的作用逐渐引起重视,被认为是脑内关键的Aβ降解酶[20~22],已证实能够降解Aβ单体[22],在类似NEP的同系物中NEP具有降解Aβ1-40与Aβ1-42最强活性[21],在NEP敲除小鼠脑内Aβ40与Aβ42水平显著上升[22]。Rempel HC等人研究观察到脑内NEP蛋白表达量与NEP酶活性成线性关系,HIV-1 Tat能够特定地抑制NEP活性,增加脑组织内Aβ沉积[21]。本研究中也观察到HIV-1 Tat能诱导HBEC-5i中NEP蛋白与mRNA的下调,使NEP降解Aβ的活性降低,同时诱导ZO-1蛋白下调、破坏血脑屏障,导致脑内Aβ沉积增加。Ras信号通路抑制剂法尼基硫代水杨酸(FTS)能够减弱HIV-1 Tat的作用,使ZO-1表达上调,保护血脑屏障,上调NEP蛋白水平,可能减少Aβ在脑细胞内的沉积。
HIV-1 Tat能促进Aβ在脑内的沉积,但在艾滋病患者中艾滋病相关性痴呆发生的介导机制目前尚不清楚[7]。已证实,许多的细胞信号通路参与紧密连接蛋白的调节,而Ras信号转导通路与氧化应激有关[23]。Ras信号通路调节细胞生长、分化、运动和死亡等细胞过程,是许多信号通路的主要交叉点,Ras信号通过下游效应器Mitogen-activated protein kinase kinase(MEK)/Extracellular signal-regulated kinases(ERK)发挥作用,有研究显示Ras信号通路参与紧密连接蛋白表达的调节,与血脑屏障通透性密切相关[13]。有研究显示,在Tat刺激的脑血管内皮细胞中观察到剂量依赖性氧化应激增加及细胞内谷胱甘肽减少[18],细胞内活性氧(reactive oxygen species,ROS)是Ras/ERK信号转导通路重要的第二信使,HIV-1 Tat能激活Ras,诱导细胞内活性氧增加,通过Ras/ERK介导紧密连接蛋白的破坏[23],然而目前尚不清楚Ras信号通路是否参与调节HIV-1 Tat蛋白诱导Aβ沉积。
本研究中用Ras信号通路抑制剂FTS预处理HBEC-5i细胞,与HIV-1 Tat共培养发现FTS可减弱HIV-1 Tat对ZO-1及NEP蛋白与mRNA的抑制作用,上调ZO-1与NEP蛋白及mRNA表达(见图2、图3),推测可能与抑制Ras信号通路活性减少HIV-1 Tat诱导的氧化应激有关。
综上,HIV-1 Tat可诱导紧密连接蛋白ZO-1下调导致血脑屏障破坏,同时抑制NEP表达,本实验研究证实HIV-1 Tat可通过激活Ras信号转导通路下调人脑微血管内皮细胞(HBEC-5i)紧密连接ZO-1蛋白与mRNA,导致血脑屏障破坏,同时抑制NEP的表达,影响Aβ在脑内的沉积。这些发现对HIV-1感染促进中枢系统Aβ沉积的可能机制提供了新的认识,将Ras信号通路作为目标可能对艾滋病相关性痴呆提供一个新的治疗途径。
[1]Andras IE,Eum SY,Toborek M.Lipid rafts and functional caveolae regulate HIV-induced amyloid beta accumulation in brain endothelial cells[J].Biochem Biophys Res Commun,2012,421(2):177-183.
[2]Andras IE,Eum SY,Huang W,et al.HIV-1-induced amyloid beta accumulation in brain endothelial cells is attenuated by simvastatin[J].Mol Cell Neurosci,2010,43(2):232-243.
[3]Chen X,Hui L,Geiger NH,et al.Endolysosome involvement in HIV-1 transactivator protein-induced neuronal amyloid beta production[J].Neurobiol Aging,2013,34(10):2370-2378.
[4]Andras IE,Toborek M.HIV-1 stimulates nuclear entry of amyloid beta via dynamin dependent EEA1 and TGF-beta/Smad signaling[J].Exp Cell Res,2014,323(1):66-76.
[5]Chen L,Choi JJ,Choi YJ,et al.HIV-1 Tat-induced cerebrovascular toxicity is enhanced in mice with amyloid deposits[J].Neurobiol Aging,2012,33(8):1579-1590.
[6]Andras IE,Rha G,Huang W,et al.Simvastatin protects against amyloid beta and HIV-1 Tat-induced promoter activities of inflammatory genes in brain endothelial cells[J].Mol Pharmacol,2008,73(5):1424-1433.
[7]Kim J,Yoon JH,Kim YS.HIV-1 Tat interacts with and regulates the localization and processing of amyloid precursor protein [J].PLoS One,2013,8(11):e77972.
[8]Huang W,Rha GB,Han MJ,et al.PPARalpha and PPARgamma effectively protect against HIV-induced inflammatory responses in brain endothelial cells[J].J Neurochem,2008,107(2):497-509.
[9]Chen PT,Chen CL,Lin LT,et al.Design of peptide substrate for sensitively and specifically detecting two abeta-degrading enzymes:neprilysin and angiotensin-converting enzyme[J].PLoS One,2016,11(4):e0153360.
[10]Ito S,Matsumiya K,Ohtsuki S,et al.Contributions of degradation and brain-to-blood elimination across the blood-brain barrier to cerebral clearance of human amyloid-beta peptide(1-40) in mouse brain[J].J Cereb Blood Flow Metab,2013,33(11):1770-1777.
[11]陈艳兰,黄 文,巫相宏,等.Rho/ROCK信号通路在HIV-1 Tat诱导血脑屏障破坏及β淀粉样蛋白沉积中的作用[J].中风与神经疾病杂志,2015,32(12):1060-1063.
[12]Chen Y,Huang W,Jiang W,et al.HIV-1 Tat regulates occludin and abeta transfer receptor expression in brain endothelial cells via Rho/ROCK signaling pathway[J].Oxid Med Cell Longev,2016,4196572.
[13]Zhong Y,Smart EJ,Weksler B,et al.Caveolin-1 regulates human immunodeficiency virus-1 Tat-induced alterations of tight junction protein expression via modulation of the Ras signaling[J].J Neurosci,2008,28(31):7788-7796.
[14]Huang W,Eum SY,Andras IE,et al.PPARalpha and PPARgamma attenuate HIV-induced dysregulation of tight junction proteins by modulations of matrix metalloproteinase and proteasome activities[J].FASEB J,2009,23(5):1596-1606.
[15]Strazza M,Pirrone V,Wigdahl B,et al.Breaking down the barrier: the effects of HIV-1 on the blood-brain barrier[J].Brain Res,2011,1399:96-115.
[16]Alluri H,Wilson RL,Anasooya Shaji C,et al.Melatonin Prpserves blood-brain barrier integrity and permeability via matrix metalloproteinase-9 inhibition[J].PLoS One,2016,11(5):e0154427.
[17]Woollard SM,Bhargavan B,Yu F,et al.Differential effects of Tat proteins derived from HIV-1 subtypes B and recombinant CRF02_AG on human brain microvascular endothelial cells: implications for blood-brain barrier dysfunction[J].J Cereb Blood Flow Metab,2014,34(6):1047-1059.
[18]Banerjee A,Zhang X,Manda KR,et al.HIV proteins (gp120 and Tat) and methamphetamine in oxidative stress-induced damage in the brain:potential role of the thiol antioxidant N-acetylcysteine amide[J].Free Radic Biol Med,2010,48(10):1388-1398.
[19]Niu F,Yao H,Zhang W,et al.Tat 101-mediated enhancement of brain pericyte migration involves platelet-derived growth factor subunit B homodimer: implications for human immunodeficiency virus-associated neurocognitive disorders[J].J Neurosci,2014,34(35):11812-11825.
[20]Brian Spencer RaM,Ryan Gindi,et al.Peripheral delivery of a CNS targeted,metalo-protease reduces Aβ toxicity in a mouse of Alzheimer’s disease [J].PLoS One,2011,6(1):e16575.
[21]Rempel HC,Pulliam L.HIV-1 Tat inhibits neprilysin and elevates amyloid beta[J].AIDS,2005,19:127-135.
[22]Liu M,Guo H,Li C,et al.Cognitive improvement of compound danshen in an Abeta25-35 peptide-induced rat model of Alzheimer’s isease[J].BMC Complement Altern Med,2015,15:382-391.
[23]Dalvi P,Wang K,Mermis J,et al.HIV-1/cocaine induced oxidative stress disrupts tight junction protein-1 in human pulmonary microvascular endothelial cells:role of Ras/ERK1/2 pathway[J].PLoS One,2014,9(1):e85246.
The role of Ras signaling pathway in HIV-1 Tat induced dysfunction of ZO-1 and Neprilysin
JIANGWenlin,HUANGWen,CHENYanlan,etal.
(DepartmentofNeurology,FirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To evaluate the role of Ras singnaling pathway in HIV-1 Tat-induced dysfunction of ZO-1 and neprilysin (NEP,endogenous Aβ-degrading enzyme) in human cerebral microvascular endothelium cells (HBEC-5i). Methods HBEC-5i viability was tested by MTT assay,with the exposure of different concentrations of Ras inhibitor farnesylthiosalicylic acid (FTS).The levels of protein and mRNA of ZO-1 and NEP in HBEC-5i were evaluated with Western blot and Real-time reverse transcription polymerase chain reaction (qRT-PCR) assay respectively.Results Farnesylthiosalicylic acid at 20 μmol/L (0.35±0.06,P>0.05) or less had no significant effect on the HBEC-5i cell viability as determined by the MTT assay.Treatment with HIV-1 Tat decreased protein and mRNA levels of ZO-1 (0.53±0.07,P<0.01 in protein levels;0.42±0.10,P<0.05 in mRNA levels) and NEP (0.40±0.04,P<0.05 in protein levels;0.31±0.09,P<0.05 in mRNA levels).While inhibition of Ras by FTS effectively protected against HIV-1 Tat-induced downregulation of ZO-1 (1.20±0.22,P<0.01 in protein levels;1.10±0.19,P<0.05,in mRNA levels) and NEP(0.58±0.03,P<0.05 in protein levels;0.97±0.38,P<0.05 in mRNA levels) expression.Conclusion These results show that HIV-1 Tat induces dysfunction of ZO-1 and neprilysin in both protein and mRNA levels and these effects can be attenuated by FTS.Ras signaling pathway plays a role in HIV-1 Tat-induced ZO-1 dysfunction and neprilysin in cerebral microvascular endothelial cells.
HIV-1 Tat; Ras signaling pathway; ZO-1; NEP
2016-10-14;
2016-11-29
国家自然科学基金(No.81371333)
(1.广西医科大学第一附属医院神经内科,广西 南宁 530021;2.广西广西壮族自治区南溪山医院神经内科,广西 桂林 541000)
黄 文,E-mail:hwen1229@163.com
1003-2754(2017)02-0100-05
R749.1+1
A
