一种改良大鼠骨髓间充质干细胞培养方法
2017-03-16王博荣鲁曦张敏龙李聪聪李鹏程王雅宁金发光
王博荣 鲁曦 张敏龙 李聪聪 李鹏程 王雅宁 金发光
·论著·
一种改良大鼠骨髓间充质干细胞培养方法
王博荣1鲁曦1张敏龙1李聪聪1李鹏程1王雅宁2金发光1
目的建立大鼠骨髓间充质干细胞(BMSCs)的分离、改良培养、纯化方法,并进行细胞形态学观察、表面标志物鉴定及多向分化能力检测。方法通过改良全骨髓贴壁法对4周龄SD雄性大鼠脱颈处死,无菌条件下分离出骨髓进行原代培养、消化传代培养及纯化。对BMSCs进行形态学观察,收获第四代BMSCs进行流式细胞仪检测其细胞表面标记物CD90、CD29、CD34、CD45的表达率及向成脂方向诱导分化。结果BMSCs的原代培养形态学观察可见骨髓细胞接种于培养皿后,细胞呈圆型,大小不一,悬浮于培养液中。24 h后部分细胞开始贴壁,呈圆形、梭形或多角形。通过换液去除未贴壁的杂质细胞,可见短梭形、星形细胞分散贴壁生长,四五天可见放射状排列的细胞集落,伸出长短不一、粗细不均的突起,梭形细胞为主,胞浆丰富,胞核大、核仁清晰。7~8 d细胞呈集落生长,融合80%~90%,呈漩涡状,同向排列,9~10 d细胞排列紧密,逐渐融合成片。传代培养可见消化传代后,传代细胞24 h完全贴壁生长。细胞形态均一,呈梭形生长,细胞生长旺盛。四至五天可传代1次。可稳定连续传代7代以上,细胞形态及生长速度未见明显变化。BMSCs表面标记物的表达通过流式细胞仪检测结果显示,培养的第4代大鼠BMSCs均一表达CD90,CD29,阳性率分别为96.9%,96.6%;而CD34,CD45,呈阴性,阳性率分别为0.395%,7.56%。BMSCs加入成脂诱导剂后18 d,诱导而成的脂肪细胞累积脂质,脂滴变大,合并呈串珠状,经油红O染色呈鲜红色。结论与传统全骨髓贴壁法相比,改良后的全骨髓贴壁法操作步骤简单,降低离心对细胞的损害,减少了污染机会,节省经费,且分离的BMSCs细胞活性高,可大量分离、纯化、扩增,所获细胞具有间充质干细胞的一般生物学特性,经诱导培养后具有多向分化潜能。可为组织器官缺损性疾病、恶性肿瘤等的治疗和组织工程提供充足的种子细胞来源,具有重要的现实意义。
骨髓间充质干细胞; 原代培养; 形态学; 分化; 鉴定
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCS)是具有自我复制和多向分化潜能的非造血干细胞[1]。目前用于分离BMSCS的方法主要有4种:全骨髓贴壁法、密度梯度离心法、细胞表面分子标记分选法、细胞筛选法,其中以全骨髓贴壁法和密度梯度离心法最为常用。后两种方法虽然分离出的细胞纯度高,但由于分离细胞数量少,活性低,加之技术难、成本高,因此较少采用。目前还没有单一某种特异性的方法用来鉴定BMSCS,因此本实验采用形态学观察初步判断BMSCS,然后通过表面标志物的表达以及在诱导条件下对其多向分化能力的判定,逆向证明体外分离培养的细胞是否为BMSCs,以确立高效稳定骨髓的大鼠BMSCS分离培养体系和鉴定方案。体外分离出培养纯度高、活力强、生物特性均一的BMSCs对组织工程及细胞的体内、体外实验显得至关重要。本实验通过BMSCs的黏附特性,应用全骨髓贴壁培养法,并改良优化,提取过程中无需离心细胞,并将其胎牛血清浓度提高到15%,建立了一个简便、有效的原代培养、增殖和纯化BMSCs的方法,旨在观察大鼠BMSCs的生物学特性及其成脂分化等多种分化潜能,为组织工程寻找良好的种子细胞提供实践。
材料与方法
一、主要材料
SD雄性大鼠购自第四军医大学,SPF级,实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准[2]。L-DMEM培养液、胎牛血清购自Gibco公司, 油红O染色试剂、胰蛋白酶、青链霉素混合液购自Sigma公司,成脂细胞诱导液购自赛业公司,CD34、CD29、CD45、CD90表面分子抗体购自B公司,CD34、CD29、CD45、CD90表面分子抗体同型对照购自abcom公司。主要仪器设备: CO2恒温培养箱购自力康公司,超净工作台购自苏净安泰,FACS Calibur 流式细胞仪购自BD公司。
二、研究方法
1. BMSCs的原代分离培养:采用全骨髓贴壁改良法:4周龄SD雄性大鼠脱颈处死,70%乙醇全身浸泡消毒10 min。无菌条件取股骨及胫骨,去除骨上附着软组织,放置在 PBS缓冲液皿中。剪掉股骨和胫骨的骨骺端,露出骨髓腔,用5 ml注射器抽取添加青、链霉素、15%胎牛血清L-DMEM培养基,冲出骨髓在DMEM培养皿中,直至骨髓腔呈白色。无需离心,将盛有骨髓条的培养皿置于37 ℃、含有5% CO2饱和湿度培养箱中培养。
2. BMSCs的培养、纯化及传代:原代培养过程中,接种后72 h全量更换培养基,可将其中未贴壁细胞去除,以后每3 d全量更换新鲜培养基。待细胞铺满培养瓶底至细胞融合成单层,密度长至70%~80%融合时,用0.02%EDTA+0.25%胰酶消化,1︰2的比例进行传代培养。
3. BMSCs的形态学观察:培养后每日用倒置相差显微镜观察细胞形态变化及生长状况并拍照。
4. BMSCs鉴定:流式细胞仪检测细胞表面标记[3]:收获P4代生长状态良好细胞,0.02%EDTA+0.25%胰酶消化,吹打混匀,分别分成三管,A空白对照组,B抗体组,C同型对照组,计数细胞,各管细胞密度为1×106,4 ℃,300×g 离心,5 min,用PBS 500 μl漂洗细胞1次,去上清,加50 μl PBS,B管依次加入单克隆抗体CD34、CD45、CD90、CD29各2 μl。C管依次加入同型阴性对照。避光冰上孵育30 min,用PBS 2 ml洗涤细胞1次,以除去未结合抗体,以离心半径15 000 r/min离心5 min去上清,再重悬细胞,过滤,流式细胞仪进行检测分析。
5. BMSCs体外定向诱导分化[4-5]:选择第4代BMSCs,按4×103个/cm2浓度接种于6孔细胞培养板,待细胞贴壁生长至细胞密度达80%时,在各诱导孔的完全培养液中加入成脂细胞诱导剂(10 mmol/L地塞米松、10 mg/L胰岛素)。各诱导孔隔天换液1次,以未加诱导培养液的细胞培养孔作为对照。成脂细胞诱导剂诱导18 d后,经40 g/L多聚甲醛固定,对诱导分化的脂肪细胞进行油红O染色。
结 果
一、BMSCs的形态学观察
原代培养:骨髓细胞接种于培养皿后,细胞呈圆型,大小不一,悬浮于培养液中。24 h后部分细胞开始贴壁,呈圆形、梭形或多角形。通过换液去除未贴壁的杂质细胞,可见短梭形、星形细胞分散贴壁生长,4~5 d可见放射状排列的细胞集落,伸出长短不一、粗细不均的突起,梭形细胞为主,胞浆丰富,胞核大、核仁清晰。7~8 d细胞呈集落生长,融合80%~90%,呈漩涡状,同向排列,9~10 d细胞排列紧密,逐渐融合成片。传代培养:消化传代后,传代细胞24 h完全贴壁生长。细胞形态均一,呈梭形生长,细胞生长旺盛。四五天可传代1次。可稳定连续传代7代以上,细胞形态及生长速度未见明显变化,见图1、2。
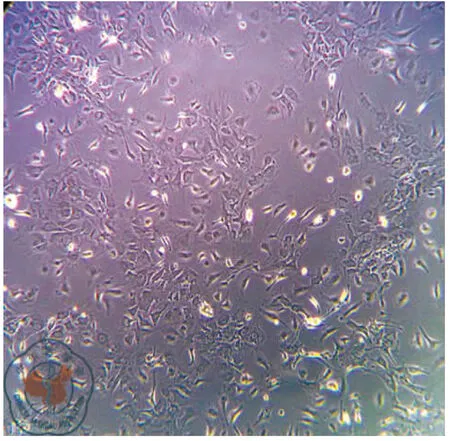
图1 骨髓间充质干细胞形态学观察(×20)
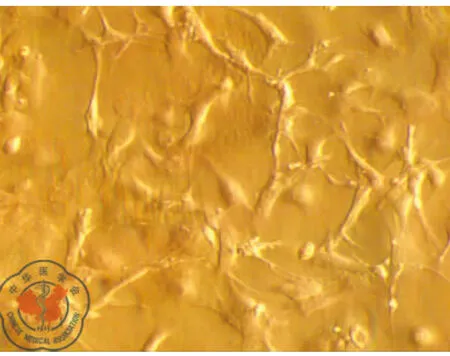
图2 骨髓间充质干细胞形态学观察(×200)
二、BMSCs表面记物的表达
流式细胞仪检测结果显示,培养的第4代大鼠BMSCs均一表达CD90, CD29,阳性率分别为96.9%, 96.6%;而CD34, CD45,呈阴性,阳性率分别为0.395%, 7.56%,见图3。
三、BMSCs成脂诱导分化鉴定
BMSCs加入成脂诱导剂后18 d,诱导而成的脂肪细胞累积脂质,脂滴变大,合并呈串珠状。经油红O染色呈鲜红色,见图4。
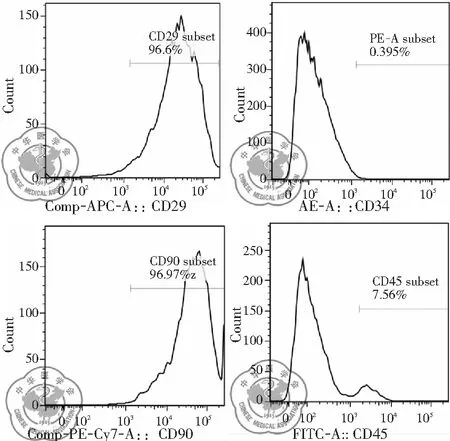
图3 大鼠骨髓间充质干细胞表面标志物的表达
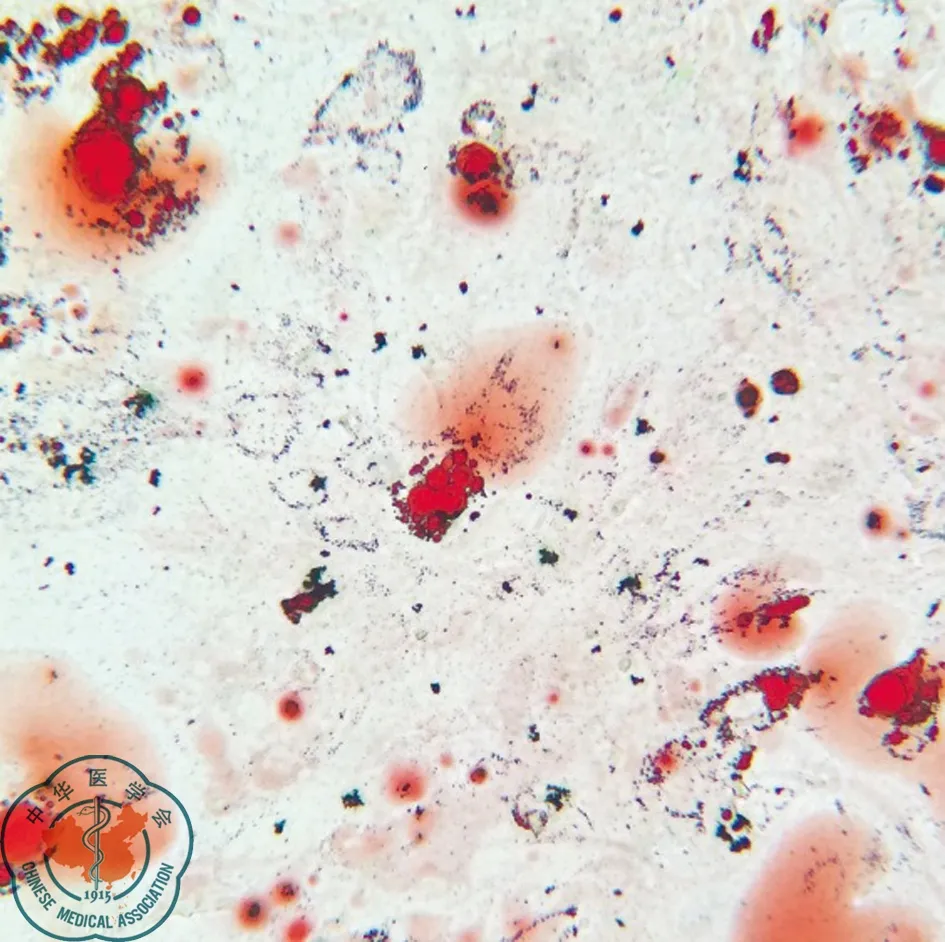
图4 大鼠骨髓间充质干细胞成脂诱导18 d油红O染色(×200)
讨 论
BMSCs是存在于骨髓中具有高度自我更新能力和多向分化潜能的成体干细胞。1966年,Friedenstein等[6]首次对BMSCs进行了描述,并从大鼠骨髓细胞中分离培养了骨/软骨形成祖细胞。目前,虽然已能在一些组织,包括肝脏、胚胎血、脐带血和羊水中分离培养,但是细胞的获得和研究主要集中在骨髓组织[7-9]。
在骨髓中含有较高的BMSCs,但改变了BMSCs生长的微环境,会影响细胞活力。本实验将全骨髓贴壁法进行改良,发现原代培养时采用全骨髓贴壁法所分离的BMSCs无需离心,72 h首次换液细胞贴壁数量多,之后同期观察其贴壁细胞数量明显优于离心后干细胞组贴壁。此外,全骨髓贴壁改良优化后所分离的细胞活性高,增殖能力强,原代细胞首次融合仅需5~7 d;其经流式细胞术纯化鉴定,其纯度达标,不亚于传统骨髓贴壁法经离心后所获得的细胞纯度,并避免了贴壁细胞数量相对少,细胞生长相对缓慢,活性相对低,及经离心后其原代细胞首次融合需10 d以上等缺点。这可能是因为分离出的细胞不经过离心环节,可以减少其污染概率,及离心造成的损伤,并且利用BMSCs的较强贴壁性对其进行分离,而细胞的生存、生长需要的某些因子来自于与其伴生的其他细胞的缘故。该法在很大程度上模拟了体内BMSCs的生长环境,含有的若干生长因子及促黏附物质促进了BMSCs的贴壁生长。原始的骨髓贴壁法经离心后BMSCs中可能失去了促进BMSCs贴壁的一些生长因子及促黏附物质,丧失了骨髓中原有的微环境,因此传统方法所分离的BMSCs生长速度较改良优化法要慢。BMSCs改良优化法在传代后纯度并没有太大区别,特别是在三四代以后。光镜下观察大鼠BMSCs,呈成纤维状或纺锤状,贴壁生长,增殖快,细胞相互紧密贴附生长,逐渐融合成片,沿胞体长轴有序排列,呈旋涡状。BMSCs经传代纯化,第4代骨BMSCs形态单一均匀,融合后呈典型的极性,漩涡状生长。目前,国际细胞治疗学会间充质及组织干细胞委员会提出的鉴定人来源BMSCs的3条最低标准[10]是:①对塑料底物的贴附特性;②CD105、CD29及CD90等阳性表达率≥95%,而CD45、CD34、CD14或CD11b、CD79a或CD19、HLA-DR等的阳性表达率≤5%;③具有多向分化潜能。因此,实验选取BMSCs表达阳性的指标CD29、CD90,以及表达阴性的指标CD34和CD45作为鉴定参考指标[11-20]。流式细胞仪检测结果显示,第4代BMSCs不表达造血前体细胞标志抗原CD34和白细胞标志抗原CD45,表达整合素家族成员的CD29、CD90。实验结果显示在成脂诱导条件下,第4代BMSCs分别表现出成脂肪细胞表型特征,说明体外分离培养的细胞为BMSCs。
以上结果表明,与传统全骨髓贴壁法相比,改良后的全骨髓贴壁法操作步骤简单,既降低了离心对细胞的损害,又减少了污染机会,节省经费,且分离的BMSCs贴壁时间短,增殖快,细胞数量多,经传代后能够纯化,提示全骨髓贴壁改良优化方法是一种更加简单有效的BMSCs分离方法。BMSCs分离方法可获得高纯度、增殖能力强、数量足的BMSCs,可为组织器官缺损性疾病、恶性肿瘤等的治疗和组织工程提供充足的种子细胞来源,具有重要的现实意义。
1 Gao Y, Zhu Z, Zhao Y, et al. Multiline age potential research of bovine amniotic fluid mesenchymal stem cells[J]. Int J Mol Sci, 2014,15(3): 3698-3710.
2 中华人民共和国科学技术部. 关于善待实验动物的指导性意见. 2006-09-30.
3 Bühring HJ, Treml S, Cerabona F, et al. Phenotypic characterization of distinct human bone marrow-derived MSC subsets[J]. Ann NY Acad Sci, 2009, 1176: 124-134.
4 常颖, 齐欣,卜丽莎. 成人骨髓间充质干细胞体外多向分化潜能特性的研究[J]. 中国危重病急救医学, 2005, 17(2): 95-97.
5 贾秀娟, 孙晓娟, 徐丽丽. 特定微环境条件下人骨髓间充质干细胞定向诱导分化为脂肪细胞[J]. 中国组织工程研究与临床康复, 2008, 12(34): 6635-6638.
6 Fridenshteǐn AIa, Piatetski -Shapiro II, Petrakova KV. Osteogenesis in transplants of bone marrow cells[J]. Arkh Anat Gistol Embriol, 1969, 56(3): 3-11.
7 Campagnoli C, Roberts IA, Kumar S, et al. Identification of mesenchymal stem/progenitor cells in human first-trimester fetal blood, liver, and bone marrow[J]. Blood, 2001, 98(8): 2396-2402.
8 Lee OK, Kuo TK, Chen WM, et al. Isolation of multipotent mesenchymal stem cells from umbilical cord blood[J]. Blood, 2004, 103(5): 1669-1675.
9 Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J]. Nature, 2002, 418(6893): 41-49.
10 De Ugarte DA, Alfonso Z, Zuk PA, et al. Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from adipose tissue and bone marrow[J]. Immunol Lett, 2003, 89(2-3): 267-270.
11 Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The international society for cellular therapy position statement[J]. Cytotherapy, 2006, 8(4): 315-317.
12 Fernández Vallone VB, Romaniuk MA, Choi H, et al. Mesenchymal stem cells and their use in therapy: what has been achieved?[J]. Differentiation, 2013, 85(1-2): 1-10.
13 De Schauwer C, Meyer E, Van de Walle GR, et al. Markers of stemness in equine mesenchymal stem cells: a plea for uniformity[J]. Theriogenology, 2011, 75(8): 1431-1443.
14 Zemel′ko VI, Grinchuk TM, Domnina AP, et al. [Multipotent mesenchymal stem cells of desquamated endometrium: isolation, characterization and use as feeder layer for maintenance of human embryonic stem cell lines][J]. Tsitologiia, 2011, 53(12): 919-929.
15 Zhang N, Dietrich MA, Lopez MJ. Canine intra-articular multipotent stromal cells (MSC) from adipose tissue have the highest in vitro expansion rates, multipotentiality, and MSC immunophenotypes[J]. Vet Surg, 2013, 42(2): 137-146.
16 Sousa BR, Parreira RC, Fonseca EA, et al. Human adult stem cells from diverse origins: an overview from multiparametric immunophenotyping to clinical applications[J]. Cytometry A, 2014, 85(1): 43-77.
17 Hwang SH, Park SH, Choi J, et al. Age-related characteristics of multipotent human nasal inferior turbinate-derived mesenchymal stem cells[J]. PLoS One, 2013, 8(9): e74330.
18 Branch MJ, Hashmani K, Dhillon P, et al. Mesenchymal stem cells in the human corneal limbal stroma[J]. Invest Ophthalmol Vis Sci, 2012 Aug 3; 53(9): 5109-5116.
19 De Cesaris V, Grolli S, Bresciani C, et al. Isolation, proliferation and characterization of endometrial canine stem cells[J]. Reprod Domest Anim, 2016, doi: 10.1111/rda.12885.
20 Phinney DG, Sensebé L. Mesenchymal stromal cells: misconceptions and evolving concepts[J]. Cytotherapy, 2013, 15(2): 140-5. doi: 10.1016/j.jcyt.2012.11.005.
(本文编辑:张大春)
王博荣,鲁曦,张敏龙,等. 一种改良大鼠骨髓间充质干细胞培养方法[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(1): 25-28.
Modified culture and identification of rat bone marrow mesenchymal stem cells
WangBorong1,LuXi1,ZhangMinlong1,LiCongcong1,LiPengcheng1,WangYaning2,JinFaguang1.
1DepartmentofRespiratoryMedicine,TangduHospital,FourthMilitaryMedicalUniversity,Xi′an710038,China;2DepartmentofRespiratoryMedicine,theSecondPeople′sHospitalofBaojiCity,Baoji721000,China
JinFaguang,Email:jinfag@fmmu.edu.cn
Objective To establish the rat bone marrow mesenchymal stem cells(BMSCs) were isolated and cultured, purified and modified optimization method in vitro, to observe cell morphology, and to assess surface markers and differentiation capacity detection. Mthods The bone marrows of 4-week-old, male Sprague Dawley rats were used to obtain mMSCs. Rats were euthanized via cervical dislocation. After 72 hours, the medium was replaced and fresh medium was provided every 3 days. BMSCs were identified via flow cytometry, multi-directional differentiation capacity, and morphology. Results Primary culture: Bone marrow cells were seeded in round culture dishes of different sizes and suspended in culture medium. After 24 hours, the part of the cells adhered to the culture dish were visible as round, fusiform, or polygonal. After removal of the non-adherent cells by media replacement, the adherent cells were found to be short, spindle or star shaped, and scattered on the plastic surface. After 4 or 5 days, radially arranged cell colonies were visible, which differed in length and thickness. Spindle cells comprised the main colonies, possessing abundant cytoplasm and a large nucleus. After a week, the cells showed colony growth, were fused at approximately 80%-90%, and were reminiscent of a whirlpool, all with the same directionality. After 10 days, the cells were arranged in close proximity to one another, gradually integrating into sheet form. Culture passage: After digestion and passage, the cells adhered to the plastic surface within 24 hours. The cells were homogeneous, spindle-shaped, and displayed strong cell growth. Each passaging was performed after 4 or 5 days of growth. Cell morphology and growth rate did not significantly differ after 10 generations of stable and continuous passage. The results of flow cytometry revealed a positivity rate of CD90 expression of 96.9%, and of 96.6% for CD29. Thus, the negativity rate of CD45 was 7.56%, and that of CD34 was 0.395% in fourth generation rat mMSCs. The mMSCs were added into an adipocytes-inducing agent, where they were cultured for 18 days, during which time, lipid and lipid droplet accumulation was induced with a string of beads. The oil red O staining was bright red. Conclusions Without centrifugation of whole bone marrow adherent culture method has the advantages of simple operation, is not easy to pollute, highly active cell, bulk separation, purification and amplification of BMSCs, cells with a mesenchymal stem cell biological characteristics. After cultured with multilineage differentiation potential.
Bone marrow mesenchymal stem cells; Primary culture; Morphology; Differentiation; Identification
10.3877/cma.j.issn.1674-6902.2017.01.006
基金编号: 国家自然科学基金资助项目(81570067)
710038 西安,第四军医大学唐都医院呼吸内科1721000 宝鸡,宝鸡市第二人民医院呼吸内科2
金发光,Email: jinfag@fmmu.edu.cn
R563
A
2016-03-29)
