局部应用辛伐他汀对家兔下颌骨骨折愈合的影响
2017-03-15刘屹嵩牛恒符增涛
刘屹嵩+牛恒+符增涛

[摘要] 目的 研究局部应用辛伐他汀对家兔下颌骨骨折愈合的影响,为辛伐他汀在口腔颌面部骨折愈合的临床应用提供相应的理论依据。方法 选择24只成年雄性新西兰家兔,所有家兔均在左侧下颌骨体处做线性骨折模型后行钛板钛钉内固定,将实验家兔随机分成实验组和对照组。实验组家兔下颌骨骨折区局部覆盖含有辛伐他汀的明胶海绵缓释膜,对照组骨折区局部覆盖不含辛伐他汀的明胶海绵缓释膜。分别于术后第2、4、8周处死实验动物,通过HE染色和免疫组化法分析辛伐他汀对家兔下颌骨骨折愈合的影响。结果 实验组骨痂形成与改建速率快于对照组;术后2、4周实验组骨形态发生蛋白-2阳性表达率明显高于对照组(P < 0.05),在第8周时两组差异无统计学意义(P > 0.05)。结论 局部应用辛伐他汀能促进新骨的形成,加速骨折的愈合。
[关键词]辛伐他汀;下颌骨骨折;骨折愈合;骨形态蛋白-2
[中图分类号] R782 [文献标识码] A [文章编号] 1673-7210(2017)01(a)-0024-04
[Abstract] Objective To investigate the effect of Simvastatin on repairing mandibular fracture in rabbits, in order to provide a theoretical basis for the clinical application of Simvastatin in the treatment of oral and maxillofacial fracture. Methods 24 adult male New Zealand rabbits made into fracture model with titanium plate fixation were divided into two groups randomly, including experimental group and control group. The rabbits of experimental group were covered by Simvastatin in form of slow-release gelfoam at local lesion and those of control group were covered by gelfoam without Simvastatin at local lesion. After 2, 4, 8 weeks of surgery, rabbits were executed. The effects of Simvastatin on bone fracture repairing were evaluated by HE staining and immunohistological staining. Results The rate ofbone callus reaction in the experimental group was faster than that of control group. The expression of bone morphogenetic protein-2 in the experimental group was higher than that in control group at 2 and 4 weeks after surgery, and the expression of bone morphogenetic protein-2 in two groups had no significant difference at 8 weeks after surgery (P > 0.05). Conclusion Simvastatin can promote the formation of new bone and accelerate fracture healing.
[Key words] Simvastatin; Mandibular fracture; Fracture healing; Bone morphogenetic protein-2
人體颌面部突出于体表且直接暴露于外界,易受外力致伤。有文献记载口腔颌面部外伤占全身创伤的7%~20%[1],而下颌骨骨折又占颌面部骨折的大部分。长期以来如何更快更好地促进颌面部骨折的愈合,使其恢复原有的形态和功能,一直是口腔科医生的追求。辛伐他汀是临床上常用的一类降脂药。Mundy等[2]研究表明,他汀类药物具有增强骨形态发生蛋白-2(BMP-2)启动因子的活性。Sugiyama等[3]研究发现,亲脂性他汀药物如辛伐他汀比亲水性的他汀药物更能促进BMP-2启动因子活性。有实验证实局部应用辛伐他汀能促进新骨形成[4],因而辛伐他汀一直是研究成骨作用的热点药物之一。本实验主要研究局部应用辛伐他汀对家兔下颌骨骨折愈合的影响。
1 材料与方法
1.1 实验动物
选用24只6月龄健康雄性新西兰家兔,体重(3.0±0.2)kg,清洁度良好,合格证号:SCXK(黑)2012-002,由哈药集团中药二厂提供。在清洁干燥的饲养条件下入圈饲养观察1周后,将所有家兔进行编号(1~24号),将编号所对应的纸条采取抽签的方式随机抽取12个作为实验组,剩下12个作为对照组。
1.2 实验药物
将10 mg辛伐他汀(山东罗欣药业有限公司)碾碎溶于10 mL无水乙醇(辽宁泉瑞试剂有限公司)中混匀,制备辛伐他汀溶液,吸取1 mL溶液完全浸入明胶海绵(江西省祥恩医疗科技发展有限公司,批号15110801)中,恒温箱烘干,即制备成含有1 mg辛伐他汀的明胶海绵。取1 mL不含辛伐他汀的无水乙醇完全浸入明胶海绵,恒温箱烘干,即制备成不含辛伐他汀的明胶海绵。60Co辐射灭菌。
1.3实验方法
所有动物于耳缘静脉处注射20%乌拉坦溶液(5 mL/kg)麻醉,取仰卧位固定于手术台,备皮、消毒,于左侧下颌骨体部用牙科高速涡轮机致下颌骨线性骨折,钛板钛钉内固定。实验组骨折断端覆盖含有辛伐他汀的明胶海绵,对照组断端覆盖不含辛伐他汀的明胶海绵,生理盐水冲洗后分层缝合。使用空气栓塞方法于术后第2、4、8周每组分别处死4只实验动物。
1.4 标本制备
截取骨折区骨块并去除表面软组织,依次经多聚甲醛固定,EDTA脱钙,梯度乙醇脱水,石蜡包埋,制备成5 μm厚切片(每组4只标本,每只标本取20张切片,共80张)。HE染色后观察骨折区新骨形成情况;按BMP-2免疫组化试剂盒(武汉博士德生物工程有限公司)检测步骤对标本染色(SP法),并在显微镜下观察,检测骨折区BMP-2表达情况。
1.5 指标检测
每张切片由3位资深的病理科医生独立阅片,每张切片在高倍镜下(400×)随机选取10个视野,每个视野计数100个细胞,根据其阳性细胞所占的比例及染色强度进行综合评分。染色强度分为:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞所占百分比:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。两项评分相乘,0~1分为(-),≥2分为(+)。
1.6 统计学方法
采用SPSS 23.0软件进行统计学处理,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 组织形态学观察
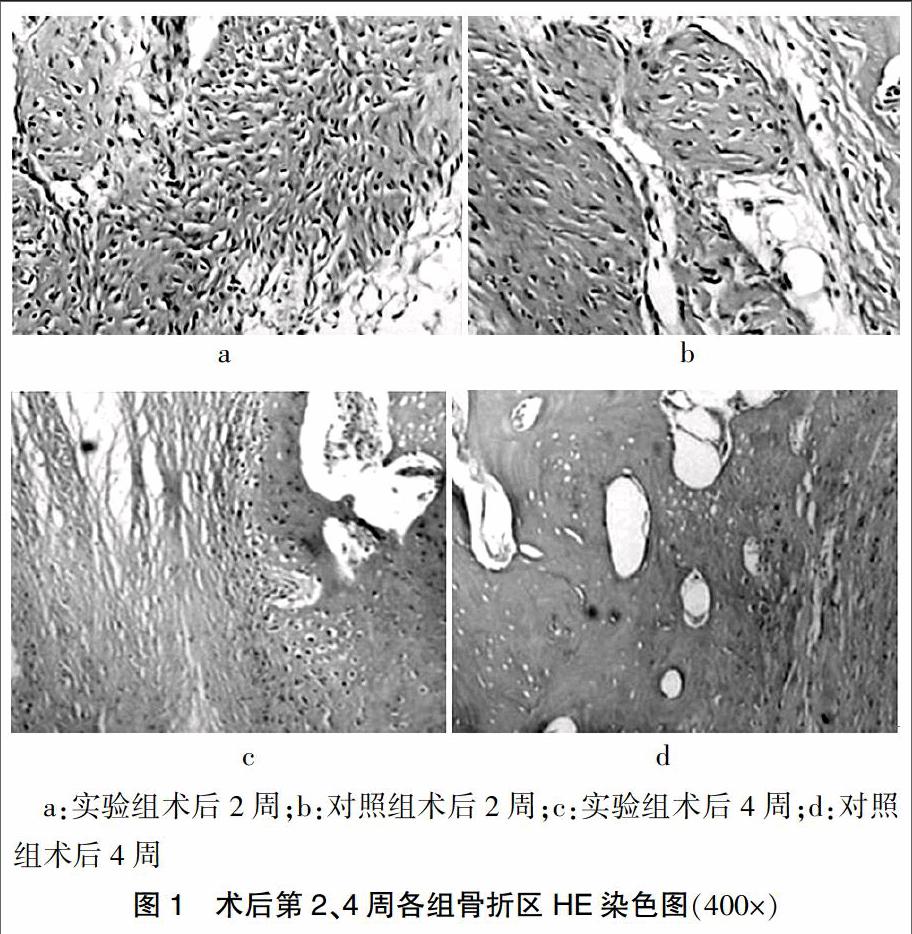
通过光镜下观察HE染色切片发现,术后2周时,实验组骨折区新生骨痂内可见大量网状排列的新生骨小梁,骨小梁较粗且边缘清晰,骨小梁周围可见有大量成纤维细胞及成骨细胞和少量血细胞及炎症细胞,部分地方可见少量的软骨组织及成软骨细胞;对照组可见骨痂区主要有疏松结缔组织组成,结缔组织中可见少量较细的骨小梁,骨小梁周围有散在的成骨细胞及炎症细胞。术后4周时,实验组骨折区可见骨小梁进一步增多、增粗,骨小梁之间逐渐相互融合,排列趋于与牙体长轴平行的规则排列,且较大的小梁空隙被新生骨充满,骨小梁间可见活跃的成骨细胞、成纤维细胞、破骨细胞同时存在,骨小梁部分被吸收,骨折区可见少量新生血管;对照组较2周时骨小梁明显增多,骨小梁呈网状或海绵状排列的不规则排列,可见部分骨小梁相互融合,新生骨数量较同期实验组减少,骨小梁周围可见成骨细胞及少量的破骨细胞和新生血管。术后8周,实验组骨折基本愈合,骨折区有大量致密骨组织形成,新生骨排列呈板状,与骨长轴方向一致,两端与骨皮质连接;对照组骨折区愈合与实验组大致相同,骨小梁板状排列,可见少量未骨化的软骨组织。不同时期骨折区HE染色情况见图1。
2.2 骨折区内BMP-2的表达
BMP-2免疫组织化学阳性染色呈棕黄色。术后2、4周实验组BMP-2的阳性表达率明显高于对照组,差异有统计学意义(P < 0.05);术后8周,BMP-2在骨折区表达明显减弱,且两组差异无统计学意义(P > 0.05)。见图2、表1。
3讨论
骨折的愈合是由成骨細胞、破骨细胞以及骨形态发生蛋白、血小板衍生生长因子、成纤维细胞生长因子、转化生长因子(TGF)、血管内皮生长因子等众多因子参与的一个长期复杂的生物学修复过程,而骨折愈合的速度和质量由局部生长因子控制[5]。骨折的愈合过程分为骨折断端直接通过哈弗系统重建完成的一期骨愈合,其特点是无骨痂的形成以及骨折表面无骨吸收的痕迹;通过血肿形成、血肿机化、骨痂形成、骨痂机化4个阶段的二期骨愈合,其特点是有骨痂的形成。本实验采用骨折断端解剖式复位后,利用进行钛钉钛板坚强内固定使其进行骨折的一期骨愈合,模拟临床上对颌骨骨折常用的治疗方法。在术后第2周及第4周HE染色中不难看到,实验组中骨纤维的数量及排列、软骨组织及破骨细胞的出现均早于对照组出现,说明实验组骨折后骨的愈合及新骨的重塑早于对照组。
BMP-2是TGF-β超家族中的一员,不但能单独诱导骨组织形成,而且可以通过自身调节控制其他BMPs的活性[6],在骨形成中起重要的调控作用。BMP-2由成骨细胞分泌,可通过促进成骨细胞及其前体细胞增殖,以及骨髓基质干细胞(BMSCs)甚至是肌细胞的前体细胞向成骨细胞分化来刺激骨形成[7-8]。目前BMP-2作为BMSCs成骨定向分化的主要调控因子已经运用于临床[9]。但是由于BMP-2的制备过程复杂、产量低、活性不稳定、体内代谢快、骨诱导时间短,且作为外源蛋白植入体内用量大时会引起毒副作用,甚至免疫排斥反应[10]。因而寻找一种刺激自身BMP-2分泌的药物十分必要,而实验证明辛伐他汀可以通过诱导BMP-2的信号转导分子mRNA的表达来上调BMP-2的表达[11]。本实验结果表明,在术后2、4周骨折区BMP-2均显著表达,且同期实验组明显高于对照组(P < 0.05)。说明此期两组均有活跃的成骨发生,但是实验组较对照组更加明显。术后8周两组BMP-2表达明显降低,差异无统计学意义(P > 0.05),说明术后8周两组骨折均基本愈合。
辛伐他汀作为HMG-CoA还原酶抑制剂广泛应用于临床中,可抑制胆固醇合成,降低心脑血管疾病发生率。随着对辛伐他汀药物作用研究的深入,发现辛伐他汀既可以通过增加对信号传导蛋白Smad1及Smad5基因的表达来增加BMP-2的信号传递来,并且抑制部分TGF-β/Smad3通路的凋亡,促进成骨效应[12-14];通过增加磷脂酰肌醇-3激酶活性,从而诱导BMP-2转录来促进骨形成[15];通过激活丝裂原活化蛋白激酶(MAPK)途径,诱导具有调节细胞增殖功能的成骨细胞热休克蛋白27表达促进骨形成;并且辛伐他汀通过增加BMSCs中成骨细胞转录因子Runx2表达、激活p38MAPK通路途径诱导BMSCs向成骨细胞分化[16-17];通过上调成骨细胞连接蛋白43的基因以及其蛋白的表达来促进成骨细胞的增殖分化,从而达到促进成骨的作用[18]。本实验采用明胶海绵为载体局部缓释辛伐他汀,研究其对骨折愈合的影响,实验结果表明辛伐他汀能有效诱导局部BMP-2表达,促进骨折愈合;从HE染色中发现成骨细胞、BMSCs实验组均多且早于对照组出现,而且相同时期实验组骨折区骨纤维从数量以及粗细均明显优于对照组,说明局部应用辛伐他汀能有效地诱导BMSCs向成骨细胞分化,从而促进骨折愈合。
目前辛伐他汀促进成骨的动物实验中,在用药方式上多数采用口服给药和皮下注射。口服他汀类药物需要经过肝脏的首过效应,真正进入血液循环的药物不足5%,且进入骨折区的药物更少;此外辛伐他汀的半衰期为1~3 h[19],并且在服药后的2 h才开始在末端组织内小剂量聚集[20];并且口服给药一般需要较长疗程,患者依从性不能保证。皮下注射会给患者带来附加伤害、增加感染机会。因此两种给药方式在临床使用中均存在弊端。在用药剂量上,局部应用辛伐他汀的药物剂量一直存在一定争议,有实验证明局部应用含有1 mg辛伐他汀是更有利于促进新骨形成[21-22]。本实验采用骨折复位固定手术同时,给予含有1 mg辛伐他汀的明胶海绵缓释给药,使药物迅速作用于骨折部位,避免口服给药和注射给药的缺陷,保证长期局部所需的药物浓度。
本次试验表明局部缓释应用辛伐他汀能够加速骨折愈合,为今后辛伐他汀在促进新骨形成、加快骨折愈合方面的研究提供理论依据以及实验基础,为临床上治疗颌面部骨折提供一种新思路。但是辛伐他汀促进成骨机制以及局部应用药物的用量方面需要进一步研究。本次试验样本量较小,具有一定局限性,需要更多高质量、大样本的实验进行验证。
[参考文献]
[1] King RE,Scianna JM,Petruzzelli GJ. Mandible fracture patterns:a suburban trauma center experience [J]. Otolaryngol,2004,25(5):301-307.
[2] Mundy G,Garrett R,Harris S,et al. Stimulation of bone for mation in vitro and in rodents by statins [J]. Science,1999,286(5446):1946-1949.
[3] Sugiyama M,Kodama T,Konishi K,et al. ComPacting an simvastatin,but not Pravastatin,induce bone morphogenetic Protein 2 in human osteosarcoma cells [J]. Bioehem Bio Phys Res Commun,2000,271(3):688-692.
[4] 徐欣晨,陈惠,张翕,等.2种给药方式下辛伐他汀对牙周炎骨质疏松大鼠上颌骨骨丢失的影响[J].口腔材料器械杂志,2016,24(2):79-83.
[5] Sykaras N,Opperman LA. Bone morphogenetic proteins(BMPs):how do they function and what can they offer the clinician [J]. Oral Sci,2003,45(2):57-73.
[6] Khosla S. Building bone to reverse osteoporosis and repair fractures [J]. Clin Invest,2008,118(2):421.
[7] Yamaguchi A,k atagiri T,Ikeda T,et al. Recombinant human bone morphogenetic protein-2 stimulates osteoblastic maturation and inhibits myogenic differentiation in vitro [J]. Cell Boil,1991,113(3):681.
[8] Thies RS,Bauduy M,Ashton BA,et al. Recombinant human bone morphogenetic protein-2 induces osteoblastic differentiation in W-20-17 stromal cells [J]. Endorcrinology,1992,130(3):1318.
[9] Boden SD,Grob D,Damine C. Ne2-steo bone growth factor for posterolateral lumbar spine results from a nonhuman primate study and a prospective human clinical pilot study [J]. Spine,2004,29(5):504-514.
[10] Camper Y. Bone grafts and substitutes [J]. Orthop Network,1995,6(3):7-9.
[11] 高陶磊,李蘊聪,崔敏,等.辛伐他汀对大鼠成骨细胞骨形态蛋白2及其信号传导蛋白Smad 1和Smad 5表达的影响[J].陕西医学杂志,2016,45(2):141-143.
[12] Park JB. Combination of simvastation and bone morphogenetic protein-2 enhances the differentiation of osteoblasts by regulating the expression of phosphor-Smad 1/5/8 [J]. Exp Ther Med,2012,4(2):303-306.
[13] Kaji H,Naito J,Inoue Y,et al. Statin suppresses apoptosis in osteoblastic cells:role of transforming growth factor-beta-Smad 3 pathway [J]. Horm Metab Res,2008,40(11):746-751.
[14] 桑遥彩,包翠芬,武蕾,等.辛伐他汀对BMSCs成骨分化过程中TGF-β1/smad信号通路的影响[J]. 中国临床解剖学杂志,2015,33(4):434-438.
[15] Ghosh CN,Mandal CC. Statin-induced Ras activation integrates the phosphatidylinositol 3-kinase to Akt and MARK for bone morphogenetic proten-2 experssion in osteoblast differentiation [J]. Biol Chem,2007,282(7):4983-4993.
[16] Hu N,Feng C,Shim JH,et al. Regulative effect of mir-205onosteogenic differentiation of bone mesenchymal stem cells (BMSCs) possible role of SATB2/Runx2 and ERK/MAPK pathway [J]. Int J Mol Sci,2015,16(5):10491-10506.
[17] 劉家寅,刘光源,田发明,等.辛伐他汀通过p38MAPK信号通路诱导BMSCs成骨分化的研究[J].中国骨质疏松杂志,2016,22(2):125-130.
[18] 王国亮,蔡湘波,李文壮,等.辛伐他汀对成骨细胞增殖分化以及连接蛋白43表达的调控[J].中国组织工程研究,2014,18(15):2303-2308.
[19] Schachter M. Chemical,pharmacokinetic and pharmacodynamic properties of statins:an update [J]. Fundam Clin Pharmacol 2005,19(1):117-125.
[20] Germershausen JI,Hunt VM,Bostedor RG,et al. Tissue selectivity of the cholesterol-lower agents lovastatin,simvastatin and pravastatin in rats in vivo [J]. Biochem Biophys Res Commun,1989,158(3):667-675.
[21] 薛江义,张晶晶,卢向东,等.阿仑膦酸钠联合辛伐他汀对骨质疏松骨折的影响[J].中国医药科学,2014,4(10):20-23.
[22] 邹卫龙,于龙,王亮,等.不同剂量辛伐他汀载药物体系对家兔骨质疏松模型骨修复的实验研究[J].中国骨质疏松杂志,2016,22(4):437-442.
(收稿日期:2016-08-19 本文编辑:程 铭)
