乌苏里蝮蛇血凝酶的分离纯化和质量研究
2017-03-15张雪玲崔艳崔爱湜
张雪玲+崔艳+崔爱湜
[摘要] 目的 建立一种分离纯化乌苏里蝮蛇血凝酶(WH)的方法并为其制定质量标准。 方法 先后采用分子筛层析法、离子交换色谱法、亲和层析法从乌苏里蝮蛇毒中分离纯化得到一种具有凝血活性的酶成分,并采用SDS-聚丙烯酰胺凝胶电泳法、RP-HPLC法测定其纯度,HPSEC法测定其分子量,IEF法测定其等电点,Lowry法测定其蛋白浓度,并用标准人血浆法测定该酶的比活力。 结果 从乌苏里蝮蛇蛇毒中分离纯化了一种凝血酶成分,SDS-Page显示为一条带、测得分子量约为34 kD,RP-HPLC得到单一的色谱峰,HPSEC法测得该酶分子量为34.7 kD,等电点为5.25,此酶具有体外凝血活性,比活力为5.40 μg/U。 结论 该方法可用于WH的分离纯化,制定的质量标准可用于控制该血凝酶的质量。
[关键词] 乌苏里蝮蛇;血凝酶;分离纯化;质量标准
[中图分类号] R282.740.2 [文献标识码] A [文章编号] 1673-7210(2017)01(a)-0020-05
[Abstract] Objective To establish a method of purification and quality standards for Wusuli haemocoagulase. Methods A component of enzyme with the clotting activity was isolated from Wusuli viper by gel filtration and anion-exchange chromatography and heparin-Sepharose affinity chromatography. SDS-Page and RP-HPLC were used to determine its purity. HPSEC was used to determine the molecular weight. IEF method was used to measure the isoelectric point while its protein concentration was determined by the Lowry method. Standard human plasma method was used to determine the specific activity of the enzyme. Results A kind of thrombin was purified from Wusuli viper. One band was displaied on SDS-Page and the molecular weight was about 34 kD. RP-HPLC got one single chromatographic peak. The molecular weight of this enzyme was measured by HPSEC method was 34.7 kD and the isoelectric point was 5.25. This enzyme possesses the characteristion of extractor clotting activity and its specific activity was 5.40 μg/U. Conclusion This method can be used for Wusuli haemocoagulase separation and purification. And this quality standards can be used to control the quality of this haemocoagulase.
[Key words] Wusuli viper; Haemocoagulase; Separation and purification; Quality standards
我國具有十分丰富的蛇类资源,全世界已知的蛇种有10科2200多种,而我国拥有7科175种之多,而且我国也是最早将蛇毒应用于医疗的国家[1]。蛇毒类凝血酶作为一种动物来源的蛋白酶类止血药,由于其毒性低、起效快、药效持久且不引起血管内栓塞等优点,近年来已经引起了人们的极大关注[2]。乌苏里蝮蛇(拉丁学名Gloydius Ussuriensis),主要分布在东北及内蒙古东部地区,是一种体型较小的血循类毒蛇[3]。本文从乌苏里蝮蛇蛇毒中提取血凝酶,且提取的酶纯度高,止血效果明显,提取纯化工艺简便可靠,可用于大批量生产。鉴于未检索到有关该酶质量标准方面的文献,本文还为该酶建立了完整的质量标准,能够更好地控制该产品的质量,也为其建立质量标准,为蛇毒血凝酶类新药的开发和质量控制提供技术依据。
1 仪器与试药
1.1 仪器
VFD-1000真空冷冻干燥机(北京博医康);ROTINA 380R冷冻高速离心机(德国Hettich);BP 211D电子天平(德国Sartorius);EPS 601型多功能电泳仪及电泳槽及制胶模具(美国Amersham Pharmacia Biotech公司);Waters e2695+e2489高效液相色谱仪(美国Waters);UV 2550紫外可见分光光度计(日本岛津);Sephadex G-50凝胶层析柱,Sephadex A-25离子交换层析柱,肝素-Sepharose亲和层析柱(美国GE公司);3.5 kD透析袋(瑞典Pharmacia);3 kD离心超滤管(美国Millipore公司);Vydac 208TP54-C8(5 μm,250 mm×4.6 mm)色谱柱;TSK-gel G3000Swxl(7.8 mm×300 mm)色谱柱。
1.2 试药
蛇毒(产自东北黑龙江省乌苏里蝮蛇蛇毒,采毒后经冷冻干燥备用,批号20150702);低分子量Maker(GE Healthcare,17-0446-01);IEF Maker(等电点范围pH3~10,16-39212-01)及两性电解质溶液均购自GE公司(批号9909-1504);标准分子量Maker(670、158、44、17、1.3 kD)(Sigma,P0061-11);标准人血浆(Standard Plasma,Siemens,2015-08-28);福林酚试液(Sigma,40N5589),其余试剂均为分析纯。
2 方法与结果
2.1 Sephadex G-50凝胶层析
Sephadex G-50凝胶层析柱,用pH 7.8,0.05 mol/L Tris-HCl缓冲液平衡。称取乌苏里蝮蛇蛇毒冻干粉1 g,溶解于2 mL上述缓冲液中,4℃、4000 r/min离心10 min,将上清液上样,流速0.3 mL/min,1 mL/管收集流出液,做体外凝血试验。
2.2 Sephadex A-25离子交换层析
将上述凝血活性最强的收集液于4℃、4000 r/min离心10 min,取上清液置3 kD超滤管中超滤浓缩,待纯化。Sephadex A-25柱用pH 7.6,0.05 mol/L Tris-HCl缓冲液平衡,将超滤浓缩液上柱,用上述缓冲液洗脱,流速0.5 mL/min,1 mL/管,测各管体外凝结活性,收集活性最强组分,将此溶液超滤浓缩,4℃下用水透析24 h,期间换3次水,冷冻干燥,制得纯化的乌苏里蝮蛇血凝酶(Wusuli haemocoagulase,WH),待分析。
2.3 肝素-Sepharose亲和层析
肝素-Sepharose亲和层析柱用pH 7.6,0.05 mol/L Tris-HCl缓冲液平衡。将上一步收集的收集液冷冻干燥,用上述缓冲液溶解,并在4℃下透析24 h,4℃、4000 r/min离心10 min,取上清液上柱,用上述缓冲液洗脱,流速1 mL/min,1 mL/管,测各管体外凝结活性,收集活性最强组分即为纯化的血凝酶活性成分,将此溶液超滤浓缩,4℃下用水透析24 h,期间换3次水,冷冻干燥,制得纯化的WH,待分析。
2.4 SDS-聚丙烯酰胺凝胶电泳法测定纯度及分子量
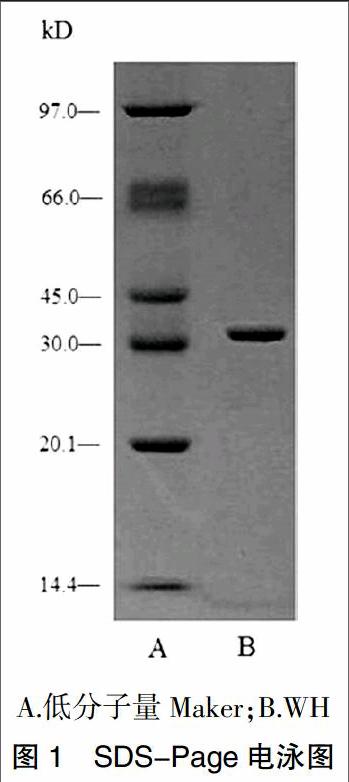
参照Ame rsham Pharmacia 公司的蛋白电泳技术手册[4]操作。采用SDS-聚丙烯酰胺凝胶电泳法,浓缩胶5%,分离胶10%,还原电泳,考马斯亮蓝染色,检测纯化组分的纯度。同时以低分子量Maker蛋白绘制标准曲线,计算该组分的分子量。电泳结果见图1。由图可见经纯化的组分电泳显示为一条带,纯度良好,分子量约为34 kD。
2.5 RP-HPLC法测定其纯度
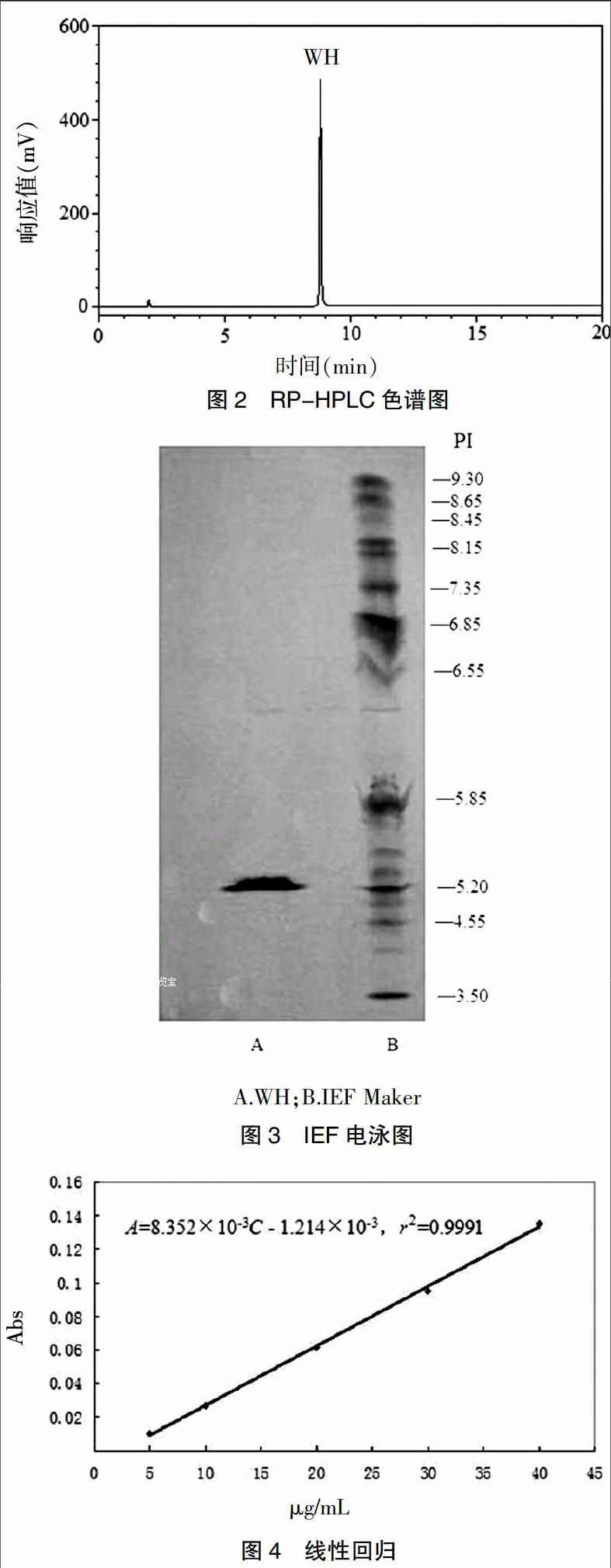
采用高效液相色谱法,Vydac 208TP54-C8(5 μm,250 mm×4.6 mm)色谱柱,流动相为0.05%三氟乙酸-85%乙腈(含0.05%三氟乙酸)(50∶50),流速1.0 mL/min,柱温40℃,检测波长为280 nm,进样量为50 μL,注入液相色谱仪测定,色谱图见图2。由色谱图可知,该色谱条件下WH显示单一色谱峰,表明纯化后得到的蛋白质纯度良好。
2.6 HPSEC法测定分子量
采用空间排阻色谱法,以TSK-gel G3000Swxl(7.8 mm×300 mm)为色谱柱,以55 mmol/L枸橼酸钠-0.01%Tween80溶液[pH6.3±0.1(称取二水合枸橼酸钠15.15 g,一水合枸橼酸0.74 g,加入0.5 mL 20% Tween80,加水800 mL溶解,用1 mol/L枸橼酸或10%氢氧化钠调节pH至6.3±0.1,用水定容至1000 mL,经0.2 μm滤膜过滤)]为流动相,流速为0.5 mL/min,柱温为室温,检测波长为280 nm。以标准分子量Maker(670、158、44、17、1.3 kD)(Sigma)为对照,并以保留时间为横坐标,以分子量对数为纵坐标绘制标准曲线。得到该酶的分子量为34.7 kD,与SDS-Page法测得的分子量相吻合。
2.7 IEF法测定等电点
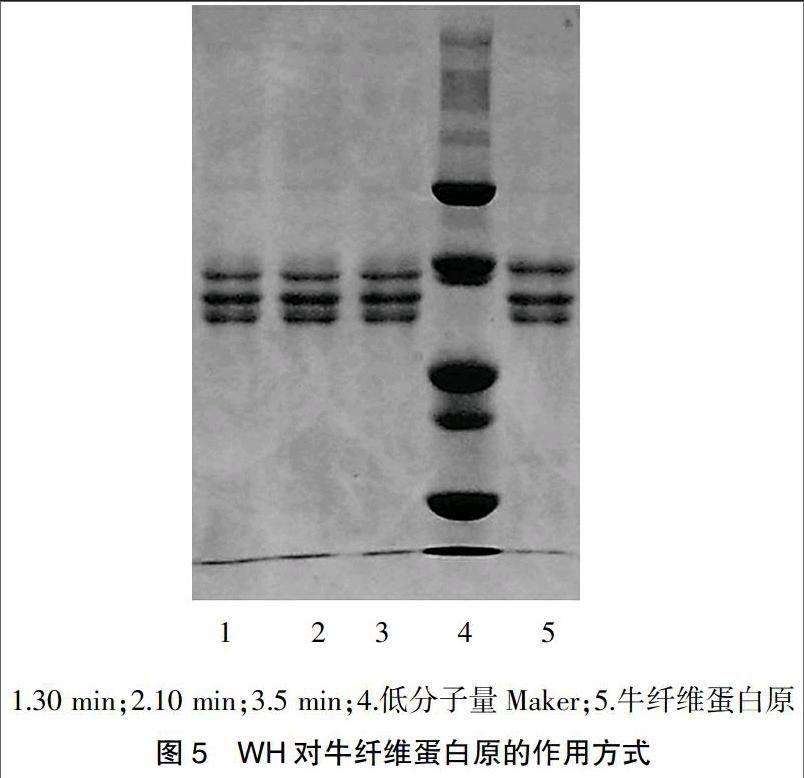
采用IEF电泳法测定该酶等电点,以10%丙烯酰胺贮液-两性电解质-50%甘油-超纯水-10%过硫酸铵(AP)-四甲基乙二胺(TEMED)-按2.5∶0.35∶0.5∶1.25∶0.025∶0.006的比例混合均勻为凝胶液制成电泳胶,200 V预电泳至电流降至1.0 mA左右,200 V恒压电泳,使电流降至1.0 mA左右。再根据情况升高电压,直至电流不再降低为止,固定30 min,考马斯亮蓝染色60 min,脱色液中脱色至本底无色。IEF电泳图见图3。结果可见WH的等电点为5.25。
2.8 Lowry法测定蛋白浓度
根据《中国药典》中规定的Lowry法[7],检测WH的蛋白浓度。
碱性铜试液配制:称取氢氧化钠10 g,碳酸钠50 g,加水400 mL使之溶解,作为甲液。称取酒石酸钾0.5 g,加水50 mL使之溶解,另取硫酸铜0.25 g,加水30 mL使之溶解,将两液混合作为乙液。临用前,合并甲、乙液,并加水至500 mL。
对照品储备液的配制:取牛纤维蛋白原20 mg精密称定,置100 mL量瓶中,加水溶解并稀释至刻度,摇匀,作为对照品储备液。
样品溶液的配制:取WH约10 mg精密称定,置100 mL量瓶中,加水溶解并稀释至刻度,摇匀。精密量取10 mL,置100 mL量瓶中,加水稀释至刻度,摇匀。
精密量取对照品储备液0.25、0.5、1、1.5、2 mL,置10 mL量瓶中,加水稀释至刻度,即浓度为5、10、20、30、40 μg/mL浓度的溶液。分别精密量取上述各溶液1 mL置具塞试管中,分别加入碱性铜试液1.0 mL,摇匀,各加入福林酚试液4.0 mL,立即混匀,置55℃水浴中准确反应5 min,置冰水浴10 min,照紫外可见分光光度法,在650 nm的波长处测定吸收度。以对照品溶液浓度C为横坐标,其对应的吸光度A为纵坐标计算线性回归方程和相关系数,得线性回归方程和相关系数分别为:A=8.352×10-3C-1.214×10-3,r2=0.9991。见图4。
另精密量样品溶液1 mL,同法测定。从线性回归方程计算溶液中的蛋白质浓度,结果得蛋白浓度为99.9%。
2.9 酶比活力测定
1个蛇毒血凝酶单位是指在(37±0.5)℃条件下,能使1 mL标准人血浆在(60±20)s内振摇出现白色絮团时蛇毒血凝酶的量。比活力公式为:比活力=供试品中蛋白的微克数/供试品中的效价。
标准人血浆的配制:取标准人血浆1支,加水1.0 mL使溶解,即得。样品溶液的配制:称取WH适量,加水溶解并稀释成5.40 μg/mL的溶液,即得。精密量取标准人血浆1 mL,置小试管中(37±0.5)℃水浴中保温2 min,精密加入样品溶液1 mL,立即摇匀,同时计时,于(37±0.5)℃水浴中观察血浆应在(60±20)s内振摇出现白色絮团。依据“2.8”项下测定的蛋白量,计算样品溶液中每单位蛋白微克数,得到WH的比活力为5.40 μg/U。
2.10 对牛纤维蛋白原作用方式分析
纤维蛋白原是一种由肝脏合成的具有凝血功能的蛋白质,是纤维蛋白的前体。分子量约34 kD,血浆中参考值2~4 g/L。纤维蛋白原由α、β、γ三对不同多肽链所组成,多肽链间以二硫键相连。在凝血酶作用下,α链或β链分别释放出A肽与B肽,生成纤维蛋白单体。在此过程中,由于释放了酸性多肽,负电性降低,单体易于聚合成纤维蛋白多聚体。但此时单体之间借氢键与疏水键相连,尚可溶于稀酸和尿素溶液中。进一步在Ca2+与活化的因子作用下,单体之间以共价键相连,则变成稳定的不溶性纤维蛋白凝块,完成凝血过程。本试验采用SDS-Page法考察了该酶对牛纤维蛋白原的作用方式,反应时间为5、10、30 min,电泳结果见图5。由结果可见牛纤维蛋白原的β和γ链在整个反应过程中没有发生变化,而反应5 min时,原本α链的位置条带消失,在分子量较小的位置(α与β链之间)出现一个新的条带,且作用效果与20、30 min几乎相同,这可能是WH作用于纤维蛋白原α链,并释放出一个肽段的结果。由此得知,WH只作用于纤维蛋白原的α链,且作用时间非常快,5 min内即发生作用,由于该反应专属性强,因此该性质可以作为该酶的特异性鉴别。
3 讨论
蛇毒是一类复杂的混合物,因此应用单一的层析方法很难将蛇毒血凝酶分离纯化。另外,蛇毒来源的不同,血凝酶的分离纯化方式也多种多样。本文先后采用Sephadex G-50凝胶层析、Sephadex A-25離子交换层析法、肝素-Sepharose亲和层析法从乌苏里蝮蛇毒中分离纯化得到一种具有有凝血活性的酶成分,且纯度良好,体外凝血试验效果明显。
我国蛇资源十分丰富,其中有蛇岛蜊蛇、白眉蝮蛇、尖吻蝮蛇、黑眉蝮蛇、江浙蝮蛇等,蛇毒类药物的研究和应用目前也受到大家的广泛关注[6-15],并且有很多蛇毒类药物已被应用于临床且收到了很好的临床疗效[16-21]。而生长在东北及内蒙古东部地区的乌苏里蝮蛇蛇毒是生产蛇毒类血凝酶的优质原料,其蛇毒类血凝酶含量高,原毒的毒副作用小,药用价值高。但是长期以来因技术原因,不能大规模生产应用,加之使用粗提物的传统习惯,限制了我国蛇毒资源的深入研究和科学利用。本文方法所收集的酶组分纯度高,且该方法具有效果稳定、重复性较好、分辨率较高、简便、经济、操作周期较短等优点。该技术的成功对我国蛇毒资源的利用和蛇毒类血凝酶学研究均有深远的意义。
本论文还针对WH的分子量、纯度、蛋白浓度、比活力、等电点、对牛纤维蛋白原作用方式等性质进行了研究,为该酶质量标准的制定提供了科学依据。其中对牛纤维蛋白原作用方式可作为鉴别项,分子量、纯度、等电点可作为检查项,蛋白浓度、比活力可作为该酶的含量测定项,已能较全面地控制该酶的质量。
[参考文献]
[1] 陈建智.蛇毒的研究和应用[J].蛇志,1989,1(1):22-23.
[2] 傅宏义,周磊.蛇毒类凝血酶的研究进展[J].中国药学杂志,2008,43(4):245-247.
[3] 李建立,刁扬.乌苏里蝮蛇采毒周期对排毒量的影响[J].蛇志,2003,15(3):14-16.
[4] Amer sham pharmacia biotech. Protein elect rophoresis technical manual [M]. New York:Amer sham Pha rmacia Bio tech,1999:13.
[5] 国家药典委员会.中国药典[M].四部.北京:中国医药科技出版社,2015:96-97.
[6] 牟萍,尹家荣,侯瑞鹏,等.长白山白眉蝮蛇毒类凝血酶的分离纯化[J].锦州医学院学报,2015,26(5):39-42.
[7] 钟读波,吴远双,余旭亚,等.长白山白眉蝮蛇蛇毒中类凝血酶的分离纯化方法研究[J].中国药房,2007,18(36):2825-2828.
[8] 黄莹.尖吻蝮蛇血凝酶的生化及免疫学特性研究[D].广州:南方医科大学,2013.
[9] 左军,马骉,姜桂荣,等.东北白眉腹蛇毒类凝血酶的分离纯化[J].哈尔滨学院学报,2002,23(8):59-61.
[10] 翟宁,陈正杰,冯军,等.尖吻蝮蛇毒中一种新类凝血酶的分离纯化[J].中国医药工业杂志,2005,36(10):601-603.
[11] 石光,庞建新,孔焕育,等.尖吻蝮蛇血凝酶药效评价及其作用机制[J].中国新药杂志,2010,19(18):1706-1709.
[12] 张慧.乌苏里蝮蛇磷脂酶A2的分离、纯化和性质测定[D].长春:吉林大学药学院,2013.
[13] 孙妙囡.乌苏里蝮蛇去整合素ussurin制备、抗肿瘤活性及安全性研究[D].长春:吉林大学,2013.
[14] 孙德军,刘珊珊,杨春伟,等.乌苏里蝮蛇丝氨酸蛋白酶基因克隆和序列分析[J].吉林大学学报:医学版,2005,31(3):325-329.
[15] 苏煌财,许云禄,林玉仙.五步蛇毒凝血酶样酶分离纯化[J].中南医院药学杂志,2013,33(23):1943-1945.
[16] 于明帅,张科.尖吻蝮蛇血凝酶临床止血作用及安全性研究进展[J].四川医学,2015,36(1):106-109.
[17] 解春艳,赵振龙,米颖.尖吻蝮蛇血凝酶对股骨干骨折术中出血的影响[J].中国药业,2013,25(5):24-25.
[18] 章征兵,胡华琨,谢维炎.尖吻蝮蛇血凝酶在先天性心脏病患儿术中应用的安全性及有效性[J].药物与临床,2012,9(16):90-91.
[19] 魏京霞.尖吻蝮蛇血凝酶与氨甲环酸术中止血效果比较[J].现代临床医学,2013,39(1):16-17.
[20] 白雪,杜峻峰,苑树俊,等.手术后应用尖吻蝮蛇血凝酶止血的安全性评价[J].中国临床药理学杂志,2011,27(4):255-258.
[21] 李凤君,袁进,韩丽萍,等.蛇毒心脏毒素诱导肺癌A549细胞的凋亡机制研究[J].中国药房,2014,25(7):583-586.
(收稿日期:2016-07-26 本文编辑:王红双)
