ZnO NPs对水培小麦(Triticum aestivum L)种子不同发育阶段的影响
2017-03-14陈泽林徐长山张兰兰乔金张海娇邵海玲
陈泽林,徐长山,张兰兰,乔金,张海娇,邵海玲
东北师范大学紫外光发射材料与技术教育部重点实验室,长春130024
纳米材料已被广泛地应用在化工、涂料、纺织、化妆品、医药制剂等多个领域[1-4]。由于其具有与体材料(粒径在微米量级以上)不同的物理化学性质,因此在一定条件下可能对生物体具有潜在的毒性效应[5-8],这方面的研究引起了人们的广泛关注。相关的研究论文也在包括《Science》和《Nature》等在内的期刊上相继发表[9-11]。
氧化锌纳米颗粒(ZnO NPs)是目前应用最广泛的纳米材料之一,大量应用于化工、微电子、生物、医药等领域[12-14]。但是,已有研究表明,ZnO NPs对细菌、植物和动物等都具有非常明显的毒性[15-19]。
近年来,关于ZnO NPs对植物毒性的报道越来越多。如Shaymurat等[20]研究了ZnO NPs对大蒜根长的影响,发现ZnO NPs对大蒜根的生长以及分生区的有丝分裂有明显的抑制作用,且浓度越高毒性越大,具有显著的浓度效应。Watson等[21]研究了ZnO NPs对小麦的影响,发现在500 mg·L-1暴露浓度下,小麦根的生长会受到明显的抑制作用。Pokhrel等[22]研究了银纳米颗粒(Ag NPs)和ZnO NPs对玉米和卷心菜的根长、发芽率、水分含量和根部形态的影响,发现ZnO NPs和Ag NPs会对卷心菜的根产生抑制作用。Lee等[23]研究了ZnO NPs和二氧化钛纳米颗粒(TiO2NPs)对绿藻的毒性,发现藻类的生长与ZnO NPs和TiO2NPs的浓度有关。Xiang等[24]研究了不同粒径大小和不同形貌的ZnO NPs对白菜种子的发芽率的影响,结果发现,浓度为80 mg·L-1的ZnO NPs对卷心菜的发芽率没有影响,但是会对卷心菜的根和芽的生长有显著的抑制,且其毒性与其尺寸和形貌有关。Chen等[25]研究了ZnO NPs对浮萍的影响,发现ZnO NPs对浮萍具有显著的毒性。这些研究结果都表明,ZnO NPs对植物体具有毒性效应,但是,有关ZnO NPs的毒性与植物种子发育阶段的关系的研究尚未见报道。
本文选择小麦(Triticum aestivum L)作为受试植物,开展了ZnO NPs对水培小麦种子不同发育阶段的影响,以期能更全面准确地评价ZnO NPs对植物的毒性。
1 材料与方法(Materials and methods)
1.1 氧化锌纳米颗粒(ZnO NPs)的制备[26]
本实验所用的ZnO NPs是通过溶胶-凝胶法制备得到。具体过程如下:取适量镁条(Mg,北京化工厂)、碘(I,北京化工厂)和97%的乙醇(CH3CH2OH,北京化工厂)置于蒸馏瓶中进行蒸馏,获得400 mL的绝对乙醇。将适量醋酸锌(Zn(CH3COO)2·2H2O,北京化工厂)和绝对乙醇加入三颈瓶中进行搅拌加热,当温度升至80 ℃时开始回流,回流2 h后得到透明的醋酸锌溶液。同时,取适量氢氧化锂(LiOH·H2O,北京化工厂)加入到绝对乙醇中并在冰水浴中超声(KQ-250DB,350 W,昆山市超声仪器有限公司)溶解。将溶解的氢氧化锂按一定比例加入到透明的醋酸锌溶液中,并用绝对乙醇稀释。稀释后的溶液经冰水浴超声30 min后放于冰箱中静置2 d。再按一定比例加入正己烷(C6H14,北京化工厂),经离心、清洗、干燥后获得白色的氧化锌粉末。用X射线衍射仪(XRD,D/MAX-2500,Rigaku,日本)和透射电子显微镜(TEM,JEOL-2100F,日本电子株式会社)对制备得到的ZnO NPs进行表征。
1.2 ZnO NPs悬浮液配制
用分析天平(XS205DU,Switzertand,瑞士)称取12 mg的ZnO NPs加入200 mL的去离子水中,水浴超声5 min,得到200 mL浓度为60 mg·L-1的氧化锌纳米颗粒悬浮液。将200 mL的悬浮液均匀分成5份,并将其中4份的浓度分别稀释至20、30、40和50 mg·L-1备用。
1.3 小麦的培养
选取200粒大小相同、籽粒饱满、健康无病害的小麦种子,用去离子水冲洗3遍后,放入去离子水中浸泡2 h左右,再用去离子水冲洗数遍并进行消毒处理。取适量消毒后的小麦种子放于1 000 mL的烧杯中,加入20 mL的去离子水,并用封口膜封住烧杯口,在室温下置于暗处培养。
1.4 用ZnO NPs处理不同发育阶段的小麦种子
取出处于吸胀阶段的小麦种子30粒,随机分成6份,每份5粒,取其中5份分别置入20 mL的浓度为20、30、40、50和60 mg·L-1的ZnO NPs悬浮液中,在暗处培养3 d,作为实验组。剩下的一组放入去离子水中,在同样的条件下培养3 d作为对照组。取出处于萌动阶段的小麦种子30粒,作上述同样的处理。取出处于发芽阶段的小麦种子30粒,随机分成6份,每份5粒,统计每一份中的小麦根长后作上述同样的处理。
1.5 用ZnO NPs和ZnSO4·7H2O水溶液处理小麦种子
取6个消毒后的1 000 mL烧杯,分成2组,每组3个。在其中一组烧杯中分别倒入20 mL的去离子水、浓度为176.66 mg·L-1的ZnSO4·7H2O溶液和浓度为50 mg·L-1的ZnO NPs悬浮液,再往每个烧杯中放入5粒处于萌动阶段的小麦,置于暗处培养3 d。在另一组烧杯底部先各放入1张与烧杯底部同样大小的定性滤纸,再作上述同样处理。
1.6 统计学方法
在本研究中,每组实验都重复进行了3次以上,采用SSPS 22.0软件(SPSS Inc.)对实验数据进行方差分析。采用ANOVA方法对实验数据进行差异显著性分析(检验标准为P < 0.05)。*表示P < 0.05,**表示P < 0.01。限于篇幅,种子发育的实物照片只给出了最为典型的结果。
2 结果与讨论(Results and discussion)
2.1 氧化锌纳米颗粒(ZnO NPs)结构与形貌
图1为溶胶-凝胶法制备得到的ZnO NPs的XRD谱和TEM图。图1中的A图为ZnO NPs的XRD谱。从XRD谱可以看到其衍射峰与PDF#36-1451卡片完全一致,表明通过溶胶-凝胶法制备得到的物质为六角纤锌矿型氧化锌。图1中的B图是ZnO NPs的TEM图,从中可以看出制备的ZnO NPs为球形颗粒且形貌均匀,平均直径为5 nm左右。

图1 ZnO NPs的XRD谱(A)和TEM图(B)Fig. 1 XRD (A) spectrum and TEM (B) images of ZnO NPs

图2 小麦种子处于3个阶段的形貌图注:A,吸胀阶段;B,萌动阶段;C,发芽阶段。Fig. 2 Morphology of wheat seeds at three phasesNote: A, Imbibition stage; B, Protrusion stage; C, Germination stage.

图3 经40 mg·L-1 ZnO 纳米粒子处理后小麦的根长Fig. 3 Root lengths of wheat treated by 40 mg·L-1 ZnO NPs
2.2 3个不同发育阶段的小麦种子形貌
图2中的(A)、(B)、(C)分别是处于吸胀阶段、萌动阶段和发芽阶段小麦种子的形貌图。从图中可以看出,处于吸胀阶段的小麦种皮完整,颜色较深。处于萌动阶段的小麦种皮变软,颜色变浅,胚根和胚芽顶破种皮外露(俗称露白)。处于发芽阶段的小麦具有一定长度的胚根和胚芽。
2.3 ZnO NPs对小麦的毒性
图3为处于吸胀阶段、萌动阶段和发芽阶段的小麦种子分别用去离子水和浓度为40 mg·L-1的ZnO NPs悬浮液处理后的根长情况。从中可以看到,实验组的小麦根长都明显小于对照组(P<0.01)。这说明40 mg·L-1暴露浓度下,ZnO NPs对处于3个发育阶段的小麦种子都具有明显的毒性。
就萌动阶段和发芽阶段而言,ZnO NPs对小麦的毒性表现出明显的浓度效应。图4为处于萌动阶段的小麦经不同浓度的ZnO NPs处理后的根长情况,图中的插图为小麦的实物图。从中可以看出,ZnO NPs的浓度越高,小麦的根长越短,即具有显著的浓度效应,这一结果与Lin和Xing[27]的研究结果一致。而从小麦实物图也可以看到,小麦根长随ZnO NPs的浓度增加而明显变短。
图5是处于发芽阶段的小麦种子在不同浓度的ZnO NPs作用下根的生长速率。从中可以看到,在ZnO NPs的作用下,小麦根的生长速率明显低于对照组(P<0.01)。经相关性分析,发现小麦根的生长速率与ZnO NPs浓度具有相关性(P<0.01)。这表明ZnO NPs对小麦根的生长速率也具有明显抑制作用,且浓度越高抑制效果越明显。
2.4 ZnO NPs的毒性与小麦种子发育阶段的关系
图6为处于不同发育阶段的小麦种子经不同浓度的ZnO NPs处理后的根长情况。其中(A)、(B)、(C)分别是对处于吸胀阶段、萌动阶段和发芽阶段的小麦种子进行处理后,小麦根长与ZnO NPs浓度的关系。从中可以看出,ZnO NPs对处于不同发育阶段的小麦种子都可以产生毒性,但是处于不同发育阶段的小麦种子对ZnO NPs的耐受性不同。因此,在不同发育阶段用ZnO NPs处理,对小麦根长的抑制效应有很大区别。在吸胀阶段,对小麦根长的抑制作用较小,而在萌动阶段和发芽阶段,对小麦根的抑制作用则非常大。
为了能更准确地比较ZnO NPs对处于不同发育阶段的小麦种子的毒性大小,我们计算了3种情况下ZnO NPs对根长的抑制率,其计算公式如下:
式中的S表示实验组小麦的平均根长,D表示对照
组小麦根的平均根长,ρ为抑制率。计算结果如图6(D)所示,其中分别给出了在吸胀阶段、萌动阶段和发芽阶段用ZnO NPs处理后小麦根长的抑制率。从中可以看到,在发芽阶段加入ZnO NPs,其对根长的抑制效果最为明显。当ZnO NPs浓度为30 mg·L-1时,对小麦根长的抑制率就已经达到了63.5%,当浓度为60 mg·L-1时,对小麦根长的抑制率达到95.7%,小麦根的生长几乎停止。而在吸胀阶段加入ZnO NPs,其对小麦根长的抑制率则比较低。当ZnO NPs浓度为30 mg·L-1时,其对小麦的根长几乎没有抑制,即使ZnO NPs浓度达到60 mg·L-1,对小麦根长的抑制率也只有37.8%,远远小于同浓度下在萌发阶段和发芽阶段用ZnO NPs处理后的抑制率。对吸胀阶段、萌动阶段和发芽阶段的抑制率分别进行差异性T检验,发现3组之间具有显著性差异,其P值都小于0.05。这说明ZnO NPs对小麦的毒性确实与小麦种子的不同发育阶段有关,在吸胀阶段毒性最小,在发芽阶段毒性最大,在萌动阶段的毒性介于二者之间。
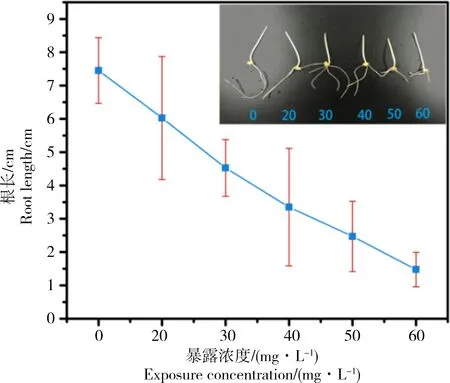
图4 处于萌动阶段的小麦种子经ZnO 纳米粒子处理后根长与ZnO 纳米粒子浓度的关系注:插图是小麦的实物图。Fig. 4 Root lengths of wheat treated under different ZnO NPs concentrations at the protrusion stageNote: The insert is the picture of wheat.

图5 对发芽阶段的小麦种子用不同浓度的ZnO NPs处理后小麦根的生长速率Fig. 5 Root growth rates of wheat seeds treated under different ZnO NPs concentrations at the budding stage
种子萌动阶段,对外界环境条件特别敏感[28],是植物一生中对不良环境条件抵抗力最弱的时期。但是,从上述结果可以看到,ZnO NPs对处于萌动阶段的小麦的毒性明显小于发芽阶段。一个容易想到的原因可能是ZnO NPs被小麦种皮吸附,有效浓度降低。为了检验这一想法,取30粒处于萌动阶段的小麦随机分作6等份,分别放于浓度为0、20、30、40、50、60 mg·L-1的ZnO NPs悬浮液中培养2 h,使小麦种皮对ZnO NPs的吸附达到饱和,取出后放入新配制的浓度同样为0、20、30、40、50、60 mg·L-1的ZnO NPs溶液中继续培养,其根长抑制率如图7中的b组所示。图7中的a组和c组是未经饱和处理的萌动阶段和发芽阶段的抑制率。从图7中可以看到,在20、40、50和60 mg·L-1的暴露浓度下,经过饱和处理后的b组的抑制率变得明显高于未经饱和吸附处理的a组的抑制率,具有显著性差异(P<0.05)。这说明小麦种皮对ZnO NPs的吸附确实能够影响其毒性。
然而,从图7中也可以看到,尽管饱和吸附处理降低了其后小麦种皮对ZnO NPs的吸附,但萌动阶段的抑制率仍然小于发芽阶段的抑制率(P<0.05)。这说明,还有其他的因素导致萌动阶段的小麦种子对ZnO NPs的耐受性更强。我们认为,这很有可能与小麦种子发育阶段获取所需营养的方式有关。在萌动阶段,小麦种子中胚乳所含的营养物质尚可以满足其生长需要,但进入发芽阶段后,小麦种子中胚乳的养分几乎耗尽,需要借助根从外界吸收养分[28]。因此,ZnO NPs对小麦根生长的抑制对处于萌动阶段的小麦影响比较小,而对处在发芽阶段的小麦影响则比较大。这也是导致了萌动阶段的抑制率小于发芽阶段的抑制率的一个重要因素。

图6 ZnO 纳米粒子对处于吸胀阶段(A)、萌动阶段(B)和发芽阶段(C)的小麦根长的影响;(D)为ZnO 纳米粒子对处于3个阶段的小麦根长的抑制率Fig. 6 Root lengths of wheat treated under different ZnO NPs concentrations at the imbibition phase (A), the sprout phase (B) and the budding phase (C), (D) Inhibition rates of ZnO NPs on wheat roots length at three phases

图7 处于萌动阶段和发芽阶段的小麦经不同方式处理后根长的抑制率注:a, 萌动阶段未经ZnO NPs悬液饱和处理;b, 萌动阶段经过饱和处理;c, 发芽阶段未经饱和处理。Fig. 7 Inhibition rates of wheat after different treatments at the sprout phase and the budding phaseNote: a, seeds not saturated with ZnO NPs suspension in the protrusion stage; b, seeds saturated with ZnO NPs suspension in the protrusion stage; c, seeds not saturated with ZnO NPs suspension in the budding phase.

图8 有无滤纸情况下, ZnO NPs和ZnSO4·7H2O对小麦根的抑制率Fig. 8 Inhibition rates of ZnO NPs and ZnSO4·7H2O on wheat roots with or without filter paper
目前,虽然有很多文献都报道了ZnO NPs对植物的毒性,如2007年Lin与Xing[27]报道了ZnO NPs对黑麦草的根长的抑制作用,2011年Du等[29]报道了ZnO NPs对小麦的生长的影响;2015年Watson等[21]报道了ZnO NPs对小麦的根长具有明显的抑制作用。但是,这些研究都没有对比分析ZnO NPs与种子的发育阶段的关系,只有Jian等[30]在2017年研究了包括小麦在内的3种植物种子的种皮形貌对ZnO NPs毒性的影响,他们认为相对于西红柿和狼尾草,小麦的种皮有很多褶皱,因此更容易吸附ZnO NPs,这与我们前面的分析一致。
2.5 Zn2+离子的影响分析
Zn2+离子对小麦的致毒浓度为25 mg·L-1[31-32],根据已有研究来看,浓度在2 000 mg·L-1以下的ZnO NPs悬浮液中游离Zn2+的浓度都远低于这一浓度。Shaymurat等[20]用ICP方法对浓度在10~50 mg·L-1的ZnO NPs悬浮液中游离Zn2+浓度进行了检测,结果表明,其浓度仅为0.353~1.936 mg·L-1。Lin等[27]也报道了浓度为20~2 000 mg·L-1的ZnO NPs悬液中的游离Zn2+浓度为0.3~3.6 mg·L-1,且在此浓度范围内Zn2+离子并不对黑麦草造成毒性。由于本文所用的ZnO NPs的浓度为20~60 mg·L-1,其中的游离Zn2+离子不会对小麦种子的发育造成影响。为此,我们仅研究了较高浓度的游离Zn2+离子对小麦种子发育的影响,并与ZnO NPs进行了对比。
图8是浓度为50 mg·L-1ZnO NPs悬浮液和浓度为176.6 mg·L-1ZnSO4·7H2O溶液(二者的Zn元素浓度均为40.2 mg·L-1)对小麦根长的抑制率。从图中可以看到,在烧杯中不放滤纸情况下,ZnO NPs和ZnSO4·7H2O对小麦根长的抑制率分别为66.7%和90.6%。而在有滤纸的情况下,ZnO NPs对小麦根长的抑制率只有4.6%,但是ZnSO4·7H2O溶液对小麦根长的抑制率几乎未受影响,仍然达到了88.4%。由于滤纸对ZnO NPs具有很强的吸附作用,会大大降低ZnO NPs的有效浓度,但其对Zn2+离子的浓度则几乎没有影响,这是造成上述差别的主要原因。从这里也可以看出,在本文所涉及的浓度范围内,ZnO NPs的毒性主要是由其自身的纳米特性造成的。高浓度的Zn2+离子虽然也会对小麦具有毒性,但是其机理应当是与ZnO NPs的致毒机理不同。
综上可知:
(1) 粒径为5 nm左右的氧化锌纳米颗粒(ZnO NPs)在水培条件下对处于吸胀阶段、萌动阶段和发芽阶段的小麦种子都可以产生毒性。就萌动阶段和发芽阶段而言,ZnO NPs的毒性与其浓度有关,浓度越大毒性越大,即具有显著的浓度效应。
(2) ZnO NPs在水培条件下对小麦的毒性大小随小麦种子发育阶段的不同而表现出明显的差异(P<0.05)。在发芽阶段的毒性最大,在吸胀阶段的毒性最小,在萌动阶段的毒性介于两者之间。
[1] Wackerlig J, Schirhagl R. Applications of molecularly imprinted polymer nanoparticles and their advances toward industrial use: A review [J]. Analytical Chemistry, 2016, 88(1): 250-261
[2] Dacosta M V, Doughan S, Han Y, et al. Lanthanide upconversion nanoparticles and applications in bioassays and bioimaging: A review [J]. Analytica Chimica Acta, 2014, 832: 1-33
[3] Firdhouse M J, Lalitha P. Biosynthesis of silver nanoparticles and its applications [J]. Journal of Nanotechnology, 2015, 2015(1): 1-18
[4] Gulson B, Mccall M J, Bowman D M, et al. A review of critical factors for assessing the dermal absorption of metal oxide nanoparticles from sunscreens applied to humans, and a research strategy to address current deficiencies [J]. Archives of Toxicology, 2015, 89(11): 1909-1930
[5] 文双喜, 王毅力. 水培实验中不同粒径纳米TiO2对芦苇种子发芽和植株生长和生理的影响[J]. 生态毒理学报, 2017, 12(2): 71-80
Wen S X, Wang Y L. Effect of nano titanium dioxide with different particle size on the seed germination and plant growth and physiology of Phragmites australis in hydroponic experiments [J]. Asian Journal of Ecotoxicology, 2017, 12(2): 71-80 (in Chinese)
[6] Hu X, Li D, Yue G, et al. Knowledge gaps between nanotoxicological research and nanomaterial safety [J]. Environment International, 2016, 94: 8-23
[7] 韩笑笑, 赵建, 王震宇, 等. 不同老化时间的TiO2纳米颗粒对玉米生长的影响[J]. 生态毒理学报, 2016, 11(2): 642-649
Han X X, Zhao J, Wang Z Y, et al. Effect of TiO2engineered nanoparticles at different aging times on the growth of Zea mays L. in soil [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 642-649 (in Chinese)
[8] Tripathi D K, Singh S, Singh S, et al. An overview on manufactured nanoparticles in plants: Uptake, translocation, accumulation and phytotoxicity [J]. Plant Physiology and Biochemistry, 2016, 110: 2-12
[9] Maynard A D, Aitken R J, Butz T, et al. Safe handling of nanotechnology [J]. Nature, 2006, 444(7117): 267-269
[10] Service Robert F. American Chemical Society Meeting. Nanomaterials show signs of toxicity [J]. Science, 2003, 300(5617): 243
[11] Colvin V L. Sustainability for nanotechnology [J]. Scientist, 2004, 18(16): 26-27
[12] Madhumitha G, Elango G, Roopan S M. Biotechnological aspects of ZnO nanoparticles: Overview on synthesis and its applications [J]. Applied Microbiology and Biotechnology, 2016, 100(2): 571-581
[13] Vrinceanu N, Tanasa D, Hristodor C M, et al. Synthesis and characterization of zinc oxide nanoparticles [J]. Journal of Thermal Analysis and Calorimetry, 2013, 111(2): 1107-1119
[14] Chibber S, Ansari S A, Satar R. New vision to CuO, ZnO, and TiO2nanoparticles: Their outcome and effects [J]. Journal of Nanoparticle Research, 2013, 15(4): 1-13
[15] Esmaeillou M, Moharamnejad M, Hsankhani R, et al. Toxicity of ZnO nanoparticles in healthy adult mice [J]. Environmental Toxicology and Pharmacology, 2013, 35(1): 67-71
[16] Bhuvaneshwari M, Iswarya V, Nagarajan R, et al. Acute toxicity and accumulation of ZnO NPs in Ceriodaphnia dubia: Relative contributions of dissolved ions and particles [J]. Aquatic Toxicology, 2016, 177: 494-502
[17] Sooyeon L, Sunghyun K, Saeyeon K, et al. Assessment of phytotoxicity of ZnO NPs on a medicinal plant, Fagopyrum esculentum [J]. Environmental Science and Pollution Research, 2013, 20(2): 848-854
[18] Franklin N M, Rogers N J, Apte S C, et al. Comparative toxicity of nanoparticulate ZnO, bulk ZnO, and ZnCl2to a freshwater microalga (Pseudokirchneriella subcapitata): The importance of particle solubility [J]. Environmental Science and Technology, 2007, 41(24): 8484-8490
[19] 张金洋, 宋文华. 纳米氧化锌的健康危害与生态安全性研究进展[J]. 生态毒理学报, 2010, 5(4): 457-468
Zhang J Y, Song W H. Review of health hazards and ecological safety of nano-ZnO [J]. Asian Journal of Ecotoxicology, 2010, 5(4): 457-468 (in Chinese)
[20] Shaymurat T, Gu J, Xu C, et al. Phytotoxic and genotoxic effects of ZnO nanoparticles on garlic (Allium sativum L.): A morphological study [J]. Nanotoxicology, 2012, 6(3): 241-248
[21] Watson J L, Fang T, Dimkpa C O, et al. The phytotoxicity of ZnO nanoparticles on wheat varies with soil properties [J]. BioMetals, 2015, 28(1): 101-112
[22] Pokhrel L R, Dubey B. Evaluation of developmental responses of two crop plants exposed to silver and zinc oxide nanoparticles [J]. Science of the Total Environment, 2013, 452-453(3): 321-332
[23] Lee W M, An Y J. Effects of zinc oxide and titanium dioxide nanoparticles on green algae under visible, UVA, and UVB irradiations: No evidence of enhanced algal toxicity under UV pre-irradiation [J]. Chemosphere, 2013, 91(4): 536-544
[24] Xiang L. Effects of the size and morphology of zinc oxide nanoparticles on the germination of Chinese cabbage seeds [J]. Environmental Science and Pollution Research, 2015, 22(14): 10452-10462
[25] Chen X, O'Halloran J, Jansen M A. The toxicity of zinc oxide nanoparticles to Lemna minor (L.) is predominantly caused by dissolved Zn [J]. Aquatic Toxicology, 2016, 174: 46-53
[26] Meulenkamp E A. Synthesis and growth of ZnO nanoparticles [J]. Journal of Physical Chemistry B, 1998, 102(102): 5566-5572
[27] Lin D, Xing B. Phytotoxicity of nanoparticles: Inhibition of seed germination and root growth [J]. Environmental Pollution, 2007, 150(2): 243-250
[28] 李阳, 黄梅, 沈飞, 等. 生物炭对小麦种子萌发与幼苗生长的植物毒理效应[J]. 生态毒理学, 2017, 12(1): 234-242
Li Y, Huang M, Shen F, et al. Phytotoxic effects of biochar on seed germination and early growth of wheat [J]. Asian Journal of Ecotoxicology, 2017, 12 (1): 234-242 (in Chinese)
[29] Du W, Sun Y, Ji R, et al. TiO2and ZnO nanoparticles negatively affect wheat growth and soil enzyme activities in agricultural soil [J]. Journal of Environmental Monitoring, 2011, 13(4): 822-828
[30] Jain N, Bhargava A, Pareek V, et al. Does seed size and surface anatomy play role in combating phytotoxicity of nanoparticles? [J]. Ecotoxicology, 2017, 26(2): 238-249
[31] El-ghamery A A, El-kholy M A, Abou El-Yousser M A. Evaluation of cytological effects of Zn2+in relation to germination and root growth of Nigella sativa L. and Triticum aestivum L. [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2003, 537(1): 29-41
[32] 杨海霞, 李涛. 含锌废水对小麦种子萌发和幼苗生长的影响[J]. 环境科学与管理, 2008, 33(4): 52-55
Yang H, Li T. Effect of Zn in sewage on wheat during its germination and seedling growth [J]. Environmental Science and Management, 2008, 33(4): 52-55 (in Chinese)
