埃索美拉唑钠中七种残留溶剂的测定
2017-03-14李成文刘秀鹏
韩 月,李成文,刘秀鹏,刘 伟
(德州德药制药有限公司,山东德州 253000)
技术方法
埃索美拉唑钠中七种残留溶剂的测定
韩 月,李成文△,刘秀鹏,刘 伟
(德州德药制药有限公司,山东德州 253000)
埃索美拉唑钠;残留溶剂;顶空气相色谱法
埃索美拉唑是奥美拉唑的S-异构体,埃索美拉唑钠是埃索美拉唑的钠盐形式,是全球首个用于治疗消化性溃疡的手性质子泵抑制剂(PPI),注射用埃索美拉唑钠是2005年3月被FDA批准用于治疗短期胃食管反流疾病的处方药[1]。埃索美拉唑钠较奥美拉唑具有更高的生物利用度和更一致的药代动力学,使到达质子泵的药物增加,抑酸效果优于其它质子泵药物[2]。埃索美拉唑钠合成制备路线[3]中用到的化学试剂较多,根据中国药典对原料药残留溶剂测定的要求,本研究建立了埃索美拉唑钠制备工艺中七种残留溶剂的测定方法,以便有效控制埃索美拉唑钠的质量,保证药品安全。
1 仪器与材料
电子分析天平AL-104;Agilent 7890B气相色色谱仪,Agilent 7697A顶空进样器,安捷伦化学工作站(Agilent Open LAB Control Panel)。 埃索美拉唑钠原料(批号:20150901、20150902、20150903);甲苯、甲基叔丁基醚(分析纯,天津市大茂化学试剂厂),乙酸乙酯、甲基异丁基甲酮、无水乙醇、二氯甲烷、乙腈(分析纯,天津市科密欧化学试剂有限公司)。
2 方法与结果
2.1 色谱与顶空条件
2.1.1 顶空条件:色谱柱为毛细管色谱柱(Agilent DB-624,30m×0.53mm×3.0μm);柱箱:初始温度40℃保持5min,以20℃/min升温至200℃保持5min;进样口温度:200℃;检测器:氢火焰离子化检测器,检测器温度为280℃,载气为N2,分流比为120:1,N2流速为4ml/min。
2.1.2 顶空条件:顶空瓶温度90℃,定量环100℃,传输管线110℃,顶空瓶加热平衡时间30min,加压时间0.5min,进样时间0.5min,顶空瓶体积10ml。
2.2 溶液的配制
2.2.1 对照品溶液:精密称取甲苯0.8912g、乙腈0.4182g、无水乙醇5.0917g、甲基叔丁基醚5.0105g、乙酸乙酯5.0117g、二氯甲烷0.6311g、甲基异丁基酮5.0011g,置同一100ml容量瓶中,加N,N-二甲基乙酰胺稀释置刻度,摇匀,作为对照品储备液。精密量取对照品储备液1ml置100ml容量瓶中,加N,N-二甲基乙酰胺稀释置刻度,摇匀,作为对照品溶液。
2.2.2 样品溶液:精密称定埃索美拉唑钠原料0.20g,置10ml顶空取样瓶中,精密加入N,N-二甲基乙酰胺1ml,密封,摇匀,作为样品溶液。
2.3 专属性试验[4]取2.2.1对照品溶液1ml置10ml顶空取样瓶中加盖密封,按照2.1的色谱条件进样分析,同时进空白溶剂N,N-二甲基乙酰胺,记录色谱图。结果显示上述7种溶剂峰形良好,出峰顺序依次为甲基叔丁基醚、无水乙醇、乙酸乙酯、二氯甲烷、乙腈、甲基叔丁基甲酮、甲苯,七种峰分离度均达1.5以上,理论板数不低于5000。
2.4 线性关系试验 精密量取对照品储备溶液2.0ml、4.0ml、5.0ml、6.0ml、8.0ml,分别置于10ml容量瓶中,加N,N-二甲基乙酰胺稀释置刻度,摇匀,分别精密量取1.0ml置10ml顶空瓶中加盖密封,作为线性对照品溶液,按照2.1的色谱条件进样分析,记录色谱图。七种溶剂线性方程和浓度范围结果见表1:
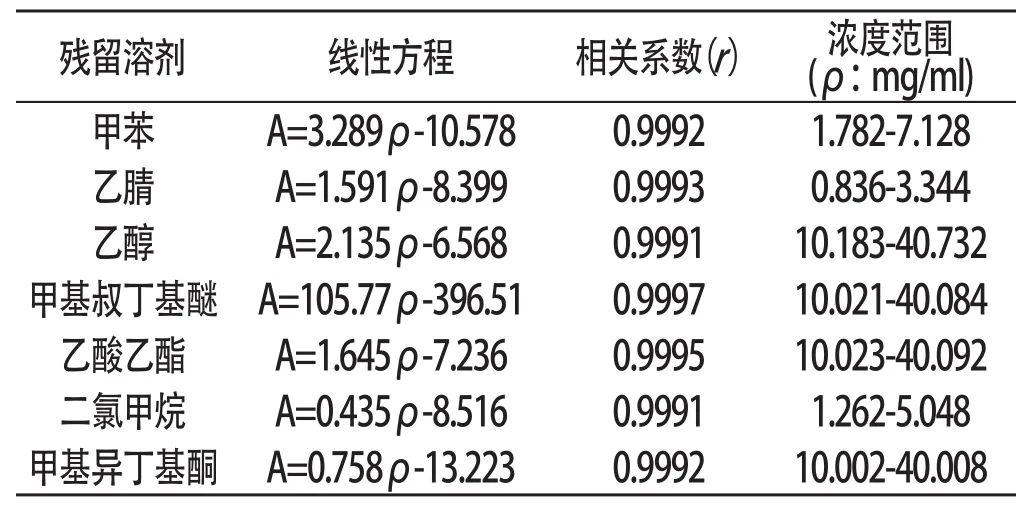
表1 七种溶剂的线性方程和浓度范围
2.5 精密度试验 精密量取2.2.1对照品溶液1ml置10ml顶空瓶中加盖密封,按照2.1的色谱条件进样分析,记录色谱图,连续测定6次,RSD%均小于5%,表明该方法精密度良好。结果见表2:

表2 精密度试验结果
2.6 加样回收率试验 精密称取埃索美拉唑钠原料(批号:20150901)0.1g置10ml顶空瓶中,精密加入N,N-二甲基乙酰胺1ml,密封,摇匀,作为回收率测定的供试品溶液,按照2.1的色谱条件进样分析。精密量取2.2.1的对照品储备液4.0ml、5.0ml、6.0ml分别置50ml量瓶中,分别用N,N-二甲基乙酰胺稀释至刻度,摇匀,分别作为回收率测定低浓度、中浓度、高浓度的对照品溶液。精密称取埃索美拉唑钠原料(批号:20150901)0.1g置10ml顶空瓶中,共9份,分别置10ml顶空瓶中,分别向其中加1.0ml回收率测定低浓度、中浓度、高浓度的对照品溶液各三份使溶解,密封后按照2.1的色谱条件进样分析。回收率在90.1% -103.6%之间,符合要求。
2.7 稳定性试验 取对照品溶液在室温下放置0、4、8、10、24h,按照2.1的色谱条件测定。计算甲基叔丁基醚、无水乙醇、乙酸乙酯、二氯甲烷、乙腈、甲基叔丁基甲酮、甲苯峰面积的RSD分别为2.6%、1.6%、1.9%、3.9%、3.3%、2.1%、1.7%。表明对照品溶液在室温放置24h稳定。精密称定埃索美拉唑钠原料(批号20150901)0.1g,置10ml顶空瓶中,共5份,分别加入1ml 2.2.1的对照品溶液,室温放置0、4、8、10、24小时,按照2.1的色谱条件测定。计算甲基叔丁基醚、无水乙醇、乙酸乙酯、二氯甲烷、乙腈、甲基叔丁基甲酮、甲苯峰面积的RSD分别为1.9%、2.3%、2.1%、4.5%、2.5%、3.2%、1.9%。表明样品溶液在室温放置24h稳定。
2.8 定量限和检测线试验 采用逐步稀释法测定最低检测线和定量限,结果甲基叔丁基醚、无水乙醇、乙酸乙酯、二氯甲烷、乙腈、甲基异丁基甲酮、甲苯的最低检测限分别为0.016、0.033、0.039、0.0022、0.038、0.055、0.061mg/ml定量限分别为0.053、0.110、0.130、0.073、0.1267、0.1833、0.2033mg/ml。
2.9 耐用性试验
2.9.1 改变顶空瓶条件:改变顶空瓶加热温度±5℃,平衡时间±5%,其它测定条件不变,测定2.2.1的对照品溶液,考察七种残留溶剂峰面积的重复性,均符合要求。
2.9.2 改变气相测定条件:改变柱温±10%,改变进样口温度及检测器温度,其它测定条件和顶空条件不变,测定2.2.1的对照品溶液,并做系统适用性评价,均符合验证要求,测定条件耐用性较好。
2.10 样品含量测定 取埃索美拉唑钠原料(批号:20150901、20150902、20150903),按照2.2.2的方法配制样品溶液,按照2.1的色谱条件进样分析,结果三批样品中甲基叔丁基醚含量分别为0.028%、0.049%、0.035%,乙腈含量分别为0.008%,0.009%、0.002%,其它五种物质均未检出。
3 讨论
本研究建立的埃索美拉唑钠残留溶剂检测方法,经方法学验证,灵敏度、精密度、准确度均达到相关要求,耐受性良好,回收率符合可接受标准,适合埃索美拉唑钠残留溶剂的测定。同时,本研究根据中国药典[4]要求制定埃索美拉唑钠残留溶剂的质量标准,甲基叔丁基醚≤5×10-3g/ml,乙醇≤5×10-3g/ml,乙酸乙酯≤5×10-3g/ml,二氯甲烷≤6×10-4g/ml,乙腈≤4.1×10-4g/ml,甲基异丁基甲酮≤5×10-3g/ml,甲苯≤8.9×10-4g/ml。本研究样品测定结果显示,原料埃索美拉唑钠中可检出甲基叔丁基醚和乙腈,而无水乙醇、乙酸乙酯、二氯甲烷、甲基异丁基甲酮、甲苯均为未检出。
[1]陶巧凤,陈雪帆,金鑫.奥美拉唑原料及其肠溶胶囊有关物质检查方法的研究[J].药物分析杂志,2005,25(5):576-578.
[2]胡慧,胡海燕.埃索美拉唑与奥美拉唑治疗胃溃疡的疗效比较[J].中国现代医生,2012,50(3):83-84.
[3]余勇,李勤耕.埃索美拉唑钠的合成[J].化学研究与应用,2014,5(4):591-595.
[4]国家药典委员会.中华人民共和国药典(四部通则9101)[S]. 2015年版.北京:中国医药科技出版社,2015.105-109,374-377.
(技术方法栏目编辑:张 健)
TQ46
A
1004-6879(2017)02-0140-03
2016-08-02)
