哲罗鱼仔稚鱼嗅囊发育及其与摄食强度的关系
2017-03-14王常安李晋南王连生赵志刚罗亮都雪尹家胜徐奇友
王常安,李晋南,王连生,赵志刚,罗亮,都雪,尹家胜,徐奇友
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.东北林业大学野生动物资源学院,黑龙江哈尔滨150040)
哲罗鱼仔稚鱼嗅囊发育及其与摄食强度的关系
王常安1、2,李晋南1,王连生1,赵志刚1,罗亮1,都雪1,尹家胜1,徐奇友1
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.东北林业大学野生动物资源学院,黑龙江哈尔滨150040)
为掌握哲罗鱼Hucho taimen仔稚鱼嗅囊的发育过程及其与摄食强度的关系,对哲罗鱼仔稚鱼嗅囊发育进行了组织形态学观察,研究了嗅囊发育与摄食强度之间的对应关系,描述了各发育时期的时序和形态特征。结果表明:初孵哲罗鱼仔鱼嗅囊上皮未分化,消化道未有食物充塞度;25~26日龄仔鱼仅有少数个体 (11.1%)消化道有一定的食物充塞度 (1级);27日龄仔鱼多数个体 (占66.7%)开始少量摄食,此时嗅囊上皮仍未分化;29日龄仔鱼均摄食,消化道食物充塞度达到2级和3级的个体分别占44.4%和33.3%;30日龄仔鱼嗅囊上皮从嗅囊基部开始分化;42日龄稚鱼上皮分化更加明显,细胞分化加剧,此时嗅囊上皮分化;45日龄稚鱼均强烈摄食,消化道食物充塞度等级均达到5级,此时嗅囊上皮分化完成;55日龄稚鱼嗅囊形成第一个初级嗅板;85日龄稚鱼嗅囊分化完成,通过光镜和电镜观察,嗅上皮细胞可分为6类,即基细胞、支持细胞、纤毛非感觉细胞、纤毛感觉细胞、柱状细胞和黏液细胞。本研究结果可为哲罗鱼资源的保护和苗种培育提供理论依据。
哲罗鱼;嗅囊;发育;摄食
鱼类摄食感觉器官在寻食、避害、识别中具有重要的作用。获知鱼类摄食感觉器官的生物特性,不仅可以了解其早期生活史,也可以改善其苗种培育技术。目前,有关鱼类摄食感觉器官发育的报道较少[1-3]。对鱼类嗅觉器官结构形态描述和发育研究的报道有斑马鱼Brachydanio rerio[4]、鲟鱼Acipenseridae[5]、大眼皱唇鲨Iago omanensis[6]、大鳞大麻哈鱼 Oncorhynchus tshawytscha[7]、驼背鲈Cromileptes altivelis[8]、多斑岭鳅Oreonectes polystigmus[9]、鲻Mugil cephalus[10]、顶鼻康吉鳗Acromycter sp.[11]、黄鳝Monopterus albus[12]、尼罗罗非鱼Tilapia nilotica[13]、大黄鱼 Psmdosciaena crocea[13]、黄姑鱼 Nibea albiflora[13]、多鳍鱼 Polypteridae[14]等。哲罗鱼Hucho taimen是中国珍稀名贵的冷水性鱼类之一,在弱光条件下仍可摄食,因此,在弱光条件下,其摄食感觉器官的感知作用可能强于视觉。目前,关于哲罗鱼摄食感觉器官形态、发育和摄食之间关系的研究尚未见报道。本试验中,研究了哲罗鱼摄食感觉器官的形态、发育及其与摄食强度的关系,旨在丰富鱼类生理的研究内容,全面了解哲罗鱼生理特性,为其早期苗种的培育提供参考依据。
1 材料与方法
1.1 材料
哲罗鱼仔鱼 (初始体质量0.11 g±0.01 g,孵化后21日龄)由中国水产科学研究院黑龙江水产研究所渤海冷水性鱼类试验站提供。
1.2 方法
1.2.1 生长试验 试验鱼采用活饵 (水蚤和水蚯蚓)进行投喂。活饵用2%NaCl消毒,过筛绢,滤水后饲喂试验鱼。活饵营养成分见表1。试验鱼饲养于平列槽 (500 L)中。试验设3个重复,每个重复5000尾。试验用水为涌泉水,饲养期间,水温为 (11.0±0.5)℃,pH为7.2±0.1,溶氧 >6.0 mg/L,氨氮<0.02 mg/L,光周期为9 D∶15 L。试验开始时流速为0.4 L/s,逐渐增加到1.0 L/s (33日龄)。23~27日龄仔鱼用水蚤饲喂,28~96日龄仔稚鱼用水蚯蚓饲喂,每日饱食投喂4次(6:00,10:00,14:00,18:00)。养殖周期为76 d。

表1 活饵营养成分 (干物质)Tab.1 Proximate nutrient composition of live food(dry matter) w/%
1.2.2 采样时间和组织学观察 嗅囊发育的取样时间分为2个阶段:前25 d,每天采集1次;后40 d,每5 d采集1次。每次随机取9尾全鱼进行嗅囊发育观察。哲罗鱼样品用MS-222麻醉,然后用Bouin's液固定48 h,常规石蜡包埋,用KD1508型切片机对样本进行纵、横方向连续切片,切片厚度为6 μm,用苏木精-伊红染色法染色、中性树胶封片,在光学显微镜 (OM)下观察嗅囊的组织学形态特征。消化道食物充塞度的采样时间和数量见表2,在显微镜或解剖镜下观察消化道的食物充塞度等级。
1.2.3 嗅囊的显微和超微结构 剪开85日龄哲罗鱼前后鼻孔之间的皮肤,暴露出嗅囊,以2.5%戊二醛和1%锇酸双重固定,干燥喷金后在KYKY 1000B扫描电镜 (SEM)下观察并拍照;用环氧树脂 (618号)包埋,切片后用柠檬酸铅复染,在JEM-1200EX透射电镜 (TEM)下观察并拍照。
2 结果与分析
2.1 嗅囊发育过程
光学显微镜下观察显示:27日龄哲罗鱼仔鱼嗅囊上皮未分化 (图1-A);30日龄仔鱼嗅囊上皮从嗅囊基部开始分化 (图1-B);42日龄稚鱼上皮分化更加明显,细胞分化加剧 (图1-C);55日龄稚鱼由上皮和固有膜组成的粘膜从嗅囊底部向上隆起形成第一个初级嗅板 (图1-D);随着进一步的发育,85日龄稚鱼嗅囊分化完成,初级嗅板数量增加,上皮细胞由感受细胞、支持细胞和基细胞组成 (图1-E)。感受细胞上端突起直达上皮表面并有微绒毛,细胞呈梭形,染色深;支持细胞为柱状细胞,细胞核大,呈圆形,细胞质染色浅;基细胞位于嗅囊上皮基部,为小卵圆形或椭圆形细胞,细胞核呈圆形,染色深,基细胞形成一个不连续的细胞层。
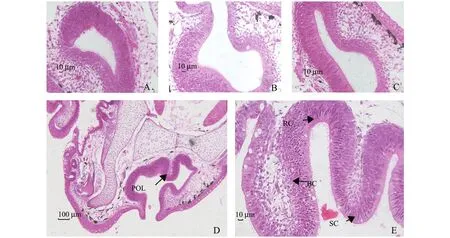
图1 哲罗鱼仔稚鱼嗅囊的发育过程Fig.1 Development of olfactory sac in early juvenile taimen
2.2 嗅囊的形态学观察
电镜下观察显示,哲罗鱼的鼻孔位于头部的眼前上方,每侧有两个,前后鼻孔呈圆形,前后鼻孔与外界相通 (图2-A)。85日龄哲罗鱼的嗅囊发育完全,呈纺锤体形。剖开嗅囊,可见初级嗅板由嗅囊壁向腔内突起,呈平行排列,方向与鼻腔的长径一致 (图2-B)。在光学显微镜和透射电镜下观察,嗅板由中央髓和两侧的嗅上皮两部分构成,中央髓由疏松的结缔组织和大量毛细血管组成(图2-C)。嗅上皮的细胞分化明显,细胞种类主要包括纤毛感觉细胞、纤毛非感觉细胞、支持细胞、柱状细胞和基细胞。
嗅板游离末端的纤毛非感觉区附近有少量的黏液细胞 (图2-D)。接近嗅板末端处,嗅板中部的结缔组织逐渐增多,呈团絮状。嗅板的感觉区表面自嗅轴开始至中央部位与纤毛非感觉细胞相间排列的为纤毛感觉细胞,中下层为支持细胞和基细胞(图2-D)。支持细胞和基细胞遍布整个嗅板,在嗅板非感觉区主要是这两类细胞。柱状细胞混杂在纤毛非感觉细胞、纤毛感觉细胞和支持细胞之间。
2.2.1 纤毛非感觉细胞 纤毛非感觉细胞分布在纤毛感觉区和纤毛非感觉区,其细胞个体较大,形态均匀,呈梭形或锥形,整齐连续排布,顶端具有较长纤毛突起,密布在纤毛区表面 (图2-D、E)。纤毛非感觉细胞长为1.8~5.1 μm,宽为0.3~0.5 μm,胞质染色浅,核较大,含多个核仁,细胞核边缘清晰,呈圆形或卵圆形。
2.2.2 纤毛感觉细胞 纤毛感觉细胞分布在嗅板感觉区,呈不连续分布状态,细胞较狭长,呈细长梭形 (图2-D、E)。纤毛感觉细胞长为1~2 μm,宽为0.1~0.4 μm,在感觉细胞顶端的纤毛较纤毛非感觉区的纤毛和非感觉细胞的纤毛短很多。纤毛基部有多个形状不规则空泡结构,空泡周围含大量的线粒体。
2.2.3 柱状细胞 柱状细胞分布在感觉区,数目少,在透射电镜下可见柱状细胞的游离端为圆锥状突起,基部较宽,包含有数量较多的溶酶体,其基部下端也含有较多的小泡结构,内有线粒体 (图2-D、E)。
2.2.4 支持细胞 支持细胞分布在嗅板的中层和中下层,与表层的纤毛非感觉细胞和纤毛感觉细胞排列紧密,细胞呈椭圆形,细胞界限明显,内有2~3个椭圆形的细胞核。支持细胞为两层,细胞电子密度较大,内有溶酶体颗粒 (图2-D、E)。

图2 哲罗鱼仔稚鱼嗅囊的形态学观察Fig.2 Morphological observation of olfactory sac in early juvenile taimen
2.2.5 黏液细胞 黏液细胞分布在感觉区与非感觉区内,多呈长椭圆形或高脚杯形 (图2-D)。黏液细胞内充满大量黏液颗粒,细胞质电子密度比周围细胞质低,显得较透亮。细胞含有黏液颗粒和溶酶体。
2.2.6 基细胞 基细胞分布在嗅板的基层,细胞核较大。细胞形态不规则,呈锥体形或椭圆形,排列不紧密,细胞间充满疏松结缔组织 (图2-F)。
2.3 仔稚鱼摄食器官发育与摄食强度的关系
对21~76日龄仔稚鱼,于每天7:00、19:00测定其消化道填充度,不同日龄仔稚鱼消化道充塞度的变化如表2所示。从表2可见:24日龄前的仔鱼,消化道未有食物充塞度;25~26日龄仔鱼仅有少数个体 (11.1%)消化道有一定的食物充塞度 (1级);27日龄仔鱼多数个体 (占66.7%)消化道有一定的食物充塞度 (1级),多数仔鱼开始少量摄食;29日龄仔鱼均摄食,消化道食物充塞度达到2级和3级的个体分别占44.4%和33.3%;45日龄稚鱼均强烈摄食,消化道食物充塞度等级均达到5级,之后随着发育的进行,稚鱼消化道食物充塞度等级均达到5级。
哲罗鱼仔稚鱼摄食感觉器官的发育和摄食强度存在明显的对应关系 (表3)。从表3可见:初孵仔鱼,消化道未有食物充塞度,此时嗅囊上皮未分化;27日龄仔鱼多数个体 (占66.7%)消化道有一定的食物充塞度 (1级),多数仔鱼开始少量摄食,此时嗅囊上皮仍未分化;43日龄稚鱼均摄食, 且77.8%个体充塞度等级达5级,此时嗅囊上皮分化;45日龄稚鱼充塞度等级均达5级,此时嗅囊上皮分化完成。
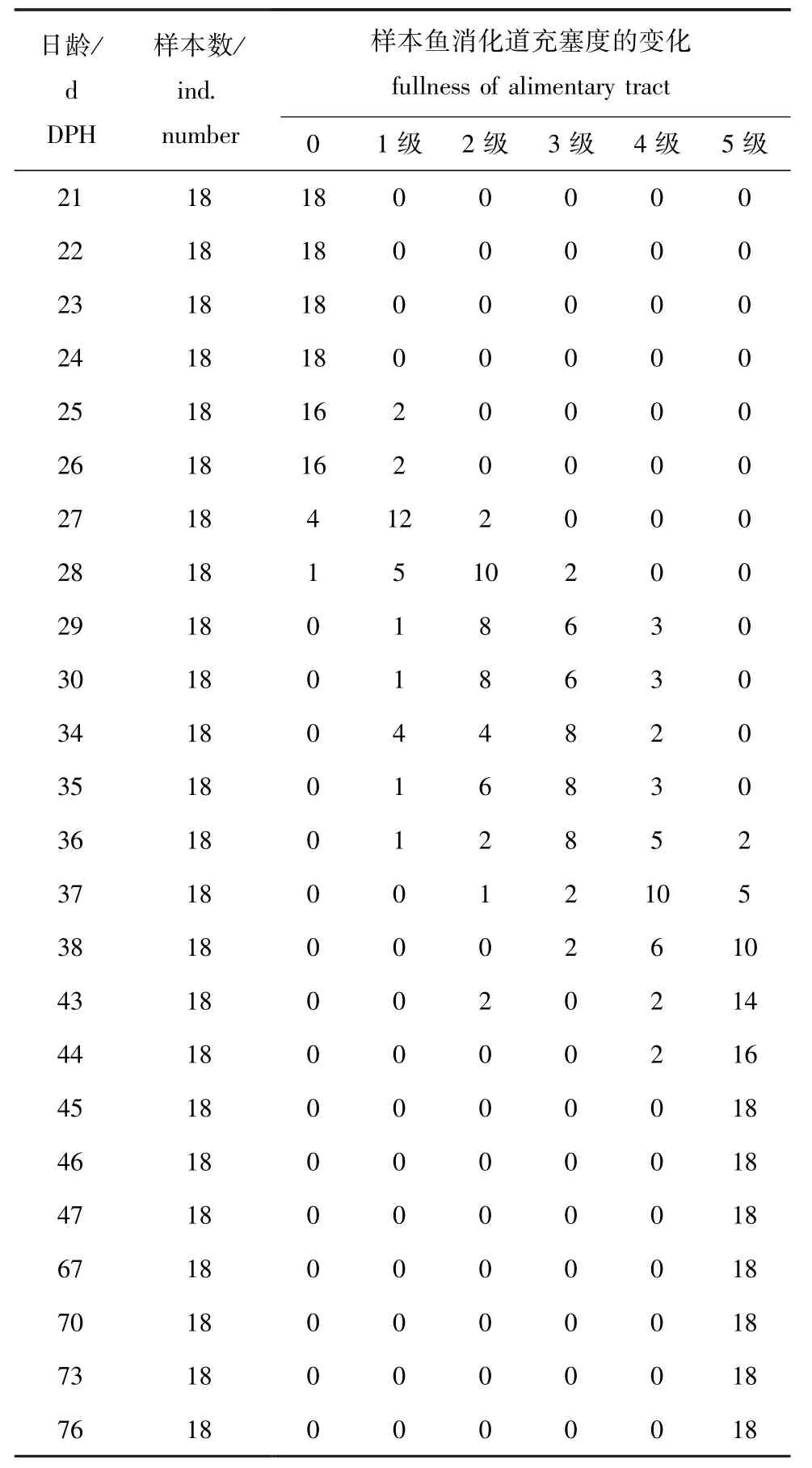
表2 不同日龄仔稚鱼消化道充塞度的变化Tab.2 Changes in fullness of alimentary tract in larval and juvenile taimen Hucho taimen

表3 仔稚鱼摄食器官发育与摄食强度的关系Tab.3 Relationship between development of olfactory sac and feeding intensity of larval and early juvenile taimen Hucho taimen
3 讨论
3.1 哲罗鱼的嗅囊发育
嗅觉和味觉是鱼类摄食感觉器官的重要属性,以区分水体中食物的可利用程度[15],两者感知的距离大不相同,嗅觉可以对100 m外的食物进行鉴别,而味觉感知距离很近[16]。肉食性鱼类缺乏味蕾或者很少,嗅觉不发达,其摄食主要靠视觉。本研究结果显示,哲罗鱼仔鱼在弱光条件下仍可摄食,是视觉、味觉和嗅觉共同作用的结果。哲罗鱼仔鱼似乎可用味蕾和嗅觉器官进行感知。
哲罗鱼初孵仔鱼的嗅囊小,细胞未分化,27日龄时嗅囊开始分化,55日龄稚鱼嗅觉开始功能化。此结果与底栖鱼类如牙鲆Paralichthys olivaceus有所不同,牙鲆初孵仔鱼嗅囊中无感觉细胞,25日龄时,嗅囊中各种细胞均分化完毕并功能化[17]。由于哲罗鱼和牙鲆的生活习性不同,嗅觉在摄食中的作用所占地位也不相同,牙鲆在转入底层生活以后,嗅觉成为摄食的主要感觉,视觉相应地变为次要感觉,而哲罗鱼在嗅觉功能化以后,视觉仍是主要感觉,但这两种鱼嗅觉发育都迟于视觉。
哲罗鱼嗅囊发育完善后只有初级嗅板,未见次级嗅板,这与虹鳟Oncorhynchus mykiss[18]、顶鼻康吉鳗[11]、鲻[10]等鱼类相似,与中华乌塘鳢 Bostrichthys sinensis[19]和驼背鲈[8]不同。哲罗鱼的嗅上皮分化较为明显,与其他硬骨鱼类类似。基层为基细胞,中层和中下层为支持细胞,在纤毛感觉区的外层主要为纤毛感觉细胞和纤毛非感觉细胞,在纤毛非感觉区的外层主要为纤毛非感觉细胞。此外,哲罗鱼嗅板表面突起大量微绒毛感觉细胞,微绒毛感觉细胞和纤毛感觉细胞分别感受水中不同的化学物质。虹鳟[20]、斑点叉尾鮰Ictalurus punctatus[21]、顶鼻康吉鳗[11]的纤毛感觉细胞主要感受氨基酸和胆汁盐,而微绒毛感觉细胞主要感受氨基酸和核苷酸。哲罗鱼嗅板表面微绒毛细胞较多,可能也具有感觉作用,其感受的化学物质可能为氨基酸和核苷酸。另外,在纤毛感觉区与非感觉区内,还有一些呈长椭圆形或高脚杯形的黏液细胞,起到保护的作用。
3.2 嗅囊发育与摄食强度的关系
已有研究表明,一些鱼类在嗅囊尚未发育完善便可以摄食。哲罗鱼仔鱼在27日龄时进行初次摄食,此时嗅囊虽开始分化,但未功能化。尽管哲罗鱼嗅囊发育和其他鲑科鱼类的发育具有相似的模式,但各阶段发育的时间间隔较长,这可能是该物种的特殊性。从本研究结果来看,哲罗鱼嗅囊的形成和功能化时序可以作为投喂的参考。
哲罗鱼仔稚鱼的摄食感觉器官发育和摄食强度存在着对应关系。27日龄前的仔鱼,消化道未有食物充塞度,此时嗅囊上皮未分化。仔鱼在孵化后27日龄时,多数个体 (占66.7%)消化道有一定的食物充塞度 (1级),此时88.9%仔鱼出现味蕾原基,需及时进行投喂[22]。而关海红等[23]认为,哲罗鱼在孵化后30日龄时卵黄囊被吸收,消化器官结构和功能发育完善,开始由混合性营养期进入外源性营养期。两结果的微小差异可能是由于试验水温不同造成的。另外,嗅囊的发育进程较口咽部味蕾较晚,43~45日龄时哲罗鱼稚鱼充塞度等级均达5级,嗅囊上皮分化,因此,仔鱼嗅囊所起的摄食感觉作用略小[22]。可见,哲罗鱼稚鱼的摄食也可能受摄食感觉器官发育程度的影响,因此,投喂策略需要做出相应的改变。
[1] Hansen A,Reutter K,Zeiske E.Taste bud development in the zebrafish,Danio rerio[J].Developmental Dynamics,2002,223(4): 483-496.
[2] Fishelson L,Delarea Y,Zverdling A.Taste bud form and distribution on lips and in the oropharyngeal cavity of cardinal fish species (Apogonidae,Teleostei),with remarks on their dentition[J].Journal of Morphology,2004,259(3):316-327.
[3] Mukai Y,Tuzan A D,Lim L S,et al.Development of sensory organs in larvae of African catfish Clarias gariepinus[J].Journal of Fish Biology,2008,73(7):1648-1661.
[4] Hansen A,Zeiske E.Development of the olfactory organ in the zebrafish,Brachydanio rerio[J].The Journal of Comparative Neurology,1993,333(2):289-300.
[5] Zeiske E,Kasumyan A,Bartsch P,et al.Early development of the olfactory organ in sturgeons of the genus Acipenser:a comparative and electron microscopic study[J].Anatomy and Embryology, 2003,206(5):357-372.
[6] Fishelson L,Baranes A.Ontogenesis and cytomorphology of the nasal olfactory organs in the Oman shark,Iago omanensis(Triakidae),in the Gulf of Aqaba,Red Sea[J].The Anatomical Record, 1997,249(3):409-421.
[7] Ochs C L.Ontogeny of glomerular territory patterning in the olfactory bulb of juvenile Chinook salmon(Oncorhynchus tshawytscha) and exploring for potential effects of sensory experience on glomerular development[D].Windsor:University of Windsor,2015.
[8] 区又君,蔡文超,李加儿.驼背鲈的嗅囊及嗅板细胞的形态学和组织学[J].海洋湖沼通报,2010(2):61-66.
[9] 黄金清,李高岩,彭瑞明,等.多斑岭鳅嗅觉器官表面超微结构及其形态适应[J].动物学杂志,2015,50(3):396-404.
[10] 李加儿,曹守花,区又君,等.鲻嗅囊的组织形态结构观察及功能探讨[J].动物学杂志,2014,49(3):399-406.
[11] 张振玲,陈宜瑜,赵亚辉,等.顶鼻康吉鳗嗅囊形态的光镜与扫描电镜观察[J].动物分类学报,2006,31(4):709-716.
[12] 陈学敏.黄鳝嗅觉器官形态结构研究[D].海口:海南大学, 2009.
[13] 符浩.鲈形目和合鳃目几种鱼嗅觉器官形态学研究[D].海口:海南大学,2013.
[14] Zeiske E,Bartsch P,Hansen A.Early ontogeny of the olfactory organ in a basal actinopterygian fish:Polypterus[J].Brain,Behavior and Evolution,2009,73(4):259-272.
[15] Hara T J.Olfaction and gustation in fish:an overview[J].Acta Physiologica Scandinavica,1994,152(2):207-217.
[16] 单保党,何大仁.黑鲷化学感觉发育和摄食关系[J].厦门大学学报:自然科学版,1995,34(5):835-839.
[17] Kawamura G,Ishida K.Changes in sense organ morphology andbehaviour with growth in the flounder Paralichthys olivaceus[J]. Nippon Suisan Gakkaishi,1985,51(2):155-165.
[18] Salinas I,LaPatra S E,Erhardt E B.Nasal vaccination of young rainbow trout(Oncorhynchus mykiss)against infectious hematopoietic necrosis and enteric red mouth disease[J].Developmental &Comparative Immunology,2015,53(1):105-111.
[19] 马细兰,洪万树,张其永,等.中华乌塘鳢嗅觉器官的形态结构[J].中国水产科学,2005,12(5):525-532.
[20] Sato K,Suzuki N.Whole-cell response characteristics of ciliated and microvillous olfactory receptor neurons to amino acids,pheromone candidates and urine in rainbow trout[J].Chemical Senses,2001,26(9):1145-1156.
[21] Hansen A,Rolen S H,Anderson K,et al.Correlation between olfactory receptor cell type and function in the channel catfish[J]. The Journal of Neuroscience,2003,23(28):9328-9339.
[22] Wang C A,Ma J Z,Xu Q Y,et al.The development of pharyngeal taste buds in Hucho taimen(Pallas,1773)larvae[J].Iranian Journal of Fisheries Sciences,2016,15(1):426-435.
[23] 关海红,匡友谊,徐伟,等.哲罗鱼消化系统器官发生发育的组织学观察[J].动物学杂志,2007,42(2):116-123.
Correlation between feeding intensity and development of olfactory sac in larval and early juvenile taimen Hucho taimen
WANG Chang-an1,2,LI Jin-nan1,WANG Lian-sheng1,ZHAO Zhi-gang1, LUO Liang1,DU Xue1,YIN Jia-sheng1,XU Qi-you1
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.College of Wildlife Resources, Northeast Forestry University,Harbin 150040,China)
Development of olfactory sac was observed and described in larval and early juvenile taimen Hucho taimen under a light microscope and electron microscope(scanning electron microscope and transmission electron microscope)to know the relationship between development of olfactory sac and feeding intensity.The undifferentiated epithelia of olfactory sac and devoid of food were found in the digestive tract in the newly hatched larvae.Few individuals(11.1%)showed initial feeding 25-26 days post hatching(DPH)and the fullness rank of digestive tracts was in degree 1,and most individuals(66.7%)appeared to begin to feed at 27 DPH,but the epithelia of olfactory sac were still undifferentiated.All individuals had active feed,with fullness rank of 2(44.4%)and 3 (33.3%)in digestive tract at 29 DAH.The initial differentiation of olfactory sac was observed at 30 DPH,obviously differentiated epithelia of olfactory sac were occurred at 42 DPH,and the well developed epithelia of olfactory sac were appeared,with fullness rank of 5 in the digestive tract at 45 DPH.The first primary lamellae were formed at 55 DPH and the olfactory sac was differentiated well at 85 DPH.The cells of olfactory epithelium were divided into six categories:basal cells,supporting cells,ciliated non-sensory cells,ciliated receptor cells,rod cells and goblet cells by the light microscopy and the transmission electron microscopy.The findings provide a theoretical basis for the protection and breeding of taimen.
Hucho taimen;olfactory sac;development;feeding
S963
A
10.16535/j.cnki.dlhyxb.2017.01.004
2095-1388(2017)01-0020-06
2016-04-13
国家 “十二五”科技支撑计划项目 (2012BAD25B10);黑龙江省自然科学基金资助项目 (QC2015041);黑龙江水产研究所基本科研业务费专项 (HSY201512);冷水性鱼类养殖产业化研究与示范 (201003055)
王常安 (1981—),男,博士,助理研究员。E-mail:gordoncase@126.com
徐奇友 (1969—),男,博士,研究员。E-mail:xuqiyou@sina.com
