多毛类动物对多环芳烃的毒性响应及代谢研究进展
2017-03-14蔡富才李艳楠赵欢杨大佐陈雪周一兵
蔡富才,李艳楠,赵欢,杨大佐,陈雪,周一兵
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
多毛类动物对多环芳烃的毒性响应及代谢研究进展
蔡富才,李艳楠,赵欢,杨大佐,陈雪,周一兵
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
多环芳烃可富集在水生生物体内,进而通过食物链的放大作用危害人类,多毛类动物是已知能够蓄积大量多环芳烃的物种,有关多毛类动物解毒代谢酶与抗氧化酶的活性及其基因表达水平作为多环芳烃监测指标的研究已有大量报道,但有关多毛类动物如何代谢蓄积在体内多环芳烃的基础理论研究目前尚处于初步阶段。本研究中,综述了近年来国内外有关多毛类动物对多环芳烃的毒性响应及代谢研究,多毛类动物对多环芳烃的代谢类似于脊椎动物,分为两个阶段,参与第一阶段代谢的酶主要是细胞色素P450酶家族,而尿苷二磷酸葡萄糖醛酸转移酶和磺基转移酶被认为是第二阶段代谢过程中起主导作用的酶类,针对目前研究中存在的问题,提出今后应加强多毛类动物对复合多环芳烃以及低剂量多环芳烃长期暴露的毒性响应研究,同时增强对不同多环芳烃的代谢研究。
多毛类动物;多环芳烃;毒性响应;代谢
多环芳烃 (polycyclic aromatic hydrocarbons, PAHs)是海洋环境中主要的有机污染物之一。目前,海洋环境中PAHs的主要来源包括大气沉降物,石油及石油产品的溢出和渗流,以及工业和家庭生活污水的排放[1-2]。多环芳烃是一类含有两个或两个以上芳烃 (苯)环的碳氢化合物,该类物质具有高辛醇-水分配系数的特点,随着苯环数量的增加,脂溶性增强,其具有很强的亲脂特性,极易吸附于有机颗粒物上,进而蓄积在沉积质和有机体中[3]。有研究发现,PAHs可以在藻类、软体动物和鱼类等多种水生生物体中富集,并沿食物链呈现逐级放大[4-6],进而对人类和生态系统造成潜在的危害[7]。因此,对海洋环境中PAHs进行早期监测及对污染生境的修复刻不容缓。多毛类动物在海洋沉积物中的分布十分广泛,是海洋底栖动物的优势物种,可占海洋沉积物中生物量的40%[8]。
多毛类动物具有不易长距离迁移的特点,这使其极易通过直接接触和主动摄食接触到沉积质中的污染物。此外,多毛类动物是多种经济鱼虾的饵料,可作为重要的载体将沉积质中的污染物通过食物链传递并放大,进而对高营养级生物产生潜在的危害。近年来,多毛类动物的特殊生态习性已引起了国内外学者的广泛关注,多毛类动物作为标准测定生物在海洋沉积质污染评价中得到广泛应用[9]。另外,据报道,一些种类的多毛类动物对重金属、合成有机物、石油烃等持久性污染物具有较强的耐受和超富集作用[10-12],其可通过生物转化的多个代谢途径来维持机体对PAHs较高的生物可利用性[13],因此,部分种类的多毛类动物可作为近岸污染沉积质生境修复的物种加以利用。本研究中就目前多毛类动物对PAHs的毒性响应及其代谢机制的相关研究进行了综述,并对其未来研究方向进行了展望。
1 多毛类动物对PAHs的毒性响应
细胞色素 P450酶系 (cytochromeP450, CYP450)是生物体中最重要的Ⅰ相代谢酶,参与很多内源及外源有机物质的代谢。CYP450家族较为庞大,包括 CYP1、CYP2、CYP3、CYP4等家族。其中CYP1、CYP2、CYP3家族主要参与外源性物质的代谢;CYP4家族除参与一些外源性有毒物质代谢外,还参与一些与生理功能有关的物质合成,如脂肪酸、胆固醇等;CYP4以后的家族主要参与内源性物质的代谢,如雌激素等[14-17]。迄今为止,在不同种类生物中发现的CYP450基因大约有12 456种[18]。生物体进行外源有机污染物代谢,除通过CYP450酶进行解毒外,还可通过氧化还原途径进行解毒。已有研究表明,PAHs进入生物体后会被CYP450酶氧化代谢,形成亲水性中间产物,这些中间代谢物会与以Ⅱ相代谢酶谷胱甘肽硫转移酶 (Glutathione-s-transferase,GST)为代表的内源性分子结合,转化为低毒代谢产物排出体外。在这一过程中亦会形成大量活性氧物质,这些物质会被包括超氧化物歧化酶 (Superoxide dismutase,SOD)、过氧化氢酶 (Catalase,CAT)、谷胱甘肽过氧化物酶 (Glutathione peroxidase,GSHPX)等抗氧化防御酶所清除[19]。生物体内解毒代谢及抗氧化成分会因污染胁迫的存在而改变[20]。近年来,有关多毛类动物对PAHs毒性响应的相关研究已有大量报道,主要集中在其解毒代谢酶与抗氧化酶方面。
1.1 解毒代谢酶
多毛类动物暴露于PAHs中,其CYP450酶首先会被诱导,从而使其活性升高。McElroy[21]研究发现,绿沙蚕 Nereis virens暴露于苯并芘 [benzo (a)pyrene,B(a)P]后,其消化道内微粒体中的CYP450活性与其他酶相比显著升高。Lee等[22]研究发现,沙蚕 Nereis diversicolor暴露于浓度为10 μg/L的B(a)P下6 d后,其CYP450活性可增加3 倍;小头虫Capitella sp.Ⅰ在3~6周后也被检测到体内CYP450活性显著升高。Forbes等[23]在研究小头虫Capitella sp.Ⅰ对荧蒽的代谢后亦发现,与空白对照组相比,其体内CYP450活性被显著诱导。相比于 CYP450酶活性的毒性响应研究,有关CYP450基因的毒性响应研究已有大量报道。多毛类动物暴露于PAHs中,其CYP450基因表达会出现相应的诱导变化。多毛类动物CYP450基因的表达量被发现与PAHs间存在明显的 “剂量-效应”和 “时间-效应”关系,且低浓度PAHs的暴露可引起 CYP450基因表达显著上调,多毛类动物CYP450基因对PAHs的暴露具有很强的敏感性。Rewitz等[24]首次从绿沙蚕肠组织中克隆到CYP4BB1和CYP342A1两个cDNA序列,并使用Northern Bloting分析发现,B(a)P可诱导绿沙蚕CYP342A1基因表达显著上调。Chen等[25]研究了在不同浓度 (0.2、0.8、2.0 mg/L)石油烃暴露下双齿围沙蚕Perinereis aibuhitensis CYP4基因表达的变化规律,结果表明,CYP4表达量随暴露时间的延长呈上升趋势,且与诱导浓度成正比,各浓度组暴露至第14天时,CYP4基因表达量均达到最高水平,分别为对照组的7.67、11.53、19.06倍,并与对照组有极显著性差异。赵欢等[26]研究了不同浓度B(a)P(5、50 μg/L)对双齿围沙蚕CYP4基因表达的影响,结果显示,双齿围沙蚕CYP4基因表达与B(a)P诱导浓度和暴露时间呈正相关,且随着诱导浓度的增加和暴露时间的延长,表达量逐步上调。
鉴于多毛类动物CYP450基因对PAHs的敏感性,除可利用多毛类动物为PAHs的监测提供依据外,还可为探究多毛类动物对PAHs的代谢分子机制提供一定参考。研究发现,PAHs可诱导多个CYP450基因同时出现表达上调,多毛类动物对PAHs的代谢可能是由多个CYP450基因共同参与解毒代谢的过程。Jøgensen等[27]研究发现,芘可同时诱导绿沙蚕CYP4BB1和CYP342A1两个基因表达上调。王振[28]在研究多齿围沙蚕对B(a)P的毒性响应时发现,暴露于低浓度B(a)P (2.5 μg/L)中的多齿围沙蚕 CYP2u、CYP3A和CYP4A基因表达均出现显著性升高,而暴露于高浓度 B(a)P(50 μg/L)的 CYP2u、CYP3A和CYP4A基因表达均出现显著性下降,其CYP4B基因表达在不同浓度B(a)P诱导下均无明显变化,由此推测,CYP4B基因可能不参与CYP450酶的解毒效应。Zheng等[29]从多齿围沙蚕体内克隆出CYP4BB2、CYP423A1和CYP424A1 3个序列全长,并探究了B(a)P暴露与这3个基因表达的相关性,结果表明,1.28 μg/L B(a)P会显著诱导多齿围沙蚕CYP4BB2、CYP423A1和CYP424A1基因的表达,当暴露至第4天时,与对照组相比,各基因转录水平分别上调了5.9、5.3和12.3倍。研究还发现,多毛类动物CYP450基因会因PAHs种类不同而出现选择性表达,不同CYP450基因可能参与不同PAHs的代谢。Li等[30]在小头虫Capitella sp.Ⅰ中克隆获得CYP4AT1和CYP331A1两个基因序列全长,不同PAHs诱导下两个基因的表达变化存在显著性差异,不同浓度3-甲基胆蒽 (3-methylcholanthrene,3-MC)均可诱导CYP4AT1基因表达,其表达量是空白对照组的2~9倍,但不可诱导CYP331A1基因表达,而不同浓度的B(a)P和荧蒽可诱导CYP331A1基因表达,其表达量是空白对照组的2~3倍。由此推测,CYP4AT1基因可能在3-MC代谢中起重要作用,而CYP331A1基因可能在B(a)P和荧蒽代谢中起重要作用。Won等[31]从多齿围沙蚕体内克隆出 CYP431A1、CYP432A1和CYP4DU1 3个基因,并发现 B(a)P暴露时, CYP431A1基因表达显著上调,而 CYP432A1和CYP4DU1基因表达均未出现显著上调;而原油暴露时,CYP431A1基因未出现显著的转录上调, CYP432A1和CYP4DU1基因均出现显著上调。由此推测,CYP431A1基因可能在B(a)P代谢中起重要作用,而CYP432A1和CYP4DU1基因可能在原油代谢中起重要作用。
除Ⅰ相解毒酶CYP450酶外,多毛类动物的Ⅱ相解毒酶GST酶对PAHs的毒性响应也已有报道。多毛类动物的GST酶活性及基因表达水平对PAHs的暴露具有很好的指示作用。王振[28]发现,不同浓度B(a)P(2.5、50.0 μg/L)均会引起多齿围沙蚕GST活性出现上升。Catalano等[32]研究了0.1 mg/L和0.5 mg/L的B(a)P暴露下沙蚕Hediste diversicolor GST酶活性的变化,亦发现不同浓度B (a)P均会引起GST酶活性上升。Bouraoui等[33]、Banni等[34]先后研究了100 μg/L B(a)P暴露下沙蚕H.diversicolor GST酶活性的变化,并分别于第12、24、36、48 h测定了其活性,发现GST酶活性与暴露时间呈正相关,且随暴露时间的延长酶活性逐步升高。Won等[31]研究发现,多齿围沙蚕暴露于原油时,其GST-omega和GST-sigma基因表达均显著上调。
1.2 抗氧化酶
多毛类动物体内抗氧化酶对PAHs的毒性响应也已有大量报道。研究发现,多毛类动物抗氧化酶活性与PAHs间亦存在明显的 “剂量-效应”和“时间-效应”关系,各种抗氧化酶的活性变化均对PAHs的暴露具有较好的指示作用。Pérez等[35]比较了蛤蜊Scrobicularia plana和沙蚕N.diversicolor抗氧化酶对不同浓度PAHs的毒性响应,发现两者体内CAT、GSH-PX酶均出现不同程度的毒性响应变化。孙福红等[36]研究发现,沙蚕 N.diversicolor暴露于110 μg/L的石油烃5 d后,其体内SOD酶活性显著低于对照组。Catalano等[32]研究了0.1、0.5 mg/L的B(a)P暴露下沙蚕H.diversicolor CAT、GSH-PX酶活性的变化,发现这两种抗氧化酶活性均出现显著性诱导。王振[28]在研究B(a)P胁迫下多齿围沙蚕抗氧化酶活性变化时发现,低浓度B (a)P(2.5 μg/L)暴露下,多齿围沙蚕 SOD、CAT、GSH-PX活性被显著性诱导,而GSH活性则受到显著性抑制;高浓度B(a)P(50 μg/L)暴露下,SOD、CAT、GSH-PX活性被显著性诱导, 而GSH同样被显著性抑制。赵欢等[26]在研究 B (a)P对双齿围沙蚕抗氧化酶活性影响时发现,在低浓度B(a)P(5 μg/L)暴露下,SOD、CAT和GSH-PX活性均随B(a)P诱导时间的延长而逐步升高;在高浓度B(a)P(50 μg/L)暴露下,SOD酶活性随 B(a)P浓度的增加出现抑制,CAT和GSH-PX酶活性则与B(a)P浓度呈正相关。王丽丽等[37]在研究 B(a)P胁迫对双齿围沙蚕 SOD、CAT活性影响时亦发现,SOD、CAT酶活性与PAHs间存在明显的 “剂量-效应”关系。多毛类动物抗氧化酶基因对PAHs的毒性响应也有所报道,Won等[31]将多齿围沙蚕暴露于原油时发现, 其Cu/Zn-SOD、Mn-SOD和CAT基因表达出现明显的转录上调,并由此表明,多齿围沙蚕体内SOD和CAT基因的表达水平可作为海洋溢油监测的重要生物指标。
综上所述,多毛类动物解毒代谢及抗氧化酶对PAHs具有很强的敏感性,其体内CYP450、GST、SOD、CAT等酶的活性及基因的分子表达水平已作为对海洋环境中 PAHs进行监测的重要生物指标[38]。
1.3 毒性响应机制
研究发现,PAHs进入生物体内可通过芳香烃受体 (aryl hydrocarbon receptor,AHR)介导调控通路对机体产生毒性效应。对脊椎动物AHR基因结构和基本功能的研究表明,AHR通道在其对PAHs毒性效应的调控中发挥着重要作用[39]。在脊椎动物中AHR主要介导CYP1A1和CYP1A2基因的诱导,其配体包括多卤代芳烃类和PAHs,如二恶英、B(a)P等。AHR在未与配体结合前与热休克蛋白90(heat shock protein 90,HSP90)、AHR相互作用蛋白 (ahr lnteracting protein,AlP)和其他蛋白结合,当PAHs等诱导剂进入胞质后先与AHR结合,使AHR构象发生改变并与HSP90或AIP解离,结合了配体的AHR再与芳香烃受体核转运因子 (ahreceptor nuclear translocator,ARNT)形成异二聚体,异二聚体进入细胞核与CYP1A1增强子结合,AHR羧基端的转录激活域与其他转录因子形成转录起始复合物,启动CYP1A1 mRNA的表达[40](图1)。
AHR通道在无脊椎动物中也已得到认证。Du 等[41]在研究马氏珠母贝Pinctada martensii对芘的毒性响应时发现,马氏珠母贝体内存在AHR且能与芘结合,从而诱导其体内CYP4基因表达,但目前尚未发现多毛类动物体内含有AHR同源物, Jørgensen等[13]认为,多毛类动物可能是由其体内其他核受体与PAHs相结合,进而调控CYP转录,合成CYP酶参与PAHs第一阶段的代谢 (图2)。
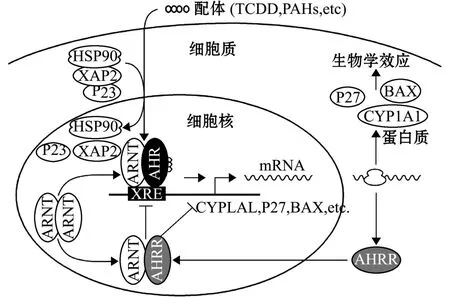
图1 AHR通道的调控机制[42]Fig.1 Regulation mechanism of AHR pathway[42]

图2 多环芳烃生物转化和消除过程[13]Fig.2 Processes that participate in the biotransformation and elimination of PAHs[13]
2 海洋多毛类对PAHs的代谢
与无脊椎动物相比,有关脊椎动物对PAHs的代谢过程研究比较全面和透彻[43]。有机物质在脊椎动物体内的代谢主要分为两个阶段:Ⅰ相代谢和Ⅱ相代谢,最后代谢产物 (polycyclic aromatic hydrocarbons metabolite,PAHm)经膜转运蛋白排除细胞外。首先,在Ⅰ相代谢酶 (细胞色素 P450 酶)的作用下,外源物质通过氧化、还原和水解等作用,在其分子上引入一官能团 (如羟基、硝基和羧基等);其次,在Ⅱ相代谢酶 [如GST、葡萄糖醛酸转移酶 (glucuronyltransferase,GT)、磺基转移酶 (sulfotransferase,ST)和N-乙酰基转移酶 (n-acetyltransferase,NAT)以及各种甲基转移酶 (methyltransferase,MT)等]的作用下,该官能团与生物内源性的水溶分子结合 (如谷胱甘肽、葡萄糖醛酸等),以提高有机物质的极性,易于排出体外;最后,Ⅰ相和Ⅱ相的PAHm经由一类存在于细胞膜上依赖膜转运蛋白排出细胞外 [图3, 以B(a)P的代谢为例]。研究表明,多毛类动物对PAHs的代谢过程基本类似于脊椎动物对PAHs的两个阶段代谢过程[44-45]。
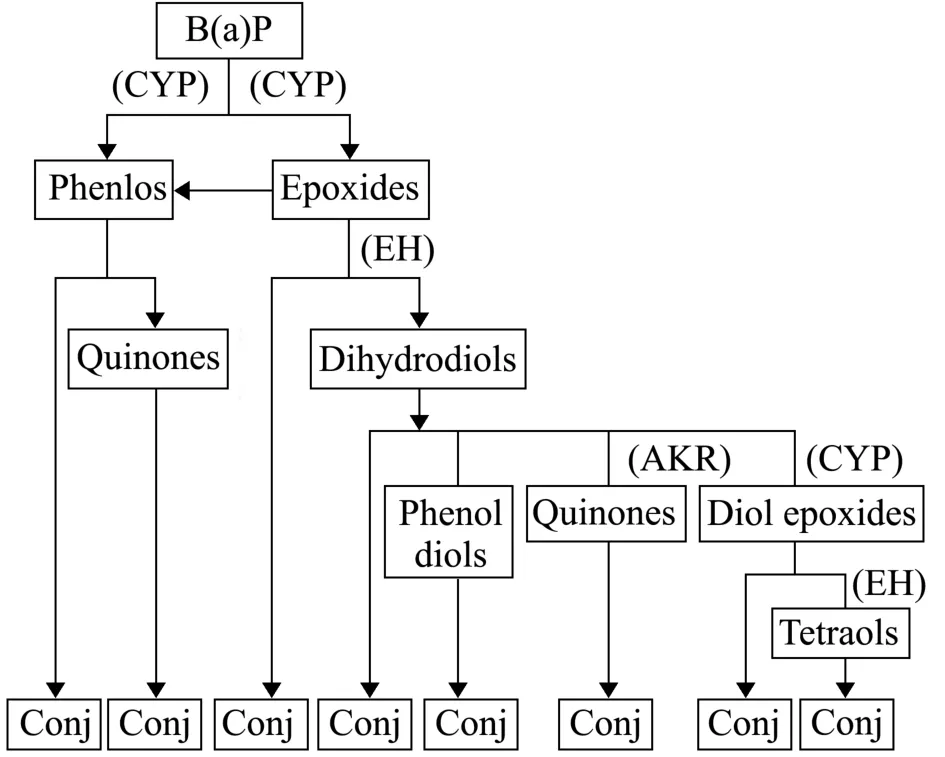
图3 苯并芘代谢途径[46]Fig.3 Benzo(a)pyrene metabolic pathways[46]
2.1 多毛类动物对PAHs的Ⅰ相代谢
目前,在探究多毛类动物对PAHs的代谢过程中,首先能够判断PAHm的含量和单氧酶的活性,因此,大多数研究主要先通过测定代谢过程中上述二者数据,并以此来确定PAHm和参与代谢的相关酶类,从而推测多毛类对PAHs的代谢过程。大量研究已证实,CYP450酶是多毛类动物对PAHs的第一阶段代谢过程中起主导作用的酶[21-23]。在探究多毛类动物对PAHs代谢的Ⅰ相PAHm过程中,有关PAHm含量的数据表明,多毛类动物对PAHs的代谢能力存在物种特异性差异。Palmqvist 等[47]在研究荧蒽暴露下小头虫Capitella sp.Ⅰ体内蓄积情况时发现,其体内蓄积的荧蒽约有18%转化为I相亲水性PAHm;Bach等[48]研究表明,当小头虫Capitella sp.Ⅰ暴露于30 μg/g荧蒽15 d后,其体内蓄积的荧蒽约有20%转化为Ⅰ相亲水性PAHm。相比之下,与其亲缘关系最近的Capitella sp.S体内蓄积荧蒽仅有约3%转化为Ⅰ相亲水性PAHm。上述结果表明,同一属不同多毛类物种对荧蒽的代谢能力存在差异。
Rust等[49]比较了B(a)P暴露下,6种多毛类下体内B(a)P的转化率,结果显示,暴露7 d后, Spio setosa、Nereis succinea、N.virens、Nephys incise、Cirriformia grandis和Clymenella torquata对B(a)P转化率分别为92%、85%、72%、27%、14%和6%,这表明不同多毛类物种对体内蓄积的B(a)P的代谢能力存在较大差异。McElroy等[50]研究了3羟基-苯并芘 [3-hydroxy-benzo(a)pyrene,3HB(a)P]暴露下4种多毛类N.succinea、Pectinaria gouldii、Haploscolopolous sp.和Capitella sp.Ⅰ的转化率,发现它们对3H-B(a)P的生物转化率依次为96%、7%、38%和42%,表明不同多毛类物种体内蓄积3H-B(a)P的代谢能力也存在较大差异。
研究表明,多毛类动物对PAHs的代谢能力存在较大的物种差异性,目前对这种物种特异性差异尚未有明确研究。Driscoll等[51]研究了3种多毛类动物Leitoscoloplos fragilis、N.diversicolor、Scolecolepides viridis对PAHs的代谢后发现,多毛类动物对PAHs的代谢过程中,物种特异性差异不仅体现在对PAHs的代谢能力上,也体现在代谢活动中对CYP450酶活性的诱导上。Jørgensen等[45]认为,代谢的第一阶段通常是整个代谢过程中起限制作用的过程,CYP450酶是代谢第一阶段中的关键酶,其活性变化的差异可能引起不同多毛类动物对PAHs的代谢能力存在差异。
在研究多毛类动物对PAHs的代谢过程中,除对PAHm进行定量分析外,进行定性分析也是必不可少的,这对探究多毛类动物对PAHs的代谢过程起着至关重要的作用。然而,一些研究发现, PAHs在多毛类动物体内代谢过程中会形成几个不同的Ⅰ相PAHm,并且每个Ⅰ相PAHm最后会形成不同的Ⅱ相PAHm,要鉴定所有PAHm存在一定难度。McElroy等[50]应用高效液相色谱法详细研究了B(a)P在多毛类动物N.succinea体内的代谢过程,发现B(a)P在第一阶段形成了3种PAHm,分别为7,8-二醇苯并芘、7-羟基苯并芘、1,6 或3,6-二羟基苯并芘。Forbes等[52]通过高效液相色谱法研究发现,荧蒽在小头虫Capitella sp.Ⅰ体内经第一阶段代谢后可形成30多个不同的波峰,但只从这些波峰中鉴定出3-羟基荧蒽和8-羟基荧蒽这两种Ⅰ相 PAHm。Giessing[44,53]、Jørgensen 等[45]研究芘在沙蚕N.diversicolor和 N.virens体内的代谢过程中发现,沙蚕对PAHs的Ⅰ相代谢仅形成一种PAHm,即1-羟基芘。相比于前两个研究,芘在沙蚕体内进行Ⅰ相代谢仅形成一种中间代谢物,这可能与PAHs分子结构有关。
2.2 多毛类动物对PAHs的Ⅱ相代谢
目前,多毛类动物对PAHs的第二阶段代谢的相关酶类和PAHm尚未最终确认。已有研究表明,糖苷化反应可能是无脊椎动物Ⅱ相代谢的重要途径。与GST酶相比,尿苷二磷酸葡萄糖醛酸转移酶 (Uridine diphosphoglucuronyltransferase,UDPGT) 和ST酶被认为是多毛类动物对PAHs的第二阶段代谢过程中起主导作用的酶类。Giessing等[44]证明了在沙蚕N.diversicolor体内可形成葡萄糖醛酸结合物,Jørgensen等[45]发现与之亲缘关系较近的沙蚕N.virens体内也存在葡萄糖醛酸结合物。在其他的海洋无脊椎动物中 (贝类和甲壳类),糖苷化反应被认为主要是由UDPGT参与催化的反应。另一个重要的Ⅱ相代谢酶ST酶在一些研究中也已经被鉴定。Simpson等[54]在对两种海洋蛤蜊 Meloidogyne arenaria和Protothaca staminea暴露于芘和1-羟基芘中10 d后发现,芘-1-硫酸盐是其主要的Ⅱ相PAHm。Giessing[44]和 Jørgensen[45]先后对沙蚕N.diversicolor和N.virens体内1-羟基芘第二阶段PAHm进行了研究,还发现了第二阶段的终产物除包括芘-1-葡萄糖醛酸苷、芘-1-葡萄糖苷外,还有芘-1-硫酸盐存在 (图4),但与其他已经过鉴定的Ⅱ相 PAHm相比,硫酸盐PAHm一般较少[44-45,53,55]。相比之下,芘-1-葡萄糖醛酸苷是其主要的Ⅱ相PAHm。
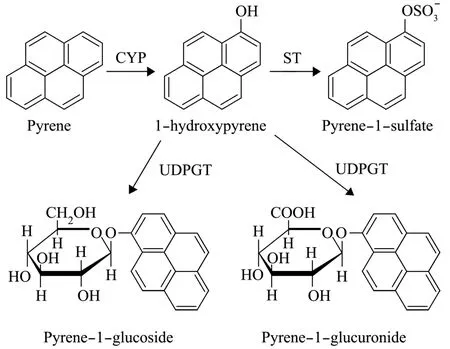
图4 芘在绿沙蚕体内的生物转化途径[45]Fig.4 Proposed biotransformation pathway of pyrene in Nereis virens[45]
3 问题与展望
3.1 毒性响应方面
(1)关于多毛类动物对PAHs的毒性响应研究主要集中在单一的PAHs化合物上,而在实际海洋环境中,PAHs多以复合物形式存在。Chen等[25]、Won等[31]、孙福红等[36]进行了多毛类动物对石油烃的毒性响应研究,这对探究多毛类动物对复合PAHs污染物的毒性响应有一定参考意义,但石油烃中除包括多环芳烃等主要有机化合物外,还包括少量其他有机物,如硫化物、氮化物、环烷酸类等,这不利于精确评价多毛类动物对复合PAHs污染物的毒性响应。因此,今后应加强多毛类动物对复合PAHs污染物的毒性响应研究,这将有助于利用多毛类动物自身的特殊生态属性对海洋环境中PAHs进行精确地监测。
(2)关于多毛类动物对PAHs的毒性响应研究大多采用短期暴露方式,且设置的污染物浓度多高于其在实际环境中的含量,这忽略了污染物低剂量长期暴露作用。目前污染物低剂量长期暴露的研究尚不多见,对此忽略将导致海洋环境污染风险监测与评价方法体系存在重大缺陷。因此,今后应开展污染物低剂量长期暴露试验。
(3)目前尚未有研究发现,多毛类动物体内含有AHR同源物,多毛类动物对PAHs的毒性响应机制研究仍停留在猜测阶段,对此方面的研究可作为今后重要研究方向之一。
3.2 代谢方面
(1)在探究多毛类动物对PAHs的代谢过程中,大多数研究以芘作为PAHs的代表物,由于芘具有紧凑的分子结构,不易被氧化,在生物体内第一阶段代谢过程中未形成环氧化物,所以可能忽视了诸如NAT、MT等转移酶在第二阶代谢过程中的重要性。因此,今后应增加其他PAHs化合物的研究,从而完善多毛类动物对PAHs的代谢研究。
(2)关于多毛类动物对PAHs的第二阶段代谢过程研究相对于第一阶段较少,并且有较少可靠数据表明,多毛类动物对PAHs的第二阶段代谢过程类似于脊椎动物同期。早期有关研究表明,多毛类动物的第二阶段代谢过程甚至与其相近物种不同,而关于多毛类动物对PAHs的代谢机制研究仍集中在少数多毛类物种上。因此,在今后的研究中应增加其他多毛类物种,以加强多毛类动物对PAHs的第二阶段代谢过程研究,这对完善多毛类动物对PAHs的代谢机制研究起着至关重要的作用。
[1] Haritash A K,Kaushik C P.Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):a review[J].Journal of Hazardous Materials,2009,169(1-3):1-15.
[2] 张晶,林先贵,曾军,等.植物混种原位修复多环芳烃污染农田土壤[J].环境工程学报,2012,6(1):341-346.
[3] Chen Yuyun,Zhu Lihong,Zhou Rongbing.Characterization and distribution of polycyclic aromatic hydrocarbon in surface water and sediment from Qiantang River,China[J].Journal of Hazardous Materials,2007,141(1):148-155.
[4] Xu Fuliu,Wu Wenjing,Wang Junjun,et al.Residual levels and health risk of polycyclic aromatic hydrocarbons in freshwater fishes from Lake Small Bai-Yang-Dian,Northern China[J].Ecological Modelling,2011,222(2):275-286.
[5] Bandowe B A M,Bigalke M,Boamah L,et al.Polycyclic aromatic compounds(PAHs and oxygenated PAHs)and trace metals in fish species from Ghana(West Africa):bioaccumulation and health risk assessment[J].Environment International,2014,65(2): 135-146.
[6] 梁慧姣,刘小龙,白莉,等.多环芳烃在水生环境食物链中的研究进展[J].安徽农业科学,2014,42(29):10261-10265.
[7] Darnerud P O,Atuma S,Aune M,et al.Dietary intake estimations of organohalogen contaminants(dioxins,PCB,PBDE and chlorinated pesticides,e.g.DDT)based on Swedish market basket data [J].Food and Chemical Toxicology,2006,44(9):1597-1606.
[8] 杜永芬,徐奎栋,孟昭翠,等.南海小型底栖动物生态学的初步研究[J].海洋与湖沼,2010,41(2):199-207.
[9] Matozzo V,Gagné F,Marin M G,et al.Vitellogenin as a biomarkerof exposure to estrogenic compounds in aquatic invertebrates:a review[J].Environment International,2008,34(4):531-545.
[10] Amiard J C,Geffard A,Amiard-Triquet C,et al.Relationship between the lability of sediment-bound metals(Cd,Cu,Zn)and their bioaccumulation in benthic invertebrates[J].Estuarine, Coastal and Shelf Science,2007,72(3):511-521.
[11] 牛俊翔,蒋玫,李磊,等.滩涂贝类养殖区底质硫化物的去除及修复[J].农业环境科学学报,2013,32(7):1467-1472.
[12] Tian Yulu,Liu Hongjun,Wang Qixiang,et al.Acute and chronic toxic effects of Pb2+on polychaete Perinereis aibuhitensis:morphological changes and responses of the antioxidant system[J].Journal of Environmental Sciences,2014,26(8):1681-1688.
[13] Jørgensen A,Giessing A M B,Rasmussen L J,et al.Biotransformation of polycyclic aromatic hydrocarbons in marine polychaetes [J].Marine Environmental Research,2008,65(2):171-186.
[14] Goldstone J V,McArthur A G,Kubota A,et al.Identification and developmental expression of the full complement of cytochrome P450 genes in zebrafish[J].BMC Genomics,2010,11:643.
[15] Kirischian N,McArthur A G,Jesuthasan C,et al.Phylogenetic and functional analysis of the vertebrate cytochrome P450 2 family [J].Journal of Molecular Evolution,2011,72(1):56-71.
[16] Uno T,Ishizuka M,Itakura T.Cytochrome P450(CYP)in fish [J].Environmental Toxicology and Pharmacology,2012,34(1): 1-13.
[17] Negishi M,Iwasaki M,Juvonen R O,et al.Structural flexibility and functional versatility of cytochrome P450 and rapid evolution [J].Mutation Research/fundamental and Molecular Mechanisms of Mutagenesis,1996,350(1):43-50.
[18] Nelson D R.Progress in tracing the evolutionary paths of cytochrome P450[J].Biochimica et Biophysica Acta(BBA)-Proteins and Proteomics,2011,1814(1):14-18.
[19] Wu Yuqiong,Wang Chongqang,Wang Yun,et al.Antioxidant responses to benzo[a]pyrene,tributyltin and their mixture in the spleen of Sebasticus marmoratus[J].Journal of Environmental Sciences,2007,19(9):1129-1135.
[20] 张景飞,王晓蓉.2,4-二氯苯酚低浓度长期暴露对鲫鱼肝脏抗氧化系统的影响[J].环境科学,2003,24(5):136-140.
[21] McElroy A E.Polycyclic aromatic hydrocarbon metabolism in the polychaete Nereis virens[J].Aquatic Toxicology,1990,18(1): 35-50.
[22] Lee R F,Singer S C.Detoxifying enzymes system in marine polychaetes:increases in activity after exposure to aromatic hydrocarbons[J].Rapp P-v Reun Cons Int Explor Mer,1980,179:29-32.
[23] Forbes V E,Forbes T L,Holmer M H.Inducible metabolism of fluoranthene by the opportunistic polychaete Capitella sp.Ⅰ[J]. Marine Ecology Progress Series,1996,132:63-70.
[24] Rewitz K F,Kjellerup C,Jorgensen A.Identification of two Nereis virens(Annelida:Polychaeta)cytochromes P450 and induction by xenobiotics[J].Comparative Biochemistry and Physiology Part C: Toxicology&Pharmacology,2004,138(1):89-96.
[25] Chen Xue,Zhou Yibing,Yang Dazuo,et al.CYP4 mRNA expression in marine polychaete Perinereis aibuhitensis in response to petroleum hydrocarbon and deltamethrin[J].Marine Pollution Bulletin,2012,64(9):1782-1788.
[26] 赵欢,赵新达,岳宗豪,等.苯并(a)芘对双齿围沙蚕抗氧化酶活性和细胞色素P450基因表达的影响[J].大连海洋大学学报,2014,29(4):342-346.
[27] Jørgensen A,Rasmussen L J,Andersen O.Characterisation of two novel CYP4 genes from the marine polychaete Nereis virens and their involvement in pyrene hydroxylase activity[J].Biochemical and Biophysical Research Communications,2005,336(3):890-897.
[28] 王振.多齿围沙蚕(Periereis nuntia Savigy)对苯并(a)芘的毒性响应[D].汕头:汕头大学,2010.
[29] Zheng Senlin,Chen Bin,Qiu Xiaoyan,et al.Three novel cytochrome P450 genes identified in the marine polychaete Perinereis nuntia and their transcriptional response to xenobiotics[J].A-quatic Toxicology,2013,134-135:11-22.
[30] Li Bo,Bisgaard H C,Forbes V E.Identification and expression of two novel cytochrome P450 genes,belonging to CYP4 and a new CYP331 family,in the polychaete Capitella Capitata sp.I[J].Biochemical and Biophysical Research Communications,2004,325 (2):510-517.
[31] Won E J,Rhee J S,Shin K H,et al.Expression of three novel cytochrome P450(CYP)and antioxidative genes from the polychaete,Perinereis nuntia exposed to water accommodated fraction (WAF)of Iranian crude oil and benzo[a]pyrene[J].Marine Environmental Research,2013,90:75-84.
[32] Catalano B,Moltedo G,Martuccio G,et al.Can Hediste diversicolor (Nereidae,Polychaete)be considered a good candidate in evaluating PAH contamination?A multimarker approach[J].Chemosphere,2012,86(9):875-882.
[33] Bouraoui Z,Banni M,Ghedira J,et al.Evaluation of enzymatic biomarkers and lipoperoxidation level in Hediste diversicolor exposed to copper and benzo[a]pyrene[J].Ecotoxicology and Environmental Safety,2009,72(7):1893-1898.
[34] Banni M,Bouraoui Z,Clerandeau C,et al.Mixture toxicity assessment of cadmium and benzo[a]pyrene in the sea worm Hediste diversicolor[J].Chemosphere,2009,77(7):902-906.
[35] Pérez E,Blasco J,Solé M.Biomarker responses to pollution in two invertebrate species:Scrobicularia plana and Nereis diversicolor from the Cádiz bay(SW Spain)[J].Marine Environmental Research,2004,58(2-5):275-279.
[36] 孙福红,周启星,张倩如.石油烃、Cu2+对沙蚕的毒性效应及对其抗氧化酶系统的影响[J].环境科学,2006,27(7):1415-1419.
[37] 王丽丽,王轶男,宋莹莹,等.镉、苯并(a)芘胁迫对双齿围沙蚕SOD、CAT活性及MDA含量的影响[J].海洋环境科学, 2015,34(1):17-22.
[38] Rhee J S,Won E J,Kim R O,et al.The polychaete,Perinereis nuntia ESTs and its use to uncover potential biomarker genes for molecular ecotoxicological studies[J].Environmental Research, 2012,112:48-57.
[39] Mandal P K.Dioxin:a review of its environmental effects and its aryl hydrocarbon receptor biology[J].Journal of ComparativePhysiology B,2005,175(4):221-230.
[40] Zhou Hailong,Zhang Linbao,Liao Chunyang,et al.Advances on toxicological mechanism of AhR pathway and early biomonitoring of persistent organic pollutants(POPs)in aquatic animals[J].A-sian Journal of Ecotoxicology,2010,5(1):9-17.
[41] Du Junqiao,Liao Chenghong,Zhou Hailong,et al.Gene cloning and expression analysis of AhR and CYP4 from Pinctada martensii after exposed to pyrene[J].Ecotoxicology,2015,24(7-8): 1574-1582.
[42] Mimura J,Fujiikuriyama Y.Functional role of AhR in the expression of toxic effects by TCDD[J].Biochimica et Biophysica Acta, 2003,1619(3):263-268.
[43] Yuan Lilai,Lv Biping,Zha Jinmiao,et al.Basal and benzo[a]pyrene-induced expression profile of phaseⅠand II enzymes and ABC transporter mRNA in the early life stage of Chinese rare minnows(Gobiocypris rarus)[J].Ecotoxicology and Environmental Safety,2014,106:86-94.
[44] Giessing A M B,Mayer L M,Forbes T L.1-hydroxypyrene glucuronide as the major aqueous pyrene metabolite in tissue and gut fluid from the marine deposit-feeding polychaete Nereis diversicolor[J].Environmental Toxicology and Chemistry,2003,22(5): 1107-1114.
[45] Jørgensen A,Giessing A M B,Rasmussen L J,et al.Biotransformation of the polycyclic aromatic hydrocarbon pyrene in the marine polychaete Nereis virens[J].Environmental Toxicology and Chemistry,2005,24(11):2796-2805.
[46] Shimada T.Xenobiotic-metabolizing enzymes involved in activation and detoxification of carcinogenic polycyclic aromatic hydrocarbons[J].Drug Metabolism&Pharmacokinetics,2006,21 (21):257-276.
[47] Palmqvist A,Selck H,Rasmussen L J,et al.Biotransformation and genotoxicity of fluoranthene in the deposit-feeding polychaete Capitella sp.I[J].Environmental Toxicology and Chemistry, 2003,22(12):2977-2985.
[48] Bach L,Palmqvist A,Rasmussen L J,et al.Differences in PAH tolerance between Capitella species:underlying biochemical mechanisms[J].Aquatic Toxicology,2005,74(4):307-319.
[49] Rust A J,Burgess R M,Brownawell B J,et al.Relationship between metabolism and bioaccumulation of benzo[a]pyrene in benthic invertebrates[J].Environmental Toxicology and Chemistry,2004,23(11):2587-2593.
[50] McElroy A,Leitch K,Fay A.A survey of in vivo benzo[a]pyrene metabolism in small benthic marine invertebrates[J].Marine Environmental Research,2000,50(1-5):33-38.
[51] Driscoll S K,McElroy A E.Bioaccumulation and metabolism of benzo[a]pyrene in three species of polychaete worms[J].Environmental Toxicology and Chemistry,1996,15(8):1401-1410.
[52] Forbes V E,Andreassen M S H,Christensen L.Metabolism of the polycyclic aromatic hydrocarbon fluoranthene by the polychaete Capitella capitata species I[J].Environmental Toxicology and Chemistry,2001,20(5):1012-1021.
[53] Giessing A M B,Lund T.Identification of 1-hydroxypyrene glucuronide in tissue of marine polychaete Nereis diversicolor by liquid chromatography/ion trap multiple mass spectrometry[J]. Rapid Communications in Mass Spectrometry,2002,16(16): 1521-1525.
[54] Simpson C D,Cullen W R,He T Y T,et al.Metabolism of pyrene by two clam species,Mya arenaria and Protothaca staminea[J]. Chemosphere,2002,49(3):315-322.
[55] Fillmann G,Watson G M,Howsam M,et al.Urinary PAH metabolites as biomarkers of exposure in aquatic environments[J].Environmental Science&Technology,2004,38(9):2649-2656.
Toxicity and metabolism of polycyclic aromatic hydrocarbons in polychaetes:a review
CAI Fu-cai,LI Yan-nan,ZHAO Huan,YANG Da-zuo,CHEN Xue,ZHOU Yi-bing
(Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
Polycyclic aromatic hydrocarbons(PAHs)endanger the health of human beings through the food chain due to accumulation in aquatic organisms.Some polychaetes have been known to accumulate and metabolise certain PAHs.The activity and gene expression level of metabolic enzymes and antioxidant enzymes in polychaetes have been reported as a good indication in PAHs monitoring in water.However,the metabolic mechanism in polychaetes is still unclear.The toxicity and metabolism of PAHs in polychaetes are summarized in the current paper,and the metabolism of PAHs in marine polychaetes was found to be similar to that in vertebrates,which includes two phases.In phase I,cytochrome P450 enzymes play an important role and uridine diphosphoglucuronyl transferase and sulfotransferase enzymes are considered to be the main enzymes in phaseⅡin polychaetes.Since there are some problems in the current research,the toxic effect of compound PAHs and low doses of PAHs in long exposure in polychaetes should be further investigated,especially the metabolism of different PAHs in polychaetes.
polychaete;polycyclic aromatic hydrocarbon;toxic effect;metabolism
X174
A
10.16535/j.cnki.dlhyxb.2017.01.020
2095-1388(2017)01-0119-08
2016-08-09
蓬莱19-3油田溢油事故海洋生态修复技术研究项目 (201005018);国家自然科学基金资助项目 (41306138);国家海洋公益性行业科研专项 (201305002,201305043)
蔡富才 (1991—),男,硕士研究生。E-mail:caifucai520@126.com
周一兵 (1957—),男,教授。E-mail:ybzhou@dlou.edu.cn
