不对称PCR技术及其在食源性致病菌检测中应用的研究进展
2017-03-14许恒毅
李 凡,许恒毅
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
不对称PCR技术及其在食源性致病菌检测中应用的研究进展
李 凡,许恒毅*
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
不对称PCR技术是获取单链DNA的一种重要方法。将不对称PCR技术与常用核酸检测方法结合,具有较高的灵敏度和较强的特异性,已被广泛应用食源性致病菌检测中。本文对不对称PCR技术进行简介,综述近年来其在食源性致病菌检测中的应用概况,并对其存在的问题进行了简单阐述。
不对称PCR技术,食源性致病菌,检测
食品安全一直是备受世界各地政府关注的焦点问题,而食源性致病菌是影响食品安全的主要原因之一。据报道,美国每年由致病菌引起的食源性疾病暴发事件达940万例,其中有55961例住院病例和1351例致死病例[1]。有资料统计表示,2016年第二季度我国国家食品药品监督管理总局抽检191672批次食品样品,不合格样品4690批次,其中食品中微生物污染问题占不合格总数的25.5%[2]。因此,建立快速、灵敏检测食源性致病菌的方法尤为重要。
目前用于食源性致病菌检测的方法主要为传统培养法,而传统检测方法一般需细菌分离、培养及生理生化鉴定,耗时、操作繁琐,已越来越不能满足对各种食源性致病菌快速检测的需求[3-5]。聚合酶链式反应(polymerase chain reaction,PCR)由美国Cetus公司的Mullis等人发明并于1985年推出。该技术弥补了传统检测方法的不足,具有快速简便、费用低等优点,已被广泛应用于各类食品中食源性致病菌的筛查[6-7]。不对称PCR技术(asymmetric PCR,aPCR)是PCR的一种,可扩增出大量单链DNA(single strand,ssDNA),ssDNA与双链DNA相比,由于不存在互补双链的竞争性结合,其杂交效率及检测灵敏度更高[8],利用这一特点建立基于aPCR的检测方法,可有效提高检测的灵敏度与特异性,在食源致病菌检测中具有良好的应用前景。本文对不对称PCR技术进行简介,综述近年来其在食源性致病菌检测中的应用概况,并对其存在的问题进行了简单阐述。
1 不对称PCR技术的原理
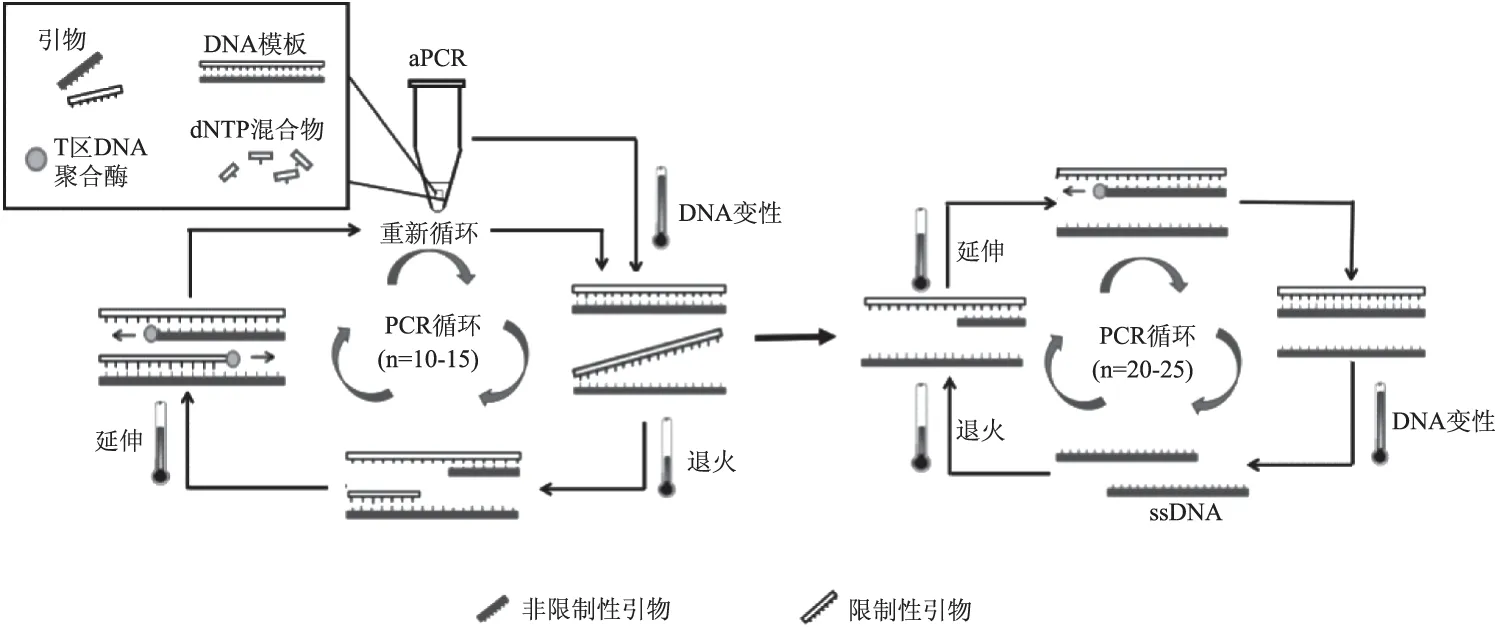
图1 aPCR原理图Fig.1 The schematic diagram of aPCR
aPCR是指在PCR反应体系中加入不等量的一对引物,经PCR扩增后产生大量的ssDNA的技术。其反应原理和操作步骤和普通PCR相似,主要区别是体系中添加了不等量的一对引物,分别称为非限制引物与限制性引物,两者比例一般为100∶1~50∶1。在模板DNA、dNTP以及适当缓冲液存在的条件下,依赖于DNA聚合酶的催化,对不等量引物所结合的DNA片段进行扩增,在PCR扩增的10~15个循环中,其扩增产物主要是双链DNA,但当限制性引物消耗完后,非限制性引物引导PCR反应进而产生大量ssDNA(见图1)。
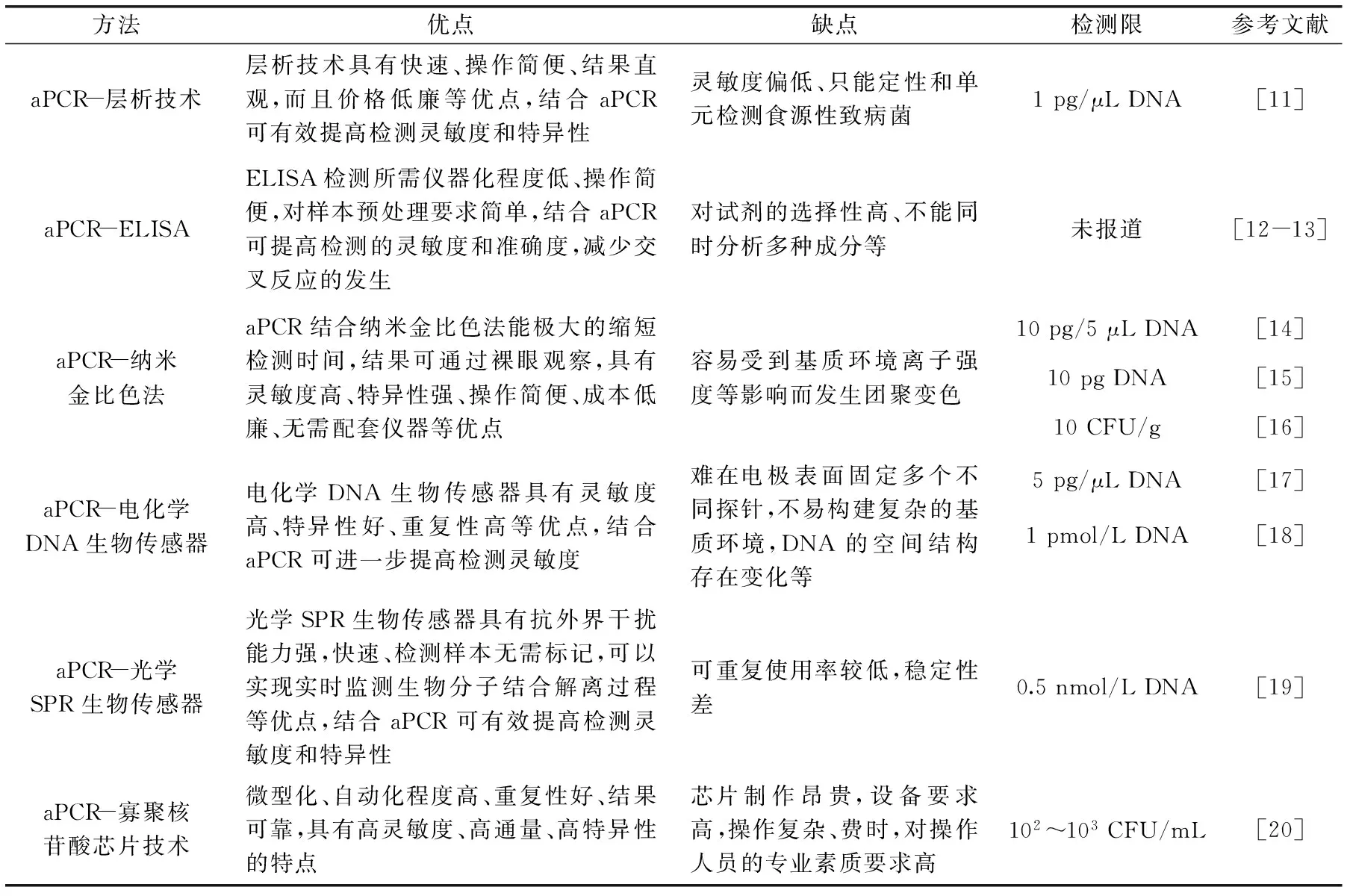
表1 基于aPCR的检测方法在食源性致病菌检测中应用的比较Table 1 Comparison for aPCR combining with other technologies for the detection of foodborne pathogens
2 基于aPCR检测食源性致病菌的技术
目前,大部分基于PCR技术的核酸检测需对DNA扩增产物进行凝胶电泳分析操作,检测灵敏度相对较低且涉及溴化乙锭(EB)等致癌物的使用,可能会对环境及操作人员健康造成危害[9-10]。aPCR技术是获取ssDNA的一种重要方法,将aPCR与各种常用的核酸检测方法进行结合,取代凝胶电泳程序,可以达到缩短检测周期、提高灵敏度和增强特异性等作用,有效避免常规PCR检测方法的不足。表1详细比较了基于aPCR的检测方法在食源性致病菌检测中应用的优缺点。
2.1 aPCR-层析技术
层析技术是以条状纤维层析材料为固相,借助毛细管作用使样品中的待测物与层析材料上的受体发生高特异性反应,通过酶促显色反应或直接使用可目测的着色标记物,对样品进行检测与分析[21]。将aPCR技术与层析技术相结合建立的核酸层析技术,通过试纸条可在10~15 min对扩增产物进行检测[11]。该技术在保证PCR高灵敏度的前提下,有效提高特异性,减少分析时间。Liu等[11]结合aPCR与层析技术同时检测大肠杆菌O157∶H7、单核细胞增生李斯特菌和金黄色葡萄球菌,分别根据大肠杆菌O157∶H7基因rfbE、单核细胞增生李斯特菌的hlyA以及金黄色葡萄球菌nuc为目的基因设计引物和捕获探针,将捕获探针包被在层析试纸检测区,通过杂交反应对目的ssDNA进行捕获,加入以金纳米颗粒标记的单链核酸序列作为信号探针进行检测,通过裸眼观察,同时检测3株菌的最低检测限均达到1 pg/μL DNA。此外,通过已知序列间杂交反应以及层析技术不需进行结合标记物与游离标记物的分离,提高了检测灵敏度及特异性,简化了分析过程。
2.2 aPCR-ELISA
酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)是一种非放射性标记免疫分析技术。PCR与ELISA结合建立的PCR-ELISA方法,是将预先固定在微孔板上的捕获探针与PCR产物在一定条件下进行杂交反应,免疫复合物所携带的酶分子可将特定的底物分子转化为具有特定颜色的化合物,通过定性或定量分析有色产物量确定样品中待测物含量[22]。该方法相对于凝胶光密度定量,其灵敏度、特异性、准确度均有较大的提高,且对仪器要求较低。Li等[23]采用PCR-ELISA法对婴儿配方奶粉中的阪崎肠杆菌进行检测,以rpoB为目的基因设计引物并进行PCR扩增,将扩增产物用于ELISA检测,在供试39株参考菌株中,19株阪崎肠杆菌用该方法检测都得到很好的阳性结果,其他20株非目的菌都表现出阴性结果,特异性达到100%。未经富集培养,检测灵敏度达1.06×103CFU/mL,相对于凝胶电泳提高了3个数量级。Hong等[24]将PCR技术与ELISA方法结合,检测禽肉中沙门氏菌和弯曲杆菌,检测限分别达到2×102和4×101CFU/mL,与常规PCR相比,分别提高了100~1000倍。虽然PCR-ELISA方法优点甚多,然而PCR产物需进行热变性使其从双链变成单链,步骤繁琐且存在互补双链,影响其杂交效率。采用aPCR进行检测,可以避免常规PCR技术的缺陷。目前,aPCR-ELISA方法主要应用于病毒的检测[12-13],还没有文献报道其在食源性致病菌检测中的应用。
2.3 aPCR-纳米金比色法
纳米金比色法是利用纳米金(gold nanoparticles,AuNPs)分散状态与集聚状态颜色的差异来设计的一种直观检测技术[25]。不同聚集状态的AuNPs呈现出明显的色差,当溶液中AuNPs呈分散状态时,宏观上表现为红色;当AuNPs发生团聚呈聚集状态时,表现为蓝紫色。将与待测DNA互补的两端探针序修饰到AuNPs表面,若探针与溶液中目标物质作用前后能够引起AuNPs状态的改变,溶液的颜色就会产生相应的变化。将aPCR方法与纳米金比色技术相结合,能极大的缩短检测时间,具有PCR的高灵敏度与分子杂交的高特异性的双重优势,同时可直观检测目的致病菌,成本低、无需依赖大型仪器。Deng等[14]将aPCR和纳米金比色法结合检测炭疽杆菌,利用aPCR扩增得到的大量ssDNA,根据目的ssDNA合成寡聚核苷酸序列,将其修饰在纳米金粒子表面作为检测探针,当加入靶核苷酸序列时,靶序列通过DNA的互补识别与纳米金探针的核苷酸杂交,由于纳米金粒子距离变小,溶液的颜色从红色变成蓝紫色。结果表明,这两种方法的结合极大的缩短了检测时间,杂交反应仅需5 min,检测灵敏度可达到10 pg/5 μL DNA。Quintela等[16]结合aPCR与纳米金比色法检测牛肉和蓝莓中的产志贺毒素大肠杆菌,经过6 h富集培养后,检测限高达10 CFU/g,比色检测时间低于1 h,特异性达到100%,与非产志贺毒素的大肠杆菌均没有发生交叉反应。Deng等[15]报道了用aPCR结合纳米金比色法对炭疽杆菌进行检测,通过裸眼观察灵敏度达到10 pg DNA,比色检测时间仅需10 min,与其余非目的芽孢杆菌未见任何交叉干扰,表现出很好的特异性。
2.4 aPCR-生物传感器
生物传感器是一种小型、便携的分析装置,是利用待测物质与生物活性材料发生生物化学反应,所产生的信号由换能器转换成电信号,再经信号放大装置输出,最终获得待测物浓度的信息[26]。生物传感器具有灵敏度高、操作简单、响应和检测迅速、携带方便等优点。将生物传感器与aPCR结合,可有效提高特异性,能够对微生物进行快速、准确的检测[27]。目前,基于aPCR的生物传感器根据转换原理的不同,主要有电化学生物传感器和光学生物传感器两类。
2.4.1 aPCR-电化学生物传感器 电化学生物传感器是以电极作为能量转换元件,利用在电极介质面上进行的电化学反应将被测化学信号转换为电信号来分析待测物的一种生物传感器[28]。将电化学生物传感器与aPCR结合用于病原菌检测,具有灵敏度高、特异性好、快速便携等优点。Low等[17]应用电化学DNA传感器检测霍乱弧菌的aPCR扩增产物,将双探针夹心杂交方法与免疫磁性分离技术及电化学DNA传感器技术紧密结合,通过比对生物体基因的互补碱基对,检测修饰电极在待测溶液中电化学信号的变化来确定靶细菌的DNA浓度。结果发现,该方法具有100%的特异性,检测灵敏度为103CFU/mL。Das等[18]将aPCR技术与电化学生物传感器结合检测炭疽杆菌,以巯基修饰的寡核苷酸探针为识别元件,PCR扩增后产物未经纯化直接与探针进行特异性杂交,检测限达到1 pmol/L DNA。Wen等[29]采用aPCR-电化学生物传感器检测大肠杆菌,将三维DNA四面体探针固定到传感器芯片表面,以uidA为目的基因进行aPCR扩增得到的大量靶序列,靶序列通过DNA的互补识别与四面体探针及信号探针进行杂交,进而检测出目的菌。结果表明,这两种方法的结合极大的提高了检测灵敏度,检测限为0.2 pg/μL DNA,相比传统的ssDNA检测方法提高了3个数量级。
2.4.2 aPCR-光学生物传感器 光学生物传感器是将反应产生的化学信号转换为光信号的一种生物传感器,其最大的优点是抗外界干扰能力强。光学生物传感器的检测模式有反射、吸收、荧光和化学发光等,在食源性致病菌检测中最有应用前景的技术主要包括表面等离子共振技术(surface plasmon resonance,SPR)等[30]。SPR是一种基于反射光谱的非标记检测技术,它先将已知生物分子键合在生物传感器表面,再加入能与之产生相互作用的目标生物分子,生物分子间的结合引起的光学信号随机被SPR传感器转化为电信号进行检测分析。将SPR与aPCR结合用于病原菌检测,具有快速、灵敏度、检测样本无需标记及实时监测生物分子反应动力学过程等优点。Zhang等[19]结合aPCR与光学SPR传感器检测沙门氏菌,将寡核苷酸探针通过生物素-链霉亲和素作用固定到传感器芯片表面,利用不对称PCR扩增出目的ssDNA,与芯片表面探针进行碱基互补配对,检测限达到0.5 nmol/L DNA,杂交反应时间仅需15 min。Lei等[31]用aPCR结合光学SPR传感器检测沙门氏菌,将巯基化的探针通过Au-S键固定传感器芯片金膜表面,利用aPCR扩增出靶序列,靶序列通过DNA的互补识别与巯基化探针及链霉亲和素的适配子进行夹心操作,检测灵敏度可达到60 CFU/mL。
2.5 aPCR-寡聚核苷酸芯片技术
寡聚核苷酸芯片技术是将特定的DNA寡聚核苷酸片段(探针)固定于支持物表面上,产生二维核苷酸探针阵列,然后与标记的样本杂交,通过检测杂交信号来实现对生物样本快速、并行、高效地检测[32]。aPCR与寡聚核苷酸芯片技术结合,利用aPCR技术扩增出一定长度的寡核苷酸单链探针代替全长cDNA点样,制成芯片,可减少非特异杂交,有效区分有同源序列的基因,杂交温度均一,提高杂交效率,具有高通量、高集成和微型化等优点。Zhu等[20]采用多重aPCR方法与寡聚核苷酸芯片技术结合,对革兰氏阴性菌中10种内酰胺酶基因及六种重要的点突变型β-内酰胺酶基因进行检测,结果发现,该方法能够有效地从参考株和111份临床分离株中检测出抗性基因,可高通量、特异性地鉴别出病原微生物的亚种与变异。虽然寡核苷酸微阵列在病原体基因检测、基因表达比较、基因突变分析以及基因序列分析等领域具有较多优势。但是价格昂贵、定量分析功能不强等因素也制约着该方法在基层实验室的应用。
3 总结与展望
食源性致病菌是影响食品安全的主要因素之一。如何从复杂的食品样品中高灵敏和高特异的检测出数量极少的食源性致病菌,一直是食品安全领域一个亟待突破的环节。现今,随着分子生物学技术的迅猛发展,aPCR技术各方面性能不断获得完善,已被广泛应用于食源性致病菌的检测。aPCR技术相对于传统的平板计数方法,极大地缩短了节约时间和工作量;将aPCR技术与常用核酸检测方法结合,相比于常规PCR,其特异性和灵敏度均取得了大幅度提高,适应食品微生物检验发展需要。但是,基于aPCR技术的食源性致病菌检测方面,仍存在一些问题需要不断地完善和改进,如无法区分活菌和死菌而产生假阳性结果、食品中存在的复杂抑制因子干扰aPCR扩增等,这些问题限制了aPCR技术在食源性致病菌检测方面的进一步发展。采用核酸交联剂如叠氮溴化丙锭(PMA)、叠氮溴化乙锭(EMA)等[33-34]有效抑制死菌DNA的扩增,可准确地反应样本中活菌数量。此外,对样品前处理技术进行改进,如结合磁分离技术对目的菌进行高效富集与分离,不仅能去除基质干扰,而且能提高aPCR的灵敏度。因此,aPCR配合其他新型试剂或方法能更大程度地体现其应用价值,在检测食源性致病菌方面具有较好的前景。
[1]Scallan E,Griffin P M,Angulo F J,et al. Foodborne illness acquired in the United States-unspecified agents[J]. Emerging Infectious Disease,2011,17(1):16-22.
[2]国家食品药品监督管理总局. 总局关于2016年第二季度食品安全监督抽检情况分析的通告(2016年第109号)[EB/OL]. http://www.cfda.gov.cn/WS01/CL1687/159821.html
[3]Cadnum JL,Hurless KN,Deshpande A,et al. Sensitive and selective culture medium for detection of environmental clostridium difficile isolates without requirement for anaerobic culture conditions[J]. Journal of Clinical Microbiology,2014,52(9):3259-3263.
[4]Wang L,Ye C,Xu H,et al. Development of an SD-PMA-mPCR assay with internal amplification control for rapid and sensitive detection of viableSalmonellaspp.,Shigellaspp. andStaphylococcusaureusin food products[J]. Food Control,2015,57:314-320.
[5]Ma K,Deng Y,Bai Y,et al. Rapid and simultaneous detection ofSalmonella,Shigella,andStaphylococcusaureusin fresh pork using a multiplex real-time PCR assay based on immunomagnetic separation[J]. Food Control,2014,42:87-93.
[6]Valentini P,Pompa P P. A universal polymerase chain reaction developer[J]. Angewandte Chemie,2016,128(6):2197-2200.
[7]Feng P,Doyle M,Beuchat L. Rapid methods for the detection of foodborne pathogens:Current and next-generation technologies[J]. Food Microbiology:Fundamentals and Frontiers,2007,3:911-934.
[8]Wooddell C I,Burgess R R. Use of asymmetric PCR to generate long primers and single-stranded DNA for incorporating cross-linking analogs into specific sites in a DNA probe. Genome Research,1996,6(9):886-892.
[9]Ahn S,Walt D R. Detection ofSalmonellaspp. using microsphere-based,fiber-optic DNA microarrays[J]. Analytical Chemistry,2005,77(15):5041-5047.
[10]侯东军,韩合敬,郝智慧,等. 纳米金比色传感器检测食品中的沙门氏菌[J]. 黑龙江畜牧兽医,2016(4):273-275.
[11]Liu F,Liu H,Liao Y,et al. Multiplex detection and genotyping of pathogenic bacteria on paper-based biosensor with a novel universal primer mediated asymmetric PCR[J]. Biosensors and Bioelectronics,2015,74:778-785.
[12]Nolasco G,Santos C,Silva G,et al. Development of an asymmetric PCR-ELISA typing method for Citrus tristeza virus based on the coat protein gene[J]. Journal of Virological Methods,2009,155(2):97-108.
[13]Nolasco G,Sequeira Z,Soares C,et al. Asymmetric PCR ELISA:increased sensitivity and reduced costs for the detection of plant viruses[J]. European Journal of Plant Pathology,2002,108(4):293-298.
[14]Deng H,Xu Y,Liu Y,et al. Gold nanoparticles with asymmetric polymerase chain reaction for colorimetric detection of DNA sequence[J]. Analytical Chemistry,2012,84(3):1253-1258.
[15]Deng H,Zhang X,Kumar A,et al. Long genomic DNA amplicons adsorption onto unmodified gold nanoparticles for colorimetric detection ofBacillusanthracis[J]. Chemical Communications,2013,49(1):51-53.
[16]Quintela I A,Benildo G,Lin C S,et al. Simultaneous direct detection of Shiga-toxin producingEscherichiacoli(STEC)strains by optical biosensing with oligonucleotide-functionalized gold nanoparticles[J]. Nanoscale,2015,7(6):2417-2426.
[17]Low K F,Karimah A,Yean C Y. A thermostabilized magnetogenosensing assay for DNA sequence-specific detection and quantification ofVibriocholerae[J]. Biosensors and Bioelectronics,2013,47:38-44.
[18]Das R,Goel A K,Sharma M K,et al. Electrochemical DNA sensor for anthrax toxin activator geneatxA-detection of PCR amplicons[J]. Biosensors and Bioelectronics,2015,74:939-946.
[19]Zhang D,Yan Y,Li Q,et al. Label-free and high-sensitive detection ofSalmonellausing a surface plasmon resonance DNA-based biosensor[J]. Journal of Biotechnology,2012,160(3):123-128.
[20]Zhu L X,Zhang Z W,Liang D,et al. Multiplex asymmetric PCR-based oligonucleotide microarray for detection of drug resistance genes containing single mutations in Enterobacteriaceae[J]. Antimicrobial Agents and Chemotherapy,2007,51(10):3707-3713.
[21]程楠,何景,董凯,等. 试纸法在食品安全快速检测中的研究进展[J]. 食品科学,2015(1):256-261.
[22]曹玮,王明忠,王晓英,等. 核酸检测及相关技术在食源性致病菌快速检测中的研究[J]. 卫生研究,2008,37(2):245-248.
[23]Li Y,Cao L,Zhang C,et al. Development and evaluation of a PCR-ELISA assay for the detection and quantification ofCronobacterspp. [J]. International Dairy Journal,2013,33(1):27-33.
[24]Hong Y,Berrang M E,Liu T,et al. Rapid detection ofCampylobactercoli,C.jejuni,andSalmonellaentericaon poultry carcasses by using PCR-enzyme-linked immunosorbent assay[J]. Applied and Environmental Microbiology,2003,69(6):3492-3499.
[25]白文荟,刘金钏,陈爱亮. 纳米金比色法在食品安全检测中的应用研究进展[J]. 食品安全质量检测学报,2014(7):1943-1950.
[26]封莉,黄继超,刘欣,等. 食源性致病菌快速检测技术研究进展[J]. 食品科学,2012,33(21):332-339.
[27]Campuzano S,Pedrero M,García J L,et al. Development of amperometric magnetogenosensors coupled to asymmetric PCR for the specific detection ofStreptococcuspneumoniae[J]. Analytical and Bioanalytical Chemistry,2011,399(7):2413-2420.
[28]Geng P,Zhang X,Teng Y,et al. A DNA sequence-specific electrochemical biosensor based on alginic acid-coated cobalt magnetic beads for the detection ofE.coli[J]. Biosensors and Bioelectronics,2011,26(7):3325-3330.
[29]Wen Y,Wang L L,Xu L,et al. Electrochemical detection of PCR amplicons ofEscherichiacoligenome based on DNA nanostructural probes and polyHRP enzyme[J]. Analyst,2016,141(18):5304-5310.
[30]栗建永,赵琢,贾晓川,等. 食源性致病菌检测分析技术的研究进展[J]. 食品研究与开发,2013,34(18):110-115.
[31]Lei P,Tang H,Ding S,et al. Determination of the invA gene ofSalmonellausing surface plasmon resonance along with streptavidin aptamer amplification[J]. Microchimica Acta,2015,182(1-2):289-296.
[32]高爽. 运用寡核苷酸芯片鉴定检测食源性致病菌技术的研究[D]. 大连:辽宁师范大学,2006.
[33]Cattani F,Barth V C,Nasário J S R,et al. Detection and quantification of viableBacilluscereusgroup species in milk by propidium monoazide quantitative real-time PCR[J]. Journal of Dairy Science,2016,99(4):2617-2624.
[34]Yang Y,Xu F,Xu H,et al. Magnetic nano-beads based separation combined with propidium monoazide treatment and multiplex PCR assay for simultaneous detection of viableSalmonellaTyphimurium,EscherichiacoliO157∶H7 andListeriamonocytogenesin food products[J]. Food Microbiology,2013,34(2):418-424.
Asymmetric polymerase chain reaction technology and its application in detection of foodborne pathogens
LI Fan,XU Heng-yi*
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
Asymmetric PCR(aPCR)is an important method to obtain single stranded DNA. This technology combined with commonly nucleic acid detection methods were widely used for the detection of foodborne pathogens due to its high sensitivity and specificity. In this paper,aPCR was introduced,and the application of aPCR in the detection of foodborne pathogens during the past 10 years was reviewed,furthermore,the problems of aPCR were briefly discussed.
asymmetric polymerase chain reaction;foodborne pathogens;detection
2016-07-25
李凡(1990-),女,硕士研究生,研究方向:食品安全与检测,E-mail:349465359@qq.com。
*通讯作者:许恒毅(1981-),男,博士,副研究员,研究方向:食品生物技术,E-mail:kidyxu@163.com。
江西省青年科学家(井冈之星)培养对象项目(20142BCB23004);食品科学与技术国家重点实验室青年研究基金项目(SKLF-QN-201504)。
TS207.4
A
:1002-0306(2017)04-0379-05
10.13386/j.issn1002-0306.2017.04.063
