海产品中霍乱弧菌、副溶血性弧菌和单增李斯特菌三重荧光定量PCR检测方法的建立
2017-03-14张继伦王粮子刘代新
李 涛,王 艳,张继伦,*,王粮子,刘代新
(1.上海震旦学院公共卫生与护理学院,上海 201908;2.上海出入境检验检疫局,上海 200135;3.江苏同科医药科技有限公司,江苏苏州 215000)
海产品中霍乱弧菌、副溶血性弧菌和单增李斯特菌三重荧光定量PCR检测方法的建立
李 涛1,王 艳2,张继伦2,*,王粮子2,刘代新3
(1.上海震旦学院公共卫生与护理学院,上海 201908;2.上海出入境检验检疫局,上海 200135;3.江苏同科医药科技有限公司,江苏苏州 215000)
目的:建立一种同时定量检测霍乱弧菌、副溶血性弧菌、单增李斯特菌的三重PCR方法。方法:依据霍乱弧菌CTX遗传单元中zot毒力基因;副溶血性弧菌TDH中tl基因;单增李斯特菌hly基因,设计特异性引物探针,建立和评价了检测试剂盒性能。结果:霍乱弧菌、副溶血性弧菌、单增李斯特菌浓度在102~105cfu/mL标准曲线线性相关系数分别为0.9998、0.999、0.9963。三种致病菌105cfu/mL与103cfu/mL两种检测浓度对数值,批内变异系数分别为0.40%、0.83%、0.49%与0.75%、0.81%、0.64%;0.76%、1.03%、0.62%与1.06%、0.72%、1.26%;0.62%、0.51%、0.81%和1.38%、0.76%、2.34%;批间变异系数分别为0.58%与0.76%;0.83%与1.01%;0.66%与1.58%。检测灵敏度分别为:23、16、35 cfu/mL。结论:本文所建立的检测试剂盒适合于海产品等产品中三种致病菌的快速筛检。
霍乱弧菌,副溶血性弧菌,单增李斯特菌,多重荧光定量PCR
霍乱弧菌(Vibriocholerae)、副溶血性弧菌(VibrioParahaemolyticus)、单核细胞增生李斯特菌(Listeriamonocytogenes,下文简称为单增李斯特菌)是公认具有高致病性的细菌,这些致病菌可能来源于鱼、虾、蟹、贝类和海藻等海产品,多个国家均把这三种菌列入法定检测项目[1-5]。

表2 霍乱弧菌、副溶血性弧菌和单增李斯特菌特异性引物探针信息Table 2 The specific primers and probes of Vibrio cholera,Vibrio Parahaemolyticus and Listeria monocytogenes
三种致病菌经典和标准的检测方法是:选择性增菌,分离培养,生化鉴定,血清分型等,该方法受操作者经验和培养基质量影响大,检测所需时间长,无法满足食品及原料快筛的要求。随着分子生物学技术的快速发展,PCR技术已经广泛应用于病毒和细菌致病基因检测和溯源中。江迎鸿,段强德,蒋蔚等采用普通PCR方法[6-9],陈丽,李宏,胡兴娟选择实时荧光PCR[10-13]对霍乱弧菌、副溶血性弧菌和单增李斯特菌进行单独和不同组合检测的研究,结果表明PCR技术与传统培养方法比较具有快速、准确的特点,而多重荧光定量PCR技术能在同一PCR反应体系中实现对多种病原体的同步检测,为食源性微生物检定提供了高效、灵敏、特异、准确的方法。本研究基于荧光PCR技术,选用三重荧光标记,能够实现三菌同时联合检测,另本研究选用特异毒力基因作为目标基因能够实现特异毒力菌株的针对性筛检,同时配有梯度标准品能够实现检验结果的定量化,为实现海产品中霍乱弧菌、副溶血性弧菌及单增李斯特菌的快速联合检测提供技术支持。
1 材料与方法
1.1 材料与仪器
实验过程中使用的霍乱弧菌、副溶血性弧菌和单增李斯特菌等13株标准菌株 均来自中国药品生物制品检定研究院,具体信息请见表1;蛋白胨、酵母浸提物 购自英国OXOID公司;Premix Ex Taq(Probe qPCR) 购自大连宝生生物工程有限公司;细菌DNA提取试剂盒(DP302)及海洋动物组织基因组DNA提取试剂盒(DP324) 购自天根生化科技有限公司;其余试剂 为进口或国产分析纯。

表1 标准菌株信息Table 1 Information of standard bacteria strains
ABI 7500型荧光定量PCR仪 购自美国 ABI 公司;高速冷冻离心机(SORVALL Stratos) 购自Thermo Scientific公司;SHP 250型生化培养箱、THZ-312型台式恒温振荡培养器 购自上海精宏实验设备有限公司;SW-CJ-2FD型超净工作台、BSC-1300IIB2型生物安全柜 购自上海博讯医疗生物仪器股份有限公司。
1.2 引物与探针
霍乱毒素(cholera toxin,CT)是霍乱弧菌主要致病因素,CTX遗传单元中zot毒力基因相对保守,并广泛存在于O1群流行株和O139群菌株中[14],选用zot基因作为霍乱弧菌的特异序列。选用副溶血性弧菌通用型特异性基因tl基因为特异靶基因。选用hly基因序列作为单增李斯特菌特异靶基因进行引物探针设计[15]。表2中特异性引物探针委托上海英俊生物技术有限公司合成。
1.3 实验方法
1.3.1 DNA模板的制备 各取过夜培养的霍乱弧菌、副溶血性弧菌、单增李斯特菌菌液1 mL,选用天根生化科技有限公司细菌DNA提取试剂盒(DP302)提取基因组;实验用海产品组织基因利用海洋动物组织基因组DNA提取试剂盒(DP324)进行提取,提取方法按照说明书进行。
1.3.2 三重荧光PCR反应体系 荧光PCR反应体系为50 μL,反应体系组成:Premix Ex Taq(2×),25 μL;引物Vp-F(10 μmol/L)1 μL;Vp-R(10 μmol/L)1 μL;VC-R(10 μmol/L)1 μL;VC-F(10 μmol/L)1 μL;Lm-F(10 μmol/L)1 μL;Lm-R(10 μmol/L)1 μL;探针Vp-P(10 μmol/L)0.5 μL;VC-P(10 μmol/L)0.5 μL;Lm-P(10 μmol/L)0.5 μL;ddH2O,12.5 μL,DNA probe,5 μL。反应程序为:95 ℃预变性10 min;进入循环,95 ℃变性5 s,60 ℃退火30 s,共反应45个循环。
1.3.3 标准品的制备 取在37 ℃过夜培养的副溶血性弧菌、霍乱弧菌、单增李斯特菌培养液各1 mL,按照10倍梯度进行稀释并平板活菌计数,每个浓度3个平行实验,取平均值计算原液中的细菌浓度。
将经活菌计数的副溶血性弧菌、霍乱弧菌、单增李斯特菌菌液,分别进行10倍梯度稀释,选取102~105cfu/mL四个浓度梯度级别各1 mL菌液,分别利用1.3.1中的方法进行核酸提取。将提取后的副溶血性弧菌、霍乱弧菌、单增李斯特菌DNA,依据同级别浓度梯度分别进行等体积混合得系列标准品A(105cfu/mL)、B(104cfu/mL)、C(103cfu/mL)、D(102cfu/mL)。
1.3.4 标准曲线的建立 以1.3.3制备的标准品为模板,在最佳条件下用荧光定量PCR仪同时扩增,反应结束后以Ct值为X轴,以起始模板对应的菌液浓度对数值为Y轴绘制标准曲线。
1.3.5 特异性实验 表1中霍乱弧菌、副溶血性弧菌、单增李斯特菌作为目标菌,混合其余十个常见菌作为对照菌,菌液浓度约为103cfu/mL,加入菌液量100 μL。提取出DNA作为模版进行扩增检测,判断试剂盒的特异性。
1.3.6 精密度(重复性)实验 分别选用两个浓度梯度的霍乱弧菌、副溶血性弧菌、单增李斯特菌DNA,进行精密度评价(各10次重复),分别计算浓度对数值的批内变异系数和批间变异系数。
1.3.7 检测下限实验 将经逐级10倍梯度稀释的菌液分别取1 mL按照1.3.1中的方法进行DNA提取,并进行20次荧光PCR检测,以其中17次反应曲线典型S型且Ct值大于40的最低浓度确定为检测下限。
1.3.8 人工模拟样本检测 将完成计数的霍乱弧菌、副溶血性弧菌、单增李斯特菌菌液混合后进行适当稀释,使每种菌液浓度均达到107cfu/mL以上,并进行梯度稀释,作107、106、105、104、103、102cfu/mL浓度梯度,将以上浓度菌液混合液1 mL分别加入到10 g不含以上三种菌的三文鱼肉及青口贝肉中混合均匀,利用天根生物海洋动物组织基因组DNA提取试剂盒(DP324)对以上模拟样品进行基因组提取并测试。
2 结果与分析
2.1 标准曲线的建立
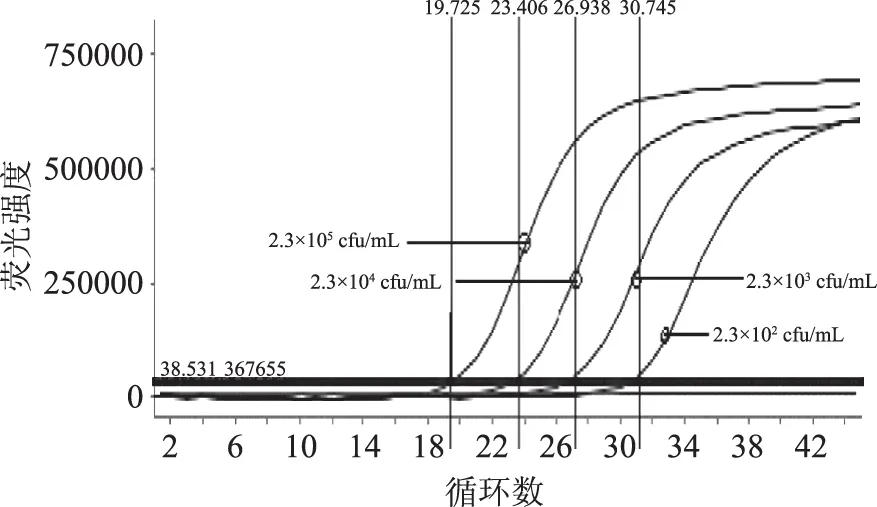
图1 标准品中不同浓度霍乱弧菌扩增曲线Fig.1 The amplification curves of Vibrio cholerae with different concentration in standard substance

图2 标准品中不同浓度副溶血性弧菌扩增曲线Fig.2 The amplification curves of Vibrio Parahaemolyticus with different concentration in standard substance
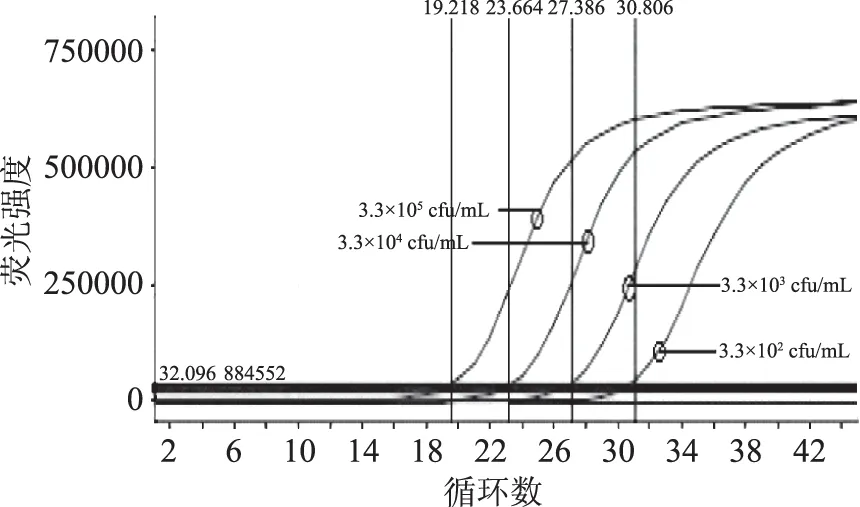
图3 标准品中不同浓度单增李斯特菌扩增曲线Fig.3 The amplification curves of Listeria monocytogenes with different concentration in standard substance

图4 霍乱弧菌标准曲线Fig.4 The standard curve of Vibrio cholerae

图5 副溶血性弧菌标准曲线Fig.5 The standard curve of Vibrio Parahaemolyticus

图6 单增李斯特菌标准曲线Fig.6 The standard curve of Listeria monocytogenes
以1.3.3制备的标准品为模版进行定量检测,以循环数为X轴,以相对荧光强度为Y轴,获得标准曲线(图1~图3)。反应结束后以Ct值为X轴,以起始模板浓度对数值为Y轴绘制标准曲线(图4~图6),所测得的霍乱弧菌标准曲线方程为:y=-0.2732x+10.746,相关系数R2为0.9998;副溶血性弧菌标准曲线方程为:y=-0.2738x+10.886,相关系数R2为0.999;单增李斯特菌标准曲线方程为:y=-0.2589x+10.242,相关系数R2为0.9963。将待测样品扩增得到的Ct值(X值)代入公式,即得到待测样本的浓度(cfu/mL)。
由图1~图6可知,构建的副溶血性弧菌、霍乱弧菌、单增李斯特菌DNA三联检测标准品可以得到较好的扩增曲线和标准曲线,并且线性关系良好,可以实现准确定量。

表3 霍乱弧菌精密度实验结果Table 3 The results of precision experiment of Vibrio cholera
注:霍乱弧菌105cfu/mL与103cfu/mL浓度对数值,批间变异系数分别为0.58%和0.76%。
2.2 特异性实验
按照1.3.5特异性实验的方法进行检测,如图7所示,经过多重荧光PCR检测,在添加有标准菌株混合样中,副溶血性弧菌、霍乱弧菌、单增李斯特菌均出现明显的扩增曲线,显示为阳性。添加其它干扰菌均无明显扩增,结果为阴性。实验结果表明:本研究建立的多重荧光定量检测方法对副溶血性弧菌、霍乱弧菌、单增李斯特菌有较好的特异性,与其他相关细菌无交叉反应。

图7 多重荧光定量PCR检测标准菌株特异性的扩增结果Fig.7 The amplification results of multiple real-time PCR method to detect standard bacteria strains
2.3 精密度实验
按照1.3.6的实验方法,按照1.3.2的试剂用量,采用3个批号试剂,每批不少于20次(依据下表3~表5,每批检测数10×2个)检验量。结果如表3~表5所示。霍乱弧菌、副溶血性弧菌、单增李斯特菌分别选择105cfu/mL及103cfu/mL两种浓度进行实验,结果标明,霍乱弧菌两个浓度对数值的批内变异系数分别为0.40%、0.83%、0.49%与0.75%、0.81%、0.64%,批间变异系数为0.58%与0.76%;副溶血性弧菌两个浓度对数值的批内变异系数分别为0.76%、1.03%、0.62%和1.06%、0.72%、1.26%,批间变异系数为0.83%和1.01%;单增李斯特菌两个浓度对数值的批内变异系数分别为0.62%、0.51%、0.81%和1.38%、0.76%、2.34%,批间变异系数为0.66%和1.58%。变异系数均小于5%,说明该方法的重复性良好。

表4 副溶血性弧菌精密度实验结果Table 4 The results of precision experiment of Vibrio Parahaemolyticus
注:副溶血性弧菌105cfu/mL与103cfu/mL浓度对数值,批间变异系数分别为0.83%和1.01%。

表5 单增李斯特菌精密度实验结果Table 5 The results of precision experiment of Listeria monocytogenes
注:单增李斯特菌105cfu/mL与103cfu/mL浓度对数值,批间变异系数分别为0.66%和1.58%。
2.4 检测下限实验
按照1.3.7检测限实验的方法进行检测,分别对霍乱弧菌2.3×103、2.3×102、2.3×101cfu/mL浓度进行检测;对副溶血性弧菌1.6×103、1.6×102、1.6×101cfu/mL浓度进行检测;对单增李斯特菌3.3×103、3.3×102、3.3×101cfu/mL浓度进行检测。结果表明:霍乱弧菌检测下限浓度为23 cfu/mL;副溶血性弧菌检测下限浓度为16 cfu/mL;单增李斯特菌为33 cfu/mL,以上表明本研究建立的方法有较好的检测灵敏度。

图8 三文鱼肉中不同浓度霍乱弧菌扩增曲线Fig.8 The amplification curves of Vibrio cholerae with different concentration in salmon meat
2.5 人工模拟样本检测结果
图8~图13结果表明:人工模拟样本三文鱼肉和青口贝肉中,霍乱弧菌、副溶血性弧菌及单增李斯特在230、160、330 cfu/g均能检出,在此浓度以下均未检出。本研究建立的方法在实际应用中,具有较好的灵敏度,能够实现以上三菌的联合检验。

图9 青口贝肉中不同浓度霍乱弧菌扩增曲线Fig.9 The amplification curves of Vibrio cholerae with different concentration in mussel meat
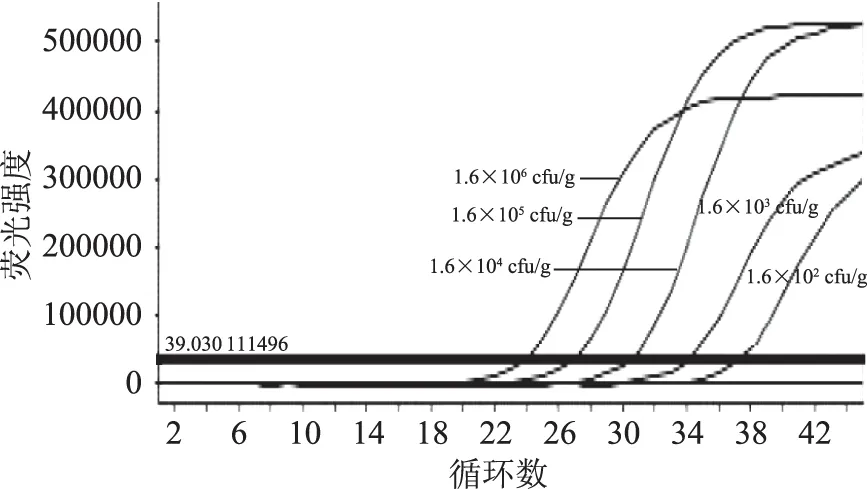
图10 三文鱼肉中不同浓度副溶血性弧菌扩增曲线Fig.10 The amplification curves of Vibrio Parahaemolyticus with different concentration in salmon meat

图11 青口贝肉中不同浓度副溶血性弧菌扩增曲线Fig.11 The amplification curves of Vibrio Parahaemolyticus with different concentration in mussel meat

图12 三文鱼肉中不同浓度单增李斯特菌扩增曲线Fig.12 The amplification curves of Listeria monocytogenes with different concentration in salmon meat

图13 青口贝肉中不同浓度单增李斯特菌扩增曲线Fig.13 The amplification curves of Listeria monocytogenes with different concentration in mussel meat
3 结论
本研究建立了一种霍乱弧菌、副溶血性弧菌和单增李斯特菌三菌联检的荧光定量PCR检测方法。增菌培养8~16 h,DNA提取1.5 h,加样和检测约2.5 h,合计所需时间20 h以内,远少于经典分离培养鉴定所需的一周时间。该方法具有特异性强、快速、高效、灵敏、可标准化的优点,实现了三种致病菌的同时检测,检出结果还包含公认致病基因信息,极大提高了检测效率,较好满足了食品及原料快速检测的需要,该技术有望应用于食品及原料的快速筛检。该方法与普通PCR法比较,检测速度更快,数据更易保存分析,避免了普通PCR电泳过程气溶胶污染,能有效降低假阳性,检测结果更准确。荧光PCR检测技术基于检测目标菌特异片段,待检样中只要存在无论死活的目标菌,就会检出,但因目前还无法提供定量、分型等信息,不能替代经典培养生化鉴定等标准方法,作为检出致病菌确认依据。
[1]滕勇勇,王琪,吴雷,等. 致病性弧菌的生物学特性和致病因子研究进展[J]. 热带医学杂志,2014,14(10):1396-1398.
[2]Liu D.Identification,subtyping and virulence determination ofListeriamonocytogenes,an omprotant food-borne pathogen[J]. Journal of Medical Microbiology,2006,55(6):645-659.
[3]Marija Z,Konrad J D,Wolfgang K.Practical relevance of methodologies for detecting and tracing ofListeriamonocytogenesin ready to eat foods and manufacture environments[J]. Food Science and Technology,2011,44(2):351-362.
[4]Chstterjee S,Ghosh K,Raychoudhuri A,et al. Phenotypic and genotypic traits and epidemiological implication ofVibrioCholeraeO1 and O139 strains in India during 2003[J].J Med Microbiol,2007,56(6):828-832.
[5]中华人民共和国卫生部疾病预防控制司. 霍乱防治手册[M].第六版.北京:人民卫生出版社,2012.
[6]Jio R,Si H P,Yeon SY.Simultaneous detection of Listeria species isolated from meat processed food s using multiplex PCR[J].Food Control,2013,32(2):659-664.
[7]江迎鸿,谭贵良,陈亚波,等. 多重PCR方法检测食品中霍乱弧菌、副溶血性弧菌和单核细胞增生李斯特氏菌[J]. 广东农业科学,2011(11):135-137.
[8]段强德,王录军,付宏岐,等.多重PCR快速检测食品中单核细胞增生性李斯特菌检测分析[J]. 山西农业科学,2015,61(3):38-40.
[9]蒋蔚,易力,陈永军,等.水产品中霍乱弧菌、副溶血弧菌和创伤弧菌多重PCR检测方法的建立[J].中国动物传染病学报,2016,24(1):44-51.
[10]陈丽,张红河,曹海芬,等.荧光聚合酶链反应检测副溶血弧菌TLH与TDH[J].检验医学;2007,22(4):450-454
[11]Fykse E M,Nilsen T,Nielsen A D,et al.Real-time PCR and NASBA for rapid and sensitive detection ofvibriocholerain ballast water[J].Mar Pollut Bull,2012,64(2):200-206.
[12]李宏,杨大伟,刘云国,等. 多重荧光定量PCR同时检测霍乱弧菌、副溶血性弧菌和创伤弧菌的方法研究[J]. 中国卫生检验杂志,2011,21(5):1180-1182.
[13]胡兴娟,沈飚,余辉,等. 多重荧光定量PCR法检测海产品中副溶血性弧菌、沙门氏菌和单增李斯特菌[J].中国食品卫生杂志,2016,28(4):440-444.
[14]Edwards KA,March JC.GM(1)-Functionalized Liposomes in a Microtiter Plate Assay for Cholera Toxin inVibrioCholeraeCulture Samples[J]. Anal Biochem,2007,368(1):39-48.
[15]王环宇,李亚鹏,杨军,等. 食品中单核细胞增生性李斯特氏菌PCR快速检测方法[J]. 中国食品卫生杂志,2004,16:10-13.
Establishment of triple real-time PCR detection method forVibriocholera,VibrioParahaemolyticusandListeriamonocytogenesin marine food products
LI Tao1,WANG Yan2,ZHANG Ji-lun2,*,WANG Liang-zi2,LIU Dai-xin3
(1.College of Public Health and Nursing,Shanghai Aurora Vocational College,Shanghai 201908,China;2.Shanghai Entry-Exit Inspection and Quarantine Bureau,Shanghai 200135,China;3.Jangsu Toneker Pharmaceutical Technology Co.,Ltd.,Jangsu 215000,China)
Objective:In order to establish a effective method to detectVibriocholera,VibrioParahaemolyticusandListeriamonocytogenesby triple real-time PCR. Methods:Specific primers and probes were designed,which based on the zot toxin gene of CTX inVibriocholera,tlgene of TDH inVibrioParahaemolyticusandhlygene ofListeriamonocytogenes. What is more,the performance of the test kit was established and evaluated. Results:The correlation coefficients of standard curve linears forVibriocholera,VibrioParahaemolyticusandListeriamonocytogeneswere 0.9998,0.999 and 0.9963. The intra-assay coefficient variables of the three pathpgens at 105cfu/mL and 103cfu/mL concentration logarithm were 0.40%,0.83%,0.49% and 0.75%,0.81%,0.64%;0.76%,1.03%,0.62% and 1.06%,0.72%,1.26%;0.62%,0.51%,0.81% and 1.38%,0.76%,2.34%;inter-assay coefficient variables were 0.58% and 0.76%,0.83% and 1.01%,0.66% and 1.58%. The sensitivity indicated that the lowest accurate quantitative concentrations ofVibriocholerae,Vibrioparahaemolyticus,Listeriamonocytogeneswere 23,16,35 cfu/mL. Conclusion:A rapid detection method for testing the three pathogens of aquatic products was established.
Vibriocholerae;VibrioParahaemolyticus;Listeriamonocytogenes;multiplex real-time PCR
2016-09-19
李涛(1985-),女,硕士,讲师,研究方向:食品病原菌检测,E-mail:litao09@126.com。
*通讯作者:张继伦(1964-),男,博士,主任技师,研究方向:病原菌检测,E-mail:jilunzhang@126.com。
上海市科委技术标准课题(13DZ05022702);上海市晨光计划(13CGB25)。
TS254.7
A
:1002-0306(2017)04-0081-07
10.13386/j.issn1002-0306.2017.04.007
