大鼠细胞外信号调节激酶1基因3ʹ非编码区双荧光素酶报告载体的构建及rno-miR-15b-5p对其活性的影响
2017-03-13罗汉将徐云峰李晓晓杨予涛徐志卿
罗汉将,徐云峰,李晓晓,杨予涛,徐志卿
大鼠细胞外信号调节激酶1基因3ʹ非编码区双荧光素酶报告载体的构建及rno-miR-15b-5p对其活性的影响
罗汉将1,徐云峰2,李晓晓1,杨予涛1,徐志卿1
目的以大鼠细胞外信号调节激酶1(ERK1)基因3ʹ非编码区(UTR)为研究对象,构建含有ERK1基因3ʹUTR区的野生型以及突变型重组双荧光素酶报告载体,通过分析双荧光素酶报告载体的活性,明确rno-miR-15b-5p对报告载体的调节作用。方法采用miRNeasy Mini Kit提取大鼠肾上腺嗜铬细胞瘤PC12细胞的总RNA,以PC12细胞的cDNA为模板,利用聚合酶链式反应(PCR)将ERK1基因3ʹUTR克隆到pmiR-RB-ReportTMvector中。利用重叠延伸PCR,将ERK1基因3ʹUTR中的rno-miR-15b-5p潜在的靶序列TGCTGCT分别突变成CGAACGT和GTACACG,并将突变的ERK1基因3ʹUTR克隆到pmiR-RB-ReportTMvector中。结果成功构建了包含ERK1基因3ʹUTR区的野生型报告载体pmiR-ERK13ʹUTR和突变型报告载体pmiR-ERK1-mut 3ʹUTR。利用荧光素酶活性检测系统,发现rno-miR-15b-5p mimic可以降低野生型报告载体的活性(P<0.001),但不影响突变型报告载体的活性。结论成功构建ERK1基因3ʹUTR区野生型和突变型双荧光素酶报告载体,初步证明ERK1基因3ʹUTR区是rno-miR-15b-5p的结合靶点。
rno-miR-15b-5p;细胞外信号调节激酶1;重叠延伸聚合酶链式反应;pmiR-ERK13ʹUTR;pmiR-ERK1-mut 3ʹ UTR;荧光素酶活性检测
[本文著录格式]罗汉将,徐云峰,李晓晓,等.大鼠细胞外信号调节激酶1基因3ʹ非编码区双荧光素酶报告载体的构建及rno-miR-15b-5p对其活性的影响[J].中国康复理论与实践,2017,23(2):166-172.
CITED AS:Luo HJ,Xu YF,Li XX,et al.Construction of rat extracellular signal-regulated kinase 1 gene 3ʹuntranslated regions dual-luciferase reporter plasmids and effect of rno-mir-15b-5p on its activitiy[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(2):166-172.
抑郁症是以显著而持久的心境低落、思维迟缓、认知功能障碍、意识活动减退和躯体症状为主要临床特征的精神疾病,但关于抑郁症发生的具体分子机制仍不明确。有研究表明,microRNAs(miRNAs)很可能作为一个重要的调节因子,通过影响突触的可塑性、神经的发生以及基因的表达,参与抑郁症发生[1]。
miRNAs是一类长度约为22个碱基的非编码小片段单链RNA,是人类非编码RNA中种类最多的一种。到目前为止,在动、植物以及病毒中已经发现有28,645个miRNAs分子,且有新的miRNA被陆续发现[2]。miRNAs在动、植物中主要参与基因的转录后调控,通过作用于靶基因3ʹ端非编码区(untranslated regions,UTR)的特定序列,切割降解靶基因的mRNA分子,调节靶基因的翻译,从而发挥调节效应[3]。已有研究资料显示,超过60%哺乳类动物基因受到miRNAs的调节[4]。
miRNAs参与多种生物学过程,对细胞的增殖、分化、凋亡和新陈代谢均起着重要的调节作用[5-8]。此外,在许多的病理过程如神经精神疾病[9]、肿瘤[10]及心血管病[11]中,都存在miRNAs表达异常的现象。
miR-15b是miR-15前体家族中的一员,参与调节肿瘤和骨骼的发生及分化等过程。研究发现,miR-15b可能作为一种成骨细胞的正向调节子,通过减少SmurfI介导的Runx2蛋白降解来促进成骨细胞分化[12]。miR-15b也被证实通过影响细胞周期进程和诱导细胞凋亡来抑制神经胶质瘤细胞的增殖[13]。
细胞外信号调节激酶1(extracellular signal-regulated kinase 1,ERK1)是由ERK1基因编码的产物,是丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)家族的一员,是Ras-Raf-MEK-ERK信号通路的关键组成部分[14]。研究表明,ERK1主要调节细胞的黏附、生长、迁移、存活、增殖、分化以及新陈代谢等多种生理过程[15],是多种信号通路共有的下游成分之一。此外,ERK1也参与多种病理学进程,许多原癌基因编码的蛋白可通过ERK信号通路来产生细胞学效应[16]。ERK信号通路的持续激活可以加速诱发肿瘤[17],但敲除ERK1基因的小鼠胸腺发育则存在障碍[18]。近期的一些研究表明,ERK信号通路也参与抑郁症的发生[9]。
我们通过miRNAs、TargetScan、miRBase等生物信息学在线网站发现,大鼠ERK1基因的3ʹUTR区域存在与rno-miR-15b-5p互补配对的碱基序列,初步推测ERK1基因是rno-miR-15b-5p潜在的作用靶点。
本研究以大鼠ERK1基因为研究对象,通过克隆ERK1基因3ʹUTR区,并突变其与rno-miR-15b-5p作用的靶序列,构建ERK1基因3ʹUTR野生型和突变型双荧光素酶报告载体,通过荧光素酶报告基因系统分析rno-miR-15b-5p mimic对含有野生型及突变型ERK1基因3ʹUTR的双荧光素酶报告载体活性的影响,初步确定rno-miR-15b-5p对ERK1基因的调节作用。该研究可为后续研究rno-miR-15b-5p通过调节ERK1基因的表达而影响大鼠的抑郁样行为奠定基础。
1 材料和方法
1.1 材料
1.1.1 实验材料
大肠杆菌DH5ɑ菌株、大鼠肾上腺嗜铬细胞瘤细胞(PC12)株为本实验室保存。
1.1.2 实验试剂
miRNeasy Mini Kit:QIAGEN,德国。Transcriptor First Strand cDNA Synthesis Kit:ROCHE,瑞士。Q5 High-Fidelity DNA polymerase、XhoI内切酶、NotI内切酶、Gel loading dye blue(6X)、T4 DNA连接酶:NEB,美国。DNA marker III:TIANGEN,中国。NucleoSpin®Gel and PCR Clean-up:MN,德国。E.Z. N.A.Plasmid Mini Kit I:OMEGA,美国。micrONTM miRNA mimic、pmiR-RB-ReportTMvector:RIBOBIO,中国。LipofectamineTM2000 Regent:INVITROGEN,美国。Dual-Luciferase®Reporter Assay System:PROMEGA,美国。Yeast Extract Powder、Tryptone、Agar Powder:USB,美国。NaCl:分析纯,中国。
1.1.3 实验仪器
聚合酶链式反应(polymerase chain reaction,PCR)仪:TECHNE,英国。低温高速离心机:EPPENDORF,德国。NanoDrop 2000紫外分光光度计:THERMO,美国。PYY-7C恒压恒流电泳仪:北京六一仪器厂。MLS-3750高压灭菌锅:SANYO,日本。DK-S22恒温水浴箱:北京市长风仪器仪表公司。AlphaImage凝胶成像系统:HP,美国。Glommax 20/20 Luminometer检测仪:PROMEGA,美国。
1.2 方法
1.2.1 基因序列的获取与miRNAs靶点预测
利用GenBank得到大鼠ERK1基因的3ʹUTR序列。通过miRNA靶基因预测网站TargetScan(http://www.targetscan.org/)、miRBase(http://www.mirbase. org/)、microRNA(http://www.microrna.org/)预测与大鼠ERK1基因3ʹUTR区结合的miRNAs。
1.2.2 PC12细胞总RNA提取、反转录及PCR扩增
PC12细胞培养48 h后,利用miRNeasy Mini Kit提取总RNA,经紫外分光光度计NanoDrop 2000测得RNA浓度,利用Transcriptor First Strand cDNA Synthesis Kit反转录总RNA 1 μg,获得大鼠cDNA。根据GenBank中ERK1基因的3ʹUTR序列,设计扩增其3ʹ UTR的上游引物F-ERK和下游引物R-ERK(见表1),以大鼠PC12细胞的cDNA作为模板,用上述引物进行PCR扩增。PCR反应体系为25 μl,包含有5×Q5 Reaction Buffer 5 μl、5×Q5 High GC Enhancer Buffer 5 μl、2.5 mmol/L dNTPs 2 μl、10 μmol/L上下游引物各1.25 μl、模板cDNA 0.5 μl、Q5 High-Fidelity DNA polymerase 0.25 μl、ddH2O 9.25 μl。扩增条件为98℃预变性30 s、98℃变性10 s、55℃退火10 s、72℃延伸20 s,共进行32个循环后,72℃后延伸2 min。扩增完成后进行1%琼脂糖凝胶电泳分析,并采用NucleoSpin®Gel and PCR Clean-up试剂盒纯化回收目的区域PCR产物。
1.2.3 野生型重组双荧光素酶报告载体的构建
用XhoI内切酶和NotI内切酶分别对上述扩增的PCR产物和pmiR-RB-ReportTMvector载体进行双酶切,纯化回收目的片段,然后用T4 DNA连接酶室温连接2 h。将连接产物转化到大肠杆菌DH5ɑ中,37℃恒温培养12~16 h,第2天进行菌落PCR和双酶切鉴定,将阳性克隆送北京奥科鼎盛科技有限公司测序,测序正确的克隆命名为pmiR-ERK13ʹUTR。
1.2.4 突变型重组双荧光素酶报告载体的构建
利用microRNA、TargetScan、miRBase等预测网站预测ron-miR-15b-5p与ERK1基因3ʹUTR结合的靶序列,将ERK1基因3ʹUTR中第242~248位碱基TGCTGCT(L1)突变为CGAACGT(M1),将第501~507位碱基TGCTGCT(L2)突变为GTACACG(M2)。针对L1位点设计突变引物MF1和MR1;针对L2位点设计突变引物MF2和MR2(见表1)。
以构建好的野生型pmiR-ERK13ʹUTR质粒为模板,利用重叠延伸PCR进行碱基突变。针对L1位点的突变,需要进行两组PCR。第一组PCR以MF1和R-ERK为引物进行扩增,第二组PCR以F-ERK和MR1为引物进行扩增。将上述两组PCR扩增产物经电泳回收后,取等体积混合,以此为模板,利用F-ERK和R-ERK引物,进行重叠延伸PCR。将PCR产物经电泳回收,送北京奥科鼎盛科技有限公司测序,分析目的序列L1是否突变成功。
针对L2位点的突变,以L1位点突变成功的PCR产物为模板,进行两组PCR,以F-ERK和MR2为引物的作为第一组,以MF2和R-ERK为引物的作为第二组。将两组PCR产物电泳回收后,取等体积混合,以此为模板,以F-ERK和R-ERK为引物,再次进行重叠延伸PCR。将PCR扩增产物纯化后,送北京奥科鼎盛科技有限公司测序,分析目的序列L2是否突变成功。将L1和L2位点均得到突变的PCR产物克隆到pmiR-RB-ReportTMvector载体中,并将其命名为pmiR-ERK1-mut 3ʹUTR。
1.2.5 细胞转染
采用LipofectamineTM2000 Regent转染试剂进行瞬时转染,方法根据试剂盒中说明书进行。转染前1 d,将PC12细胞接种到24孔细胞培养板中,每个孔中接种5×104个细胞,用含15%马血清和2.5%胎牛血清的F-12K Nutrient Mixture培养液500 μl培养过夜。转染当天,给细胞更换新鲜培养液。每个孔转染100 ng重组质粒以及终浓度为100 nmol/L的micrONTM miRNA-15b-5p mimic或其Negative control(NC)中的一种。用Opti-MEM®I Reduced Serum Medium(OMEM)配制转染混合液,取两个1.5 ml的EP管,各加入OMEM 25 μl,其中一管加入重组质粒100 ng及100 nmol/L miR-15b-5p mimic或NC,另一管加入LipofectamineTM2000 Regent 2 μl。各自混匀后静置5 min,随后将两者混匀后室温静置20 min制成转染复合物。将上述转染复合物均匀地滴加到细胞培养板各孔中。转染48 h后裂解细胞,进行下一步荧光素酶活性检测。上述实验中,每组设置3个平行副孔,不进行转染的细胞作为空白对照组,每组实验重复3次。
1.2.6 双荧光素酶活性检测
实验依据Dual-Luciferase®Reporter Assay System检测荧光素酶活性。将转染48 h后的PC12细胞用PBS洗涤2次,用Passive Lysis Buffer 100 μl裂解细胞20 min,随后用Glommax 20/20 Luminometer检测仪检测。测量管中加LAR II试剂50 μl以及细胞裂解液10 μl,测定读数记为荧光值1;再加入Stop&Glo reagent试剂50 μl,测定读数记为荧光值2,以荧光值2/荧光值1的比值作为相对荧光素酶活性。

表1 引物序列
1.3 统计学分析
采用GraphPad Prism 6.01统计软件进行多因素方差分析检验。数据以(±s)表示。显著性水平ɑ=0.05。
2 结果
2.1 miRNA靶点预测
大鼠ERK1基因是rno-miR-15b-5p的潜在靶基因之一,rno-miR-15b-5p与ERK1基因结合位点见图1。
2.2ERK13ʹUTR目的片段的扩增
以大鼠PC12细胞cDNA为模板,以F-ERK和R-ERK分别为上下游引物,利用Q5 High-Fidelity DNApolymerase进行PCR扩增,成功扩增出长度约为600 bp的扩增产物(图2),与预期大小一致。
2.3 野生型重组双荧光素酶报告载体的构建
将上一步扩增产物及pmiR-RB-ReportTMvector用XhoI和NotI进行双酶切处理,电泳回收ERK1基因3ʹ UTR片段和线性载体片段,经T4连接酶连接,然后将连接产物转化大肠杆菌DH5ɑ。将菌落PCR鉴定为阳性的3个克隆进行酶切鉴定,经琼脂糖凝胶电泳分析,3个阳性克隆均切出大小约为6200 bp和600 bp的片段(图3),初步证明重组载体构建成功。将上述3个克隆分别测序,发现插入片段与大鼠ERK1基因3ʹ UTR序列均一致,表明pmiR-ERK13ʹUTR野生型质粒构建成功。
2.4 突变型重组双荧光素酶报告载体的构建
由于ERK1基因3ʹUTR存在两个部分与rno-miR-15b-5p互补配对的靶序列L1和L2(图1),需要进行两轮突变。第一轮:以上一步构建成功的野生型pmiR-ERK13ʹUTR重组质粒作为模板,以MF1和R-ERK以及F-ERK和MR1作为两对突变引物分别进行针对L1位点的PCR扩增,得到大小约为367 bp和260 bp的PCR产物(图4A);将两部分PCR产物回收纯化,等比例混合后,作为模板,以F-ERK和R-ERK作为上下游引物,进行重叠延伸PCR,得到大小约为594 bp的产物(图4B)。将重叠延伸PCR产物回收后送北京奥科鼎盛科技有限公司测序,与ERK13ʹUTR进行比对,发现L1成功突变成M1。第二轮:以第一轮突变PCR产物作为模板,以F-ERK和MR2以及MF2和R-ERK作为两对突变引物进行针对L2的突变反应,得到大小约为518 bp和109 bp的PCR产物(图4C);将两部分PCR产物回收纯化,等比例混合后作为模板,以F-ERK和R-ERK作为上下游引物,进行重叠延伸PCR扩增,得到大小约为594 bp的PCR产物(图4D),并将该PCR产物测序,发现该PCR产物中的L1和L2位点均突变成功。
将L1和L2位点均突变的PCR产物以及pmiR-RB-ReportTMvector用XhoI和NotI进行双酶切处理,得到ERK1-mut 3ʹUTR片段和线性载体片段,通过T4连接酶,将突变片段克隆到pmiR-RB-ReportTMvector载体中。对菌落PCR鉴定为阳性的3个克隆进行酶切分析,发现上述3个克隆酶切后均产生两条亮带(图4E),大小约为6200 bp和600 bp,与预期大小一致。将上述3个克隆分别测序,发现L1和L2位点均突变成功,见图5。表明pmiR-ERK1-mut 3ʹUTR突变型质粒构建成功。
2.5 野生型和突变型重组报告载体的活性检测
将正确构建的pmiR-ERK13ʹUTR或pmiR-ERK1-mut 3ʹUTR重组报告质粒与micrONTM miRNA-15b-5p mimic或NC分别共转染至PC12细胞中,利用Dual-Luciferase®Reporter Assay System的方法检测其荧光素酶活性,发现rno-miR-15b-5p mimic可以明显下调野生型pmiR-ERK13ʹUTR报告载体活性,而对突变型pmiR-ERK1-mut 3ʹUTR报告载体活性无影响(图6)。

图1 rno-miR-15b-5p与ERK1基因的结合模式图
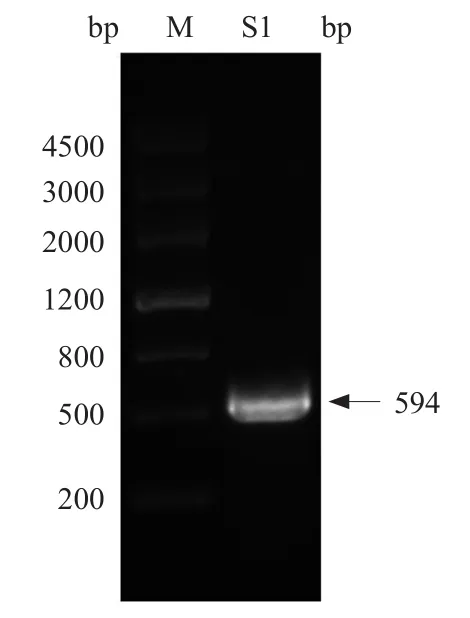
图2 ERK13ʹUTR的PCR扩增结果

图3 重组质粒pmiR-ERK13ʹUTR的酶切鉴定

图4 pmiR-ERK1-mut 3ʹUTR突变型载体的构建

图5 野生型和突变型载体部分测序分析图
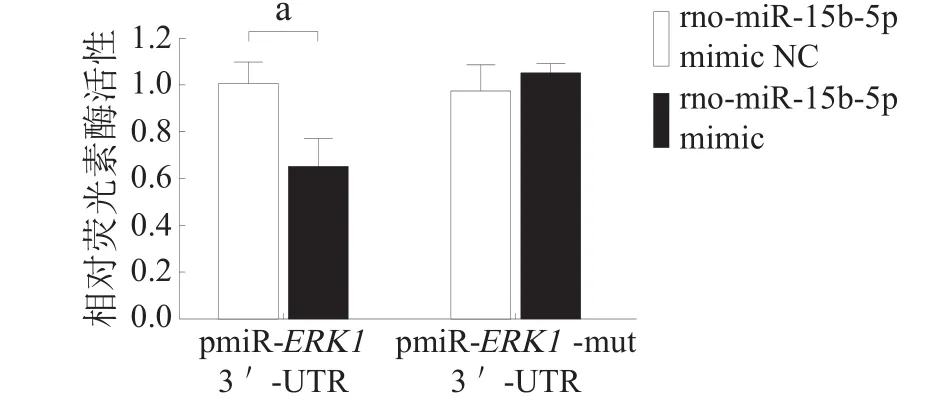
图6 rno-miR-15b-5p mimic/NC对野生型和突变型重组荧光素酶报告载体活性的影响
3 讨论
根据碱基互补配对原理,miRNAs通过与特定基因mRNA的部分碱基序列进行互补配对,进而影响目的基因mRNA的表达水平及后续翻译过程。在神经系统中,miRNAs也具有广泛的表达,参与多种生物学过程。研究显示,miR-137的过量表达可以促进成年神经干细胞的增殖,而敲减其表达则增强其分化[19]。miR-15b可以通过减缓细胞周期进程和诱导细胞凋亡来抑制神经胶质瘤细胞的增殖[13]。miR-124的异位表达可导致神经元早熟及生成的增多,而敲减其表达则导致脑室下区干细胞仍然处于未分化状态[20]。此外,研究显示,miRNAs也参与了突触的形成和发育过程,影响突触可塑性[21]。
ERK1/2主要被各种生长因子、离子射线、过氧化氢等磷酸化而激活,进入细胞核,通过修饰转录因子,影响基因的转录与表达。ERK1/2与细胞的增殖及分化关系密切。研究发现一些与增殖有关的信号分子可以通过与酪氨酸激酶受体[22]、G蛋白偶联受体(G protein-coupled receptor,GPCR)[23]、离子通道[24]等蛋白的相互作用而激活膜上Ras蛋白。GTP结合的Ras蛋白则可以激活蛋白激酶Raf-1,B-Raf,A-Raf (Rafs)[25]。Rafs可以通过磷酸化MEK1/2[26],进一步激活下游的ERK1/2,而ERK1/2的激活可以调节Elk1[27]、c-Fos[28]和c-Jun[29]等转录因子的磷酸化水平,最终影响细胞的增殖和分化。
研究表明ERK1/2与疾病的发生也有密切的关系。在阿尔茨海默病模型小鼠海马中,ERK1/2的表达存在异常[30]。在抑郁症患者[31]和慢性温和不可预期应激模型大鼠[32]海马中,ERK1/2的磷酸化水平明显降低。
为了研究在抑郁症中miR-15b和ERK1两者之间的关系,本研究利用microRNA、TargetScan、miRBase网站预测发现,rno-miR-15b-5p存在与靶基因ERK1基因3ʹUTR区互补配对的结合位点,并以此为基础,利用PCR成功得到ERK1 3ʹUTR及其与rno-miR-15b-5p结合位点突变的ERK1-mut 3ʹUTR,成功构建其野生型和突变型的双荧光素酶报告载体。
本研究选用的载体pmiR-RB-ReportTM是专门用来检测miRNAs与mRNA相互作用的工具,通过将目的基因的3ʹUTR区克隆至海肾荧光素酶基因(hRluc)下游位点,以海肾荧光素酶基因作为报告基因,以萤火虫荧光素酶基因(hluc)作为内参基因,通过检测海肾荧光素酶活性的相对变化来鉴定miRNAs对该基因是否具有调控作用。由于该载体同时包含报告基因和内参基因,因此减少了共转基因造成的实验误差,使得内参校准更加可靠。
本研究通过靶基因双向预测、目的基因片段的克隆、重组以及突变等技术成功地构建了应用于miRNA靶基因检测的野生型和突变型双荧光素酶报告载体pmiR-ERK1 3ʹUTR和pmiR-ERK1-mut 3ʹUTR。随后,利用rno-miR-15b-5p mimic与pmiR-ERK1 3ʹUTR或pmiR-ERK1-mut 3ʹUTR共转染PC12细胞进行荧光素酶活性检测,发现rno-miR-15b-5p mimic可以明显下调pmiR-ERK1 3ʹUTR的荧光素酶活性,表明大鼠ERK1基因是rno-miR-15b-5p的作用靶点。本研究为下一步深入探讨rno-miR-15b-5p与ERK1在抑郁症发病过程中的作用奠定了基础。
[1]Dwivedi Y.Evidence demonstrating role of microRNAs in the etiopathology of major depression[J].J Chem Neuroanat, 2011,42(2):142-156.
[2]Friedlander MR,Lizano E,Houben AJ,et al.Evidence for the biogenesis of more than 1,000 novel human microRNAs[J]. Genome Biol,2014,15(4):R57.
[3]Bunkar N,Pathak N,Lohiya NK,et al.Epigenetics:a key paradigm in reproductive health[J].Clin Exp Reprod Med,2016, 43(2):59-81.
[4]Friedman RC,Farh KK,Burge CB,et al.Most mammalian mRNAs are conserved targets of microRNAs[J].Genome Res, 2009,19(1):92-105.
[5]Hausser J,Zavolan M.Identification and consequences of miRNA-target interactions-beyond repression of gene expression[J].Nat Rev Genet,2014,15(9):599-612.
[6]Jonas S,Izaurralde E.Towards a molecular understanding of microRNA-mediated gene silencing[J].Nat Rev Genet,2015, 16(7):421-433.
[7]Tonevitsky AG,Maltseva DV,Abbasi A,et al.Dynamically regulated miRNA-mRNA networks revealed by exercise[J].BMC Physiol,2013,13:9.
[8]Makarova JA,Maltseva DV,Galatenko VV,et al.Exercise immunology meets MiRNAs[J].Exerc Immunol Rev,2014,20: 135-164.
[9]Lu J,Liang J,Wang JR,et al.Acupuncture activates ERK-CREB pathway in rats exposed to chronic unpredictable mild stress[J].Evid Based Complement Alternat Med,2013, 2013:469765.
[10]Palanichamy JK,Rao DS.miRNA dysregulation in cancer:towards a mechanistic understanding[J].Front Genet,2014,5: 54.
[11]Papageorgiou N,Zacharia E,Tousoulis D.Association between microRNAs and coronary collateral circulation:is there a new role for the small non-coding RNAs?[J].Ann Transl Med,2016,4(11):223.
[12]Vimalraj S,Partridge NC,Selvamurugan N.A positive role of microRNA-15b on regulation of osteoblast differentiation[J].J Cell Physiol,2014,229(9):1236-1244.
[13]Xia H,Qi Y,Ng SS,et al.MicroRNA-15b regulates cell cycle progression by targeting cyclins in glioma cells[J].Biochem Biophys Res Commun,2009,380(2):205-210.
[14]Busca R,Pouyssegur J,Lenormand P.ERK1 and ERK2 MAP kinases:specific roles or functional redundancy?[J].Front Cell Dev Biol,2016,4:53.
[15]Roskoski R Jr.ERK1/2 MAP kinases:structure,function,and regulation[J].Pharmacol Res,2012,66(2):105-143.
[16]Lei YY,Wang WJ,Mei JH,et al.Mitogen-activated protein kinase signal transduction in solid tumors[J].Asian Pac J Cancer Prev,2014,15(20):8539-8548.
[17]Gaestel M.MAPK-activated protein kinases(MKs):novel insights and challenges[J].Front Cell Dev Biol,2015,3:88.
[18]Pages G,Guerin S,Grall D,et al.Defective thymocyte maturation in p44 MAP kinase(Erk 1)knockout mice[J].Science, 1999,286(5443):1374-1377.
[19]Szulwach KE,Li X,Smrt RD,et al.Cross talk between microRNA and epigenetic regulation in adult neurogenesis[J].J Cell Biol,2010,189(1):127-141.
[20]Cheng LC,Pastrana E,Tavazoie M,et al.miR-124 regulates adult neurogenesis in the subventricular zone stem cell niche[J].Nat Neurosci,2009,12(4):399-408.
[21]Marsden WN.Synaptic plasticity in depression:molecular, cellular and functional correlates[J].Prog Neuropsychopharmacol Biol Psychiatry,2013,43:168-184.
[22]Berditchevski F,Odintsova E.ErbB receptors and tetraspanins:casting the net wider[J].Int J Biochem Cell Biol,2016,77 (PtA):68-71.
[23]Alvaro CG,Thorner J.Heterotrimeric G protein-coupled receptor signaling in yeast mating pheromone response[J].J Biol Chem,2016,291(15):7788-7795.
[24]Buraei Z,Lumen E,Kaur S,et al.RGK regulation of voltage-gated calcium channels[J].Sci China Life Sci,2015,58 (1):28-38.
[25]Kyriakis JM,Force TL,Rapp UR,et al.Mitogen regulation of c-Raf-1 protein kinase activity toward mitogen-activated proteinkinase-kinase[J].JBiolChem,1993,268(21): 16009-16019.
[26]Rauch N,Rukhlenko OS,Kolch W,et al.MAPK kinase signalling dynamics regulate cell fate decisions and drug resistance[J].Curr Opin Struct Biol,2016,41:151-158.
[27]Marais R,Wynne J,Treisman R.The SRF accessory protein Elk-1 contains a growth factor-regulated transcriptional activation domain[J].Cell,1993,73(2):381-393.
[28]Shankar E,Song K,Corum SL,et al.A signaling network controlling androgenic repression of c-Fos protein in prostate adenocarcinoma cells[J].J Biol Chem,2016,291(11):5512-5526.
[29]Morton S,Davis RJ,McLaren A,et al.A reinvestigation of themultisitephosphorylationofthetranscriptionfactor c-Jun[J].EMBO J,2003,22(15):3876-3886.
[30]Ashabi G,Alamdary SZ,Ramin M,et al.Reduction of hippocampal apoptosis by intracerebroventricular administration of extracellular signal-regulated protein kinase and/or p38 inhibitors in amyloid beta rat model of Alzheimer's disease:involvement of nuclear-related factor-2 and nuclear factor-kappaB[J]. Basic Clin Pharmacol Toxicol,2013,112(3):145-155.
[31]Borges G,Berrocoso E,Mico JA,et al.ERK1/2:function,signaling and implication in pain and pain-related anxio-depressive disorders[J].Prog Neuropsychopharmacol Biol Psychiatry,2015,60:77-92.
[32]Qi X,Lin W,Li J,et al.The depressive-like behaviors are correlated with decreased phosphorylation of mitogen-activated protein kinases in rat brain following chronic forced swim stress[J].Behav Brain Res,2006,175(2):233-240.
Construction of Rat Extracellular Signal-regulated Kinase 1 Gene 3ʹUntranslated Regions Dual-luciferase Reporter Plasmids and Effect of rno-miR-15b-5p on ItsActivitiy
LUO Han-jiang1,XU Yun-feng2,LI Xiao-xiao1,YANG Yu-tao1,XU Zhi-qing1
1.Captial Medical University School of Basic Medical Sciences,Beijing 100069,China;2.Huangdao Entry-Exit Inspection and Quarantine Bureau,Qingdao,Shandong 266555,China
YANG Yu-tao,XU Zhi-qing.E-mail:yutaoy@ccmu.edu.cn(YANG Yu-tao),zhiqingx@ccmu.edu. cn(XU Zhi-qing)
ObjectiveTo construct dual-luciferase reporter plasmids containing the wild type and mutant rat extracellular signal-regulated kinase 1(ERK1)gene 3ʹuntranslated regions(UTR)which were used to detect rno-miR-15b-5p's putative target gene.MethodsThe ratERK1gene 3ʹUTR fragment was amplified by polymerase chain reaction(PCR)from PC12 cell cDNA and cloned into pmiR-RB-ReportTMvector.The mutant ratERK1gene 3ʹUTR fragment was obtained by overlap PCR and inserted into pmiR-RB-ReportTMvector.Successful wild type and mutant recombinant plasmids were confirmed by DNAsequencing.PC12 cells were co-transfected with rno-miR-15b-5p mimic and pmiR-ERK13ʹUTR or pmiR-ERK1-mut 3ʹUTR and then analyzed by dual-luciferase reporter assay system.The achieved mutation sequence of the target site TGCTGCT was mutated to CGAACGT and GTACACG,respectively.ResultsThe wild-type reporter vector pmiR-ERK13ʹUTR and the mutant reporter vector pmiR-ERK1-mut 3ʹUTR were successfully constructed.The rno-miR-15b-5p mimic decreased the activity of pmiR-ERK13ʹUTR plasmid(P<0.001)but did not decrease the activity of pmiR-ERK1-mut 3ʹUTR plasmid.ConclusionThe recombinant pmiR-ERK13ʹUTR and pmiR-ERK1-mut 3ʹUTR plasmids were constructed successfully,and luciferase activities demonstrated that the 3ʹUTR ofERK1gene might be a potential target of rno-miR-15b-5p.
rno-miR-15b-5p;extracellular signal-regulated kinase 1;overlap polymerase chain reaction;pmiR-ERK13ʹUTR;pmiR-ERK1-mut 3ʹUTR;luciferase reporter assay
10.3969/j.issn.1006-9771.2017.02.010
R749.4
A
1006-9771(2017)02-0166-07
2016-09-05
2016-09-18)
1.北京市自然科学基金面上项目(No.7162016);2.国家自然科学基金面上项目(No.31271154;No.31171032)。
1.首都医科大学基础医学院,北京市100069;2.黄岛出入境检验检疫局,山东青岛市266555。作者简介:罗汉将(1990-),男,汉族,浙江余姚市人,硕士研究生,主要研究方向:miR-15b参与抑郁症发生的机制研究。通讯作者:杨予涛(1972-),男,博士,副教授,主要研究方向:抑郁症的发病机制;徐志卿(1963-),男,博士,教授,主要研究方向:神经递质受体和重大脑病。E-mail:yutaoy@ccmu.edu.cn(杨予涛);zhiqingx@ccmu.edu.cn(徐志卿)。
