传染性造血器官坏死病毒焦磷酸测序检测技术的建立
2017-03-10尹伟力倪杨帆张四化岳志芹
尹伟力,刘 瑶,倪杨帆,张四化,岳志芹,孙 涛
(1.烟台出入境检验检疫局,山东烟台 264000;2.荣成出入境检验检疫局,山东荣成 264300;3.武汉市农业检测中心,湖北武汉 430003;4.武汉市动物疫病预防控制中心,湖北武汉 430003;5.山东出入境检验检疫局技术中心,山东青岛 266000)
传染性造血器官坏死病毒焦磷酸测序检测技术的建立
尹伟力1,刘 瑶2,倪杨帆3,张四化4,岳志芹5,孙 涛5
(1.烟台出入境检验检疫局,山东烟台 264000;2.荣成出入境检验检疫局,山东荣成 264300;3.武汉市农业检测中心,湖北武汉 430003;4.武汉市动物疫病预防控制中心,湖北武汉 430003;5.山东出入境检验检疫局技术中心,山东青岛 266000)
根据传染性造血器官坏死病毒(IHNV)基因序列,设计了IHNV最为保守的指纹序列,以及测序引物,建立了IHNV焦磷酸测序检测方法。对所构建的IHNV焦磷酸检测方法进行特异性试验和灵敏度检测。结果表明,所建立的方法特异性好,在8种鱼类病毒中能够特异性检测出目的病毒,检测方法灵敏度高,最低检出核酸量为10 pg/μL。对建立的焦磷酸测序检测方法进行了实际应用研究,选取国内采集与进口的鱼类样本共计80批次进行IHNV检测。结果显示,焦磷酸测序检测方法可以有效的检出常规RT-PCR不能检出的假阴性样本和弱阳性样本,该方法的灵敏度和特异性可以满足水生动物疫病检测的需要。
传染性造血器官坏死病毒;焦磷酸测序;检测
传染性造血器官坏死病毒(Infectious hematopoietic necrosis virus,IHNV)是一种能引起鱼类急性全身性疾病而造成高死亡率的病毒,尤其会感染野生鲑鱼及养殖鲑鱼的幼苗[1-3]。1953年在美国华盛顿一家水产养殖孵化场的死亡虹鳟鱼发现该病毒[4-5]。在接下来的几十年里,该病在加利福尼亚大鳞鲑鱼孵化场出现类似的暴发。起初专家认为IHNV仅限于在美国西北太平洋鲑科鱼类流行[6]。然而,该病毒在20世纪70年代蔓延到欧洲、日本、美国、韩国、中国大陆和中国台湾地区,主要通过船运感染IHNV的鱼和卵来传播[7-8]。
IHNV是影响世界鱼类养殖业的主要病害,如何控制好疫病的暴发,做好病害防控,成为目前我国水产养殖业和进出口行业的重要工作。参照世界动物卫生组织(OIE)《水生动物疫病诊断手册》[9]及我国的出入境检验检疫行业标准[10],细胞培养分离与RT-PCR是目前普遍采用且有效的2种检测方法。细胞培养分离操作复杂,需要盲传2代,检测周期长,而RT-PCR必须与测序联合使用才能作为疫病确诊的依据。RT-PCR作为一种常规的核酸检测方法,其操作需要经历核酸提取、核酸扩增、琼脂糖电泳、扩增产物回收以及扩增产物测序5个阶段,全程耗时3个~5个工作日,耗时较长。如果PCR扩增产物浓度低而不能达到测序要求时,测序将无法进行,进而不能对检测到的疑似阳性样品进行最终确诊。
在实际检测工作中,需要建立一种对病原体一段很短但是特别保守的片段进行测序方法,这种方法要求快速简洁并满足对病原体大量检测的需要。因焦磷酸测序检测方法能够短时间内精准测出短DNA片段的序列,同时可以测96份样品[11-12],操作简便,能够形成标准化的检测流程,特别适合水生动物疫病病原体的检测与确证。本研究以IHNV为研究对象,设计特异的测序引物及其指纹序列,优化焦磷酸测序条件,建立特异、准确的IHNV焦磷酸测序检测技术体系,为水生动物病毒病害的监测和防控提供新的检测方法。
1 材料与方法
1.1 材料
1.1.1 病毒毒株核酸 传染性造血器官坏死病毒(IHNV)、流行性造血器官坏死病毒(EHNV)、病毒性出血性败血症病毒(VHSV)、传染性胰脏坏死病毒(IPNV)、牙鲆弹状病毒(HRV)、病毒性神经坏死病毒(VNNV)和锦鲤疱疹病毒(KHV)核酸,华中农业大学提供。鲤春病毒株由本实验室保存。
1.1.2 主要试剂与设备 引物、检测探针,宝生物工程(大连)有限公司合成;生物素标记通用引物,上海英俊Invitrogen公司合成;dNTP、ExTaqDNA聚合酶混液、One step RT-PCR试剂盒、DNA标准DL 2 000,宝生物工程(大连)有限公司产品;Qiagen DNA提取试剂盒(52906)、Qiagen RNA提取试剂盒(74104),Qiagen公司产品;Pyro SQA Reagents DNA序列分析试剂盒(96次)、链霉亲和素包被磁珠,北京基因有限公司产品。
Qiagen PYROMARKID焦磷酸测序仪;PCR扩增仪,Eppendorf公司产品;电泳仪(DYY-8C),北京六一厂产品;凝胶成像仪(G-BOX-EF),天能公司产品;紫外灯观察箱(Icm-26),上海路阳公司产品。
1.2 方法
1.2.1 测序指纹序列的确定及测序引物设计 选取IHNV较为保守的N基因作为研究对象。登录美国国立生物信息技术中心(NCBI),查询检索已公开的IHNV N基因。去除一些信息不全、不完整的序列片段,对来自同一地点、同一年份、序列差异极小的毒株,选取其中1株,最后选取的序列号如下: IHNV N基因序列,登录号分别为FJ265710.1、FJ265711.1、FJ265712.1、FJ265713.1、FJ265714.1、FJ265715.1、X89213.1。
用DNA Star 7.1软件中附带的Editseq和MegAlign功能,上面找到的序列输入至软件中,每个碱基进行比对。找到IHNV最为保守的20 bp以内的一段序列,作为焦磷酸测序的指纹序列。在指纹序列上、下游设计测序引物。
1.2.2 测序引物RT-PCR反应 按照Qiagen RNA提取试剂盒说明书提取组织样品或病毒液的RNA。
取2 μL IHNV核酸,按照RT-PCR试剂盒说明配置反应体系,加入上游测序引物0.5 μL,标记生物素下游测序引物0.5 μL,DEPC水补足体积至50 μL。PCR仪设定如下程序:50℃ 30 min;94℃ 5 min,94℃ 30 s,摸索测序引物的退火温度,72℃ 30 s,共30个循环;最后72℃延伸10 min,4℃结束反应。
取10 μL RT-PCR产物和1 μL加6×Loadingbuffer混合,在10 g/L琼脂糖凝胶上以5 V/cm电压电泳,以标准分子质量作参考,观察是否扩增成功。
1.2.3 焦磷酸测序反应 取50 μL用标记生物素的测序引物扩增的PCR产物,加入200 μg包被了链酶亲和素的磁珠,室温孵育20 min,让磁珠与PCR产物连接。用测序仪自带的真空泵工具将连接磁珠的PCR产物吸起,然后用700 mL/L酒精清洗5 s;放入denatureation buffer清洗5 s;用Washing buffer清洗10 s;用真空泵工具将PCR磁珠产物放入反应板中,加入测序引物2 μL,轻轻振摇,释放磁珠。将待测物放入80℃烘箱2 min,放置室温冷却。
将待测物放入焦磷酸测序仪中反应,温度设置为28℃。每次进样的压力选择600 mbar,进样时间设置为8 ms,每轮测序时间设置为65 s。测序引物沿着待测模板,随着不同dNTP的加入而扩增。每当有单个dNTP结合,反应会释放信号,测序仪收集信号,生成测序峰。
1.2.4 特异性试验 将IHNV的测序引物分别与病毒性出血性败血症病毒(Viral haemorrhagic septicaemia,VHSV)、流行性造血器官坏死病毒(Epizootic haematopietic necrosis virus,EHNV)、传染性胰脏坏死病毒(Infectious pancreatic necrosis virus,IPNV)、牙鲆弹状病毒(Hirame rhabdovirus,HRV)、病毒性神经坏死病毒(Viral nervous necrosis virus,VNNV)、鲤春病毒(Spring viraemia of carp virus,SVCV)和锦鲤疱疹病毒(Koi herpesvirus,KHV)的RNA模板进行RT-PCR扩增,将RT-PCR产物进行焦磷酸测序分析。
1.2.5 灵敏度试验 将IHNV核酸进行10倍倍比稀释后,采用建立的焦磷酸测序方法进行检测,并检测其灵敏度。
1.2.6 样本的检测 2013年—2015年,采集我国国内养殖的鱼类样品共计50批次,进口鱼样共计30批次,每批次采集鱼样本至少30尾,鱼品种为大磷大马哈鱼(Oncorhynchustshawytscha)、红鳍东方鲀(Fugurubripes)、虹鳟(Oncorhynchusmykiss)、大菱鲆(Scophthalmusmaximus)、大西洋鲑鱼(Salmosalar),样品为鱼苗、幼鱼或成鱼。取鱼样本的肾、脾、肝、眼、脑等器官。对于鱼苗,取整只鱼做为样品,将组织匀浆,提取RNA,进行IHNV焦磷酸测序检测。
取样本核酸,进行IHNV的常规RT-PCR检测,检测引物参考OIE《水生动物疫病诊断手册》(2015版)[9],将这两种检测结果进行比较。
2 结果
2.1 测序指纹序列的确定及测序引物设计
IHNV N基因序列比对后,发现包含558-571位点的核苷酸序列“GGACAGAAGCTCA”高度保守,将其作为标准指纹序列(图1)。根据IHNV的指纹序列,设计测序引物(图2,表1)。
2.2 测序引物的RT-PCR扩增
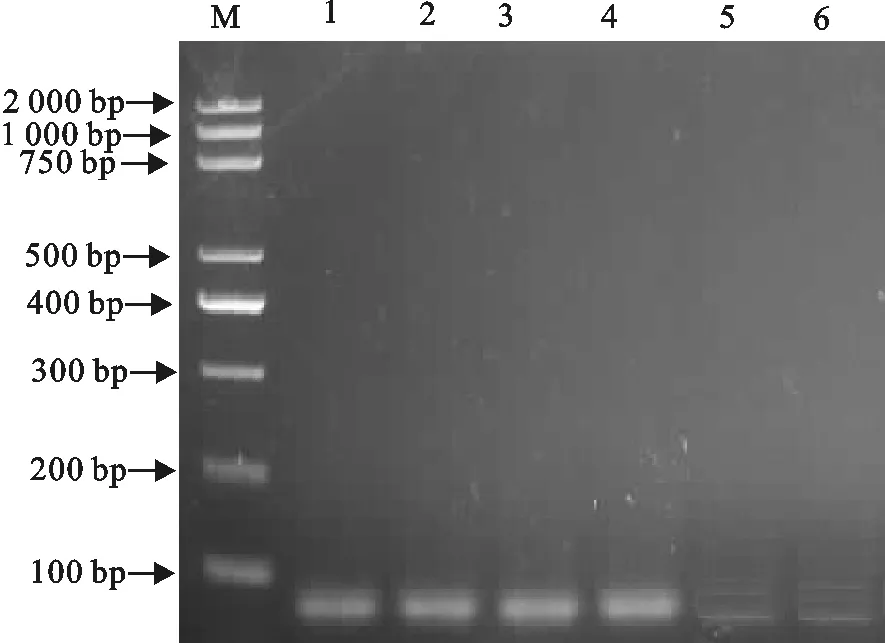
通过对PCR的变性、退火、延伸温度和时间的优化,最后确定测序引物RT-PCR的循环条件为:94℃ 5 min;94℃ 30 s, 54℃ 30s,72℃ 30 s,共循环30次;72℃ 10 min,4℃结束反应。用所建立的IHNV测序引物RT-PCR扩增IHNV核酸,检测结果均扩增出预期的目的条带(61 bp,图3)。

图1 IHNV的指纹序列

图2 IHNV N基因引物设计结果
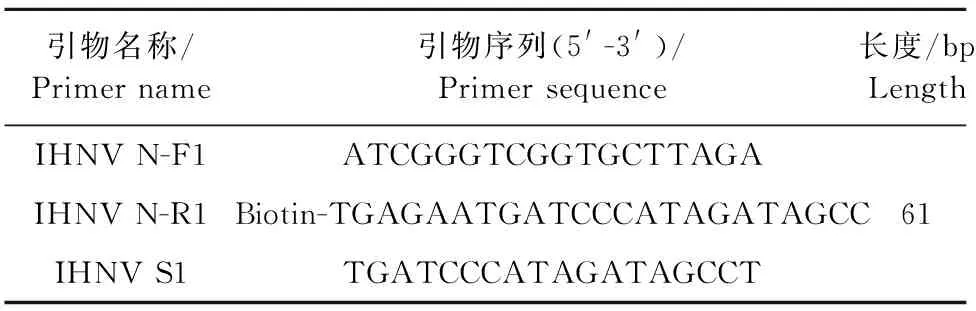
表1 引物设计
2.3 焦磷酸测序结果
IHNV的RT-PCR产物,经焦磷酸测序反应,所测序列为“GGACAGAAGCTCA”(图4),与预期的指纹序列一致。

M.DNA 标准DL 2 000;1.阴性对照;2,3.IHNV
M.DNA Marker DL 2 000;1.Negative control;2,3.IHNV
图3 电泳结果
Fig.3 The electrophoretic results

图4 IHNV测序结果
2.4 特异性试验结果
将IHNV的特异性测序引物分别与VHSV、EHNV、IPNV、HRV、VNNV、SVCV和KHV的RNA模板进行 RT-PCR扩增及焦磷酸测序,只有与特异性引物相吻合的IHNV RNA模板得到预期扩增片段大小(61 bp,图5)及相应峰型,其余病毒均未得到特异性条带及和已知序列吻合的峰型,由此鉴定了引物设计的特异性。
2.5 灵敏度试验结果
将IHNV核酸进行10倍倍比稀释后采用该焦磷酸测序方法检测,结果发现,随着核酸浓度的降低,测序结果随之减少。该方法对IHNV核酸的最低检出量达到 10 pg/μL(图6)。

M.DNA 标准DL 2 000;1.IHNV;2.SVCV;3.VHSV;4.EHNV;5.HRV;6.IPNV;7.VNNV;8.KHV;9.阴性对照
M.DNA Marker DL 2 000;1.IHNV;2.SVCV;3.VHSV;4.EHNV;5.HRV;6.IPNV;7.VNNV;8.KHV;9.Negative contol
图5 IHNV焦磷酸测序特异性试验结果
Fig.5 The specificity results of the pyrosequencing for IHNV
M.DNA 标准DL 2 000;1.10 ng/μL;2.1 ng/μL; 3.100 pg/μL;4.10 pg/μL;5.1 pg/μL;6.100 fg/μL
M.DNA Marker DL 2 000;1.10 ng/μL;2.1 ng/μL;3.100 pg/μL;4.10 pg/μL;5.1 pg/μL;6.100 fg/μL
图6 IHNV 焦磷酸测序灵敏度试验结果
Fig.6 The sensitivity analysis of the pyrosequencing for IHNV
2.6 样品的检测
IHNV阳性检出样品数量:焦磷酸测序检测与常规RT-PCR检测结果相同,共计14批阳性,常规RT-PCR 12批阳性,其中弱阳性2批。除1批RT-PCR弱阳性样品外,其余RT-PCR检出阳性样品均经测序确证为IHNV阳性。阳性检出样品涉及3种被采样鱼品种(表2)。
3 讨论
本研究建立了传染性造血器官坏死病毒的焦磷酸检测方法,并对其进行了反应条件的优化。该方法为国内外首次建立IHNV焦磷酸检测技术。
OIE对于IHNV推荐的检测方法为病毒分离与RT-PCR。病毒分离需要建立合适的水生动物细胞系,即使有已经构建好的细胞系,还需要对细胞进行传代、冻存等操作。在进行病毒分离时,需要将样品溶液进行倍比稀释,每个稀释度接种细胞,观察7d为1代。如果这一代细胞没有出现CPE,则需要盲传第2代,还需观察7 d。病毒分离方法总计需要14 d左右,操作繁琐,周期较长,不适合口岸对大量进出境水生动物快速检疫的需求。
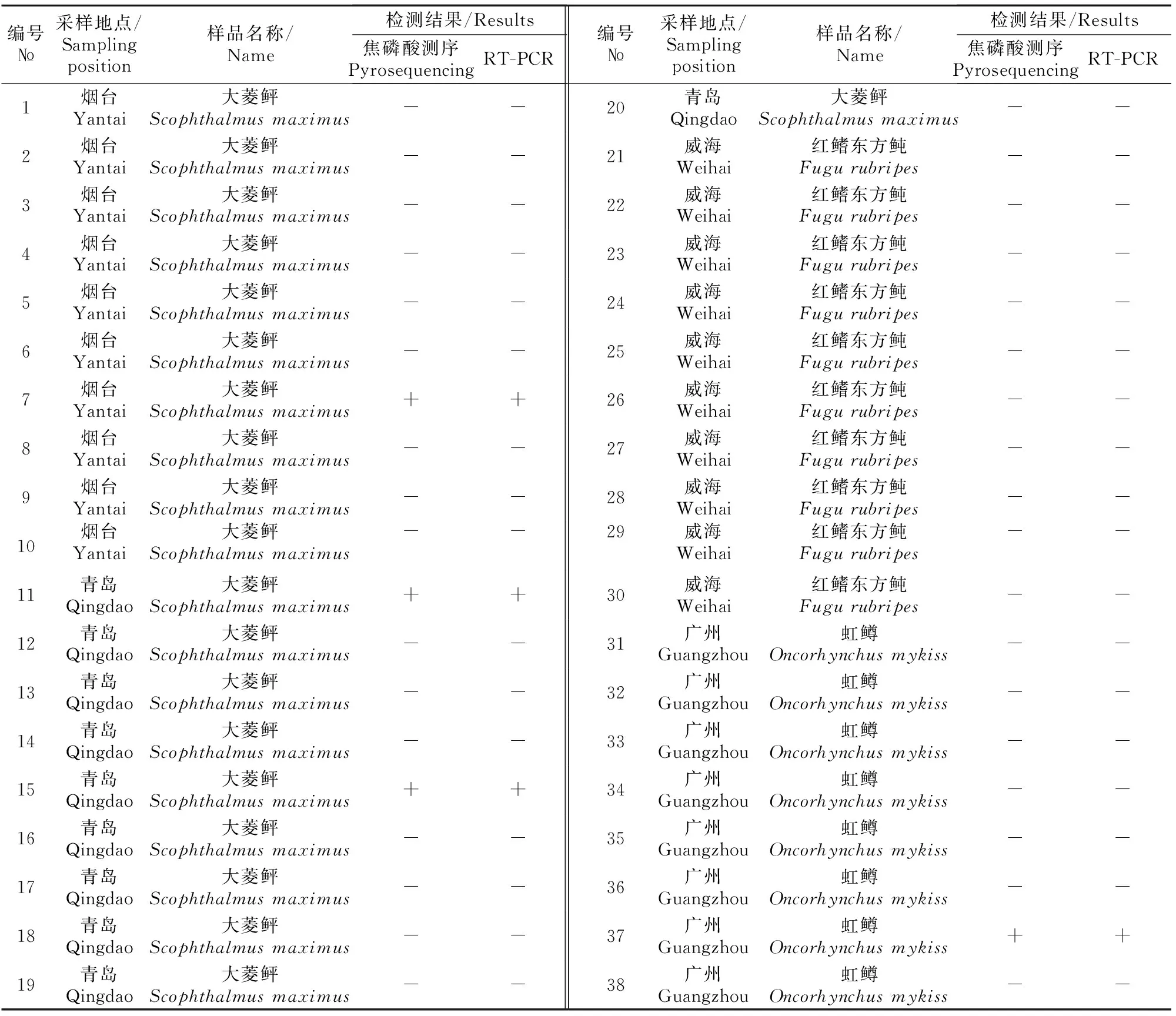
表2 IHNV焦磷酸测序检测方法与常规RT-PCR检测结果
续表2
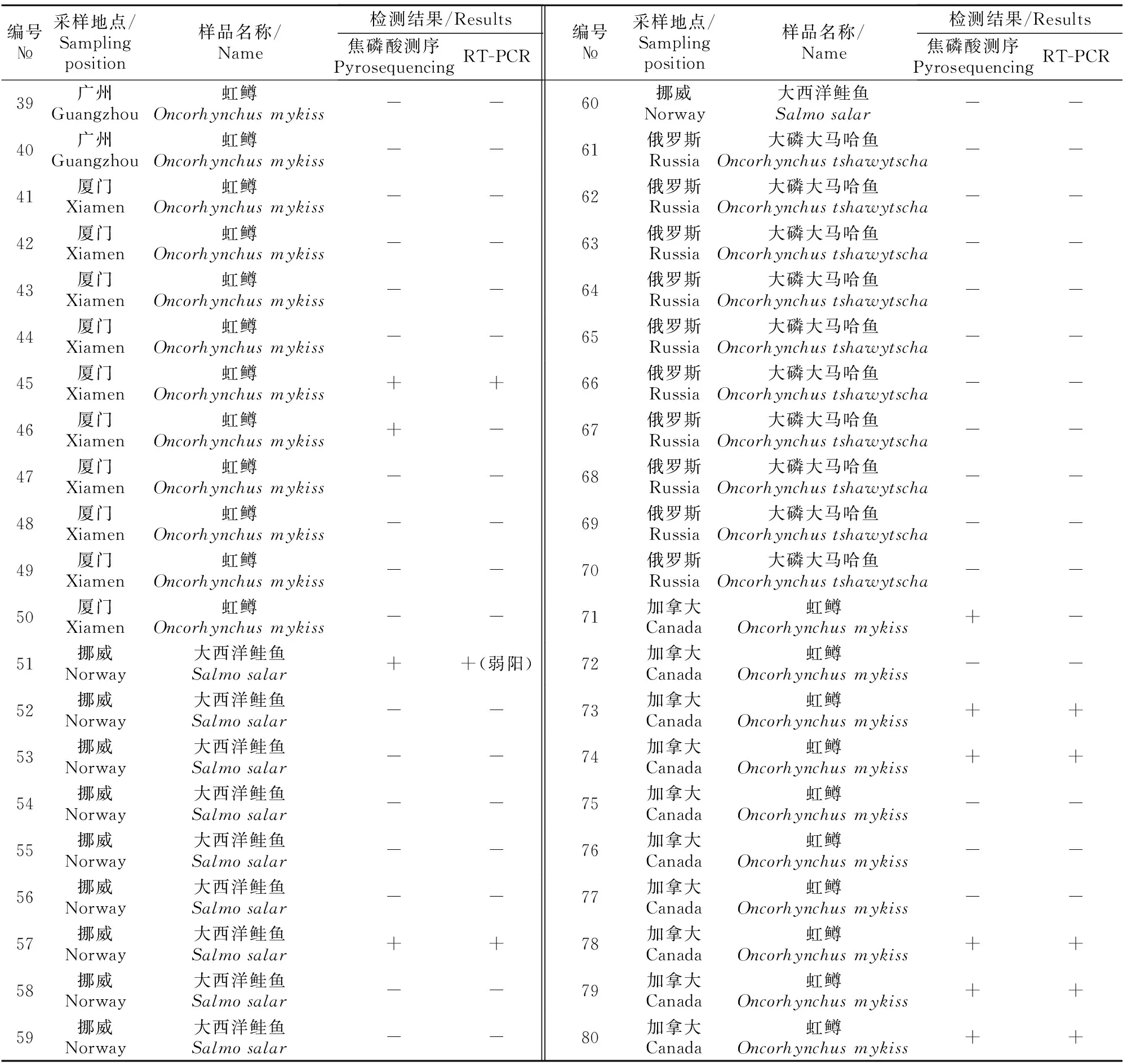
编号№采样地点/Samplingposition样品名称/Name检测结果/Results焦磷酸测序PyrosequencingRT-PCR编号№采样地点/Samplingposition样品名称/Name检测结果/Results焦磷酸测序PyrosequencingRT-PCR39广州Guangzhou虹鳟Oncorhynchusmykiss--60挪威Norway大西洋鲑鱼Salmosalar--40广州Guangzhou虹鳟Oncorhynchusmykiss--61俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--41厦门Xiamen虹鳟Oncorhynchusmykiss--62俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--42厦门Xiamen虹鳟Oncorhynchusmykiss--63俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--43厦门Xiamen虹鳟Oncorhynchusmykiss--64俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--44厦门Xiamen虹鳟Oncorhynchusmykiss--65俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--45厦门Xiamen虹鳟Oncorhynchusmykiss++66俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--46厦门Xiamen虹鳟Oncorhynchusmykiss+-67俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--47厦门Xiamen虹鳟Oncorhynchusmykiss--68俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--48厦门Xiamen虹鳟Oncorhynchusmykiss--69俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--49厦门Xiamen虹鳟Oncorhynchusmykiss--70俄罗斯Russia大磷大马哈鱼Oncorhynchustshawytscha--50厦门Xiamen虹鳟Oncorhynchusmykiss--71加拿大Canada虹鳟Oncorhynchusmykiss+-51挪威Norway大西洋鲑鱼Salmosalar++(弱阳)72加拿大Canada虹鳟Oncorhynchusmykiss--52挪威Norway大西洋鲑鱼Salmosalar--73加拿大Canada虹鳟Oncorhynchusmykiss++53挪威Norway大西洋鲑鱼Salmosalar--74加拿大Canada虹鳟Oncorhynchusmykiss++54挪威Norway大西洋鲑鱼Salmosalar--75加拿大Canada虹鳟Oncorhynchusmykiss--55挪威Norway大西洋鲑鱼Salmosalar--76加拿大Canada虹鳟Oncorhynchusmykiss--56挪威Norway大西洋鲑鱼Salmosalar--77加拿大Canada虹鳟Oncorhynchusmykiss--57挪威Norway大西洋鲑鱼Salmosalar++78加拿大Canada虹鳟Oncorhynchusmykiss++58挪威Norway大西洋鲑鱼Salmosalar--79加拿大Canada虹鳟Oncorhynchusmykiss++59挪威Norway大西洋鲑鱼Salmosalar--80加拿大Canada虹鳟Oncorhynchusmykiss++
对于RT-PCR来说,由于灵敏度有限及其引物在扩增时可能产生的错配导致的非特异性结合,检测结果会存在假阳性、假阴性和非特异性扩增,为保证结果的准确性,OIE和我国出入境检验检疫行业标准明确规定需要对PCR产物进行测序。测序需要送到专门的生物技术公司,检测周期较长。本研究建立的焦磷酸方法耗时短,一般3 h~4 h就可以出结果,并且以具体序列为检测结果,这杜绝了假阳性的出现。本研究利用建立的IHNV焦磷酸检测方法对我国国内养殖鱼与进口鱼80份样本进行检测,涉及大磷大马哈鱼(Oncorhynchustshawytscha)、红鳍东方鲀(Fugurubripes)、虹鳟(Oncorhynchusmykiss)、大菱鲆(Scophthalmusmaximus)、大西洋鲑鱼(Salmosalar)等多个品种,进行了IHNV的检测,大菱鲆曾经在我国出口鱼类养殖业中占据重要地位,而虹鳟是近些年常有疫病检出的主要宿主鱼。将检测结果与OIE推荐的常规RT-PCR相比较,结果可以看出,焦磷酸法对于常规RT-PCR的弱阳性样品样本有明显的检出,且检测结果PCR完全一致,因而可以有效的证明,焦磷酸方法的高灵敏度是有效的,避免了假阳性检出。而常规PCR检测检出的弱阳性样品,由于不能满足测序对样本浓度的要求,因而不能进行有效测序,参照OIE《水生动物疫病诊断手册》和我国检验检疫行业标准,由于不能进行有效测序,因而不能作为疫病阳性检出确诊的依据。焦磷酸测序方法的核心是设计特异性的测序引物与指纹序列。据文献所述[13],焦磷酸测序时,测序引物5′末端特异性无严格要求,而3′段需要与目的核酸序列完全互补。本研究所设计的测序引物的5′末端与3′末端DNA熔解温度(Tm)值一致,因而引物两端可以同时与模板结合,具有一致性,有利于提高检测的准确率。指纹序列的设计需要通过比对病毒各个基因的序列,选择最为保守的一段序列。因为焦磷酸测序技术不能测过长的片段,指纹序列应该选择20 bp以内的长度。
焦磷酸测序技术结合PCR的灵敏度和DNA测序技术的精确度两方面的优势,测序引物与指纹序列高度保守的情况下,对一段短序列进行测序,检测结果直观可见,操作简便,检测周期短,易于推广应用。
[1] Alonso M,Stein D A,Thomann E,et al.Inhibition of infectious haematopoietic necrosis virus in cell cultures with peptide-conjugated morpholino oligomers[J].J Fish Dis,2005,12:287-291.
[2] Fregeneda Grandes J M,Skall H F,Olesen N J.Antibody response of rainbow trout with single or double infections involving viral haemorrhagic septicaemia virus and infectious haematopoietic necrosis virus[J].Dis Aqua Organ,2009,12:831-840.
[3] Granzow H,Weiland F,Fichtner D.Enzmann. Studies of the ultrastructure and morphogenesis of fish pathogenic viruses grown in cell culture[J].Jf Fish Dis,2003,22:201-206.
[4] Gunimaladevi I,Kono T,Lapatra S E,et al.A loop mediated isothermal amplification (LAMP) method for detection of infectious hematopoietic necrosis virus (IHNV) in rainbow trout (Oncorhynchusmykiss)[J].Arch Virol,2005,9:1505-1510.
[5] Hansen J D,PatraS L.Induction of the rainbow trout MHC class I pathway during acute IHNV infection[J].Immunogenetics,2002,44:549-555.
[6] Knüsel R,Bergmann S M,Einer-Jensen K,et al.Virus isolation vs RT-PCR:which method is more successful in detecting VHSV and IHNV in fish tissue sampled under field conditions[J].JFish Dis,2007,12:309-313.
[7] Purcell M K,Hart S,Alexandra K G,et al.Strand-specific, real-time RT-PCR assays for quantification of genomic and positive-sense RNAs of the fish rhabdovirus, Infectious hematopoietic necrosis virus[J].J Virol Meth,2005,54:1321-1322.
[8] Xu L M,Liu H B,Yin J S,et al.Prokaryotic expression and immunogenicity analysis of glycoprotein from infectious hematopoietic necrosis virus[J].Chine J Virol,2014,23:295-299.
[9] Office International Des Epizooties.Manual of Diagnostic Tests for Aquatic Animals[EB/OL].[2016-6-18]http://www.oie.int/international-standard-setting/aquatic-manual/access-online/
[10] 贾 鹏,何俊强,杨俊兴,等.SN/T 1474-2014 传染性造血器官坏死病检疫技术规范[S].北京:中华人民共和国国家质量监督检验检疫总局,2014.
[11] Gruber J D,Colligan P B,Wolford J K.Estimation of single nucleotide polymorphism allele frequency in DNA pools by using Pyrosequencing[J].Hum Genet,2002,110(5):395-401.
[12] Nordstrom T,Ronaghi M,Forsberg L.Direct analysis of single-nucleotide polymorphism on double-stranded DNA by pyrosequencing[J].Biotechnol Appl Biochem,2000,31(Pt2):107-112.
[13] Ronaghi M.Pyrosequencing sheds light on DNA sequencing[J].Genome Res,2001,11(1):3-11.
Development of Pyrosequencing Method for Detecting Infectious Hematopoietic Necrosis Virus
YIN Wei-li1,LIU Yao2,NI Yang-fan2, ZHANG Si-hua4,YUE Zhi-qin5,SUN Tao5
(1.YantaiEntry-exitInspectionAndQuarantineBureau,Yantai,Shandong,264000,China;2.RongchengEntry-exitInspectionAndQuarantineBureau,Rongcheng,Shandong,264300,China;3.WuhanTestingCenterForAgriculture,Wuhan,Hubei,430003,China;4.WuhanCenterForAnimalDiseaseControlandPrevention,Wuhan,Hubei,430003,China;5.TechnicalCenterofShandongEntry-exitInspectionandQuarantineBureau,Qingdao,Shandong,266000,China)
By collecting the sequences of IHNV,the fingerprint sequences and the sequencing primers of the viruse were designed.The pyrosequencing method for detection of IHNV was established successfully.The method has good specificity and sensitivity,and can specifically identify the objective viruses in the eight fish viruses.The method has high sensitivity and the minimum detection limit of nucleic acid is 10 pg/μL.The method was verified by the detection of IHNV in 80 batches of the samples collected from domestic and imported fishes.The results indicated that the pyrosequencing method can effectively detect the false negative and weakly positive samples,which the traditional method RT-PCR cannot detect.The specificity and sensitivity of the method met the requirement for detection of aquatic animal diseases.
Infectious hematopoietic necrosis virus(IHNV);pyrosequencing;detection
2016-06-25
科技部“十二五”支撑计划项目(2013BAD12B02)
尹伟力(1982-),男,山东烟台人,硕士,高级兽医师,主要从事兽医学研究工作。
S854.43
A
1007-5038(2017)03-0043-07
