枸杞多糖改善糖尿病肾病作用的研究
2017-03-10赵蕊王春仁黄玉兰贾桂燕
赵蕊,王春仁,黄玉兰,贾桂燕
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.哈尔滨医科大学基础医学院)
枸杞多糖改善糖尿病肾病作用的研究
赵蕊1,2,王春仁1,黄玉兰1,贾桂燕1
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.哈尔滨医科大学基础医学院)
应用2型糖尿病小鼠模型,观察中药活性成分枸杞多糖(LBP)对2型糖尿病小鼠肾脏的保护作用。免疫组化半定量法检测各组小鼠肾组织PPAR-γ蛋白的表达,并通过Western blot检测LBP对2型糖尿病小鼠肾组织中的p38MAPK表达的影响,初步探讨LBP改善糖尿病肾病(DN)的可能作用机制。实验结果表明,与正常对照组比较,2型糖尿病小鼠肾组织PPAR-γ蛋白含量降低,LBP作用4 w后,能上调2型糖尿病小鼠肾组织PPAR-γ蛋白含量,且还能对高糖引起的肾组织p38MAPK活性增加表现出明显的对抗作用。总之,LBP对2型糖尿病小鼠肾组织具有保护作用,且与上调PPAR-γ蛋白表达有关。
枸杞多糖;糖尿病肾病;PPAR-γ;p38MAPK
糖尿病肾病(DN)的主要病因是由于糖代谢异常所致的肾小球硬化,并伴有尿蛋白含量增高,是2型糖尿病中最常见的并发症之一。西医药尚无安全有效的治疗手段。而中医药可从整体水平对DN进行综合调理,因此,研究开发高效低毒的治疗DN的药物,对于延长患者的寿命,提高生活质量具有重大的意义。枸杞子是我国药食两用的名贵中药材,枸杞多糖(LBP)是枸杞子中的主要活性成分,具有广泛的药理作用。研究表明,过氧化物酶体增殖物激活受体(PPAR)-γ与DN的发病有密切的关系,上调PPAR-γ蛋白水平可明显改善DN小鼠肾脏的损伤[1]。血糖持续升高可激活p38MAPK的信号转导通路,导致DN的发生、发展。p38MAPK是细胞信号传导的交汇点[2],但它在DN发病中的作用机制以及它与PPAR-γ关联的研究国内外尚未见报道。研究应用2型糖尿病小鼠模型,观察LBP对2型糖尿病小鼠肾脏的保护作用,并通过检测LBP对2型糖尿病小鼠肾组织中的PPAR-γ和p38MAPK表达的影响,初步探讨LBP改善DN的可能机制。
1 材料和方法
1.1 实验动物
选取4周龄,体重20±2 g的SPF级昆明小鼠(购于长春白求恩医科大学实验动物中心)。
1.2 主要试剂
尿微量白蛋白试剂盒、肌酐试剂盒、尿素氮试剂盒(北京晶美生物技术有限公司);PPAR-γ和Phospho-p38MAPK单克隆抗体(Santa Cruz Biotechnology公司);SP免疫组化染色试剂盒和DAB显色试剂盒(北京晶美生物技术有限公司);ECL显色试剂盒(Santa Cruz Biotechnology公司)。
1.3 实验方法
1.3.1 枸杞多糖制备
宁夏枸杞子烘干粉碎,氯仿:甲醇(2∶1)回流脱脂、脱色处理。用80%的乙醇脱小分子糖后于80℃下进行水提,提取3次,合并滤液,减压蒸馏浓缩,置于95%的乙醇中过夜,离心。获得的沉淀分别用95%的乙醇、无水乙醇、丙酮脱水,最后经真空干燥得LBP。
1.3.2 型糖尿病小鼠模型的建立与分组
小鼠随机分为正常组和造模组。正常组给予普通饲料喂养。造模组小鼠先给予高糖高脂饮食4 w,再行一次性腹腔注射0.5%的链脲佐菌素(STZ,现用现配,60 mg·kg-1),3 d后用京都血糖仪空腹测血糖。模型成功的小鼠(血糖浓度>11.1 mmol·L-1)再随机分为模型对照组、LBP(200 mg·kg-1)组和罗格列酮组(3 mg·kg-1),按照每10 g小鼠体重0.2 mL持续灌胃4 w,正常对照组和模型对照组给予同等剂量的生理盐水。
1.3.3 尿微量白蛋白检测及生化分析
各组小鼠给药4 w后,收集24 h尿液,离心,ELISA法测量尿微量白蛋白(Urinary albumin)。摘眼球取血,分离血清,全自动生化分析仪检测尿素氮(BUN)和血肌酐(Scr)水平。小鼠处死后取肾脏,称重,计算肾指数(肾重/体重(%))。取其中部分肾组织用于HE染色及免疫组化分析,另取一部分肾皮质迅速置于液氮中用作蛋白提取。
1.3.4 病理学检查
取适量肾组织在4%中性多聚甲醛中固定,脱水、透明及石蜡包埋制片等处理,5 μm厚度切片。HE常规染色,中性树胶封片。光镜观察,记录病理形态学变化。
1.3.5 免疫组化法检测PPAR-γ在蛋白水平的表达
免疫组化半定量分析各组小鼠肾组织中PPAR-γ蛋白的表达水平。结果观察:每组6张切片,随机选取20个视野,根据染色强度和面积计算阳性细胞占视野内细胞数的比例并计分,具体评分为:阳性细胞数占总细胞数低于25%的为(+/-),25%~50%为(+),51%~75%为(++),超过75%的为(+++),且计为1、2、3、4分;染色强度分别以(+/-)、(+)、(++)表示,计为1、2、3分;二者分数乘积作为免疫组化结果。
1.3.6 各组小鼠肾皮质磷酸化p38 MAPK的检测
称取100 mg肾皮质,用组织裂解液裂解后匀浆用超声细胞粉碎仪超声,离心取上清,BCA法测定蛋白浓度。定量后取各组标本经SDS-PAGE电泳分离后湿法转移至PVDF膜上,5%脱脂奶粉室温封闭2 h。加入相应的稀释一抗,4℃孵育过夜。洗膜后加辣根过氧化物酶标记的二抗,室温孵育1 h,ECL试剂盒进行显影,凝胶成像系统采集成像。Western blot检测条带用凝胶成像仪分析系统Quantity One软件扫描灰度值。计算目的蛋白与β-actin灰度值的比值,进行统计学分析。
1.3.7 数据分析
所有的数据采用SPSS 19.0统计软件进行数据处理分析,两组资料的比较采用两样本均数比较的t检验。多组间样本比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果与分析
2.1 LBP对2型糖尿病小鼠肾功能的影响
为了研究枸杞多糖对2型糖尿病小鼠肾脏的保护作用,首先检测造模后LBP处理4 w对2型糖尿病小鼠肾功能的影响,表1结果显示,与正常对照组相比,STZ诱导的模型对照组小鼠的BUN、尿微量白蛋白、Scr、肾重/体重比值水平均增高(P<0.01)。LBP灌胃4 w后,上述肾功能指标均有降低,差异有统计学意义(P<0.01),LBP给药组与罗格列酮组差异无统计学差异(P>0.05)。实验结果表明LBP可以减轻2型糖尿病小鼠的肾损伤。
2.2 各组小鼠肾脏组织的HE染色结果观察
为进一步观察LBP改善2型糖尿病小鼠的肾损伤,实验从形态学角度做了进一步分析。各组小鼠肾组织HE染色切片观察发现,正常小鼠肾小球大小适中,结构完整,肾小管形态正常,无炎症细胞浸润和纤维组织增生。2型糖尿病小鼠肾小球体积增大,肾小管结构模糊。LBP和罗格列酮作用4 w后,光镜下观察小鼠肾小球结构基本恢复正常,结果显示如图1。

表1 LBP对2型糖尿病小鼠肾功能的影响Table 1Effect of LBP on renal function in type 2 diabetic mice
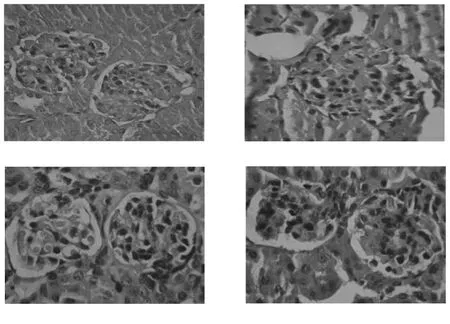
图1 肾组织形态学变化(HE×400)Fig.1Morphological changes of kidney tissue(HE×400)
2.3 免疫组化分析小鼠肾组织PPAR-γ蛋白表达
为了探讨枸杞多糖改善DN的可能机制,检测肾病相关蛋白PPAR-γ的表达。图2显示各组小鼠肾组织PPAR-γ免疫组化染色结果。显微镜下显示PPAR-γ阳性表达为棕黄色,根据染色强度和面积进行半定量分析显色结果。表2结果统计了各组小鼠肾组织PPAR-γ蛋白的表达含量。正常组小鼠肾组织PPAR-γ高表达,但是模型组PPAR-γ表达降低,与正常组相比差异有统计学意义(P<0.01),与模型组比较,LBP和罗格列酮组PPAR-γ表达明显增加,差异有统计学意义(P<0.01)。
2.4 Western bIot法检测磷酸化p38MAPK蛋白表达
最后,通过分析磷酸化p38MAPK蛋白的表达水平,进一步研究LBP改善DN的可能机制。图3显示Western blot法检测各组小鼠肾皮质p38MAPK蛋白表达情况。结果显示,与正常对照组比较,模型对照组p38MAPK蛋白表达量明显增多;与模型对照组相比,LBP和罗格列酮两组小鼠肾皮质的p38MAPK表达量降低。

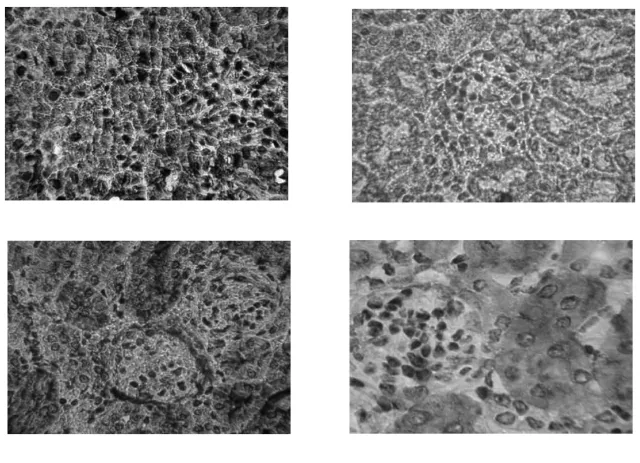
图2 PPAR-γ蛋白在各组小鼠肾脏中的表达(×400)Fig.2The protein expression of PPAR-γ in kidneys of mice(×400)

表2 LBP对2型糖尿病小鼠肾组织PPAR-γ表达的影响Table 2Effect of LBP on the expression of PPAR-γ in kidney of in type 2 diabetic mice
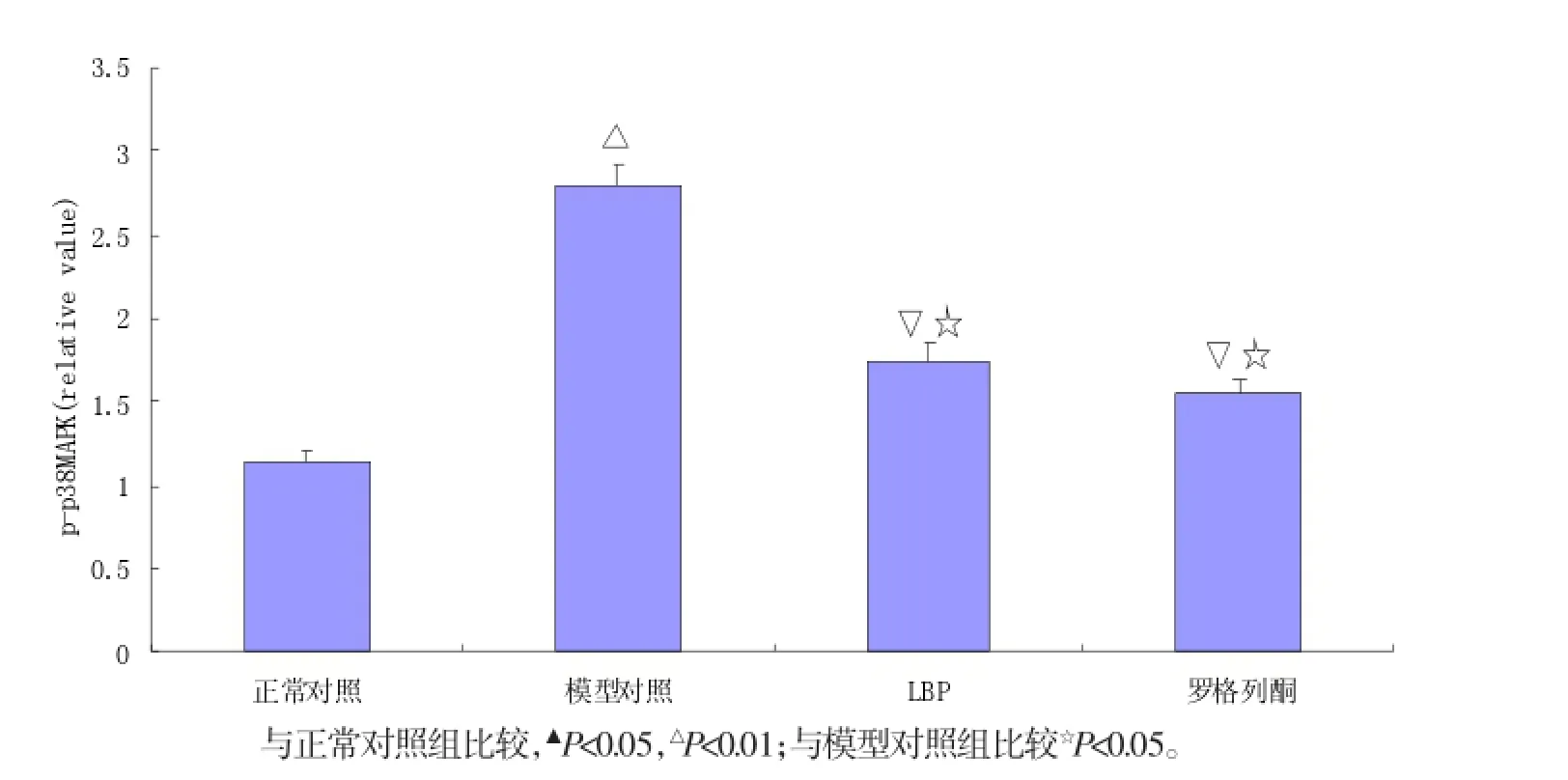
图3 LBP对2型糖尿病小鼠肾皮质p38MAPK蛋白表达的影响Fig.3Effect of LBP on the expression of p38MAPK in renal cortex of type 2 diabetic mice
3 讨论
糖尿病性肾病是糖尿病引起的严重和危害性最大的一种慢性并发症,亦是糖尿病患者致死的主要原因之一。肾脏肥大,肾小球滤过功能异常和微量蛋白尿是本症的主要特点[3]。研究结果显示,小鼠经高糖高脂饮食诱导,结合腹腔注射STZ造模后,2型糖尿病小鼠的尿素氮、血肌酐和尿微量白蛋白水平较正常小鼠均有显著增加,肾重/体重指数明显上升,说明2型糖尿病模型小鼠机体存在肾脏损伤,发生了肾病并发症。课题组的前期研究结果证明LBP有很好的降糖活性,且能够增加2型糖尿病大鼠的胰岛素敏感性[4],但其改善DN的活性及作用机制目前尚未完全阐明。实验旨在通过观察LBP对2型糖尿病小鼠的肾脏保护作用,探讨其改善DN的作用及机制,为进一步研究LBP的临床应用提供一定的理论依据和实验支持。实验结果证实,经LBP处理4 w后,肾功能等生化指标得到改善(见表1)。表明LBP对糖尿病肾病具有一定的治疗作用。
胰岛素增敏剂噻唑烷二酮(TZDs)是临床治疗2型糖尿病和糖尿病肾脏并发症常用的药物,TZDs是PPAR-γ的配体,也是PPAR-γ的激动剂。而罗格列酮是TZDs的一种[5]。研究表明PPAR-γ在维持正常肾脏功能上起到重要作用,PPAR-γ的高表达与防治DN的发生有密切关系[6]。实验结果显示,PPAR-γ蛋白在正常组小鼠肾组织中呈现功能性表达,但是PPAR-γ蛋白的表达在2型糖尿病性肾病小鼠却明显降低,实验经LBP和罗格列酮灌胃给药4 w后,小鼠肾脏病理形态学异常得到改善,且与模型组小鼠相比,肾组织PPAR-γ蛋白表达增加,这提示LBP可能发挥了PPAR-γ的特异性配体作用,通过与PPAR-γ结合,进而影响了与胰岛素效应相关的某些基因的表达,最终改善2型糖尿病小鼠的肾功能。在DN的发展过程中,炎症相关信号通路-p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路与肾组织损伤密切相关[7]。研究显示,持续高血糖能激活p38MAPK通路,进而发挥其相应的生物学功能[8],如P38 MAPK在高血糖所致的内皮通透性增高中起着主要的信号转导作用[9]。高血糖可以使P38MAPK磷酸化,活性明显升高,活化的P38MAPK作用于底物MAPKAP-K2/K3,后者则使热休克蛋白-27(HSP-27)磷酸化。试验研究结果显示,给予LBP和罗格列酮灌胃4 w后,2型糖尿病小鼠肾组织的p38MAPK表达显著减少。由此可见,LBP对持续高血糖引起的肾组织p38MAPK活性增加表现出明显的抑制作用。
4 结论
LBP对2型糖尿病小鼠损伤的肾脏具有改善作用,其机制可能与LBP抑制p38MAPK蛋白表达水平,激活2型糖尿病小鼠肾组织PPAR-γ有关。
[1]Gao D,Li Q,Gao Z,et al.Antidiabetic effects of Corni Fructus extract in streptozotocin_induced diabetic rats[J]. Yonsei Med J,2012,53(4):691-700.
[2]Fujita H,Omori S,Ishikura K,et al.ERK and p38 mediate high-glucose-induced hypertrophy and TGF-beta expression in tubular cells[J].Am J Physiol Renal Physiol,2004,286(1):120-126.
[3]周强,仝小林,刘桂芳,等.糖尿病肾病的中医临床治疗概况[J].中医药信息,2011,29(1):95-97.
[4]Zhao R,Li Q W,Xiao B.Effect of Lycium barbarum polysaccharide on the improvement of insulin resistance in NIDDM rats[J].Yakugaku Zasshi,2005,125(12):981-988.
[5]Rane M J,Song Y,Jin S,et a1.Interplay between Akt and p38MAPK pathways in the regulation of renal tubular cell apoptosis associated with diabetic nephropathy[J].Am J Physiol Renal Physiol,2010,298(1):49-61.
[6]Wang F F,Mullican S E,Dispirito J R,et al.Lipoatrophy and severe metabolic disturbance in mice with fat-specific deletion of PPAR-γ[J].Proc Nati Acad Sci,2013,110(46):18656-18661.
[7]Zhang R,ZhouS J,Li C J,et al.C-reactive protein/oxidised low-density lipoprotein/β2-glycoprotein I complex promotes atherosclerosis in diabetic BALB/c mice via p38mitogen-activated protein kinase signal pathway[J].Lipids Health Dis,2013,26(12):42.
[8]王健楠,阮洪生,崔玉东,等.身痛逐瘀汤通过调控P38 MAPK信号通路抑制LPS诱导的RAW264.7巨噬细胞一氧化氮的分泌[J].黑龙江八一农垦大学学报,2015,27(3):75-78.
[9]Mima A,Kitada M,Geraldes P,et al.Glomerular VEGF resistance induced by PKCδ/SHP-1 activation and contribution to diabetic nephropathy[J].FASEB J,2012,26(7):2963-2974.
Study of Lycium Barbarum.Polysaccharide on Diabetic Nephropathy
Zhao Rui1,2,Wang Chunren1,Huang Yulan1,Jia Guiyan1
(1.College of Life Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319;2.Basic Medical Science College,Harbin Medical University)
The protective effect of Lycium barbarum.polysaccharides(LBP)was observed in kidney of type 2 diabetic mice model.To explore the possible mechanisms of LBP on diabetic nephropathy(DN),the protein expression of PPAR-γ in kidney was tested by immunohistochemical method,and the p38MAPK expression was detected through the Western blot.The results showed that the protein expression of PPAR-γ in kidney was decreased compared with control group.After 4 w treatment,the protein level of PPAR-γ in kidney increased,and LBP also showed the obvious antagonism on p38MAPK in kidney tissues by high sugar.In a word,LBP had a protective effect in kidney of type 2 diabetic mice by improving the protein level of PPAR-γ signaling pathway.
Lycium barbarum;polysaccharides;diabetic nephropathy;PPAR-γ;p38MAPK
R285
A
1002-2090(2017)01-0089-05
2016-05-15
LBP择时给药逆转小鼠胰岛素抵抗的昼夜节律机制(2014M551281)。
赵蕊(1975-),女,副教授,燕山大学毕业,现主要从事新药研究与开发方面的研究工作。
