2型糖尿病老年男性患者血清铁蛋白、骨硬化蛋白与骨密度的相关性
2017-03-09叶燕彬安荣泽齐新文邝立鹏陈军平谢炳龙钟泽填
叶燕彬,安荣泽,齐新文*,邝立鹏,陈军平,谢炳龙,钟泽填
[1.遵义医学院第五附属(珠海)医院骨科,广东 珠海 519000;2.遵义医学院第五附属(珠海)医院检验科,广东 珠海 519000]
2型糖尿病老年男性患者血清铁蛋白、骨硬化蛋白与骨密度的相关性
叶燕彬1,安荣泽1,齐新文1*,邝立鹏1,陈军平1,谢炳龙2,钟泽填2
[1.遵义医学院第五附属(珠海)医院骨科,广东 珠海 519000;2.遵义医学院第五附属(珠海)医院检验科,广东 珠海 519000]
目的 分析2型糖尿病(type 2 diabetes mellitus,T2DM)老年男性患者血清铁蛋白(serum ferritin,SF)、血清骨硬化蛋白(serum sclerostin,Sost)水平与骨密度(bone mineral density,BMD)的相关性。方法 采用双光能X线骨密度测量仪对48例70岁以上男性2型糖尿病患者进行正位L2~4、左侧股骨的股骨颈、Ward’s三角区及大转子区域骨密度测量,并检测SF、Sost、糖化血红蛋白(hemoglobin A1c,HbA1c)水平;再用相同的测量方法测定48例血糖正常的70岁以上老年男性的相同指标作为对照组;回顾性统计分析SF、Sost水平与各部位BMD的相关性。结果 a)T2DM组Sost(325.56±123.63)pg/mL,SF(565.72±237.63)ng/mL水平显著高于对照组(204.64±84.76)pg/mL,(355.26±107.62)ng/mL,差异有统计学意义(P<0.01)。b)HbA1c与Sost、SF水平呈正相关。c)T2DM组Sost、SF水平与股骨颈、Ward’s三角骨密度呈负相关,但与L2~4及大转子区域骨密度无相关性。结论 T2DM老年男性患者Sost、SF水平较非糖尿病老年男性患者显著增高,前者Sost、SF水平与髋部骨密度呈显著负相关,表明血糖控制不良可能引起2型糖尿病老年男性患者Sost、SF水平升高,从而抑制了骨形成,最终导致了髋部骨密度的下降。
2型糖尿病;骨硬化蛋白;血清铁蛋白;骨密度
2型糖尿病(type 2 diabetes mellitus,T2DM)合并骨质疏松症(osteoporosis,OP)是指2型糖尿病导致骨量减少,骨组织微结构破坏,骨的脆性增加,从而易发生骨折的全身性代谢性骨病,致骨折及致残率高[1-2]。近年来,血清铁蛋白(serum ferritin,SF)和血清骨硬化蛋白(serum sclerostin,Sost)被证实与2型糖尿病骨质疏松的发生发展密切相关[3-6]。骨质疏松症的最严重后果是导致骨质疏松性骨折(脆性骨折),其中髋部脆性骨折最为常见,预后最差[7]。据统计[8-9],髋部骨折后,20%以上的女性和40%以上的男性患者会在1年内死亡,大约50%患者致残。全世界范围内所有髋部脆性骨折的患者中,男性患者约占30%,1990年人数为51万,预计到2025年男性髋部脆性骨折的人数将达到116万人。但骨质疏松男性患者即使是发生脆性骨折后也很少像女性患者那样接受正规抗骨质疏松治疗(低于10%的男性脆性骨折患者在住院期间接受过抗骨质疏松治疗)[10]。故髋部脆性骨折致残率和病死率极高,其中男性髋部脆性骨折病情常更严重,致死率远高于女性。本研究通过探讨2型糖尿病老年男性患者SF,Sost与骨密度(bone mineral density,BMD)的相关性,旨在揭示2型糖尿病老年男性患者SF,Sost水平对各部位BMD,尤其是髋部BMD的影响。
1 资料与方法
1.1 研究对象 选取2014年5月至2016年4月在遵义医学院第五附属(珠海)医院骨科二病区住院的老年男性患者96例,年龄70~88岁,均排除以下相关疾病及并发症:a)合并糖尿病酮症酸中毒、高渗性非酮症糖尿病昏迷及其他急性并发症;b)合并甲状腺或甲状旁腺系统疾病、库欣综合征、类风湿性关节炎;c)合并肝肾功能异常;d)合并血液系统疾病;e)近期使用糖皮质激素或影响骨代谢的其他相关药物;f)近期发生骨折的患者。
1.1.1 T2DM组 以48例合并2型糖尿病患者为T2DM组,平均年龄(77.28±5.31)岁,糖尿病病程5年以上,入院前均接受胰岛素降糖治疗。
1.1.2 对照组 以48例无糖尿病史患者为对照组,平均年龄(76.54±4.60)岁。
1.2 诊断标准 2型糖尿病的诊断标准 参考T2DM1999年世界卫生组织(world henlth organization,WHO)的诊断标准[11],并排除T1DM。
1.3 研究方法
1.3.1 糖化血红蛋白(hemoglobin A1c,HbA1c),SF,Sost的测定 所有研究对象均于清晨空腹抽取静脉血送我院检验科进行检测。血清收集:采集晨起空腹静脉血5 mL,不加抗凝剂。在离心机3 000 r/min离心5 min后,分出血清后置于-80℃冰箱保存待测。HbA1c由美国Trinity Biotech公司生产的Premier Hb9210型糖化血红蛋白分析仪进行测定。SF由瑞士罗氏公司生产的Cobase601型全自动电化学发光免疫分析仪进行测定。Sost由武汉贝茵莱生物科技有限公司提供的Bio-Swamp酶联免疫吸附法试剂盒进行测定,严格按说明书操作。
1.3.2 双光能X线骨密度检测 使用法国生产的双光能X线骨密度仪(Challenger,DMS)进行L2~4、左侧股骨颈、Ward’s三角区及大转子区域骨密度测量,单位以g/cm2表示。

2 结 果
2.1 一般资料比较 两组年龄、身体质量指数(body mass index,BMI)的比较差异无统计学意义(P>0.05),详细资料见表1。
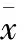
表1 两组一般资料比较(±s)
2.2 两组Sost、SF、HbA1c的比较 T2DM组Sost、SF、HbA1c水平较对照组高,差异具有统计学意义(P<0.05),详细资料见表2。
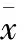
表2 两组Sost、SF、HbA1c比较(±s)
2.3 BMD的比较 两组L2~4BMD比较差异无统计学意义(P>0.05),T2DM组股骨颈、Ward’s三角区及大转子区域BMD较对照组低,差异具有统计学意义(P<0.05),详细资料见表3。
表3 两组BMD结果比较(±s,g/cm2)
2.4 T2DM组Sost、SF与BMD、HbA1c的相关性分析 a)Sost与股骨颈BMD在P=0.01水平呈显著负性相关(r=-0.650);与Ward’s三角BMD在P=0.01水平呈显著负性相关(r=-0.674);Sost与L2~4、大转子BMD呈负性相关,但差异无统计学意义(P>0.05)。b)SF与股骨颈BMD在P=0.01水平呈显著负性相关(r=-0.531);与Ward’s三角BMD在P=0.01水平呈显著负性相关(r=-0.462);SF与L2~4、大转子BMD呈负性相关,但差异无统计学意义(P>0.05)。c)Sost与HbA1c在P=0.01水平呈显著正性相关(r=0.676);SF与HbA1c在P=0.01水平呈显著正性相关(r=0.365),详细资料见表4。
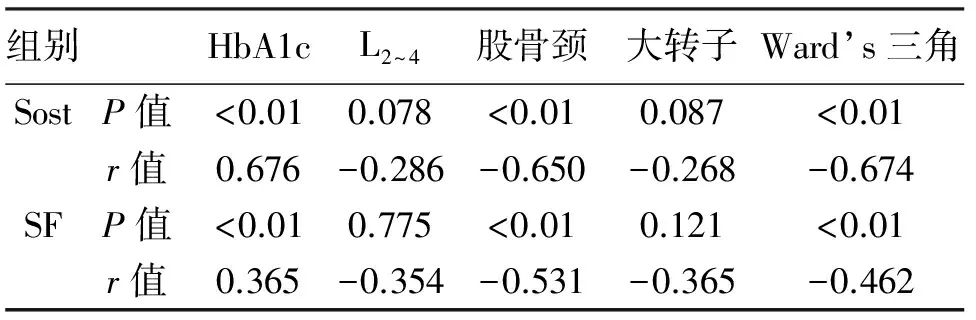
表4 T2DM组Sost、SF与BMD、HbA1c的相关性分析
3 讨 论
2013年由国际糖尿病联盟发布的糖尿病流行病学数据表明:全球已有3.82亿糖尿病患者,且在未来25年内患者数将超过5.92亿[12]。糖尿病是以慢性高血糖为特征的一组代谢性疾病,可同时造成体内骨密度和骨质量的下降[13],因骨密度和骨质量是反映骨骼强度的两个主要方面[14],两者的下降势必影响骨强度,导致骨质疏松症的发生。早在1948年,Albright[15]就首次提出糖尿病性骨质疏松症的观点,近年来围绕上述两种疾病发病关联机制的研究发现,SF和骨硬化蛋白与2型糖尿病和骨质疏松症的病情发展有着密切关系。骨硬化蛋白作为Wnt/β-catenin典型信号通路的重要负性抑制因子之一,在骨质疏松的发病机制中起着重要作用,2型糖尿病患者血清骨硬化蛋白水平较非糖尿病患者明显增高[16-17],高水平骨硬化蛋白表示生物体内骨形成能力受到抑制,造成骨质量的下降[3]。血清铁蛋白是反映机体铁负荷的主要生化指标,游离铁的大量增加,可导致氧化应激反应的发生,从而损伤胰岛素分泌功能和葡萄糖耐量,使血糖进一步升高[18]。有研究表明,铁过多主要可导致成骨细胞功能抑制,骨形成下降,造成骨量的丢失,从而影响骨强度,导致骨质疏松的发生[5-6,19]。
性别和年龄是血清铁蛋白和骨硬化蛋白的两个独立影响因子[20]。本研究只选择老年男性作为研究对象,排除了上述两个独立影响因子,特别是排除了绝经后女性对血清铁蛋白和骨硬化蛋白的影响。本研究结果表明,2型糖尿病老年男性患者骨密度下降和髋部骨质疏松情况较非糖尿病老年男性患者更加严重,前者可能合并更高的脆性骨折风险和骨折不愈合概率。且通过相关性分析发现,2型糖尿病老年男性患者血清铁蛋白和骨硬化蛋白水平与股骨颈和ward’s三角区骨密度值呈显著负性相关。综上所述,2型糖尿病老年男性患者体内血清铁蛋白和骨硬化蛋白水平显著升高,是造成骨强度下降的一个重要危险因素,而血清铁蛋白和骨硬化蛋白水平与HbA1c呈显著正性相关,说明长期血糖控制不良是造成上述两种蛋白升高的重要因素之一,间接导致骨密度的下降。故良好的血糖控制和注重髋部的骨密度监测是此类患者脆性骨折重要的防治手段。
[1]Lee RH,Pieper CF,Colon-Emeric C.Functional impairments mediate association between clinical fracture risk and type 2 diabetes mellitus in older women[J].J Am Geriatr Soc,2015,63(8):1546-1551.
[2]Oei L,Zillikens MC,Dehghan A,et al.High bone mineral density and fracture risk in type 2 diabetes as skeletal complications of inadequate glucose control:the Rotterdam Study[J].Diabetes Care,2013,36(6):1619-1628.
[3]Heilmeier U,Carpenter DR,Patsch JM,et al.Volumetric femoral BMD,bone geometry,and serum sclerostin levels differ between type 2 diabetic postmenopausal women with and without fragility fractures[J].Osteoporos Int,2015,26(4):1283-1293.
[4]Orban E,Schwab S,Thorand B,et al.Association of iron indices and type 2 diabetes:a meta-analysis of observational studies[J].Diabetes Metab Res Rev,2014,30(5):372-394.
[5]Kim BJ,Ahn SH,Bae SJ,et al.Iron overload accelerates bone loss in healthy postmenopausal women and middle-aged men:a 3-year retrospective longitudinal study[J].J Bone Miner Res,2012,27(11):2279-2290.
[6]Li GF,Pan YZ,Sirois P,et al.Iron homeostasis in osteoporosis and its clinical implications[J].Osteoporos Int,2012,23(10):2403-2408.
[7]Angthong C,Angthong W,Harnroongroj T,et al.Survival times of patients with a first hip fracture with and without subsequent major long-bone fractures[J].J Nippon Med Sch,2013,80(1):42-49.
[8]Diamond TH,Thornley SW,Sekel R,et al.Hip fracture in elderly men:prognostic factors and outcomes[J].Med J Aust,1997,167(8):412-415.
[9]Kanis JA,Oden A,Johnell O,et al.The components of excess mortality after hip fracture[J].Bone,2003,32(5):468-473.
[10]Shepherd AJ,Cass AR,Ray LA,et al.Treatment for older men with fractures[J].Osteoporos Int,2012,23(3):1041-1051.
[11]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中国糖尿病杂志,2014,22(8):2-42.
[12]Guariguata L.Contribute data to the 6th edition of the IDF Diabetes Atlas[J].Diabetes Res Clin Pract,2013,100(2):280-281.
[13]Farr JN,Khosla S.Determinants of bone strength and quality in diabetes mellitus in humans[J].Bone,2016,59(82):28-34.
[14]中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南(2011年)[J].中华骨质疏松和骨矿盐疾病杂志,2011,4(1):2-17.
[15]Bartter FC,Forbes AP,Albright F.A comparison of the effect on bone formation of the hyperadrenocorticism of Cushing’s syndrome with that induced by adrenocorticotropic hormone[J].J Clin Endocrinol Metab,1948,8(7):592.
[16]Ardawi MS,Akhbar DH,Alshaikh A,et al.Increased serum sclerostin and decreased serum IGF-1 are associated with vertebral fractures among postmenopausal women with type-2 diabetes[J].Bone,2013,56(2):355-362.
[17]Garcia Martin A,Rozas Moreno P,Reyes Garcia R,et al.Circulating levels of sclerostin are increased in patients with type 2 diabetes mellitus[J].J Clin Endocrinol Metab,2012,97(1):234-241.
[18]Van Campenhout A,Van Campenhout C,Lagrou AR,et al.Iron-binding antioxidant capacity is impaired in diabetes mellitus[J].Free Radic Biol Med,2006,40(10):1749-1755.
[19]Zarjou A,Jeney V,Arosio P,et al.Ferritin ferroxidase activity:a potent inhibitor of osteogenesis[J].J Bone Min Res,2010,25(1):164-172.
[20]Modder UI,Hoey KA,Amin S,et al.Relation of age,gender,and bone mass to circulating sclerostin levels in women and men[J].J Bone Min Res,2011,26(2):373-379.
Correlation between the Serum Ferritin as well as Sclerostin and Bone Mineral Density in Elderly Male Patients with Type 2 Diabetes Mellitus
Ye Yanbin,An Rongze,Qi Xinwen,et al
(Department of Orthopedics,Fifty Affiliated Hospital of Zunyi Medical College,Zhuhai 519000,China)
Objective To analyze the correlation between serum ferritin(SF) as well as serum sclerostin(Sost) levels and bone mineral density(BMD) in elderly male patients with type 2 diabetes mellitus(T2DM).Methods The dual-energy X-ray bone densitometers(Challenger,DMS,France) manufactured in France was adopted to determine the BMD in the second to the fourth lumbar vertebra(L2~4) in anteroposterior position,the left femoral neck,the Ward’s triangle area as well as the greater trochanter region of the 48 cases of elderly male T2DM patients with the age of above 70-year-old;in addition,the SF,Sost and glycosylated hemoglobin(HbA1c) levels were determined;then the same measuring method was utilized to measure the same indicators of the 48 cases of elderly male non-T2DM patients with the age of above 70-year-old(the control group);and retrospective statistical analysis was conducted to analyze the correlation between the SF as well as Sost levels and the BMD in each part.Results Firstly,the Sost(325.56±123.63)pg/mL and SF(565.72 ±237.63)ng/mL levels in the T2DM group were remarkably higher than those in the control group(204.64±84.76)pg/mL and(355.26±107.62)ng/mL,respectively,with the difference being of highly statistical significance(P<0.01).Secondly,HbA1c was positively correlated with the Sost and SF levels.Thirdly,the Sost and SF levels in the T2DM group were negatively correlated with the BMD in the femoral neck and the Ward’s triangle area,but they showed no correlation with that in the L2~4and the greater trochanter region.Conclusion The results indicated that the Sost and SF levels in elderly male patients with T2DM are notably higher than those in elderly male patients with no T2DM;the Sost and SF levels in the former are markedly negatively correlated with the BMD in the hip,which suggested that poor blood glucose control might induce increased Sost and SF levels in elderly male patients with no T2DM,thus inhibits bone formation and finally the decreases BMD in the hip.
type 2 diabetes mellitus;sclerostin;serum ferritin;bone mineral density
贵州省科学技术厅基金项目(黔科合J字LKZ 201343);*本文通讯作者:齐新文
1008-5572(2017)02-0138-04
R322.7+1
B
2016-07-18
叶燕彬(1988- ),男,研究生在读,遵义医学院第五附属(珠海)医院骨科,519000。
叶燕彬,安荣泽,齐新文,等.2型糖尿病老年男性患者血清铁蛋白、骨硬化蛋白与骨密度的相关性[J].实用骨科杂志,2017,23(2):138-141.
