去白悬浮红细胞储存过程中ATP、2,3-DPG含量变化与氧化应激的相关性分析
2017-03-09王素玲何路军王艳彬
王素玲,韩 卫,何路军,王艳彬,王 切
(1.河北省血液中心检验科,河北 石家庄 050071;2.河北医科大学基础医学院人体解剖学教研室,河北 石家庄 050017)
·论 著·
去白悬浮红细胞储存过程中ATP、2,3-DPG含量变化与氧化应激的相关性分析
王素玲1,韩 卫1,何路军1,王艳彬1,王 切2*
(1.河北省血液中心检验科,河北 石家庄 050071;2.河北医科大学基础医学院人体解剖学教研室,河北 石家庄 050017)
目的探讨去白悬浮红细胞储存过程中三磷酸腺苷(adenosine triphosphate,ATP)、2,3-二磷酸甘油酸(2,3-diphosphoglycerate,2,3-DPG)含量变化与氧化应激的相关性。方法采集志愿者血液,制备去白悬浮红细胞,于2~6 ℃保存。于保存7 d、14 d、28 d、42 d时,应用荧光酶标仪测定去白悬浮红细胞内活性氧族(reactive oxygen species, ROS)含量,采用分光光度法测定细胞外过氧化氢(hydrogen peroxide,H2O2)含量,采用化学比色法测定ATP含量,采用紫外测试法测定2,3-DPG含量。对去白悬浮红细胞内ROS、ATP、2,3-DPG和细胞外H2O2含量与储存时间进行相关性分析;对去白悬浮红细胞内ATP、2,3-DPG含量与ROS、H2O2含量进行相关性分析。结果 随着储存时间的延长,去白悬浮红细胞内ROS含量和细胞外H2O2含量均明显升高,保存42 d的ROS和H2O2含量明显高于保存7 d、14 d和28 d红细胞的ROS和H2O2含量,且ROS和H2O2含量与储存时间均呈正相关。去白悬浮红细胞内ATP、2,3-DPG含量却明显降低,保存42 d的ATP、2,3-DPG含量明显低于保存7 d、14 d和28 d红细胞的ATP、2,3-DPG含量,并且ATP、2,3-DPG含量与储存时间均呈负相关。去白悬浮红细胞内ATP、2,3-DPG含量与ROS、H2O2含量也呈负相关。结论随储存时间延长,去白悬浮红细胞内ATP和2,3-DPG含量逐渐降低,与红细胞内氧化应激反应逐渐增强密切相关。
血液保存;腺苷三磷酸;2,3-二磷酸甘油酸
红细胞输注是临床上提高血液运氧能力,改善组织缺氧状态的一种重要治疗手段。但随储存时间的延长,红细胞会发生“储存损伤”[1],明显的改变为三磷酸腺苷(adenosine triphosphate,ATP)、2,3-二磷酸甘油酸(2,3-diphosphoglycerate, 2,3-DPG)减少。这不仅降低了红细胞的运氧能力,还可能引起严重的输血后并发症,增加患者病死率[2-5]。研究表明氧化应激所产生的大量活性氧族(reactive oxygen species, ROS)是导致红细胞储存损伤的重要机制之一[6-7]。悬浮红细胞是目前国内外临床上应用最为广泛的血液制剂,在悬浮红细胞储存过程中,ATP、2,3-DPG的含量变化与细胞内外氧化应激水平的相关性,尚未见报道。本研究将去白悬浮红细胞于2~6 ℃储存,分别于储存第7、14、28、42 d观察去白悬浮红细胞内ROS、ATP、2,3-DPG和细胞外过氧化氢(hydrogen peroxide, H2O2)含量变化,并进行ATP、2,3-DPG含量与ROS,H2O2含量的相关性分析,报告如下。
1 材料与方法
1.1 去白悬浮红细胞的制备及处理 全血采自6例健康献血者,每例采血400 mL。将采集到的血液标本按照国家《全血及成分血质量要求》[8]的规定进行乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒、梅毒螺旋体等经输血传播病原体检测。检验合格后的血液严格按照《血站技术操作规程(2012版)》[9]操作步骤制备成去白悬浮红细胞。采用无菌接合机将去白悬浮红细胞分装到4个空血袋内,分为7 d组、14 d组、28 d组和42 d组,然后将各组血液均置于2~6 ℃保存。分别于贮存的7 d、14 d、28 d、42 d观察各组去白悬浮红细胞内ROS、ATP、2,3-DPG含量及细胞外H2O2含量变化。
1.2 主要试剂 ROS检测试剂盒为碧云天生物技术研究所产品,H2O2测定试剂盒、ATP测定试剂盒、血红蛋白测定试剂盒均为南京建成科技有限公司产品,2,3-DPG测定试剂盒为德国Roche公司产品。
1.3 去白悬浮红细胞内ROS含量测定 取200 μL悬浮红细胞,2 000 r/min 离心5 min,弃上清。加入2倍体积生理盐水,轻轻洗涤红细胞,2 000 r/min 离心5 min,弃上清。按上述步骤将红细胞洗涤3次。向红细胞沉淀内加入200 μL生理盐水悬浮细胞,吸取50 μL细胞悬液并加入450 μL生理盐水,将细胞稀释10倍。吸取100 μL稀释的细胞悬液,2 000 r/min 离心5 min,弃上清,加入稀释好的DCFH-DA(1∶1 000生理盐水稀释) 200 μL。于37 ℃细胞培养箱内孵育30 min,每隔5 min颠倒混匀1次。2 000 r/min 离心5 min,弃上清,终止反应。用200 μL生理盐水将红细胞洗涤3次。加入等体积RIPA细胞裂解液将细胞裂解。将细胞裂解产物加入到黑色96孔检测板内,通过荧光酶标仪测定荧光值(激发波长488 nm,发射波长525 nm)。吸取20 μL细胞裂解产物按试剂盒操作说明测定其血红蛋白含量。通过荧光值与血红蛋白值之比表示红细胞内ROS含量。
1.4 去白悬浮红细胞内ATP含量测定 检测步骤按试剂盒操作说明进行。
1.5 去白悬浮红细胞内2,3-DPG含量测定 取1 mL悬浮红细胞于2 500 r/min 4 ℃离心10 min,弃上清。向红细胞沉淀内加入5 mL冰的高氯酸(0.6 mol/L)立即混匀。5 000 r/min 4 ℃离心10 min后,吸取4 mL无色上清。在上清内加入0.5 mL 2.5 mol/L碳酸钾,冰浴2 h。5 000 r/min 4 ℃离心10 min后去除高氯酸盐沉淀,取0.1 mL上清用于检测。检测步骤按试剂盒操作说明进行。
1.6 去白悬浮红细胞外H2O2含量测定 收集1 mL储存的去白悬浮红细胞,3 000 r/min 4 ℃离心10 min,收集上清,用于H2O2含量测定。检测步骤按试剂盒操作说明进行。
1.7 统计学方法 应用SPSS 13.0统计学软件处理数据。计量资料比较分别采用单因素方差分析和SNK-q检验;相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 去白悬浮红细胞内ROS、ATP、2,3-DPG和细胞外H2O2含量变化 随着红细胞保存时间的延长,ROS和 H2O2含量呈逐渐升高趋势,保存14 d、28 d的红细胞内ROS含量高于保存7 d,保存42 d的红细胞内ROS含量又高于保存7 d、14 d和28 d(P<0.05);保存28 d和42 d的红细胞外H2O2含量高于保存7 d和14 d,保存42 d的红细胞外H2O2含量高于保存28 d(P<0.05);随着保存时间的延长,红细胞内ATP和2,3DPG含量呈逐渐下降趋势,保存14 d、28 d、42 d的红细胞内ATP和2,3-DPG含量低于保存7 d,保存42 d的红细胞内ATP含量低于保存14 d和28 d(P<0.05);保存28 d和42 d的红细胞内2,3-DPG含量低于保存14 d,保存42 d的红细胞内2,3-DPG含量少于保存28 d(P<0.05)。见表1。
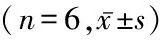
表1 不同保存时间ROS、H2O2、ATP和2,3-DPG比较Table 1 The comparison of ROS, H2O2, ATP and 2,3-DPG in different storage time
*P<0.05与7 d比较P<0.05与14 d比较 △P<0.05与28 d比较(SNK-q检验)
2.2 相关性分析 去白悬浮红细胞内ROS及细胞外H2O2含量与储存时间呈正相关(P<0.01);去白悬浮红细胞内ATP、2,3-DPG含量与储存时间呈负相关(P<0.01);ATP、2,3-DPG含量与ROS和H2O2含量呈负相关(P<0.01)。见表2,3。

表2 去白悬浮红细胞储存中ROS、H2O2、ATP、2,3-DPG与储存时间的相关性分析 Table 2 The correlation between ROS,H2O2,ATP, 2,3-DPG and storage time

表3 去白悬浮红细胞储存中ATP、2,3-DPG与ROS、H2O2的相关性分析 Table 3 The correlation between ATP, 2,3-DPG and ROS,H2O2 during storage of suspended red blood cells without leukocyte
3 讨 论
去白悬浮红细胞是目前国内外临床应用最为广泛的血液制剂,适用于大多数需要补充红细胞、提高血液携氧能力的患者,也是改善急性大出血、严重创伤、器官移植等大量失血患者机体缺氧状态的一种主要治疗手段。但随储存时间的延长,红细胞会发生储存损伤。实验研究和临床调查均表明,储存损伤红细胞的运氧能力已降低,输注长时间保存的红细胞还可能增加肾衰竭、败血症、感染、多器官功能衰竭等并发症发生率,甚至增加患者的病死率[10-14]。因此,去白悬浮红细胞储存过程中的损伤变化已引起高度重视。
红细胞富含氧气和血红蛋白。在储存过程中,血红蛋白会不断发生自动氧化,在这个过程中会有大量ROS产生,如O2-、OH和H2O2等,ROS与红细胞膜内的脂质、重要活性蛋白、结构蛋白发生过氧化反应,改变膜的结构和功能,引起细胞损伤甚至死亡[15]。这是引起红细胞储存损伤的重要机制之一。本研究结果显示,随着储存时间的延长,去白悬浮红细胞内ROS含量和细胞外H2O2含量都逐渐增加;在去白悬浮红细胞储存过程中,红细胞内ROS含量与储存时间、细胞外H2O2含量与储存时间均呈正相关。表明随着去白悬浮红细胞储存时间延长,细胞内外的ROS含量都逐渐增加,即去白悬浮红细胞内外的氧化应激反应随储存时间延长而增强。
ATP是红细胞内的能量物质,其浓度的高低是判断红细胞活性的重要指标之一,对维持红细胞的正常代谢、结构和功能至关重要。2,3-DPG常被作为红细胞携氧能力的标志物。当其与血红蛋白结合时,即降低了血红蛋白与氧的亲和力,从而促进氧合血红蛋白释放氧。因此, ATP和2,3-DPG的含量高低是判断储存红细胞保存质量的重要指标[6]。本研究结果显示,随着储存时间的延长,去白悬浮红细胞内的ATP和2,3-DPG含量明显逐渐降低;在去白悬浮红细胞储存过程中,去白悬浮红细胞内ATP和2,3-DPG含量与储存时间均呈负相关。表明随着储存时间的延长,去白悬浮红细胞内的能量物质减少,携氧能力降低,即随去白悬浮红细胞随储存时间的延长逐渐发生了储存损伤。
随着储存时间的延长,去白悬浮红细胞内外的ROS含量均逐渐增加,而标志红细胞保存质量的ATP和2,3-DPG含量却逐渐降低,两者之间是否具有相关性?本研究结果显示,在去白悬浮红细胞储存过程中,红细胞内的ATP和2,3-DPG含量与细胞内ROS、细胞外H2O2含量均呈负相关。表明去白悬浮红细胞内的ATP和2,3-DPG含量的降低与细胞内外氧化应激反应增强密切相关;随着储存时间的延长,氧化应激可能是导致去白悬浮红细胞储存损伤的主要原因之一。
总之,在悬浮红细胞储存过程中,随着储存时间的延长,去白悬浮红细胞内ATP和2,3-DPG含量的逐渐降低与细胞内外氧化应激反应增强密切相关。这将为降低红细胞“储存损伤”、改善红细胞储存质量提供一定的理论依据。
[1] Kim-Shapiro DB,Lee J,Gladwin MT. Storage lesion:role of red blood cell breakdown[J]. Transfusion,2011,51(4):844-851.
[2] Berra L,Pinciroli R,Stowell CP,et al. Autologous transfusion of stored red blood cells increases pulmonary artery pressure[J]. Am J Respir Crit Care Med,2014,190(7):800-807.
[3] Karkouti K. From the Journal archives:the red blood cell storage lesion:past,present,and future[J]. Can J Anaesth,2014,61(6):583-586.
[4] Shimmer C,Hamouda K,Ozkur M,et al. Influence of storage time and amount of red blood cell transfusion on postoperative renal function:an observational cohort study[J]. Heart Lung Vessel,2013,5(3):148-157.
[5] Roback JD. Vascular effects of the red blood cell storage lesion[J]. Hematology Am Soc Hematol Educ Program,2011,2011:475-479.
[6] Orlov D,Karkouti K. The pathophysiology and consequences of red blood cell storage[J]. Anaesthesia,2015,70(Suppl 1):29-37,e9-12.
[7] Chaudary R,Katharia R. Oxidative injury as contributory factor for red cells storage lesion during twenty eight days of storage[J]. Blood Transfus,2012,10(1):59-62.
[8] 中国国家标准化管理委员会.全血及成分血质量要求[S].北京:中华人民共和国标准化管理委员会,2012:4.
[9] 中华人民共和国卫生部.血站技术操作规程(2012版)[S].北京:中华人民共和国卫生部,2012:7-10.
[10] Weinberg JA,MacLennan PA,Vandromme-Cusick MJ,et al. The deleterious effect of red blood cell storage on microvascular response to transfusion[J]. J Trauma Acute Care Surg,2013,75(5):807-812.
[11] Reynolds JD,Bennett KM,Cina AJ,et al. S-nitrosylation therapy to improve oxygen delivery of banked blood[J]. Proc Natl Acad Sci USA,2013,110(28):11529-11534.
[12] Wang D,Sun J,Solomon SB,et al. Transfusion of older stored blood and risk of death:a meta-analysis[J]. Transfusion,2012,52(6):1184-1195.
[13] Redlin M,Habazettl H,Schoenfeld H,et al. Red blood cell storage duration is associated with various clinical outcomes in pediatric cardiac surgery[J]. Transfus Med Hemother,2014,41(2):146-151.
[14] Dunn LK,Thiele RH,Ma JZ,et al. Duration of red blood cell storage and outcomes following orthotopic liver transplantation[J]. Liver Transpl,2012,18(4):475-481.
[15] Raval JS,Fontes J,Banerjee U,et al. Ascorbic acid improves membrane fragility and decreases haemolysis during red blood cell storage[J]. Transfus Med,2013,23(2):87-93.
(本文编辑:许卓文)
Correlation analysis between ATP, 2,3-DPG concentration in suspended red blood cells without leukocyte and Oxidative stress during storage
WANG Su-ling1, HAN Wei1, HE Lu-jun1, WANG Yan-bin1, WANG Qie2*
(1.DepartmentofClinicalLaboratory,HebeiBloodCenter,Shijiazhuang050071,China;2.DepartmentofHumanAnatomy,theSchoolofBasicMedicalSciences,HebeiMedicalUniversity,Shijiazhuang050017,China)
Objective To investigate the correlation between the change of adenosine triphosphate(ATP), 2,3-diphosphoglycerate(2,3-DPG) concentration and oxidative stress level in suspended red blood cells without leukocyte during storage. Methods The blood of volunteers were collected to prepare suspended red blood cells without leukocyte. The suspended red blood cells were stored at 2-6 ℃. On day 7, day 14, day 28 and day 42 of storage, the concentration of reactive oxygen species(ROS) in red blood cells was detected by fluorescence microplate reader, the concentration of hydrogen peroxide(H2O2) outside cell was detected with spectrophotometric method, the concentration of ATP was detected with chemical chromatometry, the 2,3-DPG was detected with Uv test method. Correlation analysis between the ROS, H2O2, ATP, 2,3-DPG and storage time were carried out, respectively. Correlation analysis between ATP, 2,3-DPG and ROS, H2O2were carried out, respectively. Results With the extension of storage time, the concentration of ROS and H2O2were significantly increased, the ROS and H2O2content on day 42 of storage were significantly higher than that of day 7, day 14 and day 28. There were positive correlation between ROS and storage time, between H2O2and storage time. But with the extension of storage time, the concentration of ATP and 2,3-DPG were significantly decreased. The ATP and 2,3-DPG content on day 42 of storage were significantly lower than that of day 7, day 14 and day 28. There were negative correlation between ATP and storage time, between 2,3-DPG and storage time. There were negative correlation between ATP and ROS, between ATP and H2O2, between 2,3-DPG and ROS, between 2,3-DPG and H2O2. Conclusion With the extension of storage time, the concentration of ATP and 2,3-DPG in suspended red blood cells without leukocyte were gradually reduced, which is closely related with the increasing of oxidative stress reaction.
blood preservation; adenosine triphosphate; 2,3-diphosphoglycerate
2016-02-06;
2016-03-03
河北省科技计划项目(13277717D)
王素玲(1976-),女,河北玉田人,河北省血液中心主管检验师,医学博士,从事血液保存方法的改进相关研究。
*通讯作者。E-mail:wangqie1012@163.com
R31.122;R954
A
1007-3205(2017)02-0192-04
10.3969/j.issn.1007-3205.2017.02.017
