HPV16 DNA存在状态在宫颈病变筛查和预测中的应用价值
2017-03-09王丽丽王晓娜
王丽丽,张 琳,王晓娜
(河北医科大学第二医院妇科,河北 石家庄 050000)
·论 著·
HPV16 DNA存在状态在宫颈病变筛查和预测中的应用价值
王丽丽,张 琳,王晓娜
(河北医科大学第二医院妇科,河北 石家庄 050000)
目的研究人乳头瘤病毒16(human papillomavirus 16,HPV16)阳性患者病毒存在状态与宫颈病变级别的关系,以及HPV16整合型对高级别宫颈病变的预测和诊断价值。方法选择已明确病理学结果且为HPV16阳性的165例患者为研究对象,其中宫颈炎18例,子宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)1为24例,CIN2为45例,CIN3为51例,宫颈癌27例。应用多重PCR检测165例患者宫颈脱落细胞中HPV16 DNA的E2、E6基因,通过比较E2和E6的面积灰度值得到E2/E6比值,比较不同级别病变中HPV16 DNA存在状态。结果在炎症中HPV16单一型别感染的检出率为6.73%(7/104),CIN1中其检出率为10.58%(11/104),CIN2中为29.81%(31/104),CIN3中为30.77%(32/104),宫颈癌组中为22.11%(23/104)。随着宫颈病变级别的升高,HPV16单一型别感染的检出率逐渐增加(Z=3.119,P=0.002)。在宫颈炎、CIN1、CIN2、CIN3、宫颈癌中混合型的检出率分别为16.67%(3/18)、20.83%(5/24)、46.67%(21/45)、62.74%(32/51)、77.78%(21/27),将不同级别宫颈病变整合型的检出率进行统计学分析,差异有统计学意义(χ2=28.009,P<0.05)。HPV16 DNA整合状态诊断宫颈病变的灵敏度为60.16%,特异度为79.07%,阳性预测值为90.24%,阴性预测值为40.96%,其诊断宫颈病变有较高的特异度和阳性预测值。结论运用多重PCR扩增HPV16的E2和E6基因,E2/E6比值可以作为判断病毒存在状态的指标,与宫颈病变的级别相关。此外,整合在HPV感染进程中是一个早期事件,随着宫颈病变级别的升高,整合的发生率增加。
宫颈肿瘤;宫颈上皮内瘤样病变;人乳头瘤病毒16
宫颈癌是发展中国家最常见的恶性肿瘤之一,高危型人乳头瘤病毒(high risk human papillomavirus,hrHPV)持续感染被认为是宫颈癌和子宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)的主要病因。研究表明50%以上的宫颈癌患者中均可以检测到人乳头瘤病毒16(human papillomavirus 16,HPV16)。HPV在体内存在的状态可能与宫颈病变的发生发展有关,本研究通过检测宫颈脱落细胞中的HPV16 DNA的存在状态与宫颈病变级别的相关性,判断其是否可作为预测HPV16 DNA阳性者发展至CIN风险的标志物,报告如下。
1 资料与方法
1.1 一般资料 选择2009年1月—2012年9月于我院门诊行新柏液基细胞学技术(Thinprep cytologic test,TCT)或HPV检测者为研究对象,其中对细胞学结果大于等于无明确诊断意义的不典型鳞状上皮细胞病变(atypical squamous cell of undertermind significant,ASCUS)或HPV分型检测高危型阳性者行阴道镜检查,对异常阴道镜图像患者采取多点活组织检查送病理,以病理诊断作为金标准。所有研究对象为已知病理学结果和HPV16感染者,按病理学诊断分为炎症、CIN1、CIN2、CIN3和宫颈癌5个级别组。从上述各组中选取165例HPV16阳性患者,年龄19~77岁,平均(40.7±9.4)岁,取其剩余细胞学标本应用多重PCR技术进行HPV基因存在状态的检测。其中宫颈脱落细胞血标本取自病理组织学检查之前,时间间隔为1个月。入选标准:非妊娠期,未合并其他性传播疾病,无宫颈治疗史,无盆腔放疗和化疗史。
1.2 宫颈脱落细胞的收集 由经过规范培训的医生采集,并于4 ℃冰箱保存,用于HPV基因分型检测,剩余的标本放置于-80 ℃冰箱储存,用于HPV整合状态的检测。
1.3 HPV分型检测 采用凯普核酸分子快速导流杂交基因芯片技术进行21种基因分型检测。
1.4 阴道镜下活组织检查和组织病理学诊断 对TCT大于等于ASCUS者以及高危型HPV16阳性者,均于阴道镜下取活组织检查,并送组织病理学诊断。
1.5 DNA提取和观察 选取HPV16 DNA阳性的宫颈脱落细胞标本,进行离心、提取,将 DNA产物保存在-20 ℃冰箱以备实验应用,长期保存则放置于-80 ℃冰箱中。
1.6 电泳 取6 μL PCR反应所得的DNA产物与上样缓冲液混合后,点样于样品槽中,在1×TBE缓冲液中110 V/era电压下电泳约20 min,并设置阴性对照。在波长254 nm紫外灯下观察结果,应用凝胶电泳图像分析软件分析HPV16E2、E6基因PCR扩增所得的产物电泳条带的面积灰度值。从而可以确定目的基因的含量。通过计算E2/E6比值判断HPVl6感染的体内状态:游离型E2/E6>0.9;整合型E2/E6为0~0.15;混合型E2/E6>0.15~0.9。
1.7 统计学方法 应用SPSS 13.0统计软件处理数据。等级资料比较采用秩和检验;计数资料比较采用趋势χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 HPV16单一感染和多重感染与宫颈病变级分布 165例研究对象中HPV16单一型别感染占63.03%(104/165),HPV16的多型别感染占36.97%(61/165),包括了2~5种HPV型别。与HPV感染的多型别比较,随着宫颈病变级别的升高,HPV16单一型别感染的检出率逐渐增加。不同感染类型的宫颈病变分级分布差异有统计学意义(Z=3.119,P=0.002),见表1。
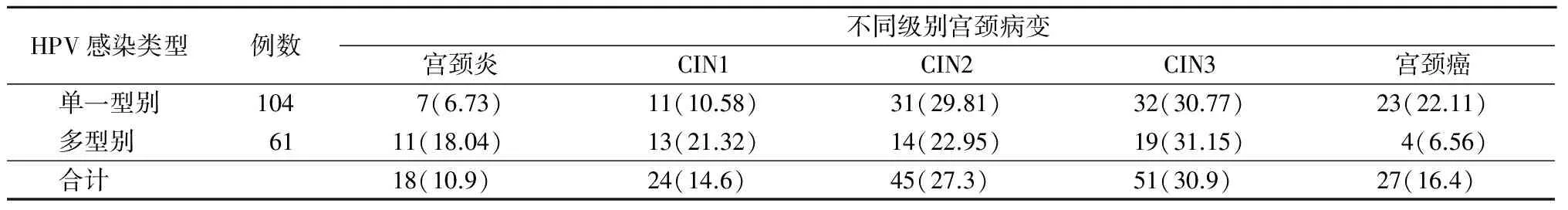
表1 不同级别CIN和宫颈癌中HPV16感染类型的比较Table 1 Comparison of different types of HPV 16 of patients with different grades of CIN and cervical cancer (例数,%)
2.2 不同级别宫颈病变中HPV16 DNA的存在状态 在165例研究对象中,不同级别宫颈病变的HPV16在体内存在状态共检出游离型83例,游离型和整合型共同存在的混合型82例,尚未发现单纯整合型。
炎症、CIN1、CIN2、CIN3、宫颈癌5个病变级别中HPV16 DNA混合型的检出率分别为16.67%(3/18)、20.83%(5/24)、46.67%(21/45)、62.74%(32/51)、77.78%(21/27),随着宫颈病变严重程度的增加,混合型的检出率逐渐增加,差异有统计学意义(趋势χ2=28.009,P<0.05),见表2。
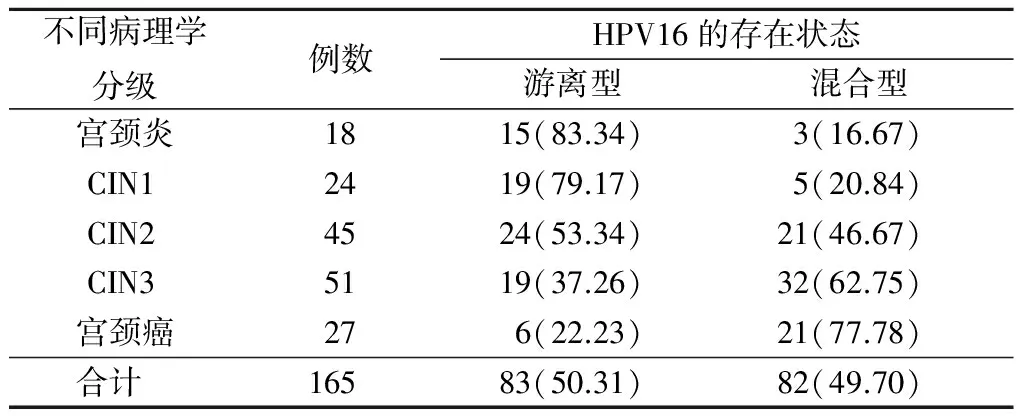
表2 不同级别CIN和宫颈癌中HPV16 DNA存在状态比较Table 2 Comparison of physical states of HPV-16 DNA of patients with different grades of CIN and cervical cancer (例数,%)
2.3 HPV16 DNA整合状态对CIN2及以上宫颈病变的诊断价值 HPV16 DNA整合状态诊断宫颈病变的灵敏度为60.16%,特异度为80.95%,阳性预测值为90.24%,阴性预测值为40.96%,其诊断和筛检宫颈病变有较高的特异度和阳性预测值,见表3。
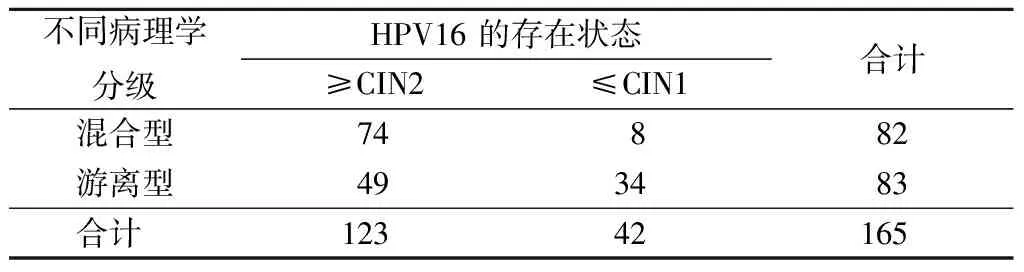
表3 HPV16 DNA整合状态对CIN2及以上宫颈病变的诊断价值Table 3 HPV16 integration state for the prediction of ≥CIN2 lesions (例数)
3 讨 论
3.1 HPV E2与E6、E7的结构和功能 HPV E2蛋白可调节病毒的转录和复制,在病毒DNA复制及抑制病毒早期基因转录方面起重要作用[1]。HPV早期基因产物E6和E7蛋白利用多种机制逃避宿主的免疫监视,使病毒持续感染,并解除对细胞周期和细胞凋亡的调控,从而促进DNA损伤的积累,最终促使细胞转化,在肿瘤发生中起关键作用[2]。有研究指出HPV在体内的整合状态可作为宫颈病变进展的生物标志[3]。Cricca等[4]研究发现E1、E2基因的破坏和缺失在宫颈高级别病变中的发生率远远高于在宫颈低级别病变中的发生率。因此,在高级别宫颈病变中,E2基因可以作为判断HPV16 DNA整合入宿主基因组的指标[5]。Boulet等[6]通过检测综合乳头瘤病毒序列的多聚合酶链反应(detection of integrated papillomavirus sequences polymerase chain reaction,DIPS-PCR)和基因测序系统性评价了E2/E6作为病毒整合状态判定方法的可靠性,并且Chang等[7]的研究也肯定了HPV整合状态在诊断宫颈病变中的灵敏度和特异度。
目前检测病毒存在形式的方法主要是通过E2/E6比值判断,本研究中将E2/E6为0~0.15判断为整合型[8],E2/E6>0.15~0.9判断为混合型,E2/E6>0.9判断为游离型[9]。随着宫颈病变级别的升高,E2/E6比值逐渐降低,且呈线性相关。有学者发现E2/E6比值大多介于0和0.8之间,也就是说不同级别病变中的病毒大多以游离和混合型共同存在于宿主细胞中,本研究中不同级别病变中均存在混合型的HPV。
本研究以165例不同级别的HPV16 DNA阳性患者为研究对象,但未发现以纯整合型存在的形式,一方面可能是因为样本量小,另一方面可能是因为本研究的引物只是针对E2区域设计的,整合可能发生在E2以外的区域。本研究中HPV混合型在慢性宫颈炎中的检出率为16.67%,在CIN1中为20.83%,在CIN2中为46.67%,在CIN3中为62.74%,在宫颈癌中为77.78%。可见随着宫颈病变严重程度的增加,整合的发生率相应增加,这也表明HPV16的整合可以发生在CIN即癌前病变阶段,甚至可发生在慢性宫颈炎患者中,这与Manawapat等[10]在一项关于病毒基因组整合状态及病毒载量的前瞻性队列研究结论相一致。然而在过去的 10年中,一些学者则认为整合是发生在浸润性宫颈癌中的一个事件。本研究结果显示宫颈癌中HPV16以游离形式存在的为22.22%。Nambaru等[11]研究同样发现宫颈癌中HPV16以20%~40%的游离形式存在。这表明HPV16的整合是宫颈病变发生发展的早期事件,但随着宫颈病变级别的升高,整合的发生率升高。整合的发生与HPV的致癌机制相关,HPV16 DNA整合可导致E6、E7的过表达,这是导致细胞向恶性转化的机制之一[12]。
3.2 病毒整合状态与持续感染 病毒持续感染者发展至宫颈高级别瘤变的风险较高,病毒基因组以整合状态存在时一方面难以被细胞免疫所清除[2],另一方面由于E2负调控蛋白的缺失增加了病毒癌基因的表达,这些因素促进了病毒持续感染的发生[13]。导致病毒基因以整合状态存在的妇女比以游离状态存在的妇女有更高的发展为持续感染的风险。本研究为回顾性研究,为了进一步研究HPV16整合和疾病进展之间的关系,后期的研究应致力于对这些患者的随访。
由于整合和持续感染之间的关系,整合状态的检测可作为筛查宫颈病变的辅助指标以及预测高级别CIN和浸润性宫颈癌的转归指标,并可能成为判断病毒感染持续的有效预测指标。
3.3 整合状态与多重感染 有关整合状态与多重感染之间的联系鲜有报道,有学者发现在宫颈癌中更常表现为单一感染而非多重感染,本研究结果也支持这一观点,随着宫颈病变级别的升高,HPV感染更趋向于单一型别的感染。在HPV16和HPV18双重感染中,比起任一型别单一感染,病毒基因组更多以游离状态存在,表明可能存在竞争细胞整合位点的相关机制[14]。因此,多重感染可能并不增加宫颈癌发生的风险。HPV DNA可以游离型、整合型、混合型3种方式存在于宿主细胞中,不同存在形式与病毒的致病能力相关,整合是宫颈病变发生发展中的常见事件,是宫颈病变进展的关键因素之一。病毒基因组整合入宿主细胞后可导致宿主基因组不稳定、抑癌基因功能失活,从而导致细胞永生化,引发宫颈恶性肿瘤的发生。
[1] Johansson C,Somberg M,Li X,et al. HPV-16 E2 contributes to induction of HPV-16 late gene expression by inhibiting early polyadenylation[J]. EMBO J,2012,31(14):3212-3227.
[2] Ghittoni R,Accardi R,Chiocca S,et al. Role of human papillomaviruses in carcinogenesis[J]. Ecancermedicalscience,2015,9:526.
[3] Tsakogiannis D,Kyriakopoulou Z,Ruether IG,et al. Determination of human papillomavirus 16 physical status through E1/E6 and E2/E6 ratio analysis[J]. J Med Microbiol,2014,63(Pt 12):1716-1723.
[4] Cricca M,Venturoli S,Leo E,et al. Disruption of HPV 16 E1 and E2 genes in precancerous cervical lesions[J]. J Virol Methods,2009,158(1/2):180-183.
[5] Bodily J,Laimins LA. Persistence of human papillomavirus infection:keys to malignant progression[J]. Trends Microbiol,2011,19(1):33-39.
[6] Boulet GA,Benoy IH, Depuydt CE,et al. Human papillomavirus 16 load and E2/E6 ratio in HPV16-positive women:biomarkers for cervical intraepithelial neoplasia >or=2 in a liquid-based cytology setting?[J]. Cancer Epidemiol Biomarkers Prev,2009,18(11):2992-2999.
[7] Chang L,He X,Yu G,et al. Effectiveness of HPV 16 viral load and the E2/E6 ratio for the prediction of cervical cancer risk among Chinese women[J]. J Med virol,2013,85(4):646-654.
[8] Arias-Pulido H,Peyton CL,Joste NE,et al. Human papillomavirus type 16 integration in cervical carcinoma in situ and in invasive cervical cancer[J]. J Clin Microbiol,2006,44(5):1755-1762.
[9] Cricca M,Morselli-Labate AM,Venturoli S,et al. Viral DNA load,physical status and E2/E6 ratio as markers to grade HPV16 positive women for high-grade cervical lesions[J]. Gynecol Oncol,2007,106(3):549-557.
[10] Manawapat A,Stubenrauch F,Russ R,et al. Physical state and viral load as predictive biomarkers for persistence and progression of HPV16-positive cervical lesions:results from a population based long-term prospective cohort study[J]. Am J Cancer Res,2012,2(2):192-203.
[11] Nambaru L,Meenakumari B,Swaminathan R,et al. Prognostic significance of HPV physical status and integration sites in cervical cancer[J].Asian Pac J Cancer Prev,2009,10(3):355-360.
[12] Tsakogiannis D,Kyriakopoulou Z,Ruether IG,et al. Determination of human papillomavirus 16 physical status through E1/E6 and E2/E6 ratio analysis[J]. J Med Microbiol,2014,63(Pt 12):1716-1723.
[13] Bodily J,Laimins LA. Persistence of human papillomavirus infection:keys to malignant progression[J]. Trends Microbiol,2011,19(1):33-39.
[14] Cheung JL,Cheung TH,Tang JW,et al. Increase of integration events and infection loads of human papillomavirus type 52 with lesion severity from low-grade cervical lesion to invasive cancer[J]. J Clin Microbiol,2008,46(4):1356-1362.
(本文编辑:许卓文)
Application value of HPV16DNA integration in screening and prediction of cervical lesions
(DepartmentofObstetricsandGynecology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China)
Objective To evaluate the correlation between physical status of human papillomavirus 16(HPV16) and degree of cervical lesion and the role of HPV-16 integration in prediction and diagnosis of high squmous intrepithelil lesion(HSIL). Methods A total of 165 cervical cells samples were collected from the patients with HPV positive. All patients′ pathological results were definite, including 18 cases of cervicitis, 24 cases with cervical intraepithelial neoplasia(CIN)1, 45 cases with CIN2, 51 cases with CIN3 and 27 cases with cervical cancer. The total genomic DNA were extracted and multiplex PCR were performed for detection of the level of HPV E2 and E6 genes. Comparing the physical status of HPV16 in different degrees of cervical lesions according to the E2/E6 ratio. Results The single infection ratios of HPV16 in cervicitis, CIN1, CIN2, CIN3 and cervical cancer were 6.73%(7/104), 10.58%(11/104), 29.81%(31/104), 30.77%(32/104), 22.11%(23/104), respectively. Single HPV infection rate was gradually increasing with the processing of cervical lesion level. The integration ratios of HPV16 in cervicitis, CIN1, CIN2, CIN3 and cervical cancer were 16.67%(3/18), 20.83%(5/24), 46.67%(21/45), 62.74%(32/51), 77.78%(21/27), respectively. The difference was statistically significant(P<0.05). The sensitivity and specificity of diagnosis of cervical lesions by HPV16 DNA integrate status were 60.16% and 79.07% and the positive predictive value and negative predictive value were 40.96% and 90.24%. Conclusion The E2/E6 ratio of HPV16 can be used as indicators to judge the state of viral integration, and the integration status of HPV16 was accompanied with the processing of cervical lesion level.
uterine cervical neoplasms; cervical intraepithelial neoplasia; human papillomavirus 16
2016-01-20;
2016-11-21
王丽丽(1965-),女, 河北泊头人,河北医科大学第二医院主任医师,医学学士,从事宫颈病变、普通妇科疾病诊治研究。
R737.33
A
1007-3205(2017)02-0164-04
WANG Li-li, ZHANG Lin, WANG Xiao-na
10.3969/j.issn.1007-3205.2017.02.010
