经胸超声心动图通过左心房参数评估房颤患者左房淤血状态
2017-03-09王晓霞李芳源刘海波
王晓霞,李芳源,刘海波
北京市通州区中西医结合医院 a.超声科;b.放射科,北京 101100
经胸超声心动图通过左心房参数评估房颤患者左房淤血状态
王晓霞a,李芳源b,刘海波a
北京市通州区中西医结合医院 a.超声科;b.放射科,北京 101100
目的通过经胸超声心动图(Trans-Thoracil Echocardiography,TTE)检测阵发性房颤(Atrial Fibrillation,AF)患者相关参数来评估患者左心耳血流速度(Left Atrial Appendage Flow Velocity,LAA-FV)。方法研究对象为90例非瓣膜阵发性房颤患者,在TTE和经食管超声心动图(TEE)检测期间为窦性心律,评估所有患者超声心动图和临床相关参数。结果LAA-FV(61±23)cm/s和心电图上P波与TTE上二尖瓣血流A波起始时间间隔(PA-TMF,相关系数:−0.33;P<0.001)、左心房内径(LAD,相关系数:−0.32;P<0.001)、组织多普勒超声室间隔a’速度(TDI,相关系数:0.36;P<0.001)、E/e’比值(相关系数:−0.27,P<0.001)、二尖瓣血流E峰速度(相关系数:−0.21,P=0.007)、二尖瓣血流E/A比值(相关系数:−0.17,P=0.04)、CHA2DS2-VASc评分(相关系数:−0.14,P=0.03)和血浆B型钠尿肽(BNP)水平(−0.33,P=0.003)密切相关。多因素分析显示,PA-TMF(标准化回归系数:−0.16;P=0.04)、a’速度(标准化回归系数:0.25,P=0.005)和LAD(标准化回归系数:−0.21;P=0.02)是LAA-FV独立预测因子(多重相关系数:0.43;P<0.001)。结论心房重构相关参数,如降低的a’速度、增加的LAD及PA-TMF期间窦性心律可以预测阵发性AF患者左心房淤血状况。
超声心动图;左心房;房颤;心房相关参数;血流速度
引言
心房颤动(Atrial Fibrillation,AF)是最常见的心律失常,与中风和血栓栓塞事件风险增加有关[1]。多普勒经食管超声心动图(Trans-Esophageal Echocardiography,TEE)检测左心耳血流速度(Left Atrial Appendage Blood Flow Velocity,LAA-FV)已经用于评估左心房淤血的严重程度,其是血栓形成和脑卒中的危险因素[2]。虽然TEE具有高分辨率动态图像,但是存在一定的创伤和低输出量[3]。与TEE相比,经胸超声心动图(Trans-Thoracic Echocardiography,TTE)可通过无创方法评估AF患者LAA-FV。
TTE检测的一些参数已经作为早期心房重构的标志物。其中a’速度可代表左心房收缩功能,降低的a’速度与阵发性AF患者早期心房重构相关[4]。另一项研究表明,阵发性AF患者左心房收缩功能与左心房体积呈负相关[5]。此外,如果心房重构,组织多普勒超声心动图评估的心房传导时间将会延长[6]。因此,Allessie等人提出AF后心房重构的3个正反馈,包括心房传导、收缩和结构重构[7]。然而,目前仍不明确心房相关参数是否与LAA-FV相关。因而,本研究目的是通过TTE检测阵发性AF患者心房相关参数来评估患者LAA-FV。
1 材料和方法
1.1 临床资料
2014年8月~2016年1月在我院就诊的90例非瓣膜阵发性AF患者作为研究对象。入选标准:① 通过心电图明确诊断为阵发性AF患者;② 年龄>18岁;③ 患者进行TEE或TTE检测时为窦性心律。排除标准:① 二尖瓣狭窄患者;② 心脏瓣膜病患者;③ TTE检测时心率>90 bpm患者;④ 肝肾功能异常。所有患者或其家属均签署知情同意书。
1.2 超声心动图检测
采用美国GE公司生产的彩色多普乐超声心动图,TTE探头频率设定为3~5 MHz。常规超声心动图参数来源于TTE B超图像、脉冲多普勒和组织多普勒成像。TTE和TEE多普勒谱扫描速度分别是100 mm/s和66.7 mm/s。通过三尖瓣返流速度峰值估计右心室收缩压,可增加右心房压力。通过TTE上心电图评估P波和TTE上二尖瓣血流A波起始时间间隔,见图1。在TTE分析中,患者处于空腹状态,未服用药物,除使用局麻药物利多卡因。在左房耳通过脉冲式组织超声心动图获得LAA-FV。降主动脉粥样硬化定义如下:0=没有明显的动脉粥样硬化;1+=钙化和斑块厚度<2+;2+=任何合并复合型主动脉斑块存在,或斑块厚度≥4 mm。

图1 二尖瓣血流和左心耳血流速度心动图
1.3 统计学方法
采用SPSS 20.0统计软件进行分析。数据以均数±标准差(±s)表示。采用t检验或简单回归分析LAA-FV相关参数;多元回归分析用于评估LAA-FV的超声心动图相关因素。P<0.05为差异有统计学意义。
2 结果
2.1 患者临床特征
患者临床特征如表1所示,90例非瓣膜性阵发性AF患者,CHADS2和CHA2DS2-VASc评分分别是(0.8±0.7)和(1.6±1.4)。85%患者之前进行抗凝治疗。单一回归分析显示,LAA-FV与高龄(P=0.004)、CHA2DS2-VASc评分(P=0.03)、血浆脑钠肽水平(P=0.003)及低肾小球滤过率(P=0.04)密切相关。此外,LAA-FV在糖尿病[(50±18)cm/s vs (61±23) cm/s]和脑卒中[(42±12)cm/s vs (61±23)cm/s]患者中较低。而在抗凝治疗患者[(61± 23)cm/s vs(49±19)cm/s]中较高。在心电图参数中,P-R间隔与LAA-FV不相关。
2.2 患者超声心动图参数
患者超声心动图参数如表2所示,采用TEE检测,LAA-FV是(61±23)cm/s,与左心房自发性回声和降主动脉动脉粥样硬化程度负相关(P分别为<0.002和0.04),无患者发生左心房栓塞。心电图P波起始和左心耳射血峰值时间间隔与LAA-FV相关(P<0.001)。采用组织多普勒超声心动图检测,LAA-FV与室间隔a’速度正相关(P<0.001);与左心房内径(P<0.001)、E峰速度(P=0.007)、E/A比值(P=0.04)和E/e’比值(P<0.001)负相关。2.3 多因素模型分析

表1 患者的临床特征及其与LAA-FV的关系 [n (%)]

表2 超声心动图参数及其与LAA-FV的关系
多因素模型分析显示,室间隔a’速度(标准化回归系数:0.25,P=0.005)、左心房内径(标准化回归系数:−0.21;P=0.02)和PA-TMF(标准化回归系数:-0.16,P=0.04)是LAA-FV独立预测因子(多重相关系数:0.43;P<0.001)(表3)。TTE检测患者的平均心率是(65±12)bpm,与PATMF不相关。此外,使用抗心律失常药物与PA-TMF持续时间无显著相关。

表3 多因素模型分析与左心耳血流速度相关的因素
2.4 LAA-FV与左心房参数相关性
两个心房之间的几何距离是心房传导的决定因素。左心房内径与PA-TMF正相关,提示几何距离变化是PATMF的关键(P=0.004)。此外,LAA-FV与PA-TMF负相关(P<0.001)。LAA-FV与a’速度、左心房内径和PATMF的相关性,见图2。
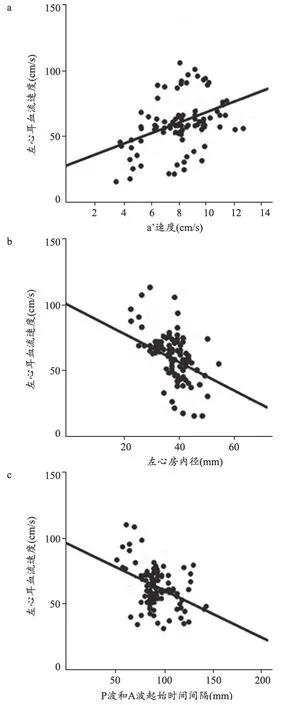
图2 左心耳血流速度(LAA-FV)与a’速度(a)、左心房内径(b)和心电图上P波和TTE上二尖瓣血流A波起始时间间隔(PA-TMF)(c)的相关性。
3 讨论
在AF期间患者心房可发生传导、收缩和结构重构[8]。心房间质纤维化增加可干扰心房传导。以往的研究采用TTE和心电图均证实,进展性系统性硬化患者心房传导时间延长;在这些患者中,心电图上P波起始与二尖瓣血流起始、峰值的时间间隔均延长[9]。在本研究中,阵发性AF患者PA-TMF持续时间与LAA-FV负相关。PA-TMF延长提示左房传导和结构重构,导致心房间传导时间延长,从而可以评估阵发性AF患者LAA-FV。两个心房之间的几何距离可能是决定心房传导时间的重要因素。我们的研究证实,左心房内径与PA-TMF持续时间正相关,提示左心房内径也可以评估阵发性AF患者LAA-FV。Masuda等[10]提出,采用组织多普勒超声心动图检测a’速度降低,可评估阵发性AF患者LAA-FV。也有研究报道,AF期间左心房收缩功能损伤,早期心房重构AF患者心房顿抑更严重[11],可用来解释a’速度降低和左心房淤血之间的联系。我们的研究表明,a’速度也是LAA-FV的一个独立预测因素。a’速度、左心房内径和PA-TMF评估LAA-FV的标准化回归系数较低,分别是0.25、-0.21和-0.16。然而,通过结合这些参数,可表示左心房重构,其中LAA-FV更准确评估。
此前采用不同TTE方法评估AF患者缺血性脑卒中风险[12]。Tamura等[12]采用TTE发现左心耳壁速度降低,而且与脑血管事件风险增加有关。与其他研究相比,本研究最大的特点是a’速度、左心房内径和PA-TMF较容易测得。CHADS2和CHA2DS2-VASc评分用于非瓣膜性AF患者脑卒中风险的量化,因此,抗血栓是必要的治疗[13-14]。最近的指南推荐,即使CHA2DS2-VASc评分低于1的低风险患者,也要进行抗血栓治疗[15]。研究发现,LAA-FV和左心房血栓形成存在密切的联系[16]。在本研究中,采用TEE检测的LAA-FV与CHA2DS2-VASc评分密切相关。然而,我们研究中,3例患者LAA-FV较低,但CHA2DS2-VASc评分为0。TEE结果表明,LAA-FV与缺血性脑卒中的相关性高于非瓣膜性AF患者CHA2DS2-VASc评分[17]。因此,我们仍然需要评估患者左房淤血状况,即使患者是低临床风险评分。然而,TEE具有创伤性,且不容易操作,一些临床疾病也不允许进行TEE检查。因此,a’速度降低、左心房内径增加和PA-TMF结合可替代LAA-FV。采用TTE检测更容易获得这些参数,并提供左房血栓形成风险评估。然而,这些TTE参数与临床血栓栓塞事件的关联仍不确定,因为在本研究中无AF患者发生血栓栓塞。需要通过长时间随访来解决这个问题。
总之,本研究表明,a’速度降低,左心房内径增加,PA-TMF期间窦性心律,可以预测非瓣膜阵发性AF患者左心房淤血。
[1] 李华珍,王红.房颤患者血浆D-二聚体水平与心血管事件关系观察[J].人民军医,2012,1(1):25-26.
[2] Kim MN,Lee JJ,Kim SA,et al.The difference of predictors for recurrence after catheter ablation of non-paroxysmal atrial fibrillation according to follow-up period[J].Int Heart J,2014,55(4):312-318.
[3] 费洪文,何亚乐,廖洪涛,等.经食管脉冲组织多普勒评价阵发性房颤患者的左心耳功能[J].中国临床医学影像杂志,2008,19(10): 708-710.
[4] Khankirawatana B,Khankirawatana S,Peterson B,et al.Peak atrial systolic mitral annular velocity by Doppler tissue reliably predicts left atrial systolic function[J].J Am Soc Echocardio,2004,17(4):353-360.
[5] Toh N,Kanzaki H,Nakatani S,et al.Left atrial volume combined with atrial pump function identifies hypertensive patients with a history of paroxysmal atrial fibrillation[J].Hypertension, 2010,55(5):1150-1156.
[6] Muller P,Hars C,Schiedat F,et al.Correlation between total atrial conduction time estimated via tissue Doppler imaging(PATDI Interval),structural atrial remodeling and new-onset of atrial fibrillation after cardiac surgery[J].J Cardio Electro, 2013,24(6):626-631.
[7] Allessie M,Ausma J,Schotten U.Electrical,contractile and structural remodeling during atrial fibrillation[J].Cardio Res, 2002,54(2):230-246.
[8] Yoshizawa T,Niwano S,Niwano H,et al.Prediction of new onset atrial fibrillation through P wave analysis in 12 lead ECG[J].Int Heart J,2014,55(5):422-427.
[9] Mizuno R,Fujimoto S,Nakano H,et al.Atrial conduction abnormalities in patients with systemic progressive sclerosis[J]. Eur Heart J,1997,18(12):1995-2001.
[10] Masuda M,Iwakura K,Inoue K,et al.Estimation of left atrial blood stasis using diastolic late mitral annular velocity[J].Eur Heart J Cardio Imaging,2013,14(8):752-757.
[11] Khan IA.Atrial stunning: determinants and cellular mechanisms[J]. Am Heart J,2003,145(5):787-794.
[12] Tamura H,Watanabe T,Nishiyama S,et al.Prognostic value of low left atrial appendage wall velocity in patients with ischemic stroke and atrial fibrillation[J].J Am Soc Echocardio, 2012,25(5):576-583.
[13] Anderson JL,Halperin JL,Albert NM,et al.Management of patients with atrial fibrillation(compilation of 2006 ACCF/AHA/ESC and 2011 ACCF/AHA/HRS recommendations): a report of the American College of Cardiology/American Heart Association Task Force onpractice guidelines[J].J AM Coll Cardiol,2013,61(18):1935-1944.
[14] Komatsu T,Sato Y,Ozawa M,et al.Comparison between CHADS2 and CHA2DS2-VASc score for risk stratification of ischemic stroke in Japanese patients with non-valvular paroxysmal atrial fibrillation not receiving anticoagulant therapy[J].Int Heart J,2014,55(2):119-125.
[15] Camm AJ,Lip GY,De Caterina R,et al.2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association[J].Eur Heart J,2012,33(21):2719-2747.
[16] Mugge A,Kuhn H,Nikutta P,et al.Assessment of left atrial appendage function by biplane transesophageal echocardiography in patients with nonrheumatic atrial fibrillation: identification of a subgroup of patients at increased embolic risk[J].J Am Coll Cardiol,1994,23(3):599-607.
[17] Takashima S,Nakagawa K,Hirai T,et al.Transesophageal ec ho cardiographic findings are independent and relevant predictors of ischemic stroke in patients with nonvalvular atrial fibrillation[J].J Clin Neurol,2012,8(3):170-176.
本文编辑 聂孝楠
Trans-Thoracic Echocardiographic Assessment of Left Atrial Blood St a sis in Atrial Fibrillation Patients by Clinical Parameters of Left Atrial Remodeling
WANG Xiao-xiaa, LI Fang-yuanb, LIU Hai-boa
a. Department of Ultrasonography; b. Department of Radiology, Beijing Tongzhou District Hospital of Integrated Traditional Chinese and Western Medicine, Beijing 101100, China
ObjectiveTo estimate the left atrial appendage flow velocity (LAA-FV) with clinical parameters, which were noninvasively detected in patients with paroxysmal atrial fibrillation (AF) via trans-thoracic echocardiography (TTE).MethodsTrans-esophageal echocardiography (TEE) and TTE examinations were simultaneously performed in 90 cases of patients with non-valvular paroxysmal AF during the period of showing sinus rhythm, thereby to assess the obtained echocardiography and clinical parameters.ResultsLAA-FV (61±23) cm/s was significantly correlated with the time interval between the initiation of P-wave on electrocardiogram (ECG) and that of A-wave of transmitral fow on TTE (PATMF, r=−0.33, P<0.001), left atrial diameter (LAD, r=−0.32, P<0.001), ventricular septal a’ velocity via tissue Doppler imaging (TDI, r=0.36, P<0.001), E/e’ratio (r=−0.27, P<0.001), E velocity of transmitral flow (r=−0.21, P=0.007), E/A ratio of transmitral flow (r=−0.17, P=0.04), CHA2DS2-VASc score (r=−0.14, P=0.03) and plasma B-type natriuretic peptide (BNP) level (r=−0.33, P=0.003). Multivariate analysis revealed that PA-TMF (standardized regression coefficient γ=−0.16, P=0.04), a’velocity (γ=0.25, P=0.005) and LAD (γ=−0.21, P=0.02) were independent predictors of LAA-FV (multiple correlation coefficient R=0.43; P<0.001).ConclusionClinical parameters of atrial remodeling, such as decreased a’velocity, increased LAD and PA-TMF under sinus rhythm, could be regarded as useful predictors of left atrial blood stasis in patients with non-valvular paroxysmal AF.
echocardiography; left atrial; atrial fibrillation; relative atrial parameters; velocity of blood flow
R445.1
A
10.3969/j.issn.1674-1633.2017.02.010
1674-1633(2017)02-0038-05
2016-06-04
作者邮箱:pzf181@126.com
