干细胞对环孢素肾病大鼠肾组织转化生长因子β1的影响
2017-03-09张勇张巍张剑平卓文利吴卫真谭建明
张勇张巍张剑平卓文利吴卫真谭建明
·论著·
干细胞对环孢素肾病大鼠肾组织转化生长因子β1的影响
张勇1张巍2张剑平2卓文利2吴卫真2谭建明2
目的 观察干细胞治疗技术对环孢素肾病大鼠肾组织转化生长因子β1(TGF-β1)的影响。方法 实验大鼠分成3组,每组10只大鼠:C组:正常对照组;H组:模型组;B组:骨髓间充质干细胞治疗组。28 d处死大鼠切取肾脏,免疫组织化学染色、RT-PCR、Western blot测定肾组织TGF-β1、α-平滑肌肌动蛋白(α-SMA)的表达水平。采用单因素方差分析比较各组数据。结果 (1)免疫组织化学染色结果显示:与C组比较,H组、B组TGF-β1(0.899±0.046 vs 9.524±1.232,6.437±0.728;P < 0.01)、α-SMA(2.427±0.188 vs 11.912±2.610,9.232±2.268;P < 0.01)表达水平均显著升高,差异具有统计学意义。与H组比较,B组大鼠的TGF-β1(9.524±1.232 vs 6.437±0.728;P < 0.01)、α-SMA(11.912±2.610 vs 9.232±2.268;P < 0.01)表达水平显著下降,差异具有统计学意义;(2)RT-PCR结果显示:与C组比较,H组、B组TGF-β1(0.119±0.003 vs 0.826±0.004,0.651±0.004;P < 0.01)、α-SMA(0.370±0.006 vs 0.900±0.007,0.642±0.007;P < 0.01)mRNA水平均显著升高,差异具有统计学意义(P < 0.05)。与H组比较,B组大鼠的TGF-β1(0.826±0.004 vs 0.651±0.004;P < 0.01)、α-SMA(0.900±0.007 vs 0.642±0.007;P < 0.01)mRNA水平显著下降,差异具有统计学意义;(3)Western blot结果显示:与C组比较,H组、B组TGF-β1(0.218±0.004 vs 0.825±0.003,0.650±0.006;P < 0.01)、α-SMA(0.263±0.003 vs 0.841±0.003,0.615±0.003;P < 0.01)蛋白水平均显著升高,差异具有统计学意义。与H组比较,B组大鼠的TGF-β1(0.825±0.003 vs 0.650±0.006;P < 0.01)、α-SMA(0.841±0.003 vs 0.615±0.003;P < 0.01)蛋白水平显著下降,差异具有统计学意义。结论 骨髓间充质干细胞治疗可以下调环孢素肾病大鼠肾组织TGF-β1表达水平,减少α-SMA表达水平,从而改善大鼠肾间质纤维化程度。
亲环素类; 肾病; 骨髓; 间质干细胞; 转化生长因子β1
环孢素是临床上常见的钙调磷酸酶抑制剂,常用于器官移植、难治性肾病和自身免疫系统疾病的治疗,多年使用中人们发现环孢素可以导致肾脏损害,其主要病理特征是缺血、间质纤维化和炎性细胞浸润,根据这一特点实验研究中,人们通常认为应用大剂量环孢素来制造慢性肾衰模型。在笔者的既往研究中应用干细胞治疗技术干预环孢素肾病大鼠,发现经过干细胞干预的环孢素肾病大鼠,肾功能进展情况明显放缓,病理检查也发现干预组大鼠的肾间质纤维化程度也明显减轻,治疗观察期内也未发生大鼠死亡及其他脏器损伤[1]。干细胞对慢性肾病模型良好的治疗效果。也使得笔者更加想了解干细胞治疗慢性环孢素肾病大鼠的机制,根据既往文献报道,以及肾间质纤维化程度改善的作用特点,利用既往研究环孢素肾病模型的肾组织标本,同时筛选出转化生长因子β1(transforming growth factor β1,TGF-β1)和α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)两个细胞因子作为检测因子。其中TGF-β1是目前公认的肾脏致纤维化因子,其高表达在慢性环孢素肾病的发生发展中有着重要作用,是导致慢性环孢素肾病进展的重要因素[2];α-SMA也是间质纤维化发生的重要细胞因子,其表达量可以一定量的反映纤维化程度。通过检测环孢素肾病大鼠肾组织TGF-β1、α-SMA表达水平,初步探索骨髓间充质干细胞治疗环孢素肾病的可能机制。
材料与方法
一、主要试剂及仪器
兔抗鼠TGF-β1抗体(美国Abcam公司),兔抗鼠α-SMA抗体(美国Santa cruz公司),HRP标记羊抗兔二抗试剂盒(中杉公司),RT-PCR试剂盒(Takara公司),LAS 4000凝胶成像仪(日本富士公司)。
二、方法
(一)大鼠骨髓间充质干细胞的制备和鉴定
4周龄雄性SD大鼠,体质量60~80 g,采用卓文利等[3]报道的方法分离纯化骨髓间充质干细胞,同时完成成骨、成脂诱导鉴定,流式细胞仪检测细胞表面抗原CD34-CD45的表达吸收峰0.9﹪,而CD90表达吸收峰分别为94.5﹪,符合骨髓间充质干细胞要求[1]。
(二)实验动物分组和干预方法
SPF级健康雄性SD大鼠30只(150~180 g),购自福建医科大学实验动物中心。置于福州总医院比较医学中心饲养,给予低盐饲料[4](SPF级,购自广东省实验动物中心,钠质量分数0.042﹪),随机分3组:正常对照组(n = 10,C组)、环孢素组(n = 10,H组)、骨髓间充质干细胞组(n = 10,B组)。
模型制备:使用橄榄油溶解环孢素(诺华制药提供),大鼠按25 mg/kg·d-1灌胃法给模型组及干细胞组注入环孢素,对照组灌入等量橄榄油;干细胞治疗组分别于第7、21天通过尾静脉注入1 ml干细胞悬液,浓度1.0×106个/ml,其余各组注入等量生理盐水,所有大鼠均于第28天颈椎脱臼法处死切取肾脏分别做免疫组化、RT-PCR及Western blot 检测。
(三)实验大鼠相关指标测定
1.免疫组织化学染色观察TGF-β1、α-SMA表达:肾组织经石蜡包埋切片、烤片后,常规二甲苯、梯度酒精脱蜡至水。采用链霉菌抗生物素蛋白-过氧化物酶连结法(streptavidin-perosidase,SP)进行。抗体孵育前切片经微波修复,操作按说明书进行;最后用3,3'-二氨基联苯二胺盐酸盐显色。采用AMS病理图文分析系统进行半定量分析并进行统计学计算。
2. RT-PCR观察肾脏TGF-β1、α-SMA的mRNA表达:取100 mg冻存肾脏组织加液氮研磨均匀后,加入TRIzol RNA提取液,按说明书步骤提取,测定RNA浓度,按RT-PCR试剂盒操作顺序进行RT及PCR反应,选取β-actin做内参,反应结束取PCR产物各8 μl,加入上样缓冲液2 μl混匀,1.0﹪的琼脂糖凝胶电泳、凝胶成像系统扫描分析。
3.Western blot观察肾脏TGF-β1、α-SMA的蛋白表达:取适量新鲜冰冻组织块放置于匀浆器中,用眼科剪将组织块剪成小块状。加入300 μl含PMSF RIPA裂解液裂解后置于匀浆器中进行匀浆,以上步骤反复数次直至组织完全裂解;Bradford法测定蛋白含量。通过计算各样本取总量50 μg总蛋白,加入适量上样缓冲液,变性、电泳、转膜,免疫反应、化学发光显影,凝胶图象处理系统调整自动曝光直接读取图片并分析目标带净光密度值。
三、统计学分析方法
采用SAS8.1进行统计学处理,TGF-β1、α-SMA的免疫组织化学半定量数据、mRNA水平、蛋白表达水平均采用± s表示。组间差异采用单因素方差分析,以P < 0.05为差异有统计学意义。
结 果
一、肾组织病变情况
光镜下,正常组大鼠肾脏结构正常,模型组及干细胞治疗组大鼠均可见到不同程度小管萎缩空泡变性、间质纤维化增生、炎性细胞浸润、肾内小动脉壁增厚及动脉透明样变性,肾小球局灶性硬化等典型的环孢素肾病特点,但是干预组病变程度较模型组病变程度轻(图1)。
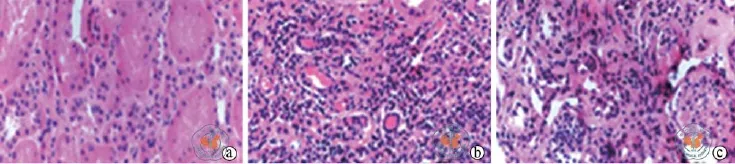
图1 光学显微镜下观察各组大鼠肾组织(HE染色,×400)
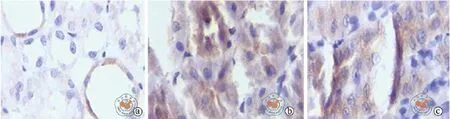
图2 光学显微镜下观察TGF-β1免疫组织化学染色(DAB染色,×400)
二、免疫组织化学染色结果
与C组比较,H组、B组TGF-β1(0.899±0.046 vs 9.524±1.232,6.437±0.728;P < 0.01)、α-SMA(2.427±0.188 vs 11.912±2.610,9.232±2.268;P < 0.01)表达水平均显著升高,差异具有统计学意义。与H组比较,B组大鼠的TGF-β1(9.524±1.232vs 6.437±0.728;P < 0.01)、α-SMA(11.912±2.610 vs 9.232±2.268;P < 0.01)表达水平显著下降,差异具有统计学意义(图2,3)。

图3 光学显微镜下观察α-SMA免疫组织化学染色(DAB染色,×400)
三、RT-PCR检测结果
与C组比较,H组、B组TGF-β1(0.119±0.003 vs 0.826±0.004,0.651±0.004;P < 0.01)、α-SMA(0.370±0.006 vs 0.900±0.007,0.642±0.007;P < 0.01)mRNA水平均显著升高,差异具有统计学意义(P < 0.05)。与H组比较,B组大鼠的TGF-β1(0.826±0.004 vs 0.651±0.004;P < 0.01)、α-SMA(0.900±0.007 vs 0.642±0.007;P < 0.01)mRNA水平显著下降,差异具有统计学意义(图4)。

图4 RT-PCR结果
四、Western blot检测结果
与C组比较,H组、B组TGF-β1(0.218±0.004 vs 0.825±0.003,0.650±0.006;P < 0.01)、α-SMA(0.263±0.003 vs 0.841±0.003,0.615±0.003;P < 0.01)蛋白水平均显著升高,差异具有统计学意义。与H组比较,B组大鼠的TGF-β1(0.825±0.003 vs 0.650±0.006;P < 0.01)、α-SMA(0.841±0.003 vs 0.615±0.003;P < 0.01)蛋白水平显著下降,差异具有统计学意义(图5)。
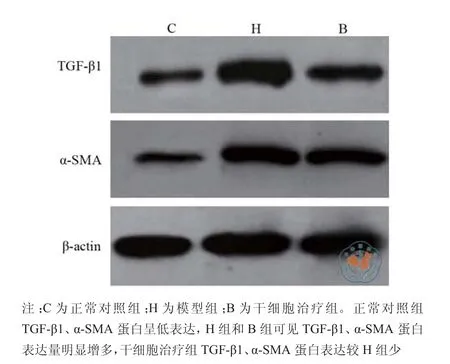
图5 Western blot 结果
讨 论
慢性肾脏疾病是影响人类健康的重要疾病,根据中华医学会肾脏病学分会的统计[5],我国约有1.2亿肾脏患者,每年都有大量的肾病患者进展到终末期肾病(ESRD),虽然肾脏替代治疗可以有效延长生命改善生活质量,但是昂贵的医疗支出也成为各国政府和患者家庭沉重的负担[6]。干细胞技术是近年来研究的热点之一,其潜在的细胞分化和组织修复能力、免疫调节能力都使得人们对其充满期待[7]。慢性环孢素肾病模型是良好的肾间质纤维化和慢性肾衰模型之一。
在笔者的既往研究中,发现使用骨髓间充质干细胞可以有效延缓环孢素肾病的进展,大鼠肾功能进展速度放缓[1],病理肾组织切片上也发现肾组织的间质纤维化程度是明显减轻的。这说明干细胞治疗对于慢性环孢素肾病的进展是有作用的。
关于干细胞是如何改善肾功能、减轻环孢素肾病疾病进展的可能机制,笔者删选并检测了部分细胞因子的表达水平。其中TGF-β1是目前公认的最重要的致肝纤维化因子之一,其高表达已被证实在慢性环孢素肾病的发生发展中有着重要作用,是导致慢性环孢素肾病进展的重要因素;在本研究中发现模型组大鼠的肾组织TGF-β1的表达水平较正常对照组是明显升高的,这与Dell等[2]的研究报道是一致的。同时,在给予干细胞治疗后,发现无论是在免疫组织化学染色、RNA转录水平 、蛋白表达水平上TGF-β1表达量都是显著下降的,说明骨髓间充质干细胞可以通过下调TGF-β1表达从而延缓环孢素肾病进展。
与此同时,笔者也注意到α-SMA的表达与TGF-β1表达改变是一致的,α-SMA是成纤维细胞重要的细胞表面因子之一,其高表达是小管间质纤维化的重要特征之一[8],其表达水平可以反映肾间质纤维化程度。既往研究已经发现环孢素肾病大鼠的α-SMA表达水平是明显升高的[4,9],这一点在本研究中也得到了证实,同时发现使用骨髓间充质干细胞治疗之后α-SMA表达水平是明显下降的,这与笔者前一阶段研究中发现的肾间质纤维化评分改善是一致的[1],也说明在TGF-β1表达下调后环孢素肾病大鼠的肾间质纤维化程度也是好转的。
通过本研究发现干细胞治疗可以影响TGF-β1、α-SMA的表达,同时改善肾组织病变情况,完善了骨髓间充质干细胞治疗环孢素肾病的机制研究,但是干细胞是如何影响这些细胞因子的表达水平,其信号转导通路具体如何目前尚未清楚,还需要进一步的研究去证实。
1 张勇, 张巍, 张剑平, 等. 骨髓间充质干细胞对慢性环孢素肾病大鼠的治疗作用[J/CD]. 中华细胞与干细胞杂志(电子版), 2016, 6(3):135-140.
2 Dell K, Böhler T, Gaedeke J, et al. Impact of PGE1 on cyclosporine A induced up-regulation of TGF-betal,its receptors,and related matrix production in cultured mesangial cells[J]. Cytokine, 2003, 22(6):189-193.
3 卓文利, 付云烽, 徐廷昭, 等. 大鼠骨髓间充质干细胞的分离培养纯化及生物学特性的鉴定[J]. 医学临床研究, 2009, 26(3):386-389.
4 Naesens M, Kuypers DR, Sarwal M. Calcineurin inhibitor nephrotoxicity[J]. Clin J Am Soc Nephrol, 2009, 4(2):481-508.
5 Liu, ZH. Nephrology in China[J]. Nat Rev Nephrol, 2013, 9(9):523-528.
6 United States Renal Data System. Annual data report[Z] , 2015 .
7 Castiglione RC, Maron-Gutierrez T, Barbosa CM, et al. Bone marrowderived mononuclear cells promote improvement in glomerular function in rats with early diabetic nephropathy[J]. Cell Physiol Biochem, 2013, 32(3):699-718.
8 Li C, Lim SW, Sun BK, et al. Expression of apoptosis-related factors in chronic cyclosporine nephrotoxicity after cyclosporine withdrawal[J]. Acta Pharmacol Sin, 2004, 25(4):401-411.
9 Issa N, Kukla A, Ibrahim HN. Calcineurin inhibitor nephrotoxicity: a review and perspective of the evidence[J]. Am J Nephrol, 2013,
张勇,张巍,张剑平,等. 干细胞对环孢素肾病大鼠肾组织转化生长因子β1的影响[J/CD].中华细胞与干细胞杂志(电子版), 2017, 7(1):18-22.
Effect of mesenchymal stem cells on transforming growth factor-β1 in renal tissue of chronic cyclosporine nephropathy in rats
Zhang Yong, Zhang Wei, Zhang Jianping, Zhuo W enli, Wu Weizhen, Tan Jianming.1the Second Military Medical University, Shanghai 200433, China;2Department of Urology, Fuzhou General Hospital of Nanjing Military Command, Fuzhou 350025, China
Tan Jianming, Email:tanjim156@xmu.Edu.cn
ObjectivesTo investigate the effect of mesenchymal stem cells on transforming growth factor-β1 in the renal tissue of rats with chronic cyclosporine nephropathy.MethodsThe experimental animals were divided into 3 groups: Group C: normal group(control); Group H: chronic cyclosporine nephropathy group; Group B: mesenchymal stem cells therapy group. On day 28 kidney tissue was evaluated for the expression levels of TGF-β1 and α-SMA by immunohistochemistry, RT-PCR, and Western blot.Results(1)Immunohistochemistry results: Compared with group C, TGF-β1(0.899±0.046 vs 9.524±1.232, 6.437±0.728; P < 0.01), α-SMA(0.370±0.006 vs 0.900±0.007, 0.642±0.007; P < 0.01)in model group and group Bare significantly increased. Compared with group H, expression levels of the above proteins in the groups B decreased(TGF-β1: 9.524±1.232 vs 6.437±0.728; P < 0.01; α-SMA:11.912±2.610 vs 9.232±2.268, P < 0.01).(2)RT-PCR results: Compared with group C, TGF-β1(0.119±0.003 vs 0.826±0.004, 0.651±0.004; P < 0.01), α-SMA(0.370±0.006 vs 0.900±0.007, 0.642±0.007; P < 0.01)in group H and group B are significantly increased. Compared with group H, expression levels of the above proteins in groups B decreased(TGF-β1: 0.826±0.004 vs 0.651±0.004; P < 0.01; α-SMA: 0.900±0.007 vs 0.642±0.007; P < 0.01);(3)Western blot results: Compared with group C, TGF-β1(0.218±0.004 vs 0.825±0.003, 0.650±0.006; P < 0.01), α-SMA(0.370±0.006 vs 0.900±0.007, 0.642±0.007; P < 0.01)in model group and group B significantly increased. Compared with group H, expression levels of the above proteins decreased in group B(TGF-β1: 0.825±0.003 vs 0.650±0.006; P < 0.01; 0.841±0.003 vs 0.615±0.003; P < 0.01).ConclusionBone mesenchymal stem cells can mitigate renal interstitial fibrosis by decreasing the expression of TGF-β1 and α-SMA.
Cyclophilins; Kidney diseases; Bone marrow; Mesenchymal stem cells; Chronic cyclosporine nephropathy; Transforming growth factor β1
10.3877/cma.j.issn.2095-1221.2017.01.004
福建省重大专项课题(2012YZ0001)
200433 上海,第二军医大学1;350025 福州,南京军区福州总医院泌尿外科2
谭建明,Email:tanjim156@xmu.Edu.cn
