盐霉素与三氧化二砷对肾癌KCC853细胞生物学行为的影响
2017-03-09周明澍王珊珊袁守军王毅
周明澍王珊珊袁守军王毅
·论著·
盐霉素与三氧化二砷对肾癌KCC853细胞生物学行为的影响
周明澍1王珊珊2袁守军2王毅1
目的 研究盐霉素(Sal)与三氧化二砷(As2O3)体外对人肾癌KCC853细胞生物学行为的影响。方法 采用MTT法检测单药及联合用药对KCC853细胞株的抑制效应;运用集落实验检测两种药物对细胞菌落增殖的影响;利用细胞划痕试验观察两种药物对细胞迁移的影响;利用Hoechst33258染色法观察单药及联合用药对KCC853细胞凋亡的形态变化。采用方差分析及F检验进行统计学分析。结果 Sal与As2O3在体外对KCC853细胞的增殖具有抑制作用,不同浓度(0.16、0.8、4、20、100 μg/ml)的Sal对KCC853细胞的抑制率分别为:6.9﹪、10.8﹪、19.4﹪、58.5﹪、96.0﹪;不同浓度(0.008、0.04、0.2、1、5 μg/ml)的As2O3对KCC853细胞的抑制率分别为:7.0﹪、7.7﹪、15.0﹪、48.4﹪、86.6﹪;联合用药组对KCC853细胞的抑制率分别为:18.9﹪、21.4﹪、40.4﹪、54.7﹪、95.8﹪。表现出一定的浓度依赖性,P < 0.05。在细胞集落抑制实验中,Sal对KCC853细胞集落的制率为:37.23﹪;As2O3对KCC853细胞集落的制率为:43.83﹪;联合用药组与Sal、As2O3单药组相比效果更显著,其抑制率达到57.5﹪,P < 0.01。进一步研究发现:Sal与As2O3能有效抑制KCC853细胞的迁移能力。结论 低剂量的盐霉素与As2O3能有效地抑制KCC853细胞的生长和迁移,并能促进其凋亡。
盐霉素; 三氧化二砷; 生物学; 肾肿瘤
肾癌是泌尿系常见的恶性肿瘤,严重威胁着人类生命健康,其发病率占泌尿系肿瘤的第二位[1]。肾癌对传统的放、化疗均不敏感,早期肾癌经手术治疗常能达到满意的效果,进展期肾癌已失去手术指征,常采用分子靶向药物和免疫疗法等非手术治疗为主。因此,探索新型的抗肿瘤药物应用于肾癌显得十分紧迫。
盐霉素(salinomycin,Sal)作为一种新型的抗肿瘤干细胞药物,已成为新药研发的一大热点。文献[2]报道:Sal能有效杀伤乳腺癌干细胞,其活性是紫杉醇的100倍,且对肝癌[3]、乳腺癌[2]、胰腺癌[4]和膀胱癌[5]等多种实体肿瘤都有抑制作用。三氧化二砷(As2O3)是一种广谱的抗肿瘤药物,已广泛应用于白血病的治疗。研究[6-8]发现:As2O3对肾癌、乳腺癌和胰腺癌等多种实体肿瘤均具有抑制效应。本实验将初步探讨Sal与As2O3对人肾癌细胞株KCC853的生物学行为的影响,为今后进一步的研究和体内动物实验提供参考。
材料与方法
一、材料
1.肿瘤细胞株:人肾癌KCC853细胞株为本实验室传代培养,购自北京协和细胞资源中心。KCC853细胞用含10﹪胎牛血清的RPMI1640培养基培养,置于37℃恒温、5﹪ CO2的培养箱中培养。每2~3 d用0.25﹪的胰蛋白酶对处于对数生长期的细胞进行消化、传代。
2.药物与试剂:盐霉素标准品(山东鲁抗医药集团);三氧化二砷[北京双鹭药业股份有限公司产品(批号:20131003)];0.25﹪胰蛋白酶、二甲基亚砜、四氮唑蓝(methyl thiazolyl tetrazolium,MTT)(美国Sigma-Aldrich公司);培养液RPMI1640(美国Gibco BRL公司);新生胎牛血清(美国PAA公司);Hoechst33258染液(上海碧云天生物技术公司)。瑞氏-姬姆萨染色液(珠海贝索生物技术有限公司)。
3.主要仪器:BP121S分析天平(德国Sartorius公司);倒置显微镜(重庆重光仪器公司);CO2培养箱(上海力申科学仪器有限公司);涡旋震荡仪(德国Eppendorf公司);777-7A超净工作台(北京长城空气净化工程公司);荧光显微镜(美国Etaluma公司);酶标仪(芬兰Thermo公司)。
二、方法
1. MTT比色法检测药物效应:将对数生长期的KCC853细胞消化、离心、重悬后,计数,以每孔5 000个细胞数种于96孔板内,待细胞过夜贴壁后,加入含有不同药物浓度的培养基[Sal单药浓度 为0.0064,0.032,0.16,0.8,4,20,100,500 μg/ml,As2O3单药浓度为0.00032,0.0016,0.008,0.04,0.2,1,5,25 μg/ml,联合用药浓度为(0.16 + 0.008),(0.8 + 0.04),(4 + 0.2),(20 + 1),(100 + 5)μg/ml],置入培养箱中培养72 h后每孔加入0.5 mg/ml的MTT 100 μl,继续培养4 h,弃上清液,每孔加入200 μl 二甲基亚砜,震荡10 min后,使用酶标仪测定570 nm处的吸光度值。实验设试剂对照组、肿瘤细胞对照组和药物实验组,每种情况设3个平行孔,实验重复3次,取平均值。根据实验结果计算肿瘤细胞生长的抑制率(抑制率=1-实验组平均OD570/对照组平均OD570)和半效抑制浓度(IC50)。
2.显微镜下观察细胞形态变化:取对数生长期的KCC853细胞消化、离心、重悬后,计数,以每孔(2~3)×105个细胞种于6孔板内,置于37℃、5﹪CO2培养箱中培养24 h后,分别加入Sal 15 μg/ml、As2O31 μg/ml、Sal + As2O3[(15 + 1)μg/ml]暴露48 h,然后在显微镜下拍照观察。实验设对照组、Sal组、As2O3组和联合用药组。
3.细胞集落实验:取对数生长期的KCC853细胞消化、离心,计数,调节细胞浓度以每孔100~200个细胞数种于6孔板内,轻轻晃动6孔板,使细胞分散均匀。置培养箱中孵育1周左右,终止培养,弃上清液,PBS清洗2次,空气干燥。甲醛固定15 min,弃甲醛后,空气干燥。用姬姆萨染液染色10 min后,流水缓慢清洗染色液,空气干燥,最后显微镜下观察,计算集落抑制率。实验设对照组、Sal 4 μg/ml组、As2O30.2 μg/ml组和联合用药组,实验重复3次,取平均值。集落抑制率=[1-(实验组集落形成率/对照组集落形成率)]×100﹪。
4.细胞划痕实验:取对数生长期的KCC853细胞,消化、离心后计数,以每孔(3~5)×105个细胞种于6孔板内,置于培养箱中培养。待细胞在培养板内贴壁长满后,移弃原培养基,PBS清洗1次。然后用20 μl灭菌枪头垂直于培养板在细胞上划“一”字线,用PBS清洗2次,去除划掉的细胞碎片,加入含有Sal和As2O3的无血清的1640培养基,在显微镜下观察拍照,然后置入37℃、5﹪CO2培养箱中继续培养24 h,再次在显微镜下观察拍照。实验设对照组、Sal 15 μg/ml组、As2O31 μg/ml组和联合用药组。
5. Hoechst33258染色观察细胞凋亡形态:将对数生长期的KCC853细胞消化、离心重悬后,以每孔(2~3)×105个细胞种于6孔板内,置培养箱中培养24 h后,Sal(15 μg/ml)、As2O3(1 μg/ml)、Sal+ As2O3[(15 + 1)μg/ml]分别暴露于KCC853细胞48 h后,弃上清液,用PBS清洗2次,加入0.5 ml 4﹪的多聚甲醛固定10 min。吸去固定液,PBS清洗2次,每孔加入10 μg/ml Hoechst33258染色液1 ml,染色15 min后,使用PBS清洗2次,在荧光显微镜下拍照观察。
三、统计学分析方法
运用SPSS 17.0统计软件进行统计分析,细胞集落实验数据以±s表示,并采用F检验,以P < 0.05为差异有统计学意义。
结 果
一、Sal与As2O3对KCC853细胞增殖的影响
体外MTT实验结果表明,KCC853细胞在不同浓度Sal(0.16,0.8,4,20,100 μg/ml)中暴露72 h后,其细胞生长的抑制率分别为:6.9﹪、10.8﹪、19.4﹪、58.5﹪和96.0﹪,IC50值为19.44 μg/ml(图1),不同浓度的As2O3(0.008,0.04,0.2,1,5 μg/ml)对KCC853细胞的抑制率分别为:7.0﹪、7.7﹪、15.0﹪、48.4﹪和86.6﹪,IC50值为1.13 μg/ml(图2),两种药物联合应用的效应(图3和表1)。由此可知,Sal与As2O3对KCC853细胞的增殖具有良好的抑制效应。

图1 Sal对KCC853细胞增殖的抑制作用
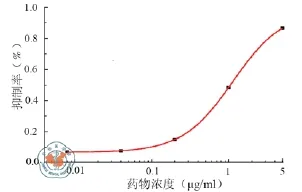
图2 As2O3对KCC853细胞增殖的抑制作用

图3 Sal联合As2O3对KCC853细胞的生长抑制作用
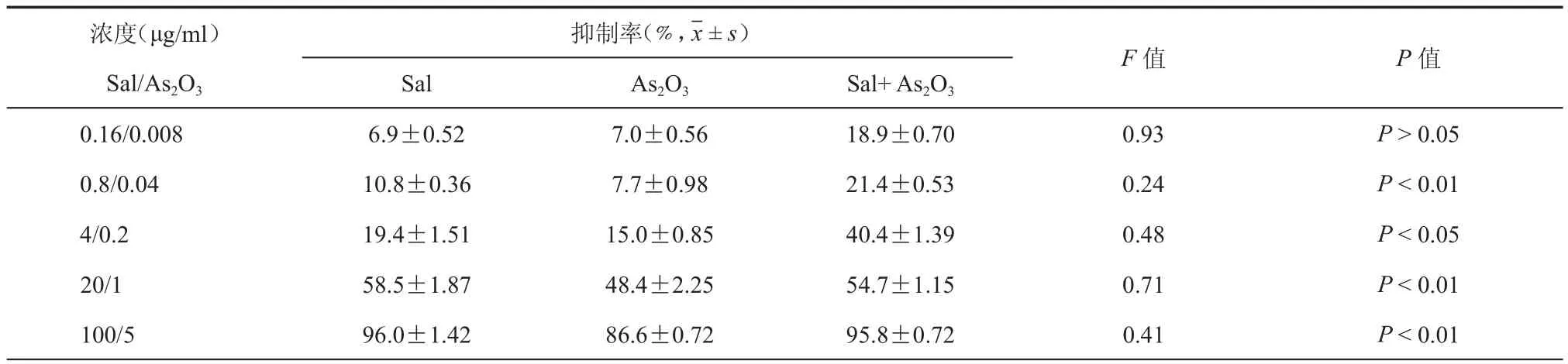
表1 不同浓度Sal与As2O3对KCC853细胞增殖的抑制结果
二、KCC853细胞的形态变化
采用单药剂量IC50左右的浓度,即Sal 15 μg/ml、As2O31 μg/ml和Sal+ As2O3[(15 +1)μg/ml],通过显微镜从形态学角度观察单药及联合用药作用48 h后细胞的形态变化(图4),实验发现,空白对照组中KCC853细胞呈多边形生长,细胞形态规则,生长旺盛,边界清楚,未出现明显的细胞凋亡。各用药组细胞数量稀少,有不同程度的细胞死亡,细胞皱缩、漂浮、变圆甚至破裂成小碎片,联合用药组比单药组效果更明显。

图4 倒置显微镜下观察Sal与As2O3对KCC853细胞形态的影响 (×10)

图5 倒置显微镜下观察Sal与As2O3对KCC853细胞迁移的影响 (×10)
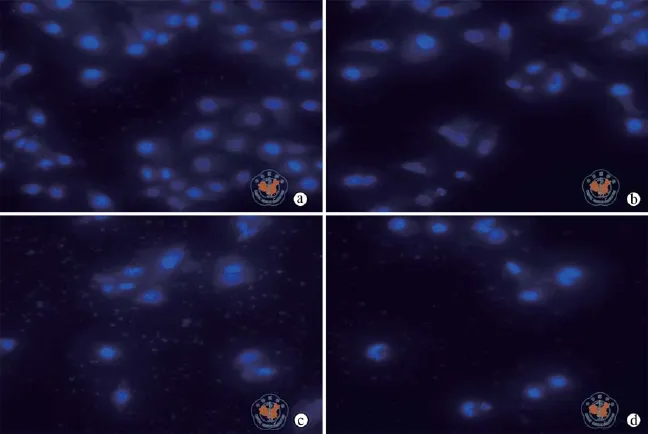
图6 荧光显微镜下观察KCC853细胞凋亡的形态变化(Hoechst33258染色,×40)
三、细胞集落抑制实验
实验结果发现,低剂量的Sal与As2O3能显著地抑制KCC853细胞集落的形成,其抑制率分别为:37.23﹪、43.83﹪;联合用药组与Sal、As2O3单药组相比,其抑制率达到57.5﹪,P < 0.01。
四、细胞划痕试验
根据实验步骤分别拍照记录划痕后0 h和24 h的实验结果,与对照组相比,Sal与As2O3能有效抑制KCC853细胞向划痕处迁移(图5)。
五、Hoechst33258染色法观察KCC853细胞凋亡的形态
KCC853在Sal与As2O3的暴露下细胞培养48 h后,染色,在显微镜下选择若干视野,观察拍照(图6),结果发现对照组细胞生长旺盛,细胞形态正常,细胞核呈正常蓝色,未发生明显的凋亡;而加药组,细胞稀少,细胞表现出浓密致染,并可见核碎裂;联合用药组凋亡细胞数比各单药组明显增多。
讨 论
研究发现,Sal与多种抗肿瘤药物联合应用时,表现出协同抗肿瘤效应[9-11],且能克服肿瘤细胞对药物的耐受,提高肿瘤细胞对传统化疗药物的敏感性,并诱导多药耐受的肿瘤细胞凋亡[12-13]。As2O3与紫杉醇[14]、塞来昔布[15]等药物联合应用时,具有明显的协同抗肿瘤效应。
在本实验中,Sal与As2O3能有效抑制KCC853细胞的生长,且表现出一定的剂量依赖性。通过显微镜观察发现,低剂量IC50的Sal与As2O3对KCC853细胞的生长具有明显的抑制作用,与对照组比较,其细胞数量明显减少,细胞出现皱缩、漂浮、变圆甚至破裂成小碎片,联合用药组比各单药组效果更加明显,进一步从细胞形态学上验证了Sal与As2O3对KCC853细胞的抑制效应。在细胞集落实验中,低剂量的Sal与As2O3能显著抑制细胞的集落形成,Sal对集落形成的抑制率为37.23﹪,As2O3的集落抑制率为43.83﹪,联合用药组集落形成抑制率达到了57.50﹪,比单药组效果更加明显。细胞划痕试验验证了Sal与As2O3能抑制KCC853细胞的迁移能力,与对照组相比具有明显的差异性。
文献[16]报道:观察细胞形态学变化是研究细胞凋亡最可靠的方法。Hoechst33258染色法是从形态学角度检测细胞凋亡的一种常用方法,因Hoechst33258染色液能穿过细胞膜,染色后在荧光显微镜下可直接观察细胞的形态变化。当细胞发生凋亡时,细胞核染色质固缩、浓密致染,甚至呈碎块状;而正常未发生凋亡的细胞,其细胞核呈正常蓝色。在本实验中,Sal组与As2O3组细胞都不同程度地发生凋亡,联合用药组细胞凋亡更明显。
肿瘤细胞生物学行为的研究是肿瘤基础研究的重要问题之一,同时也是为临床肿瘤疾病诊断和治疗提供新方法、新技术的理论依据。本实验在体外将Sal与As2O3作用于KCC853细胞,通过观察KCC853细胞生物学行为的改变,为今后进一步研究和体内实验提供理论参考。
1 Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5):E359-386.
2 Gupta PB, Onder TT, Jiang G, et al. Identification of selective inhibitors of cancer stem cells by high throughput screening[J]. Cell, 2009, 138(4):645-659.
3 Wang F, Dail WQ, Wang YG, et al. The synergistic in vitro and vivo antitumor effect of combination therapy with salinomycin and 5- fl uorouracil against hepatocellular carcinoma[J]. PLOS One, 2014, 9(5):e97414.
4 Schenk M, Aykut B, Teske C, et al. Salinomycin inhibits growth of pancreatic cancer and cancer cell migration by disruption of actin stress fi ber integrity[J]. Cancer Lett, 2015, 358(2):161-169.
5 Qu H, Ma B, Yuan HF, et al. Effect of salinomycin on metastasis and invasion of bladder cancer cell line T24[J]. Asian Pac J Trop Med, 2015, 8(7):578-582.
6 Xu Y, Gu X, Gong M, et al. Galectin-3 inhibition sensitizes human renal cell carcinoma cells to arsenic trioxide treatment[J]. Cancer Biol Ther, 2013, 14(10):897-906.
7 Zhang S, Ma C, Pang H, et al. Arsenic trioxide suppresses cell growth and migration via inhibition of miR-27a in breast cancer cells[J]. Biochem Biophys Res Commun, 2016, 469(1):55-61
8 Lang M, Wang X, Wang H, et al. Arsenic trioxide plus PX-478 achieves effective treatment in pancreatic ductladeno carcinoma[J]. Cancer Lett, 2016, 378(2):87-96.
9 Zhou Y, Liang C, Xue F, et al. Salinomycin decreases doxorubicin resistance in hepatocellular carcinoma cells by inhibiting the β-catenin/ TCF complex association via FOXO3a activation[J]. Oncotarget, 2015, 6(12):10350-10365.
10 Zou ZZ, Nie PP, Li YW, et al. Synergistic induction of apoptosis by salinomycin and gefitinib through lysosomal and mitochondrial dependent pathway overcomes gefitinib resistance in colorectal cancer[J]. Oncotarget, 2015.[Epub ahead of print]
11 袁浩锋, 何科, 汪中扬, 等. 盐霉素单药及联合用药对膀胱移行细胞癌T24细胞增殖的体外抑制作用[J].中国医药科学, 2015, 5(17): 27-44.
12 Zhang B, Wang XY, Cai FF, et al. Antitumor properties of salinomycin on cisplatin-resistant human ovarian cancer cells in vitro and in vivo: Involvement of p38 MAPK activation[J]. Oncol Rep, 2013, 29(4): 1371-1378.
13 Zhou J, Li P, Xue X, et al. Salinomycin induces apoptosis in cisplatinresistant colorectal cancer cells by accumulation of reactive oxygen species[J]. Toxicol Lett, 2013, 222(2):139-145.
14 蔡朋朋, 王东红, 李雪松, 等. As203及联合紫杉醇对胃癌MGC803细胞的生长和耐药性的影响[J]. 中国现代医生, 2013, 51(29):4-10.
15 高克非, 曾根. 三氧化二砷联合塞来昔布对上皮性卵巢癌细胞的抗肿瘤效应及相关机制研究[J]. 现代肿瘤医学, 2015, 23(13):1805-1809.
16 Chan L, Lai N, Wang E, et al. A rapid detection method for apoptosis and necrosis measurement using the cellometer imaging cytometry[J]. Apoptosis, 20ll(12):1295-1303.
Effects of salinomycin and arsenic trioxide on the biological behaviors of renal cancer KCC853 cell
Zhou Mingshu1, Wang Shanshan2, Yuan Shoujun2,Wang Yi1.1Department of Urology, The Second Affiliated Hospital of University of South China, Hengyang 421001, China;2Institute of Radiation Medicine, Academy of Military Medical sciences, Beijing 100850, China
Wang Yi, Email: wayne0108@126.com
ObjectiveTo study the effect of salinomycin and arsenic trioxide on human renal cancer cell lines KCC853.MethodThe effects of salinomycin and arsenic trioxide alone or in combination on cell proliferation,migration and apoptosis were analyzed using MTT method, cell colony test, cell scratch test and Hoechst 33258 staining method, respectively. Statistical analysis was performed by analysis of variance and F test.ResultIn vitro, salinomycin(0.16, 0.8, 4, 20, 100 μg/ml)and arsenic trioxide(0.008, 0.04, 0.2, 1, 5 μg/ml)alone could inhibit the proliferation of KCC853 cells in a concentration-dependent manner and time-dependent manner. The inhibition rate were 6.9﹪、10.8﹪、19.4﹪、58.5﹪、96.0﹪ ,7.0﹪、7.7﹪、15.0﹪、48.4﹪、86.6﹪ , respectively. Synergic inhibitory effect was 18.9﹪、21.4﹪、40.4﹪、54.7﹪、95.8﹪observed when the two agents were used. the P < 0.05. In the cell colony test, colony inhibition rate were 37.23﹪and 43.83﹪ for salinomycin and arsenic trioxide respectively. The inhibition rate was 57.5﹪ when the two agents were used. Further study found, salinomycin and arsenic trioxide could inhibit the migratory ability of KCC853 cells.ConclusionLow doses of salinomycin and arsenic trioxide could inhibit the proliferation and migration of KCC853 cells significantly, and promote cell apoptosis.
Salinomcin; Arsenic trioxide; Biology; Kidney neoplasms
2016-07-16)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2017.01.003
421001 衡阳,南华大学附属第二医院泌尿外科1;100850 北京,军事医学科学院放射与辐射医学研究所2
王毅,Email:wayne0108@126.com
周明澍,王珊珊,袁守军,等. 盐霉素与三氧化二砷对肾癌KCC853细胞生物学行为的影响[J/CD].中华细胞与干细胞杂志(电子版), 2017, 7(1):12-17.
