黑果腺肋花楸原花青素的提取及抑菌性研究
2017-03-08李奋梅王艳丽张海平安建辉孙爱东
朱 月,李奋梅,王艳丽,朱 宁,张海平,安建辉,孙爱东
(北京林业大学生物科学与技术学院,食品加工与安全北京市重点实验室,北京 100083)
黑果腺肋花楸原花青素的提取及抑菌性研究
朱 月,李奋梅,王艳丽,朱 宁,张海平,安建辉,孙爱东*
(北京林业大学生物科学与技术学院,食品加工与安全北京市重点实验室,北京 100083)
本文利用响应面分析法对黑果腺肋花楸原花青素的提取工艺进行优化,并探究其抑菌性质。结果表明:黑果腺肋花楸原花青素的最佳提取条件为:乙醇浓度62%,液料比25∶1 mL/g,提取温度72 ℃,提取时间60 min。在此条件下提取的黑果腺肋花楸原花青素含量为3.32%;经AB-8大孔树脂纯化,原花青素含量提高约4倍,为14.29%;抑菌性实验表明黑果腺肋花楸原花青素对供试菌种的抑菌效果依次为:枯草芽孢杆菌>金黄色葡萄球菌>大肠杆菌>酿酒酵母,抑菌作用随原花青素浓度的增加而提高,且纯化前的黑果腺肋花楸原花青素具有更强的抑菌性。
黑果腺肋花楸,原花青素,提取纯化,抑菌性
黑果腺肋花楸(AorniamealnocarpaElliot),又名野樱莓、不老莓,蔷薇科,原产于美国东北部地区[1]。其果树是以生产果实为主的经济林树种,果实具有较高的营养价值和药用价值,是集食用、药用、园林绿化、生态保护等价值于一身的珍贵树种。自20世纪90年代初,辽宁省干旱地区造林研究所最先开始了我国腺肋花楸引种栽培和果实加工利用的实验研究工作。
黑果腺肋花楸果实中含有多种营养物质,例如膳食纤维、糖类、蛋白质、多酚类化合物等,其中最重要的物质是酚类物质[2]。酚类物质如酚酸、原花青素、花青素、黄酮醇等含量丰富,且与黑果腺肋花楸的生物活性密切相关[3]。黑果腺肋花楸果实中多酚类物质主要分为单体多酚和聚合多酚。单体多酚主要为酚酸、类黄酮及其甙类化合物、花青素及其糖苷类化合物;聚合多酚为原花青素。黑果腺肋花楸果实中原花青素占总酚的41.9%~59.1%[4],可见黑果腺肋花楸酚类物质中原花青素含量最高,对黑果腺肋花楸的生物活性起着至关重要的作用。原花青素具有抗氧化活性、防治心血管疾病、抗癌、抗高血压、降血糖等生物活性[5-8];其抗氧化能力是VE的50倍、VC的20倍,是迄今为止发现的最好天然抗氧化剂之一[9];原花青素的抗菌、抗病毒作用已研究近30年,研究表明一定浓度的原花青素溶液对立枯丝核菌、串珠镰孢和大斑病长蠕孢等菌均有抑制作用[10]。目前,原花青素已被广泛应用于药品、保健品和食品等领域。原花青素的提取方法有超声法、有机溶剂浸提法和微波法等。
本文以黑果腺肋花楸为原料,利用超声辅助提取法,探究其原花青素的提取工艺,并利用响应面分析法对提取工艺参数进行优化,同时对黑果腺肋花楸原花青素的抑菌性进行研究,为黑果腺肋花楸原花青素的深度开发和综合利用提供科学依据。
1 材料和方法
1.1 材料和仪器
黑果腺肋花楸 黑龙江省;无水乙醇、无水甲醇、盐酸 分析纯,国药集团化学试剂有限公司;香草醛、表儿茶素 分析纯,上海阿拉丁生化科技有限公司;AB-8大孔树脂 上海阿拉丁生化科技有限公司;LB培养基、孟加拉红培养基、LB肉汤培养基、麦芽汁培养基 分析纯,北京奥博星生物技术有限公司;大肠杆菌、金黄色葡萄球菌、酵母菌、枯草芽孢杆菌 本实验室提供。
JYL-C010打浆机 九阳股份有限公司;UV-6100紫外分光光度仪 上海元析仪器有限公司;超声破碎仪 昆山市超声仪器有限公司;L3660D低速离心机 上海知信实验仪器有限公司;FD-18冷冻干燥机 北京德天佑科技发展有限公司;LQ-A 30002电子天平 瑞安市乐祺贸易有限公司;HL-2S恒流泵 上海青浦沪西仪器厂;SW-CJ-2D超净工作台 北京天林恒泰科技有限公司;LDZX-30KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;DHP-9272电热恒温培养箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 黑果腺肋花楸原花青素的提取工艺 黑果腺肋花楸鲜果→去梗、清洗、破碎→超声辅助提取黑果腺肋花楸原花青素→原花青素粗提物分离→真空浓缩→冷冻干燥→原花青素纯化物→抑菌实验。
1.2.2 黑果腺肋花楸原花青素含量测定 采用盐酸-香草醛法[11]测定黑果腺肋花楸中原花青素含量,方法略作修改。
1.2.2.1 标准曲线的制作 将表儿茶素标准品用甲醇配制成浓度为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL标准溶液,于25 mL试管中加入1 mL表儿茶素标准溶液、5 mL 5 g/100 mL香草醛-甲醇溶液和3 mL浓盐酸,摇匀,常温避光反应1 h,以甲醇代替样液作为空白对照,于500 nm波长处测定反应液吸光度A。得回归方程为:Y=2.8183X+0.0176,R2=0.9991。
1.2.2.2 原花青素含量的测定 在一定条件下提取黑果腺肋花楸原花青素,提取完毕后,将提取液在4000 r/min下离心20 min;取1 mL提取液,1∶5稀释;取1 mL稀释液加入5 mL 5 g/100 mL香草醛-甲醇溶液和3 mL浓盐酸,摇匀,常温避光反应1 h,以甲醇代替表儿茶素标准溶液作为空白对照,于500 nm波长处测定反应液吸光度A。原花青素含量计算公式如下:
原花青素含量(%)=[(A-0.0176)×N×V×2.8183]/M×100
其中,A:吸光度;N:稀释倍数;V:溶液体积;M:黑果腺肋花楸匀浆重量(g)。
1.2.3 单因素实验设计
1.2.3.1 乙醇浓度对原花青素含量的影响 取3 g黑果腺肋花楸匀浆(预处理的花楸鲜果于打浆机中打浆1 min),在液料比25∶1 mL/g、提取时间60 min、提取温度70 ℃条件下,以不同乙醇浓度(30%、40%、50%、60%、70%、80%)超声辅助提取原花青素(超声提取时间20 min,功率600 W[12]);提取完毕后采用1.2.2方法测定原花青素含量。
1.2.3.2 液料比对原花青素含量的影响 取3 g黑果腺肋花楸匀浆,在乙醇浓度60%、提取时间60 min、提取温度70 ℃条件下,以不同液料比(20∶1、25∶1、30∶1、35∶1、40∶1、45∶1 mL/g)超声辅助提取原花青素(超声提取时间20 min,功率600 W);提取完毕后采用1.2.2方法测定原花青素含量。
1.2.3.3 提取温度对原花青素含量的影响 取3 g黑果腺肋花楸匀浆,在乙醇浓度60%、提取时间60 min、液料比25∶1 mL/g条件下,以不同温度(40、50、60、70、80 ℃)超声辅助提取原花青素(超声提取时间20 min,功率600 W);提取完毕后采用1.2.2方法测定原花青素含量。
1.2.3.4 提取时间对原花青素含量的影响 取3 g黑果腺肋花楸匀浆,在乙醇浓度60%、提取温度70 ℃、液料比25∶1 mL/g条件下,以不同时间(40、60、80、100、120、140 min)超声辅助提取原花青素(超声提取时间20 min,功率600 W);提取完毕后采用1.2.2方法测定原花青素含量。
1.2.4 黑果腺肋花楸原花青素提取工艺优化 结合单因素实验结果,选取乙醇体积分数、液料比、提取温度对原花青素含量影响显著的3个因素,在单因素实验基础上采用三因素三水平的响应面分析方法优化原花青素提取工艺。
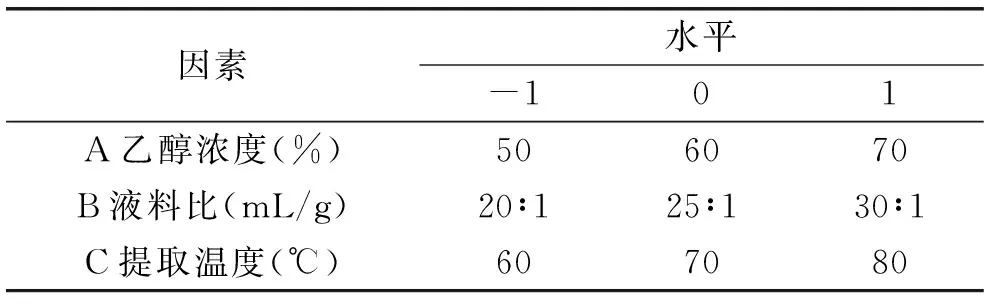
表1 黑果腺肋花楸原花青素响应面分析因素与水平Table 1 Factors and levels of response surface methodologyanalysis of black chokeberry
采用Design Expert 8.0.6 trial软件对实验数据进行回归分析,通过获得影响因素的一次效应、二次效应及其交互效应方程,对影响黑果腺肋花楸原花青素提取的因素进行更深入的研究。
1.2.5 AB-8大孔树脂纯化
1.2.5.1 AB-8大孔树脂预处理 AB-8大孔树脂用无水乙醇浸泡24 h,充分溶胀,去离子水洗至无醇;加入5% HCl溶液浸泡12 h后,去离子水洗至中性;加入5% NaOH溶液浸泡12 h后,去离子水洗至中性;抽滤吸干树脂表面水分,待用[13]。
1.2.5.2 AB-8大孔树脂吸附和洗脱 取26 mm×60 cm层析柱,将3 mg/mL的原花青素粗提液以1 mL/min流速上柱吸附,吸附完毕后用5 BV去离子水洗去蛋白质、多糖等杂质;然后用50%乙醇溶液以1 mL/min流速洗脱,收集洗脱液,真空浓缩,冷冻干燥后测定原花青素纯化物含量。
1.2.6 黑果腺肋花楸原花青素的抑菌性实验 采用牛津杯法[14]测定原花青素的抑菌性。具体实验步骤为:供试菌株的活化、菌悬液的制备、原花青素溶液配制、含菌平板制作及牛津杯法抑菌效果检测。
1.2.6.1 供试菌种活化 将大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和酿酒酵母从4 ℃冰箱取出,转接至新鲜营养琼脂表面,细菌于37 ℃培养24 h,酵母菌于30 ℃培养3 d。
1.2.6.2 菌悬液的制备 将活化的大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌取一接种环放置于LB肉汤培养基中,摇床150 r/min振荡8 h后,调整菌悬液浓度到108CFU/mL[15];将活化的酿酒酵母取一环放置于麦芽汁培养基中,摇床上150 r/min振荡14 h。
1.2.6.3 原花青素溶液配制 将黑果腺肋花楸粗提物和纯化物分别配制成6 mg/mL的原花青素水溶液,用水1∶2稀释,测定两个不同浓度对供试菌的抑制效果。
1.2.6.4 含菌平板的制作 新鲜配制的LB琼脂培养基和孟加拉红培养基于121 ℃下灭菌20 min,当培养基冷却至50 ℃左右在超净台上将培养基倒入灭菌的培养皿中,每个培养皿倒入约20 mL左右培养基;待培养基凝固,取0.1 mL菌悬液用三角涂布棒分别涂布于培养基上备用。
1.2.6.5 牛津杯法 将灭菌牛津杯用无菌镊子夹出,垂直放置于培养基表面,轻轻按压,使杯底与培养基之间无缝隙,每个平板放置4个牛津杯,每个牛津杯注入200 μL药液,并用无菌生理盐水作对照。细菌于37 ℃培养24 h,酵母菌于30 ℃培养2 d。
1.3 数据处理
本文采用Excel软件进行单因素实验和抑菌性实验数据处理;采用Design Expert 8.0.6 trial进行多元回归拟合和方差分析。
2 结果与分析
2.1 单因素结果
2.1.1 乙醇浓度对黑果腺肋花楸原花青素含量的影响 由图1可知,随着乙醇浓度的增加,黑果腺肋花楸提取物中原花青素含量升高,当乙醇浓度为60%时,黑果腺肋花楸原花青素含量达到最大值,此后随着乙醇浓度增加原花青素含量下降,所以60%乙醇浓度为黑果腺肋花楸原花青素的最佳乙醇提取浓度。
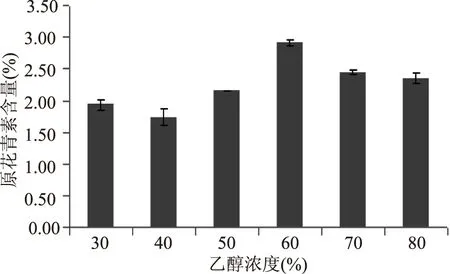
图1 不同乙醇浓度对黑果腺肋花楸原花青素提取含量的影响Fig.1 Effect of ethanol concentration on procyanidins content from black chokeberry
2.1.2 液料比对黑果腺肋花楸原花青素含量的影响 由图2可知,当液料比为25∶1 mL/g时黑果腺肋花楸原花青素含量最高为3.82%,随着液料比增加,花楸原花青素含量缓慢下降。可能的原因是随着料液比的增大,脂溶性杂质的成分溶出量增加,可与乙醇结合,为原花青素的竞争性抑制剂,导致原花青素含量下降。所以确定黑果腺肋花楸花楸原花青素最佳提取的液料比为25∶1 mL/g。
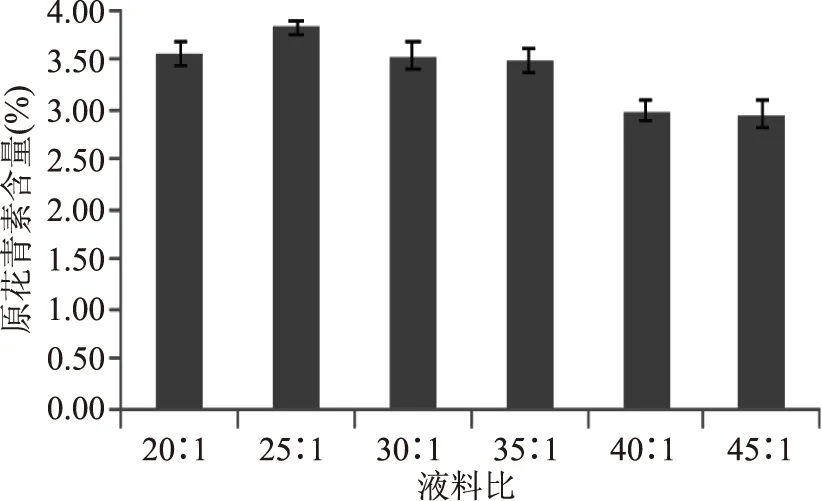
图2 不同液料比对黑果腺肋花楸原花青素提取含量的影响Fig.2 Effect of liquid-to-solid ratio on procyanidins content from black chokeberry
2.1.3 温度对黑果腺肋花楸原花青素含量的影响 由图3可知,随着温度的升高,原花青素含量增加,当温度为70 ℃时原花青素含量最高,温度高于70 ℃时含量缓慢下降。如果温度过高,一方面其中活性成分会受到破坏,杂质溶出量增加,给后续操作带来不便[16];另一方面因为提取原花青素所用有机溶剂为乙醇,温度过高也会造成溶剂损失。综合以上因素,提取温度应在70 ℃较为合适。

图3 不同温度对黑果腺肋花楸原花青素提取含量的影响Fig.3 Effect of temperature on procyanidinscontent from black chokeberry
2.1.4 提取时间对黑果腺肋花楸原花青素含量的影响 由图4可知,提取时间40、60、80 min对原花青素含量影响不大;随着时间增加,原花青素含量下降,推测其原因:其一,长时间加热会对原花青素结构造成破坏,本实验在较高温度下(70 ℃)提取原花青素,为保证原花青素活性,应选取较短时间提取原花青素;其二,80 min后原花青素可能与细胞内的其它物质反应,从而使原花青素含量减少。

表3 方差分析结果Tbale 3 Results of variance analysis
注:*表示影响显著(p<0.05);**表示影响极显著(p<0.01)。
综上所述,本实验选取60 min为黑果腺肋花楸原花青素最佳提取时间。根据相关性分析,时间是四个单因素中对原花青素含量的影响最小的因素,所以之后的响应面优化实验中,综合考虑乙醇浓度、液料比和提取温度三个因素对黑果腺肋花楸原花青素含量的影响。
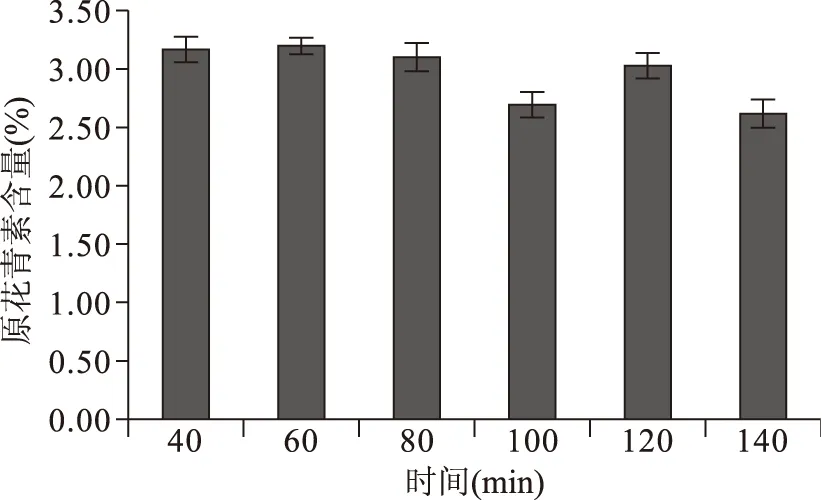
图4 不同提取时间对黑果腺肋花楸原花青素含提取量的影响Fig.4 Effect of time on procyanidinscontent from black chokeberry
2.2 响应面分析法实验结果
2.2.1 响应面实验结果及方差分析 响应面实验设计及结果如表2所示,通过多元回归拟合分析得出乙醇浓度、液料比、提取温度对黑果腺肋花楸原花青素含量影响,可以用二次多项回归方程表示:原花青素含量Y=3.33+0.11A+0.066B+0.066C-0.12AB+0.087AC+0.14BC-0.23A2-0.31B2-0.28C2。

表2 黑果腺肋花楸原花青素响应面分析实验设计及结果Table 2 Design and results of response surfacemethodology experiment of black chokeberry

T检验表明:方程中A、BC影响显著(p<0.05),A2、B2、C2影响极显著(p<0.001)。
2.2.2 双因素交互作用分析 图5~图7表示各因素交互作用响应面图。从响应面图的陡峭程度可直观反映出两因素交互作用的强弱[17]。由图5~图7看出,料液比与提取温度之间的交互作用最明显,乙醇浓度与提取温度交互作用次之,相比较而言乙醇浓度与料液比交互作用较弱。
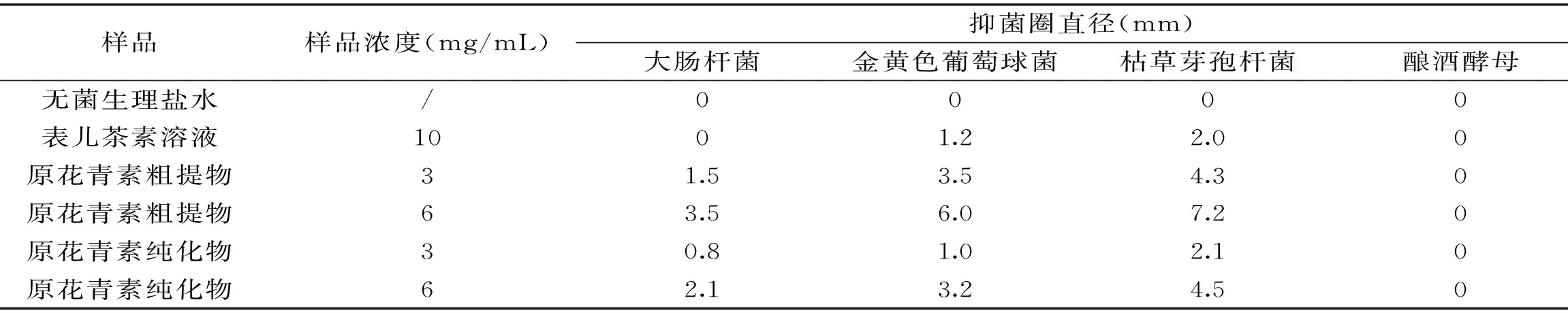
表4 黑果腺肋花楸原花青素的抑菌效果Table 4 Antibacterial activity of procyanidins from black chokeberry

图5 液料比与乙醇浓度响应面图Fig.5 Response surfaces of liquid-to-solid ratio and alcohol concentration

图6 液料比与提取温度响应面图Fig.6 Response surfaces of extraction temperture and liquid-to-solid ratio

图7 提取温度与乙醇浓度响应面图Fig.7 Response surfaces of extraction temperture and alcohol concentration
结合回归数学分析模型,可预测提取的最优条件参数为乙醇浓度62.48%、液料比25.49∶1 mL/g、提取温度71.80 ℃,在此条件下原花青素含量为3.36%。结合实际情况,提取的最佳工艺参数为乙醇浓度62%,液料比25∶1 mL/g、提取温度72 ℃,提取时间60 min。在此条件下对提取的黑果腺肋花楸原花青素进行验证,实际测得原花青素含量为3.32%,与理论值预测值仅差0.04%,说明采用响应面法得到的优化工艺可行性强,优化结果可靠。
2.3 AB-8大孔树脂分离实验结果
经AB-8大孔树脂分离后,测得纯化物中原花青素含量为14.29%,与分离前原花青素含量(3.32%)相比,纯度提高约4倍。说明经AB-8大孔树脂纯化后,原花青素含量显著提高,结合文献可知[18-19],AB-8大孔树脂适合用于黑果腺肋花楸原花青素的分离纯化。
2.4 黑果腺肋花楸原花青素抑菌性实验结果
由表4可以看出,黑果腺肋花楸原花青素对几种供试菌种的抑菌效果不同。黑果腺肋花楸粗提物和纯化物对枯草芽孢杆菌的抑制作用最强,其次是金黄色葡萄球菌,再次是大肠杆菌,几种样品对酿酒酵母均无抑制作用。多酚类物质对细菌的抑制作用较明显,对某些真菌无明显的抑制作用,本实验研究结果与文献报道相似[20-21]。不同的原花青素样品浓度对供试菌种的抑制作用也不尽相同,随浓度提高,抑菌效果增强。黑果腺肋花楸原花青素粗提物比原花青素纯化物的抑菌效果更强,表儿茶素相对于两种提取物而言抑菌作用最弱。可能的原因是原花青素纯化前大分子蛋白质,有机酸类物质等对微生物也有一定的抑菌作用;另一原因是由于多酚类物质协同效应,多种酚类物质共存会增加某一种酚类原有的活性,即总酚可能比单独某种酚类物质的抑菌效果要好[20],从而纯化前比纯化后的原花青素样品抑菌作用更强。
3 结论
经响应面优化得出黑果腺肋花楸原花青素最佳提取工艺参数为乙醇浓度62%,液料比25∶1 mL/g、提取温度72 ℃,提取时间60 min。在此条件下提取的黑果腺肋花楸原花青素含量为3.32%;经AB-8大孔树脂纯化后,原花青素浓度由纯化前的3.32%提高到14.29%,原花青素含量约提高4倍,说明AB-8大孔树脂可以很好地分离纯化黑果腺肋花楸原花青素。
抑菌性实验表明黑果腺肋花楸原花青素对枯草芽孢杆菌、金黄色葡萄球菌和大肠杆菌均有一定的抑制作用,抑菌作用大小依次为枯草芽孢杆菌>金黄色葡萄球菌>大肠杆菌>酿酒酵母;纯化前的原花青素样品具有更强的抑菌作用,且随浓度提高抑菌作用增强。
目前,国外关于黑果腺肋花楸多酚类物质的研究已取得阶段性进展,而国内对其研究仍处于起步阶段,本文首次研究黑果腺肋花楸原花青素的提取纯化工艺并探究其抑菌性质。为我国黑果腺肋花楸产业的发展提供依据。
[1]Seidemann J. Chokeberries a fruit little-known till now[J]. Dtsch Lebensmitt Rundsch,1993,89:149-151.
[2]Kulling SE,Rawel HM. Chokeberry(Aroniamelanocarpa)—A review on the characteristic components and potential health effects[J]. Planta Med,2008;74:1625-1634.
[3]Oszmianski J,Wojdylo A. Aronia melanocarpa phenolics and their antioxidant activity[J]. Eur Food Res Technol,2005,221:809-813.
[4]Ireneusz Ochimian,Józef Grajkowski,Miosz Smolik.Comparison of some morphological features,quality andchemical content of four cultivars of chokeberry fruits(Aroniamelanocarpa)[J].Not Bot Horti Agrobo,2012,40(1):253-260.
[5]Valcheva-Kuzmanova S,Borisova P,Galunska B,et al. Hepatoprotective effect of the natural fruit juice from Aronia melanocarpa on carbon tetrachloride-induced acute liver damage in rats[J]. Exp Toxicol Pathol,2004,56(2):195-201.
[6]Bell DR,Gochenaur K. Direct vasoactive and vasoprotective properties of anthocyanin-rich extracts[J]. J Appl Physiol,2006,100(8):1164-1170.
[7]Valcheva-Kuzmanova S,Kuzmanov K,Mihova V,et al. Antihyperlipidemic effect of Aronia melanocarpa fruit juice in rats fed a high-cholesterol diet[J]. Plant Foods Hum Nutr,2007,62(11):19-24.
[8]Valcheva-Kuzmanova S,Kuzmanov K,Tancheva S,et al.Hypoglycemic and hypolipidemic effects of Aronia melanocarpa fruit juice in streptozotocin-induced diabetic rats[J]. Methods Find Exp Clin Pharmacol,2007,29(50):101-105.
[9]Bagchi D,Garg A,Kroh n RL. Oxygen free radical scavenging abilities of vit amins C and E and a grape seed proanthocyanidin extractinvitro[J].Res Commun Mol Pathol Pharmacol,1997,95(2):179-189.
[10]李春阳. 葡萄籽中原花青素的提取纯化及其结构和功能研究[D]. 无锡:江南大学,2006.
[11]陈健. 响应面分析法优化超声波提取槟榔原花青素工艺[J]. 食品科学,2011,32(4):82-86.
[12]李莹,李才国. 原花青素含量测定方法研究进展[J]. 化学与化工,2007(8):28-29.
[13]周桃英,罗登宏,李国庆,等. AB-8大孔树脂纯化荷叶总黄酮的工艺研究[J]. 中国食品添加剂,2009(5):113-119.
[14]刘如运. 几种常用抑菌实验方法的评价及比较[J]. 现代企业教育,2013,7(2):341-342.
[15]周丽明. 芒果多酚的提取分离纯化及抗氧化抑菌作用研究[D]. 武汉:华中农业大学,2007.
[16]Liliana del Rocío Castro-López,Encarna Gómez-Plaza. Role of cell wall deconstructing enzymes in the proanthocyanidin-cell wall adsorption-desorption phenomena[J]. Food Chemistry,2015,12(31):526-532.
[17]周玮婧,孙智达,谢笔钧. 荔枝皮原花青素提取工艺优化[J]. 农业工程学报,2009,25(1):175-179.
[18]赵平,张月萍,任鹏. AB-8大孔树脂对葡萄籽原花青素的吸附过程[J]. 化工学报,2013,64(3):980-985.
[19]范明霞,刘新桥,陈莹,等. 大孔树脂吸附纯化葡萄籽原花青素的研究[J]. 应用化工,2009,38(6):864-867.
[20]孙红男,陈健,孙爱东,等. 苹果多酚抑菌效果的研究[J]. 北京林业大学学报,2010,32(4):280-283.
[21]Borchera A D,Keen C L,Gershwin M E. Mushrooms,tumors,and immunity:An update[J]. Experimental Biology and Medicine,2004,229(5):393-406.
Extraction and antibacterial activity of procyanidins fromAroniamelanocarpa
ZHU Yue,LI Fen-mei,WANG Yan-li,ZHU Ning,ZHANG Hai-ping,AN Jian-hui,SUN Ai-dong*
(Key Loboratory of Forestry Food Processing Security,College of Biological Sciences and Biotechnology,Beijing 100083,China)
Response surface methodology was employed to optimize the extraction conditions of procyanidins fromAroniamelanocarpaand antibacterial activity was researched by Oxford-cup tests. Results indicated that the optimum extractive conditions were determined as follows:ethanol concentration 62%,liquid to solid ratio 25∶1 mL/g,extraction temperature 72 ℃,extraction time 60 min,the content of procyanidins through this optimized procedure was 3.32%. The content of procyanidins were four times as much purification as crude extracts after the treatment by AB-8 macroporous resin,which content of procyanidins was 14.29%. Bacteriostatic experiment of procyanidins from black chokeberry on several strains tested showed antimicrobial effect as follows:Bacillussubtilis>Staphylococcusaureus>Escherichiacoli>Saccharomycescerevisiae. Antibacterial activity increased with increasing of procyanidins concentration and crude extracts ofAroniamelanocarpaprocyanidins had better antibacterial activity.
Aroniamelanocarpa;procyanidins;extraction and purification;antibacterial activity
2016-08-12
朱月(1993-),女,在读硕士研究生,研究方向:天然产物与功能性食品,E-mail:zhuyue1109@163.com。
*通讯作者:孙爱东(1968-),女,教授,研究方向:天然产物生理活性物质的开发与利用,E-mail:adsun68@163.com。
国家自然基金项目(31471593)。
TS255.1
B
1002-0306(2017)02-0302-06
10.13386/j.issn1002-0306.2017.02.050
