响应面优化银耳结缔多糖提取工艺与抗氧化活性研究
2017-03-08程晓庆谭红军梁旭明石文娟苏智敏
师 萱,程晓庆,杨 勇,谭红军,梁旭明,*,石文娟,苏智敏,
(1.重庆市中药研究院,重庆 400065;2.海南大学食品学院,海南海口 570228;3.重庆市银耳营养食品企业工程技术研究中心,重庆 409003)
响应面优化银耳结缔多糖提取工艺与抗氧化活性研究
师 萱1,程晓庆2,杨 勇1,谭红军1,梁旭明1,*,石文娟3,苏智敏1,3
(1.重庆市中药研究院,重庆 400065;2.海南大学食品学院,海南海口 570228;3.重庆市银耳营养食品企业工程技术研究中心,重庆 409003)
利用单因素实验结合响应面Box-Benhnken实验设计对银耳结缔多糖提取工艺进行优化。对所得粗多糖初步纯化后进行结构特征和抗氧化活性研究。结果表明,银耳结缔多糖最佳工艺条件为提取温度92 ℃,提取时间4.2 h,液料比41∶1(mL/g),多糖提取得率为(23.41±0.92)mg/g,与预测值相对误差较小(1.07%)。抗氧化活性分析表明,银耳结缔多糖对DPPH自由基、ABTS+自由基的清除率和还原能力呈浓度-效应关系,其在三种体系中的EC50值分别是6.59、4.04和4.94 mg/mL,说明银耳结缔多糖具有较强的抗氧化能力。
银耳结缔,多糖,响应面优化,抗氧化活性
银耳(Tremellafuciformis)是一种名贵药食两用菌,具有滋补生津、润肺养胃的功效[1]。我国是银耳生产大国,主产集中在四川通江地区和福建等地,随着银耳栽培技术的发展,促使我国银耳产量大幅提高,产值也跃居于世界前列。银耳多糖是银耳中的主要成分,研究表明,银耳多糖与其具有的抗肿瘤[2]、抗氧化[2-4]、降血脂[3-4]、抗辐射[5]、减肥[6]、促进伤口愈合[4,7]、增强机体免疫力及预防肠道疾病[3-4,7]等多种药理活性有关。
自日本学者首次从银耳子实体中提取出多糖之后,银耳多糖提取工艺的研究越来越受关注,采用的提取方法有溶剂提取法(热水、酸和碱)、酶法、超声波辅助、微波辅助提取、高压蒸煮技术和高压脉冲电场辅助等[1,8-11]。其中热水浸提法是目前最为广泛应用的一种技术,但有关银耳多糖热水浸提法工艺优化研究多采用“正交实验设计法”,致使其仅限于局部区域考察实验影响因素水平,很难全面反映影响因素的实际情况。而响应面分析法通过建立复杂多维空间曲面,直接反映出因素之间的交互作用对多糖提取率的影响,更能促使实验结果接近实际[12]。
随着银耳栽培和加工技术的发展,银耳烂菇、残次和结缔头等废料也越来越多,银耳加工废料不及时或者不适当地处理,多数情况未经处理而直接丢弃[13],既会严重污染生产生活的环境,又造成极大的资源浪费。因此如何正确处理和综合利用银耳加工废料有待于进一步的开发和研究。鉴于此,本实验采用单因素实验与Box-Behnken设计法对银耳结缔多糖提取工艺进行优化,旨在建立银耳结缔多糖提取的二次回归模型、确定最佳提取工艺,在此基础上对结构和体外抗氧化活性进行了分析测定,以便为银耳加工废料正确处理、功能活性的深入研究、产业化应用和综合利用提供理论基础和技术支持。
1 材料与方法
1.1 材料与仪器
银耳 于2015年11月份购于重庆市南山路农贸市场,取银耳结缔,用万能粉碎机粉碎,过40目筛,置于干燥瓶中备用;葡萄糖、无水乙醇、浓硫酸、苯酚、三氯乙酸、盐酸、氢氧化钠 以上均为分析纯,购于广州化学试剂厂。
HH-4型数显恒温水浴锅 常州澳华仪器有限公司;TDZ5-WS多管架自动平衡离心机 上海奥普勒仪器有限公司;754NPC紫外可见分光光度计 上海奥谱勒仪器有限公司;DHG-9070A电热鼓风干燥箱 上海一恒科学仪器有限公司;RE52AA旋转蒸发仪 上海亚荣生化仪器厂;EL204电子分析天平 梅特勒有限-托利多仪器(上海)有限公司;300Y多功能粉碎机 伯欧五金厂;Nicolet 6700型傅立叶红外光谱仪 Thermo scientific,USA。
1.2 实验方法
1.2.1 银耳结缔粗多糖提取工艺流程 银耳结缔粉末→热水浸提法提取银耳结缔粗多糖→过滤→滤液浓缩→醇沉(无水乙醇)→离心→沉淀物→除蛋白(Sevage试剂)→干燥→银耳结缔粗多糖干品[14]。
1.2.2 多糖含量的测定 采用硫酸-苯酚法[15]。
1.2.2.1 标准曲线的绘制 采用蒸馏水分别配制成含量为0、12、24、36、48、60 μg/mL的葡萄糖标准溶液。然后加1.0 mL 6%苯酚溶液,摇匀,迅速滴加入5.0 mL浓硫酸,摇匀冷却,室温放置20 min,于490 nm测吸光值,以2.0 mL蒸馏水按同样显色操作作为空白对照,以浓度C(μg/mL)为横坐标,吸收度A为纵坐标,绘制标准曲线,得回归方程:A=0.01449C-0.00337,R2=0.9999。
1.2.2.2 银耳结缔粗多糖提取得率的测定 按照王婉冰等的方法[15],精确称取提取物,按照标准曲线绘制方法用硫酸-苯酚法测定吸光度值代入标准曲线方程中,得其多糖含量,粗多糖提取率按下式计算:
粗多糖提取得率(mg/g)=多糖含量测定值×稀释倍数×提取物质量/原料质量
1.2.3 单因素实验设计 研究不同液料比、提取温度和提取时间对银耳结缔多糖提取效果的影响。具体内容:精确称取0.5 g左右银耳结缔粉末,在提取时间4 h、液料比为40∶1(mL/g)条件下,探讨不同提取温度(60、70、80、90和100 ℃)对银耳结缔多糖提取率的影响;在提取温度90 ℃、液料比为40∶1条件下,探讨不同提取时间(1、2、3、4、5和6 h)对银耳结缔多糖提取率的影响;在提取温度90 ℃、提取时间为4 h条件下,探讨不同液料比(20∶1、30∶1、40∶1、50∶1和60∶1 mL/g)对银耳结缔多糖提取率的影响。
1.2.4 响应曲面优化实验设计 在单因素实验的基础上根据响应面Box-Behnken设计原理选取提取温度(X1)、提取时间(X2)和液料比(X3)3个因子优化银耳结缔多糖提取工艺,因素水平见表1。以多糖提取得率(Y)为响应值,用SAS 8.0软件对实验结果进行回归分析建立数学模型,以确定银耳结缔多糖的最佳提取工艺条件。
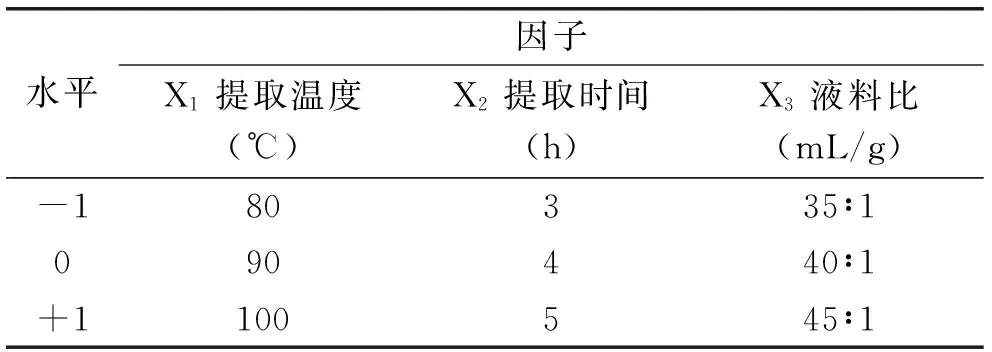
表1 Box-Behnken响应面设计实验因子与水平Table 1 Variables and levels of Box-Behnken response surface design
1.2.5 傅里叶红外光谱(FTIR)分析 取传统水浸提法所得银耳结缔多糖样品(2.0 mg)按照1∶100的比例与KBr固体粉末(200 mg)混合均匀后,在红外灯下将样品与KBr粉末在研钵中混匀并充分研磨,然后利用真空压片机进行压片,采用傅立叶红外光谱仪(Thermo scientific,USA)中进行红外光谱测定,扫描范围4000~400 cm-1,扫描分辨率2 cm-1,扫描次数20次,分析银耳结缔多糖的结构。
1.2.6 银耳结缔多糖抗氧化活性研究
1.2.6.1 ABTS+自由基清除能力的测定 参照Pellegrini等的方法[16],并略作修改。将7 mmol/L ABTS溶液和2.4 mmol/L过硫酸钾溶液等量混合并在室温、避光条件下反应12 h,然后用60 mL 95%乙醇稀释1 mL ABTS储备液,得到在室温下于734 nm波长下的吸光度为0.700±0.001的工作液(A0)。取0.3 mL不同浓度的银耳结缔多糖溶液(0.5、1.0、2.0、4.0、6.0、8.0和10.0 mg/mL)与2.7 mL ABTS工作液反应30 min后,在734 nm波长下测定其吸光值(A1),记为样品吸光值。按照公式(1)计算清除率:
ABTS+自由基清除率(%)=(A0-A1)/A0×100
式(1)
1.2.6.2 DPPH自由基清除能力的测定 参照Hanato等的方法[17],并略作修改。分别将0.3 mL不同浓度银耳结缔多糖溶液(0.5、1.0、2.0、4.0、6.0、8.0和10.0 mg/mL)加入不同比色管中,然后取2.7 mL浓度为40 μg/mL的DPPH溶液于各比色管中,振荡使其充分混合均匀,在室温下静置60 min。之后,在波长517 nm处测定混合液的吸光值(A1)。用2.7 mL DPPH溶液与0.3 mL溶剂混合,静置60 min后,在波长517 nm处检测其吸光值(A0)。按照公式(2)计算清除率:
DPPH自由基清除率(%)=[A0-A1]/A0×100
式(2)
1.2.6.3 还原能力的测定 参照Oyaizu等的方法[18],并略作修改。将2.5 mL银耳结缔多糖溶液(0.5、1.0、2.0、4.0、6.0、8.0和10.0 mg/mL)分别与2.5 mL 0.2 mol/L pH6.6的磷酸盐缓冲溶液混合,再加入1.0 mL 1%铁氰化钾溶液在50 ℃下水浴30 min。然后加入2.5 mL 10%三氯乙酸,混匀后在3000 r/min下离心10 min,取上清液2.5 mL与2.5 mL蒸馏水、0.5 mL 0.1%三氯化铁溶液混合,静置10 min后在700 nm下测定其吸光值。
1.2.7 数据统计 每组实验均重复3次,利用SPSS 21.0统计软件(SPSS公司,芝加哥,美国)对数据进行统计分析。采用Graphpad prism5.0和Origin8.0画图软件对实验数据进行画图。
2 结果与分析
2.1 单因素实验结果
2.1.1 不同提取温度对银耳结缔多糖提取得率的影响 由图1可以看出,银耳结缔多糖提取得率随温度的变化呈先增大后减小趋势,在90 ℃左右时达到最大值,为(23.36±1.31) mg/g,且与其他提取温度对银耳结缔多糖提取得率的影响差异显著(p<0.05)。可能是由于提取温度的升高可增加多糖的溶解性[19]。当提取温度超过90 ℃后银耳结缔多糖提取得率呈下降趋势,其原因可能是提取温度过高时会导致多糖分子降解或破坏而导致银耳结缔多糖含量减少[20]。因此选择银耳结缔多糖的提取温度为90 ℃,研究结果与周帅飞等[21]银耳子实体多糖提取研究基本一致,传统的热水浸提法提取银耳多糖,当料水比1∶40(g/m L),温度90 ℃,时间3 h,提取次数为2次时,银耳多糖的提取率为16.63%。

图1 不同提取温度对银耳结缔多糖提取得率的影响Fig.1 Effect of different extraction temperature on the yield of Tremella fuciformis pedicel(TPP)注:图中不同的小写字母表示在0.05水平上差异显著(n=3),图2、图3同。
2.1.2 不同提取时间对银耳结缔多糖提取得率的影响 由图2可知,银耳结缔多糖提取得率随提取时间的延长呈先升高而后降低的趋势。在1 h到4 h之间,银耳结缔多糖提取得率随时间的延长而升高,而在4 h到6 h之间,银耳结缔多糖提取得率则随时间的延长而降低。即在提取时间为4 h时,银耳结缔多糖提取得率达到峰值。其原因可能是提取时间过短,银耳结缔多糖不能被充分提取;而过长会导致多糖降解和蛋白质等杂质的产生而降低,因而选择银耳结缔多糖提取时间为4 h。

图2 不同提取温度对银耳结缔多糖提取得率的影响Fig.2 Effect of different extraction time on the yield of TPP
2.1.3 不同液料比对银耳结缔多糖提取得率的影响 由图3可以看出,液料比在20∶1和40∶1之间银耳结缔多糖提取得率随液料比的增大而提高,在40∶1和60∶1之间则快速降低,即在40∶1时银耳结缔多糖提取得率达到峰值后下降,并与其他处理差异显著。其原因可能是液料比过小不仅会导致多糖溶解不完全,也不利于多糖的溶出,并且也会导致后续醇沉等工艺难度加大,从成本节约角度考虑选择液料比为40∶1(mL/g)。

图3 不同料液比对银耳结缔多糖提取得率的影响Fig.3 Effect of different liquid-solid ratio on the yield of TPP
2.2 响应面优化实验结果
2.2.1 响应面回归模型的建立与分析 以银耳结缔多糖提取得率为指标,采用响应面优化银耳结缔多糖提取工艺的实验结果见表2。采用SAS8.0对实验数据进行回归拟合分析,可得到提取条件与以银耳结缔多糖提取得率之间的二次多项式模型为:Y=23.16667+3.22625X1+0.385X2+1.38625X3-7.434583X12+0.745X1X2- 0.7575X1X3-1.892083X22+0.37X2X3-4.109583X32。式中,Y为银耳结缔多糖提取得率的预测值;X1、X2、X3分别代表提取温度、液料比和提取时间的编码值。

表3 回归方程系数显著性检验表Table 3 Test of significance for regression equation coefficients
注:*差异显著(p<0.05),**差异极显著(p<0.01)。

表2 响应面实验设计与结果Table 2 Response surface experimental design and results

回归方程各项方差分析表明X12因素对银耳结缔多糖提取得率有极其显著的影响(p<0.01),X1和X32因素对银耳结缔多糖提取得率有显著的影响(p<0.05),而因子X2、X3、X22、X1X2、X1X3和X2X3对银耳结缔多糖提取得率影响不显著(p>0.05)。各因子对银耳结缔多糖提取得率的影响依次是X1(提取温度)>X3(提取时间)>X2(液料比)。
2.2.2 验证实验 经SAS8.0软件分析X1、X2和X3的代码值分别为0.217、0.160和0.156,将这三个值代入变换式,得到与之相对应理论组合值为:92.17 ℃、40.8∶1和4.16 h。为检验模型预测的准确性,方便实际操作,将最佳条件调整为:提取温度92 ℃、提取时间4.2 h、液料比41∶1(mL/g),理论计算提取得率达到23.66 mg/g。在此条件下进行验证实验,银耳结缔多糖提取得率为(23.41±0.92) mg/g,与模型预测值的相对误差为1.07%。表明实验所得回归方程的最大预测值与验证值非常接近,说明回归方程能较真实地反映各筛选因素的影响,建立的模型与实际情况比较吻合。值得一提的是,本实验方法所得银耳结缔的多糖提取得率23.41 mg/g,要明显低于同样采用传统热水浸提法所得银耳子实体的多糖含量166.30 mg/g。这可能与提取方法,特别是与银耳多糖不同部位中多糖含量不同有关,由于银耳结缔中的纤维素含量相对银耳子实体更高,致使银耳结缔中多糖含量要明显低于银耳子实体中多糖的含量[21]。
2.3 银耳结缔多糖红外光谱分析结果
由图4可以看出,银耳结缔多糖在3400 cm-1附近即3445.09 cm-1处有较强且宽的吸收峰,而3400 cm-1是多糖分子间或分子内O-H的伸缩振动峰,表明此处是O-H键的伸缩振动;2920 cm-1附近的吸收峰是-CH3与=CH2的C-H伸缩振动,而银耳结缔多糖在2924.68 cm-1处出现吸收谱带,表明银耳结缔多糖存在-CH3与=CH2的C-H键的伸缩振动;1400~1200 cm-1之间则是烷基C-H的变角振动吸收峰;以上三个吸收峰可以证明该样品为多糖类化合物[22]。1720 cm-1附近即1724.08 cm-1处出现了吸收峰,则表示银耳结缔多糖中存在C-O弯曲糖醛酸的振动。1418cm-1附近即1419.43 cm-1处出现了吸收峰,则表示银耳结缔多糖中存在-COO-中的C=O对称伸缩振动,1076 cm-1附近即1077.77 cm-1处出现了强宽峰,则银耳结缔多糖中存在吡喃型糖环,918 cm-1附近即917.96 cm-1出现了弱吸收峰,则表明银耳结缔多糖中存在吡喃环非对称环伸缩振动的特征峰,而799 cm-1附近即798.40 cm-1处出现的弱吸收峰,则证明银耳结缔多糖中存在甘露糖残基。此外,在920 cm-1和800 cm-1处吸收峰分别表示与之对应的是β-糖苷键和α-糖苷键[23-25],在608.84 cm-1处出现强吸收谱带,此处为-NH2的伸缩振动。综合以上条件分析可得出结论,银耳结缔多糖可能含有酸类、胺类、醇类化合物等[26-27]。

表4 银耳结缔多糖清除自由基EC50值Table 4 The EC50 values of scavenging capacities for free radicals of polysaccharides from Tremella fuciformis pedicel

图4 银耳结缔多糖的红外光谱图Fig.4 Infrared spectrum of polysaccharides from Tremella fuciformis pedicel
2.4 银耳结缔多糖抗氧化活性分析结果
银耳结缔多糖分别在DPPH自由基清除体系、ABTS+自由基清除体系和Fe3+-Fe2+氧化还原体系中抗氧化活性测定结果见表4。由表4可知,在所选质量浓度范围内,银耳结缔多糖对DPPH自由基、ABTS+自由基的清除率和还原能力均随着质量浓度的提高而增大,表明呈浓度-剂量效应关系。银耳结缔多糖在三种体系中的EC50值分别是6.59、4.04和4.94 mg/mL,表明银耳结缔多糖在三种评价体系中抗氧化能力强弱存在较大差异,相比较而言,银耳结缔多糖在ABTS自由基清除体系中的抗氧化能力表现最好。但银耳结缔多糖的抗氧化活性要低于文献报道的银耳多糖,如吴振等报道热风干燥银耳多糖的DPPH和还原力的EC50分别为2.19 mg/mL和3.48 mg/mL[28]。其原因是可能一方面与银耳结缔多糖为粗多糖有关,同时还可能与原料品种和部位有关,因为本实验选用原料为市场上直接购买的干银耳的结缔,银耳原料干制工艺不清楚,因而难以判断银耳品质。如国内外研究发现,真菌多糖的理化组成、水溶性等理化性质、分支度、分子量大小、黏度和高级螺旋结构等与其生物活性功能联系密切,并受到样品处理方法、提取工艺和干燥方法三大类因素的影响[4,29]。此外,吴振等的研究还表明,传统热风干燥相比于冷冻干燥和抽真空干燥对银耳多糖的抗氧化活性影响更大[28],类似的研究在白桦茸多糖和灵芝多糖上也有发生,说明传统高温干燥破坏了真菌多糖的品质和活性[30]。
3 结论
本研究采用单因素与响应面实验设计对银耳结缔多糖常规水提醇沉法的提取工艺参数进行了优化,影响银耳结缔多糖提取得率的主次顺序为提取温度>提取时间>液料比,实验优化所得银耳结缔多糖热水提取工艺条件为提取温度92 ℃、提取时间4.2 h和液料比41∶1(mL/g),在此条件下所得银耳结缔多糖实际提取得率为(23.41±0.92) mg/g。在此基础上对所得银耳结缔多糖除蛋白(Sevage试剂)后,进一步利用红外光谱和体外抗氧化体系分别对银耳结缔多糖的结构和抗氧化活性进行了分析测定,结果显示银耳结缔多糖对ABTS+和DPPH自由基均具有较好的清除作用,其EC50分别为4.04和6.59 mg/mL,同时,银耳结缔多糖还具有较强的还原力(EC50为4.94 mg/mL)。此外,银耳结缔中纤维素含量相对较高,这些可能是引起银耳结缔多糖抗氧化活性偏低的原因,但具体什么原因还有待于进一步深入研究。
值得一提的是,在生产过程中银耳结缔多作为下脚料而丢弃,本实验所得粗多糖提取工艺简单、可重复性强,因而具有较高的开发利用前景。
[1]刘健影.银耳多糖提取工艺优化及其在饮料中的应用[D]. 长春:吉林农业大学,2015.
[2]B Chen.Optimization of extraction ofTremellafuciformispolysaccharides and its antioxidant and antitumour activitiesinvitro[J].Carbohydrate Polymmers,2010,81(2):420-424.
[3]颜军,郭晓强,邬晓勇等.银耳茶的研制及其抗自由基的研究[J].食品科技,2006(10):205-207.
[4]黄秀锦.银耳多糖的提取、分离、纯化及其功能性质研究[J].食品科学,2008,29(1):134-136.
[5]W Xu,X Shen,F Yang,et al.Protective effect of polysaccharides isolated fromTremellafuciformisagainst radiation-induced damage in mice[J]. Radiat Res,2012,53(3):353-360.
[6]HJ Jeong,SJ Yoon,YR Pyun,et al.Polysaccharides from edible mushroom hinmogi(Tremellafuciformis)inhibit differentiation of 3T3-L1 adipocytes by reducing mRNA expression of PPARγ,C/EBPα,and leptin[J].Food Science &Biotechnology,2008,17(2):267-273.
[7]ZW Shi,Y Liu,Y Xu,et al.Tremella Polysaccharides attenuated sepsis through inhibiting abnormal CD4(+)CD25(high)regulatory T cells in mice[J].Cellular Immunology,2014,288(1-2):60-65.
[8]蔡淑妮,王晓梅,张忠山,等.银耳多糖的提取工艺及鉴定[J].食品工业,2014(7):58-60.
[9]吴琼,郑成,宁正祥,等.微波辅助萃取银耳多糖的研究[J]. 食品科技,2006(9):109-111.
[10]YZ Chen,L Zhao,Liu B,et al.Application of response surface methodology to optimize mimcrowave-assisted extraction of polysaccharide from Tremella[J].Physics Procedia,2012,24:429-433.
[11]陶瑞霄,贾冬英,姚开,等.高压提取银耳多糖研究[J].食品科技,2015(6):229-233.
[12]祁小妮,林楠楠,李振亮,等.生地黄多糖提取工艺的优化及抗氧化活性研究[J].食品与发酵工业,2016(2):231-235.
[13]杜新华.古田凤埔:银耳结缔头废料再利用[N].福建日报,2008-12-17(6).
[14]黄晓君,聂少平,王玉婷,等.铁皮石斛多糖提取工艺优化及其成分分析[J].食品科学,2013,34(22):21-26.
[15]王婉冰,徐子恒,王宏军,等.响应面实验优化海蓬子外种皮水溶性多糖提取工艺及其抗菌活性[J].食品科学,2015,36(14):5-9.
[16]R Re,N Pellegrini,A Proteggente,et al.Rice-EVANS.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999,26(9-10):1231-1237.
[17]T Hanato,H Kagawa,T Yasuhara,et al.Two new flavonoids and other constituents in licorice root:their relative astringency and radical scavenging effects[J].Chemical & Pharmaceutical Bulletin,1998,36(6):2090-2097.
[18]L Barros,P Baptista,ICFR Ferreira.Effect of Lactarius piperatus fruiting body maturity stage on antioxidant activity measured by several biochemical assays[J].Food and Chemical Toxicology,2007,45(9):1731-1737.
[19]CX Jiang,X Li,YP Jiao,et al.Optimization for ultrasound-assisted extraction of polysaccharides withantioxidant activityinvitrofrom the aerial root of Ficus microcarpa[J].Carbohydr Polym,2014,110(1):10-17.
[20]Q Zheng,D Ren,N Yang,et al.Optimization for ultrasound-assisted extraction of polysaccharideswith chemical composition and antioxidant activity from the Artemisia sphaerocephala Krasch seeds[J]. International Journal of Biological Macromolecules,2016,91:856-866.
[21]周帅飞,毛淑敏,秦红岩,等.银耳多糖的提取工艺研究[J].安徽农业科学,2013(27):11148-11149.
[22]马素云.银耳多糖提取纯化、结构特征及溶液性质研究[D].杭州:浙江大学,2012.
[23]L You,Q Gao,M Feng,et al.Structural characterisation of polysaccharides from Tricholoma matsutake and their antioxidant and antitumour activities[J].Food Chemistry,2013,138(4):2242-2249.
[24]ZS Zhang,XM Wang,ZP Han,et al.Purification,antioxidant and moisture-preserving activities of Polysaccharide from papaya[J].Carbohyd-rate Polymers,2012,87(3):2332-2337.
[25]L Wen,Q Gao,CW Ma,et al.Effect of polysaccharides from Tremella fuciformis on UV-induced photoaging[J].Journal of Functional Foods,2016,20:400-410.
[26]孙毓庆,胡育筑.分析化学(第二版)[M].北京:科学出版社,2006:328.
[27]M Kacurakova,P Capek,V Sasinkova,et al.FT2IR study of plant cell model compounds:pectic polysaccharides and hemi cellulose[J].Carbohydrate Polymers,2000,43(2):195-203.
[28]吴振,李红,罗杨,等.不同干燥方式对银耳多糖理化特性及抗氧化活性的影响[J].食品科学,2014,35(13):93-97.
[29]L ma,H Chen,W Zhu,et al. Effect of different drying methods on physicochemical properties and antioxidant activities of polysaccharides extracted from mushroom Inonotus obliquus[J]. Food Research International,2013,50(2):633-640.
[30]L Fan,J Li,K Deng,et al.Effects of drying methods on the antioxidant activities of polysac-charides extracted from Ganoderma lucidum[J]. Carbohydrate Polymers,2012,87(2):1849-1854.
Optimization the extraction process of polysaccharide by response surface methodology from theTremellafuciformispedicel and its antioxidant activity
SHI Xuan1,CHENG Xiao-qing2,YANG Yong1,TAN Hong-jun1,LIANG Xu-ming1,*,SHI Wen-juan3,SU Zhi-min1,3
(1.Chongqing Academy of Chinese Materia Medica,Chongqing 400065,China;2.College of Food Science,Hainan University,Haikou 570228,China;3.Chongqing Engineering Research Center for Tremella Nutrition Food Enterprises,Chongqing 409003,China)
Optimization of hot water extraction of polysaccharide fromTremellafuciformispedicel(TPP)were investigated using the single-factor test and the response surface methodology(RSM)in the paper. The property structure and antioxidant activities of TPP were analyzed after the crude polysaccharide was preliminarily separated by Sevage method. The results showed that the optimum technological conditions were extraction temperature 92 ℃,extraction time 4.2 h,liquid-solid ratio of 41∶1(mL/g),and the yield of TPP achieved the maximum of(23.41±0.92) mg/g. The evaluation of antioxidant activity suggested that TPP exhibited good antioxidant activity,and there was a certain dose-effect relation between polysaccharide concentration and eliminating rate. The EC50for reducing power and scavenging activities against ABTS+and DPPH radical were 4.94,4.04,and 6.59 mg/mL,respectively.
Tremellafuciformispedicel;polysaccharides;response surface methodology;antioxidant activity
2016-08-09
师萱(1980-),女,硕士,助理研究员,主要从事天然产物及保健食品研究与开发方面的研究,E-mail:shixuan0932@126.com。
*通讯作者:梁旭明(1979-),男,博士,副研究员,主要从事中药新药研发和天然产物方面的研究,E-mail:Liangxuming2004@yahoo.com.cn。
重庆市基本科研业务费计划项目(2014cstc-jbky-01902)。
TS255.1
B
1002-0306(2017)02-0297-06
10.13386/j.issn1002-0306.2017.02.049
