响应面优化蒲公英多酚超声波辅助乙醇提取工艺及其抗氧化性
2017-03-08于国泳李全宏
刘 杨,赵 婧,梁 莉,于国泳,李全宏,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.国家果蔬加工重点实验室,北京 100083)
响应面优化蒲公英多酚超声波辅助乙醇提取工艺及其抗氧化性
刘 杨1,2,赵 婧1,2,梁 莉1,2,于国泳1,2,李全宏1,2,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.国家果蔬加工重点实验室,北京 100083)
本实验以蒲公英全草为原料,选取超声波提取时间、超声波功率、料液比、超声提取温度四个因素为自变量,结合单因素实验结果,对蒲公英多酚超声波辅助提取工艺进行优化,最后对蒲公英不同部位多酚抗氧化活性进行评估。结果表明:四因素对提取率的影响大小依次是提取温度>超声波功率>超声提取时间>料液比;超声波辅助乙醇提取蒲公英多酚的最佳工艺条件为提取时间37 min、超声功率380 W、提料液比 1∶48、温度42 ℃,多酚平均提取率为3.68%±0.05%,与理论预测值3.72%误差值仅为0.94%。在优化条件下依次对蒲公英全草、叶片和根中的多酚进行提取并比较其抗氧化活性,三者均具有较强的抗氧化能力,蒲公英不同部位的抗氧化活性大小依次为蒲公英叶片>蒲公英全草>蒲公英根。
蒲公英,多酚,超声提取,响应面法,抗氧化性
蒲公英(TalraxacummongolicumHand.-Mass)为菊科多年生草本植物,叶子绿色,头状花序,种子上有白色冠毛结成的绒球[1]。蒲公英味苦、甘、寒,为101种药食同源植物之一[2-3]。中医认为蒲公英有清热解毒、利尿缓泻、保肝利胆等作用,药理研究也表明蒲公英具有广谱抗菌、提高免疫力、降脂降压和抗胃损伤等作用[4-6]。蒲公英的生物活性与植物体中的蒲公英醇、蒲公英素、酚酸类、黄酮类、三萜类和植物甾醇类等物质有关[7-8]。中国蒲公英资源丰富,分布广泛,适应性强,人工栽培技术和产业化种植正在逐年扩大[9],并且蒲公英在药品、食品、保健品等领域拥有非常广阔的应用前景。但目前,我国对蒲公英的利用还处于鲜食或制备浸膏上,对蒲公英功能成分的分析和精深加工远远落后于发达国家[10-12]。因此,进一步深入研究蒲公英全草功能成分对促进蒲公英深加工相关产业的发展具有重要意义。
酚酸一般含有一个羧基官能团,是酚类物质中的一类[13]。在人体及其他动物体内,酚酸除了具有清除自由基、抗氧化、抗肿瘤、抑菌等作用外,对抑制肥胖、提高免疫力、改善情绪等也体现出了一定的生物活性[14]。自1985年Wolbis M等[15]从蒲公英中分得7种酚酸类物质开始,对蒲公英酚酸类物质的研究逐渐开展。蒲公英中的酚酸主要有对羟基苯甲酸、对羟基苯乙酸、香荚兰酸、原儿茶酸、绿原酸及咖啡酸等[16]。其中,绿原酸为蒲公英具有抑菌作用的主要成分,绿原酸的含量是中药蒲公英质量的评价标准[8,17]。目前,对蒲公英多酚的研究主要集中在蒲公英中单一酚酸的提取,多酚的提取方式也比较传统,对蒲公英植物中多酚总体的提取、性质及应用的研究还不多见。贾梅珍等[18]报道了采用乙醇热回流法提取蒲公英中绿原酸的最佳工艺,此法耗时长、温度高。梁引库[19]采用热水浸提法提取蒲公英中的绿原酸;杨岚等[20]75%乙醇提取蒲公英花中的总酚酸,得到总酚平均含量为4.09%的提取液,并且表明此提取液对超氧阴离子自由基、羟自由基和油脂自氧化均有较好的清除效果;普义鑫[21]比较了甲醇、乙醇、丙酮、蒸馏水对槟榔多酚的提取效果,甲醇的提取率最高,蒸馏水最差,溶剂浸提法成本低、适用性强,但甲醇等有机溶剂对人体有害,提取效率低,不适合工业化生产。邢少青[22]比较了微波辅助及超声波辅助两种多酚提取方法,在正交优化条件下,超声提取法提取荷叶多酚的提取率为12.6%,而微波辅助法的提取率为11.8%,超声波提取因操作简单快速,提取率高,不破坏生物结构而显示出明显优势。
本研究以蒲公英全草为实验材料,利用超声波在乙醇提取过程中产生的空化和震动作用,缩短蒲公英多酚的提取时间,通过考察提取时间、超声波功率、超声提取温度及料液比的四个因素对多酚提取率的影响,采用响应面法优化蒲公英中多酚的提取工艺条件,并考察蒲公英全草、蒲公英叶片和蒲公英根的3个抗氧化指标,以揭示蒲公英不同部位的体外抗氧化活性,以期为蒲公英多酚的进一步功能性研究提供理论依据。
1 材料与方法
1.1 材料与仪器
蒲公英全草(TalraxacummongolicumHand.-Mass) 于2016年4月采自中国农业大学校园,除去土及枯黄叶,全草洗净,于-20 ℃预冷,真空冷冻干燥,粉碎后过80目筛,于避光处密封保存;绿原酸标准品 HPLC≥98%,上海源叶生物科技有限公司;无水乙醇、甲醇、Folin-Ciocalteu 显色剂、无水碳酸钠、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、三氯化铁、水杨酸、过氧化氢、硫酸亚铁 均为分析纯;6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 购于美国Sigma公司。
BP221S电子天平 德国Sartorius公司;九阳料理机 九阳股份有限公司;KQ-500DE型数控超声清洗器 昆山市超声仪器有限公司;LGJ-18冷冻干燥机 北京松源华兴科技发展有限公司;MVP 10型旋转蒸发仪 德国IKA公司;TGL-16A台式高速冷冻离心机 长沙平凡仪器仪表有限公司;UV-2450型紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 蒲公英多酚的提取 准确称取0.3 g蒲公英全草冻干粉,以一定的料液比加入70%的乙醇水溶液。在一定温度、功率下超声提取一定时间后,于10000×g,5 ℃条件下离心10 min。上清液旋转蒸发至小于25 mL,转入25 mL容量瓶,用70%的乙醇水溶液定容,备用。
1.2.2 单因素实验 根据文献报道和预实验的结果,影响多酚超声波提取效果的主要因子有超声时间、超声功率、料液比和提取温度。实验设置了提取功率(100、200、300、400及500 W)、提取时间(10、20、30、40、50及60 min)、液料比(1∶30、1∶50、1∶70、1∶90及1∶110 g/mL)以及提取温度(20、30、40、50、60、70 ℃)四个单因子,固定因素水平为超声提取功率200 W、提取时间30 min、料液比1∶50及提取温度30 ℃,分别考察了这四个因素对蒲公英多酚提取率的影响,以确定各因子的影响效果和适宜的参数范围。
1.2.3 响应曲面优化实验设计 以Design-Expert 8.0.6为统计分析软件,根据Box-Behnken的中心组合实验设计原理,结合单因素实验结果,以超声提取时间(A)、超声波功率(B)、料液比(C)和超声提取温度(D)为自变量,蒲公英多酚提取率(Y)为响应值,采用四因素三水平的响应面分析法进行实验设计,因素水平设计见表1。
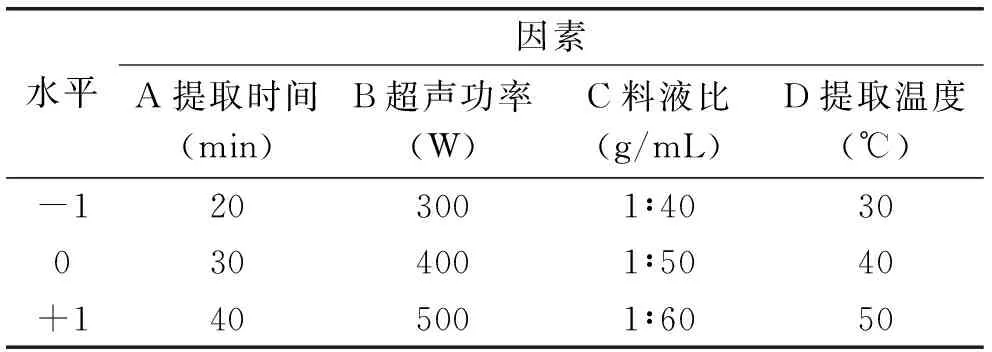
表1 响应面分析实验设计因素与水平Table 1 Variables and levels in response surface design
1.2.4 多酚含量的测定 多酚的测定采用Folin-Ciocalteu比色法[23]。
1.2.4.1 标准曲线的制作 以70%乙醇水溶液分别配制100、150、200、250、300、350、400、450及500 μg/mL绿原酸标准溶液。准确量取1.0 mL于10 mL容量瓶中,各加入6 mL蒸馏水,摇匀后加入0.5 mL Folin-Ciocalteu试剂,再次摇匀。5 min之后,加入1.5 mL 20%(m/V)Na2CO3溶液,混匀后用蒸馏水定容至10 mL。在30 ℃下静置2 h,然后用分光光度计测定溶液在765 nm处的吸光值。以绿原酸标准溶液的质量浓度(μg/mL)为横坐标,吸光度为纵坐标,得线性回归方程y=0.0214x+0.1614,R2=0.9994。
1.2.4.2 样品的测定 精密吸取蒲公英多酚酸提取溶液1.0 mL,按1.2.4.1方法进行操作并测定吸光度,每个实验重复三次。按以下公式计算提取率:
式中:C提取液多酚酸的浓度(μg/mL);V为粗提液体积(mL);N为稀释倍数;W为原料重量(g)。
1.2.5 抗氧化活性的测定 在响应面法优化提取工艺参数的基础上,分别对蒲公英的全草、叶子和根中的多酚进行提取,进行抗氧化活性的测定。
1.2.5.1 总还原能力的测定 取1.0 mL不同质量浓度的样品溶液,分别加入1.5 mL 0.2 mol/L的磷酸盐缓冲溶液(pH6.6)和1.5 mL 1%(m/V)的铁氰化钾溶液,混匀后于50 ℃水浴锅中反应20 min,立即冰浴冷却,加入1.0 mL 10%三氯乙酸溶液,于4500 r/min条件下离心10 min。取其上清液1 mL,加入1 mL 0.1% FeCl3溶液和2 mL蒸馏水,充分混匀,10 min后测定700 nm处吸光值,以吸光值表示总还原能力的大小。以70%无水乙醇作空白参比,同时以Trolox作阳性对照[24]。
1.2.5.2 DPPH自由基清除能力 DPPH自由基清除能力按照Ardestani等的方法进行测定[25]。吸取不同质量浓度梯度的样品溶液1.0 mL,加入2.0 mL 0.1 mmol/L无水乙醇配制的DPPH试剂,震荡混匀后避光反应30 min,在517 nm处测定吸光值。以70%无水乙醇作空白参比,同时以Trolox作阳性对照。
式中:A0为空白对照的吸光值;A1为样品的吸光值。
1.2.5.3 羟自由基清除能力的测定 取1.5 mL不同质量浓度的样品溶液,分别加1.0 mL 2.5 mmol/L的水杨酸溶液、1.0 mL 5 mmol/L的FeSO4溶液和2.0 mL蒸馏水,充分混匀,加入1.0 mL 5 mmol/L的H2O2,置于37 ℃恒温水浴锅中反应30 min,立即冰浴冷却,于510 nm波长处测定其吸光度,以70%无水乙醇作空白参比,同时以Trolox作阳性对照[26]。
式中:A0为空白对照吸光度;A1为样品溶液吸光度(不加H2O2);A2为样品溶液吸光度(加H2O2)。
1.3 数据处理
所有数据均为3次重复实验的平均值,并表示为平均值±标准差,单因素实验数据运用Origin7.5软件绘制趋势曲线图;响应面实验采用Design-Expert 8.0.6软件进行方差分析,并优化出最佳提取工艺。
2 结果与分析
2.1 单因子实验结果
2.1.1 超声提取时间的影响 由图1可以看出,蒲公英多酚提取率在30 min达到峰值,此后多酚提取率下降明显。在一定范围内,提取率随超声时间的延长而提升,但增高幅度有所下降[27]。但是,随着超声提取时间的延长,热效应也会逐渐增强,温度的上升导致对热敏感的酚酸的转化降解[14],反而降低了提取率。因此,最佳超声提取时间为30 min。
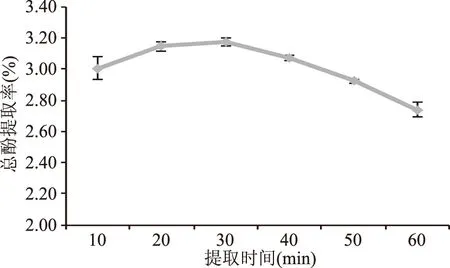
图1 提取时间对蒲公英多酚提取率的影响Fig.1 Effects of extraction time on the extraction of dandelion polyphenols
2.1.2 超声提取功率的影响 由图2可见,蒲公英多酚提取率随着超声功率的增大而呈现先上升后下降趋势,400 W时达到最大值,随后提取率下降。超声波在提取溶液中产生的空化效应和机械作用可以有效破碎植物细胞壁[28],使蒲公英细胞中的结合酚类游离出来,因此,在一定范围内超声波功率的提高有利于多酚的提取。当功率过高时,游离出来的多酚可能会在超声波的机械作用下分解,同时也会使细胞内的脂溶性物质更多的溶入提取液中,影响多酚提取。

图2 提取功率对蒲公英多酚提取率的影响Fig.2 Effects of ultrasound power on the extraction of dandelion polyphenols
2.1.3 提取温度的影响 由图3可知,在温度20~40 ℃,随着温度的升高,分子运动加快,细胞壁渗透性增强,多酚的溶解度升高,提取率随温度的上升而逐渐增加。40~70 ℃时,随着提取温度的进一步上升,蒲公英中杂质的溶出量增加,不溶性杂质吸附了多酚类物质;并且过高的温度引起了酚类化合物的降解,提取率缓慢下降[29]。因此,选定最佳提取温度为40 ℃。
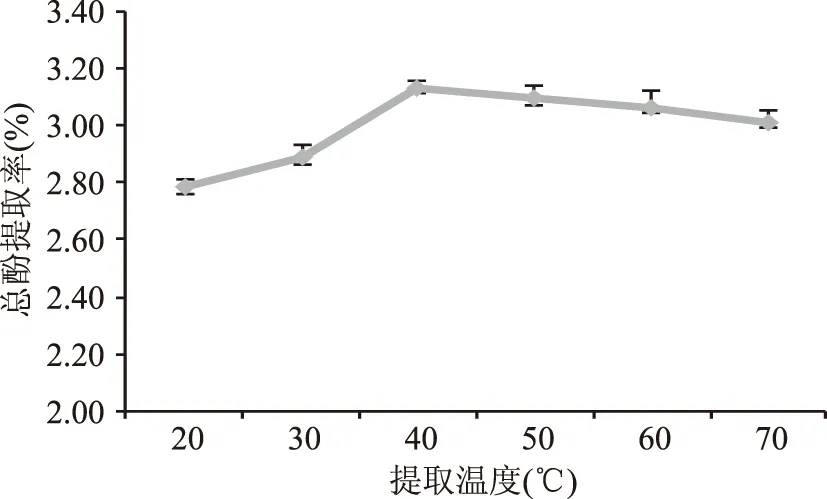
图3 提取温度对蒲公英多酚提取率的影响Fig.3 Effects of temperature on theextraction of dandelion polyphenols
2.1.4 料液比的影响 溶剂用量增加有利于多酚物质溶解析出,图4中,料液比在1∶30~1∶50的范围内,多酚的提取率上升迅速。当料液比达到1∶50后,进一步增加溶剂量提取率缓慢下降,可能原因是蒲公英中一些其他物质如多糖溶解,妨碍了多酚的提取分离。因此,选取最佳料液比为1∶50。
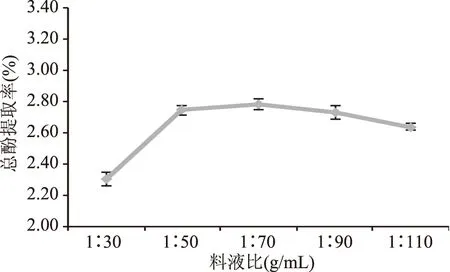
图4 料液比对蒲公英多酚提取率的影响Fig.4 Effects of solid-liquid on theextraction of dandelion polyphenols
2.2 响应曲面优化实验
2.2.1 Box-Behnken实验设计与结果 根据Box-Behnken响应面设计原理,在单因素实验基础上,以70%乙醇为提取剂,以蒲公英多酚提取率为响应值,响应面实验设计及结果见表2。
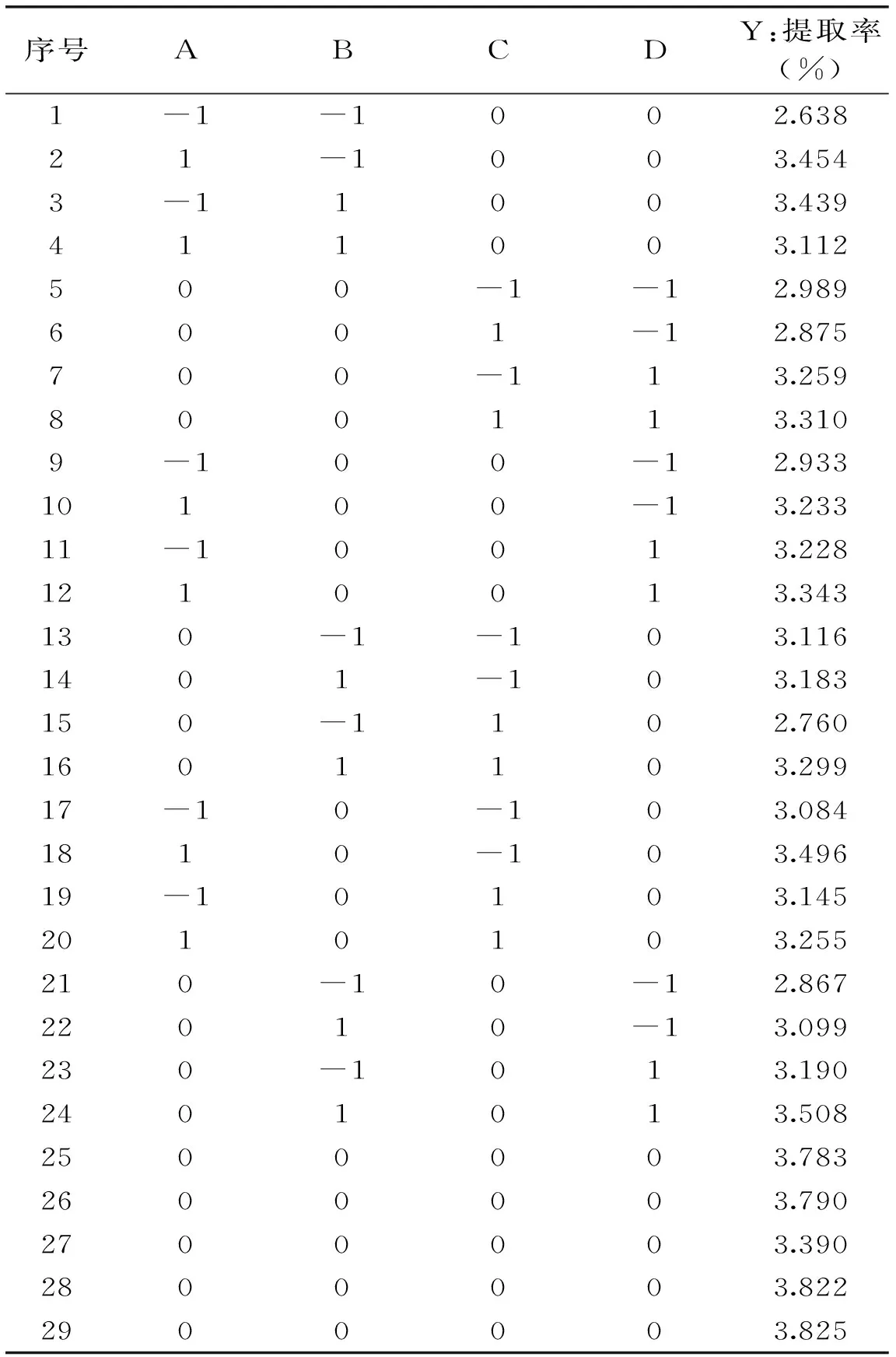
表2 响应面实验设计与结果Table 2 Response surface experimental design and results
2.2.2 模型的建立与显著性检验 应用Design Expert进行回归拟合分析,可得到四因素与多酚提取率之间的二次多项式模型为:Y=3.72+0.12A+0.13B-0.040C+0.15D-0.29AB-0.076AC-0.046AD+0.12BC+0.021BD+0.041CD-0.22A2-0.31B2-0.30C2-0.29D2。式中,Y为蒲公英多酚提取率的预测值。
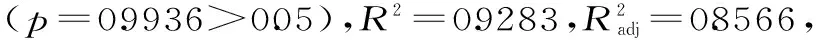
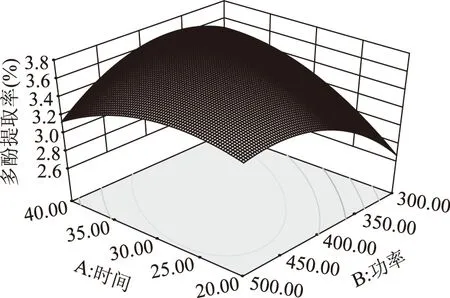
图5 各因素交互作用影响多酚提取量的响应面图Fig.5 Response surface graphs showing the interactiveeffects of various factors on the yield of polyphenols
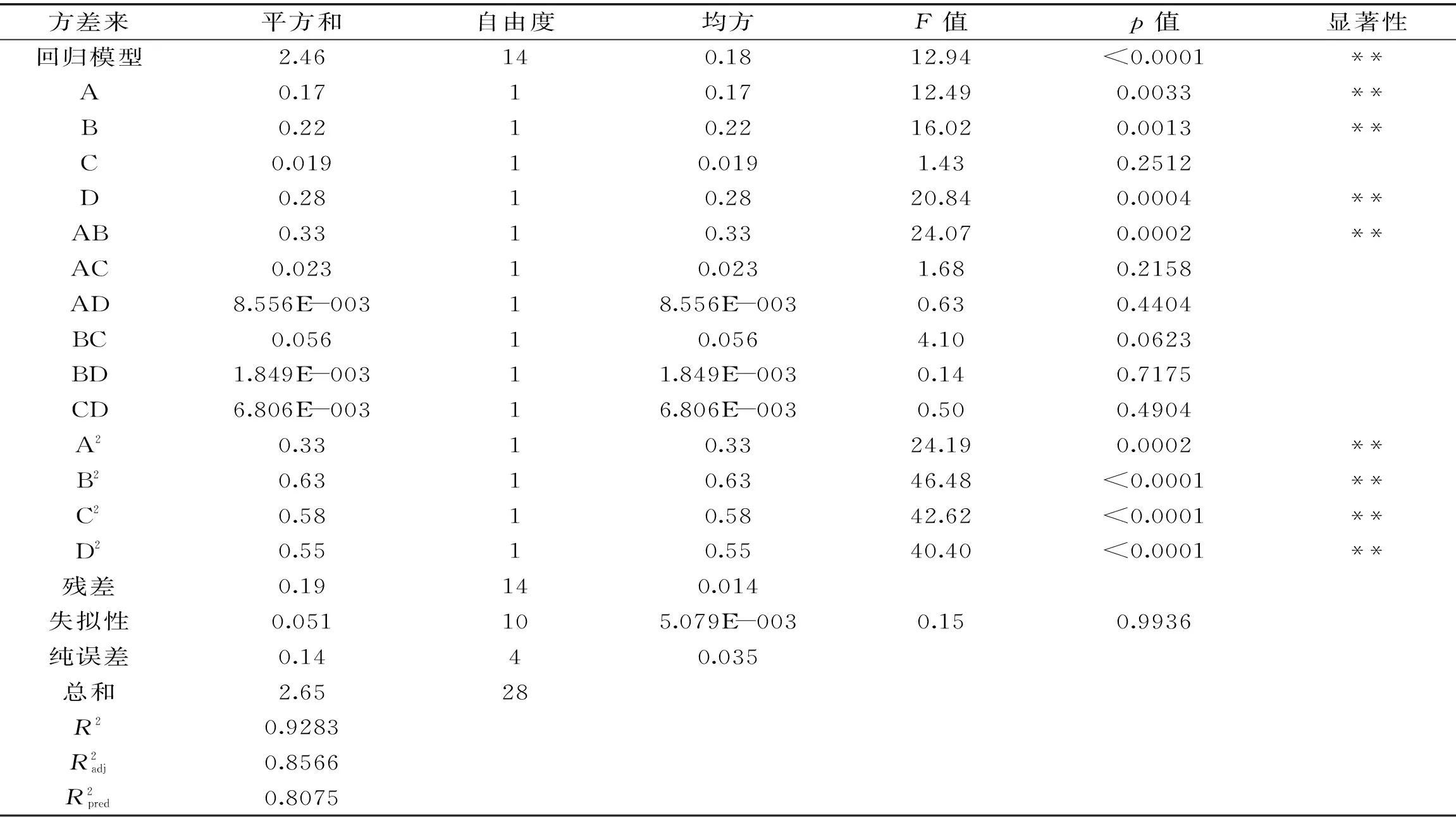
表3 回归方程系数显著性检验表Table 3 Test of significance for regression equation coefficients
注:*差异显著(p<0.05),**差异极显著(p<0.01)。
由图5可见,响应面坡度比较陡峭,说明A提取时间和B超声波功率对蒲公英多酚提取率的影响较大。在A提取时间在23~40 min、B超声功率在320~420 W的范围内存在极值,即两者之间存在较好的交互作用。提取时间和超声功率的交互作用显著可能是因为功率越大提取效率越高,所需时间越短,而在一定功率下处理较长时间则会引起提取效率下降,因此对蒲公英全草中多酚的提取率交互作用显著。
2.2.3 最佳条件的预测及验证实验 通过回归模型的预测,得到超声波辅助提取蒲公英全草中多酚类物质的最佳提取工艺为:提取时间36.97 min、超声波功率381.13 W、提料液比1∶48.03、超声提取温度41.73 ℃,此时多酚类化合物的理论提取率最大为3.72%。结合生产实际,将各因素进行调整为:提取时间37 min、超声波功率380W、料液比1∶48、超声提取温度42 ℃。在此条件下进行6次平行实验进行验证,多酚平均提取率为(3.67%±0.05%),与理论预测值3.71775%误差值仅为0.94%,且经t检验的结果差异不显著(p>0.1),证实了该模型的有效性。

图6 蒲公英不同部位的总还原能力(A)、DPPH自由基清除能力(B)和羟自由基清除能力(C)Fig.6 Total reducing power(A),DPPH(B)and hydroxyl free radical scavenging abilities(C)of different parts of dandelion
2.3 蒲公英不同部位的抗氧化活性分析
在最优提取工艺条件下分别对蒲公英全草、蒲公英叶片和蒲公英根中的多酚进行提取,测定其多酚提取率分别为蒲公英全草(3.6638%±0.0296%)、蒲公英叶片(3.9722%±0.0169%)、蒲公英根(3.3658%±0.0173%)。进一步测定三者的总还原能力、DPPH自由基和羟自由基的清除能力,结果如图6所示。
由图6可知,蒲公英不同部位提取出的多酚均具有一定的抗氧化能力,且随质量浓度的升高呈递增的趋势,表现出明显的量效关系。相同质量浓度条件下,不同部位蒲公英多酚的总还原能力、DPPH自由基和羟自由基的清除能力依次为蒲公英叶子>蒲公英全草>蒲公英根。蒲公英不同部位多酚总还原能力要明显高于Trolox,而DPPH清除能力和羟自由基清除率要低于Trolox,可能原因是DPPH与Trolox单电子配对效率不高,因此DPPH的褪色程度减慢。
3 结论
采用超声辅助乙醇提取蒲公英中的多酚物质,在单因素实验基础上,通过响应面Box-Benhnken 实验设计,建立了蒲公英多酚得率的二次多项式数学模型,优化出超声辅助提取蒲公英全草中多酚的最佳工艺条件为:提取时间37 min、超声功率380 W、料液比1∶48、提取温度42 ℃。在此条件下进行6次平行实验进行验证,多酚平均提取率为(3.68%±0.05%)与预测值3.72%相差不大。另外,蒲公英多酚具有较强的抗氧化作用,在一定范围内,随着质量浓度升高呈现抗氧化能力上升趋势,通过对蒲公英不同部位的总还原能力、DPPH自由基和羟自由基清除能力测定发现,抗氧化能力由高到低依次为蒲公英叶片、蒲公英全草、蒲公英根。
[1]杨月欣.中国功能食品原料基本成分数据表[M].北京:中国轻工业出版社,2013:56.
[2]龚祝南,张卫明,刘常宏,等.中国蒲公英属植物资源[J].中国野生植物资源,2001(3):9-14,5.
[3]查德忠,王国辰.中国中医药年鉴[M].北京:中国中医药出版社,2015:365.
[4]史栋栋.蒲公英代谢物的抗乳腺癌细胞MCF-7活性成分及其作用机理研究[D].上海:上海交通大学,2014.
[5]Ishawu Iddrisu,Ibok Oduro,Marina Aferiba Tandoh,et al. Anti-diabetic effect of dandelion leaves and roots in type two diabetic patients[J]. Nutrition & Food Science,2015,45(3):479-492.
[6]Davaatseren Munkhtugs,Hur Haeng Jeon,Yang Hye Jeong,et al. Dandelion leaf extract protects against liver injury induced by methionine and choline-deficient diet in mice[J]. Journal of Medicinal Food,2012,16(1):26-33.
[7]刘雅杰,于德江,李宝荣.蒲公英属植物的药用价值[J].中国野生植物,1990(3):31.
[8]谢沈阳,杨晓源,丁章贵,等.蒲公英的化学成份及其药理作用[J].天然产物研究与开发,2012(1):141-151.
[9]钟淑梅.蒲公英人工加倍及其应用价值研究[D].武汉:华中农业大学,2010.
[10]林云,江林,蒋健,等.蒲公英的药理作用研究进展[J].中国现代中药,2011(8):42-47.
[11]孙玉顺,王博,姜秋杰,等.野菜蒲公英的开发与利用[J].食品研究与开发,200(6):101-103.
[12]Hagymási K,Blázovics A,Fehér J,et al.Theinvitroeffect of dandelions antioxidants on microsomal lipid peroxidation[J]. Phototherapy Research,2000,14(1):43-44.
[13]Stalikas C D. Extraction,separation,and detection methods for phenolic acids and flavonoids[J]. Journal of Separation Science,2007,30(18):3268-3295.
[14]张东明.酚酸化学[M].北京:化学工业出版社,2009:39.
[15]Wolbis Maria,Krolikowska Maria. Polyphenolic compounds of dandelion[J]. Acta pol Pharm,1985,42(2):215-217.
[16]凌云,鲍燕燕,朱莉莉,等.蒲公英化学成分的研究[J].中国药学杂志,1997(10):10-12.
[17]国家药典委员会.2015中华人民共和国药典[M].北京:中国医药科技出版社出社,2015:35:2-353.
[18]贾梅珍,冯昕.蒲公英中绿原酸的提取及抑菌活性的初步研究[J].食品工业,2013(10):14-17.
[19]梁引库.巨大型蒲公英绿原酸的分离纯化及其抑菌实验研究[J].食品科技,2013(6):227-230.
[20]杨岚,李华峰,刁海鹏,等.蒲公英花中总酚酸和总黄酮含量测定及其抗氧化性能研究[J].食品科学,2011(17):160-163.
[21]普义鑫.槟榔多酚提取、纯化及组分分析[D].株洲:中南林业科技大学,2012.
[22]邢少青.荷叶中多酚类化合物的提取、分离工艺及其指纹图谱的研究[D].武汉:武汉理工大学,2009.
[23]Singleton VL,Orthofer R,Lamuela-Raventos RM.Analysis of total phenols and other oxidation substrates and antioxidant by means of Folin-Ciocalteu reagent[J]. Methods in Enzymology,1999(299):152-178.
[24]郭庆启,张娜,李梦云,等.落叶松松塔成分、抗氧化能力与海拔高度的相关性研究[J].北京林业大学学报,2013,35(1):59-63.
[25]Ardestani Amin,Yazdanparast Razieh.Antioxidant and free radical scavenging potential of Achillea santolina extracts[J]. Food Chemistry,2007,104(1):21-29.
[26]江慎华,王书源,马海乐,等.丁香活性物质提取工艺优化与抗氧化活性研究[J].农业机械学报,2010,41(1):132-138.
[27]徐菊茂.杭白菊中黄酮类成分的提取动力学研究[J].中国药业,2012,21(16):31-32.
[28]王成会,林书玉.超声提取机理分析-中国声学学会2007年青年学术会议论文集[C].中国声学学会青年工作委员会,2007(2):452-454.
[29]Pinelo M,Rubilar M,Jerez M,et al. Effects of solvent,temperature,and solvent-to-solid ratio on the total phenolic content and antiradical activity of extracts from different components of grape pomace[J].Journal of Agricultural and Food Chemistry,2005,53(6):2111-2117.
Optimization of ultrasonic-assisted alcohol extraction of polyphenols from dandelion and their antioxidant activity
LIU Yang1,2,ZHAO Jing1,2,LIANG Li1,2,YU Guo-yong1,2,LI Quan-hong1,2,*
(1.College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China;2.Fruits and Vegetables Processing Key Laboratory,Beijing 100083,China)
This study aimed to optimize the ultrasonic-assisted extraction of polyphenols from dandelion using single-factor experiments and response surface methodology. The antioxidant activity of the extracted flavonoids was evaluated. The optimal extraction conditions were determined as follows:the time of ultrasonic-assisted extraction 37 min,ultrasound power 380 W,solid-to-liquid ratio 1∶48 g/mL and temperature 42 ℃. Under these conditions,the predicted and experimental extraction yield of polyphenols was(3.68%± 0.05%)and 3.72%,respectively. The good consistency indicated the mathematical model could fit experimental data well. Polyphenols compounds were extracted from the whole plants,leaves or roots of dandelions under the optimal conditions,and their antioxidant activities were evaluated and compared. The polyphenols extracted from both parts possessed high total reducing power. DPPH and hydroxyl free radical scavenging abilities. The antioxidant activity of different parts of dandelion was in the decreasing order:leave>whole plant>root.
dandelion;polyphenols;ultrasonic-assisted extraction;response surface methodology;antioxidant activity
2016-08-09
刘杨(1992-),女,硕士研究生,研究方向:天然产物与功能因子,E-mail:liuyangr@yeah.net。
*通讯作者:李全宏(1966-),男,博士,教授,研究方向:天然产物与功能食品,E-mail:liquanhong66@163.com。
TS201.1
B
1002-0306(2017)02-0287-06
10.13386/j.issn1002-0306.2017.02.047
