香茶藨子叶片总酚、总黄酮提取及抗氧化性研究
2017-03-08邹维娜徐启江杜伟伟李灵玉
邹维娜,王 微,*,徐启江,杜伟伟,李灵玉
(1.东北林业大学,森林植物生态学教育部重点实验室,黑龙江哈尔滨 150040;2.东北林业大学,林业生物制剂教育部工程研究中心,黑龙江哈尔滨 150040; 3.东北林业大学,生物资源生态利用国家地方联合工程实验室,黑龙江哈尔滨 150040;4.东北林业大学生命科学学院,林木遗传育种国家重点实验室,黑龙江哈尔滨 150040)
香茶藨子叶片总酚、总黄酮提取及抗氧化性研究
邹维娜1,2,3,王 微1,2,3,*,徐启江4,*,杜伟伟1,2,3,李灵玉1,2,3
(1.东北林业大学,森林植物生态学教育部重点实验室,黑龙江哈尔滨 150040;2.东北林业大学,林业生物制剂教育部工程研究中心,黑龙江哈尔滨 150040; 3.东北林业大学,生物资源生态利用国家地方联合工程实验室,黑龙江哈尔滨 150040;4.东北林业大学生命科学学院,林木遗传育种国家重点实验室,黑龙江哈尔滨 150040)
目的:获得微波辅助提取香茶藨子叶片中总酚及总黄酮的最佳工艺,以及香茶藨子叶片中总酚及总黄酮的体外抗氧化活性。方法:在单因素的基础上,采用响应面法对影响总酚和总黄酮提取量的主要因素进行分析,探讨微波辅助提取香茶藨子叶片中总酚及总黄酮的最优工艺,并与超声提取、索氏提取进行比较。采用DPPH和FRAP法对香茶藨子叶片中总酚及总黄酮的自由基清除能力和总抗氧化活性进行评价。结果:最佳的提取工艺条件为:提取温度58 ℃,液固比39∶1 mL/g,乙醇浓度57%,提取时间15 min和微波功率600 W,此条件下总酚及总黄酮的提取量分别为99.89、38.16 mg/g。微波辅助提取得到的香茶藨子叶片提取物对DPPH自由基有很好的清除作用,IC50值为0.0445 mg/mL,此外其还有较高的总抗氧化能力,FRAP值为4.832 mmol/g。结论:优选的总酚、总黄酮提取工艺稳定可行,香茶藨子叶片中总酚及总黄酮有较好的抗氧化活性,为其研究开发提供一定的科学依据。
香茶藨子,总酚,总黄酮,响应面法,微波辅助提取,抗氧化
香茶藨子(RibesodoratumWendl.)为虎耳草科茶藨子属落叶灌木,又名黄花茶藨子。茶藨属植物为浆果类资源,被称为第三代新兴果树[1]。香茶藨子原产北美洲,在我国东北及华北地区多有栽培[2]。耐寒力强,在东北、华北及西北地区冬季不需要采取防护措施即可安全越冬[3]。
茶藨子属植物的果实、叶片及芽中含有大量的营养成分[4]。现有研究表明:茶藨子属植物中含有槲皮素、芦丁、异槲皮苷、黄芩苷、杨梅素、山柰酚[5]、没食子酸、香草酸、没食子儿茶素等[6]多种有效成分。酚及黄酮类活性化合物不仅对保护心血管系统,抗癌,抗病毒,治疗咳嗽、风湿、冠心病、肝脏及动脉硬化等会起到一定治疗作用[7-9],也具有抗氧化和抗炎活性[10]。因此,茶藨子属植物在医药、食品保健等领域都有广阔的应用前景。
目前对于茶藨子属植物的研究与应用方面多集中于黑茶藨子,进而对黑茶藨子的需求量日渐增多,盲目开发及人为破坏导致其群体数量及分布范围变小[11],将阻碍其资源和产品的利用,所以当务之急是寻找一种新的替代性资源,作为同属植物的香茶藨子可成为首选考虑,现在对于香茶藨子的研究多集中于栽培管理方面,对其酚及黄酮类活性物质的提取工艺、抗氧化作用鲜有报道。本文以香茶藨子叶为研究对象,对微波辅助提取、超声提取、索氏提取进行了比较,与常规提取方法相比,微波辅助提取具有节能、省时、高效等优点[12],此外,该方法在提取过程中无粉尘、有害气体、余热产生,符合绿色环保要求。随后,对香茶藨子叶片中总酚和总黄酮的微波辅助提取工艺进行优化并研究其抗氧化活性,为香茶藨子的开发利用提供科学理论依据。
1 材料与方法
1.1 材料与仪器
香茶藨子叶片 采于哈尔滨东北林业大学知园,晾干,粉碎,过200目筛,置阴凉干燥处备用;总抗氧化能力检测试剂盒(FRAP法) 碧云天生物技术有限公司;VC、DPPH、Folin-Ciocalteu(2N) 美国Sigma公司;没食子酸、芦丁标准品 南京泽郎医药科技有限公司;碳酸钠、亚硝酸钠、硝酸铝、氢氧化钠、乙醇 均为市售分析纯。
MAS-II微波反应罐 新仪微波化学科技有限公司;HX-200A植物粉碎机 永康市溪岸五金药具厂;WK891型电热恒温鼓风干燥箱 重庆四达实验仪器厂;SHB-III型循环水式多用真空泵 郑州长城科工贸有限公司;FA1104电子分析天平 上海天平仪器厂;721可见分光光度计 上海佑科仪器仪表有限公司;Infinite 200 PRO NanoQuant酶标仪 上海安景科技有限公司;KQ-250DB型数控超声波清洗器 昆山市超声仪器有限公司;索氏提取器 天津玻璃仪器厂。
1.2 实验方法
1.2.1 标准工作曲线的绘制 以没食子酸为标准品,波长的测定参考文献[13],采用Folin-Ciocalteu法测得总酚含量。取40 μL不同浓度(0、100、200、400、600、800及1000 μg/mL)没食子酸于离心管中,分别加入1.8 mL稀释20倍的Folin-Ciocalteu试剂(2N)。混合均匀避光静置5 min后,添加1.2 mL Na2CO3(7.5%)避光静置1~2 h,取澄清液用可见分光光度计在波长765 nm处测吸光度,以吸光度(A)为纵坐标,没食子酸质量浓度(μg/mL)为横坐标,绘制没食子酸标准曲线,得标准工作曲线方程为:y=0.0014x+0.038,R2=0.9993。
以芦丁为标准品,采用NaNO2-Al(NO3)3比色法测总黄酮含量,参考韩志萍等的方法稍作调整[14]。取0.2 mL不同浓度(0、50、100、200、300、400、500 μg/mL)芦丁于离心管中,分别加入2.8 mL蒸馏水,加5%亚硝酸钠水溶液0.5 mL,放置6 min。加10%硝酸铝0.5 mL,混匀后放置6 min。加入5%氢氧化钠溶液2.5 mL,混匀,放置15 min后,蒸馏水定容至10 mL(加3.5 mL水)。用可见分光光度计,在λ=510 nm处测吸光度,以吸光度(A)为纵坐标,芦丁质量浓度(μg/mL)为横坐标,绘制芦丁标准曲线,得标准工作曲线方程为:y=0.0002x+0.0036,R2=0.9991。
1.2.2 香茶藨子叶片中总酚及总黄酮提取量的测定 称取1.00 g香茶藨子叶片粉末,在一定的温度、乙醇浓度、液固比下提取,抽滤,离心,定容。移取一定量待测液按1.2.1方法测定吸光度,按下式计算总酚及总黄酮提取量。
总酚/总黄酮提取量(mg/g)=(C×V×n)/m
式中:C代表根据回归方程计算得到的质量浓度(mg/mL),V代表提取液总体积(mL),n代表稀释倍数,m代表香茶藨子叶片粉末的质量(g)。
1.2.3 香茶藨子叶片中总酚及总黄酮的提取
1.2.3.1 微波法提取 称取1.00 g香茶藨子叶片粉末,加入一定量的乙醇后放于微波仪器中设置不同的条件进行提取(具体参考数值详见1.2.4单因素实验设计),抽滤,离心,定容,每组实验重复3次。移取一定量待测液按1.2.1方法测定吸光度。
1.2.3.2 超声法提取 称取1.00 g香茶藨子叶片粉末,加入50%乙醇30 mL,于50 ℃、功率250 W条件下超声提取30 min,重复3次,提取液抽滤,离心,定容,移取一定量待测液按1.2.1方法测定吸光度。
1.2.3.3 索氏法提取 称取1.00 g香茶藨子叶片粉末,加入50%乙醇30 mL,于50 ℃条件下提取2 h,重复3次,提取液抽滤,离心,定容,移取一定量待测液按1.2.1方法测定吸光度。
1.2.4 微波提取的单因素实验设计 分别以不同提取温度、液固比、乙醇浓度、提取时间、微波功率作为单因素,考察各因素对总酚、总黄酮提取量的影响,每组实验重复3次。
1.2.4.1 微波温度的影响 在液固比30∶1 mL/g,乙醇浓度50%,提取时间15 min,微波功率600 W的条件下,探讨微波温度(30、40、50、60、70 ℃)对香茶藨子叶片中总酚、总黄酮提取量的影响。
1.2.4.2 液固比的影响 在微波温度60 ℃,乙醇浓度50%,提取时间15 min,微波功率600 W的条件下,探讨液固比(10∶1、20∶1、30∶1、40∶1、50∶1 mL/g)对香茶藨子叶片中总酚、总黄酮提取量的影响。
1.2.4.3 乙醇浓度的影响 在微波温度60 ℃,液固比40∶1 mL/g,提取时间15 min,微波功率600 W的条件下,探讨乙醇浓度(10%、30%、50%、70%、90%)对香茶藨子叶片中总酚、总黄酮提取量的影响。
1.2.4.4 提取时间的影响 在微波温度60 ℃,液固比40∶1 mL/g,乙醇浓度50%,微波功率600 W的条件下,探讨提取时间(5、10、15、20、25 min)对香茶藨子叶片中总酚、总黄酮提取量的影响。
1.2.4.5 微波功率的影响 在微波温度60 ℃,液固比40∶1 mL/g,乙醇浓度50%,提取时间15 min的条件下,探讨微波功率(300、400、500、600、700 W)对香茶藨子叶片中总酚、总黄酮提取量的影响。
1.2.5 响应面优化实验设计 综合单因素实验结果,利用响应面分析法进行提取工艺条件的优化[15]。选取提取温度、液固比、乙醇浓度作为响应变量,以总酚及总黄酮提取量为响应值,根据Box-Benhnken中心组合设计原理进行三因素三水平实验设计,实验因素和水平见表1。
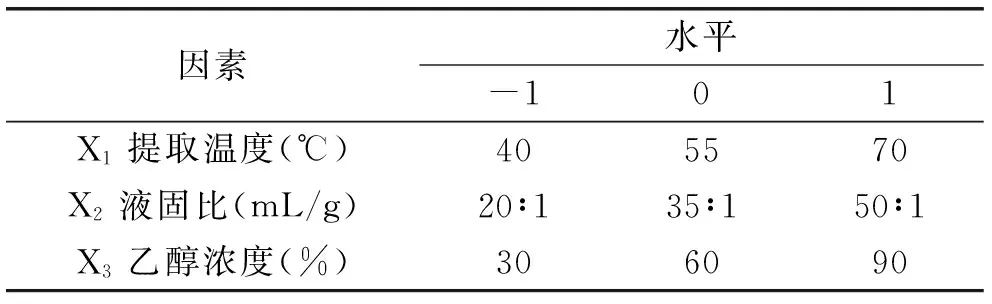
表1 响应面分析因素与水平Table 1 Factors and levels of response surface methodology
1.2.6 香茶藨子叶片提取物的抗氧化活性测定 将香茶藨子叶片在优化后的微波提取工艺及其他不同方法下得到的提取物进行旋干,精密称取VC和旋干粗提物2.00 mg,再用2.5 mL乙醇将其溶解,然后配制成一系列不同浓度的VC和样品溶液,其浓度分别为0.8、0.4、0.2、0.1、0.05、0.025、0.0125 mg/mL,备用。
1.2.6.1 对DPPH自由基清除率的测定 DPPH溶液为紫红色,在517 nm处有最大光吸收,通过加入抗氧化剂后吸光值的下降表示对自由基的清除作用。取0.1 mL不同浓度的样品乙醇溶液与1.4 mL的乙醇溶液混合,再加入1 mL DPPH(0.04 mg/mL)放置于避光处70 min,反应完成后进行检测,初始吸光度以1.5 mL的55%乙醇溶液与1 mL DPPH(0.04 mg/mL)作为混合液。在517 nm处测定样品溶液吸光值,每个样品重复测定3次,结果取平均值[16]。
DPPH自由基清除率实验计算公式:DPPH清除能力(%)=(1-As/Ac)×100
在517 nm波长下,初始对照液吸光度为Ac,样品的吸光度为As。
1.2.6.2 FRAP法测定总抗氧化能力 称取27.8 mg FeSO4·7H2O,溶解并定容到1 mL,此时浓度即100 mmol/L。取适量100 mmol/L FeSO4溶液稀释至0.05、0.1、0.15、0.3、0.6、0.9、1.2、1.5、2、4 mmol/L,备用。
96孔板的每个检测孔中加入180 μL FRAP工作液,空白对照孔中加入5 μL 55%乙醇溶液;标准曲线孔内加入5 μL各种浓度的FeSO4标准溶液;样品检测孔内加入5 μL各种样品,轻轻混匀。37 ℃下反应5 min,于593 nm处重复3次平行测定其吸光度[17]。以吸光度(A)为纵坐标,FeSO4摩尔浓度(mmol/L)为横坐标,绘制FeSO4标准曲线,得标准工作曲线方程为:y=0.2862x+0.0296,R2=0.999。样品的FRAP值以达到相同吸光度所需FeSO4的毫摩尔数表示。FRAP值越大,抗氧化活性越强。
1.3 数据处理
采用Microsoft Excle(Office 2007)、Design-Expert.V8.0.6.1、Origin8 Pro SR4软件进行数据整理及分析。
2 结果与分析
2.1 不同提取工艺的比较
微波提取、超声提取、索氏提取对香茶藨子叶片中总酚及总黄酮提取量影响的结果如图1,可以看出微波的提取效果明显好于另外两种,这可能是由于在微波作用下,溶剂分子高速转动成为激发态,溶剂分子回到基态所释放的能量传递给目标化合物分子,加速其热运动,从而使提取速率提高数倍,同时又减少其他杂质的溶出,保证提取目标物的质量[18]。超声提取、索氏提取需要的时间较长,且提取量低于微波提取,因此选定微波辅助提取作为样品的提取方法。

图1 不同提取工艺的比较Fig.1 Comparison of different extraction processes
2.2 单因素实验结果与分析
2.2.1 微波温度的影响 由图2可以看出,总酚、总黄酮提取量随提取温度的升高而增长较快,在50 ℃和60 ℃时,总酚、总黄酮提取量较大,温度高于60 ℃时总酚、总黄酮提取量开始下降。这可能是由于温度过高,其中的活性成分会受到破坏,杂质的溶出量增加,提取时适宜温度约为60 ℃。

图2 提取温度的影响Fig.2 Effect of extraction temperature
2.2.2 液固比的影响 由图3可以看出,在液固比40∶1 mL/g时,总酚、总黄酮提取量最高,当液固比小于40∶1 mL/g 时,活性物质不能完全被浸出;当液固比大于40∶1 mL/g后,提取量开始下降。这可能是由于随着液固比增加,溶液浓度逐渐变小,酚及黄酮类活性物质对微波能的吸收受到影响[19],因而香茶藨子总酚、总黄酮的提取量不增加反而下降。从提取效果和减少溶剂用量等方面综合考虑,用量应不宜过大,故将液固比定在约40∶1 mL/g比较合适。

图3 液固比的影响Fig.3 Effect of liquid-to-solid ratio

图4 乙醇浓度的影响Fig.4 Effect of ethanol concentration
2.2.3 乙醇浓度的影响 由图4可以看出,总酚、总黄酮提取量开始随乙醇浓度的增大而增加,当浓度达到50%~70%时,总酚、总黄酮提取量最高,当乙醇浓度再增加时,提取量又开始下降,这可能是由于乙醇浓度过高,其他醇溶性物质被提出,导致酚及黄酮类化合物溶出量下降[20]。从成本和提取量来考虑,乙醇浓度最好控制在50%~70%为好。
2.2.4 提取时间的影响 由图5可以看出,总酚、总黄酮提取量随提取时间的加长不断增大,但15 min后趋于稳定且略有下降趋势,这可能与微波提取时间过长导致酚及黄酮类物质破坏有关[21],因此提取时间选择15 min。
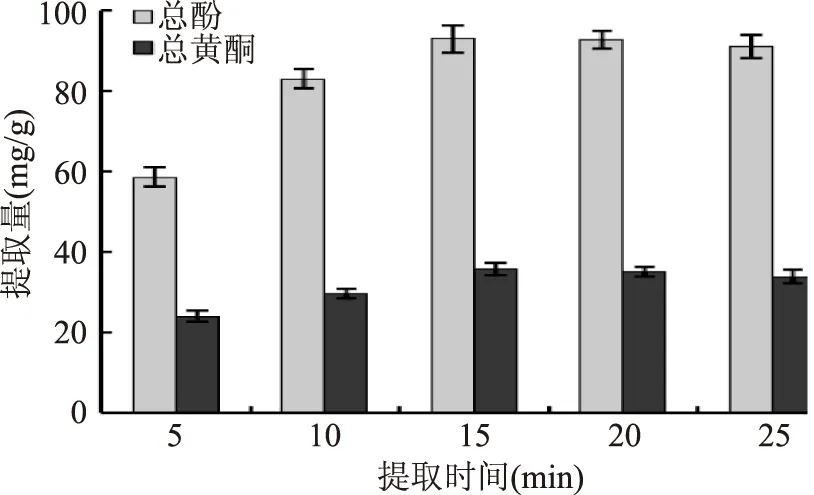
图5 提取时间的影响Fig.5 Effect of extraction time
2.2.5 微波功率的影响 从图6分析发现,功率越大,总酚、总黄酮提取得量越高。但当功率为600 W和700 W时,总酚、总黄酮提取量的变化不大,由此可知提取功率600 W较为适宜。
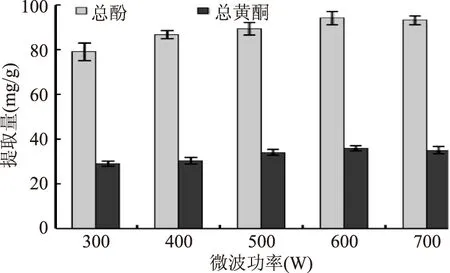
图6 微波功率的影响Fig.6 Effect of microwave power
2.3 响应面法优化提取工艺
2.3.1 回归模型的建立与分析 在本实验中,采用BBD实验设计及响应面分析对香茶藨子叶片中总酚及总黄酮提取量影响比较显著的3个参数(提取温度、液固比、乙醇浓度)做了模型拟合以及条件预测。方案及结果如表2所示。
采用Design-Expert.V8.0.6.1软件,对表2中的实验数据进行回归分析,得出香茶藨子叶片中总酚及总黄酮提取量的回归方程:
以总酚的提取量Y1(mg/g)为响应值的多元函数回归方程为:
以总黄酮的提取量Y2(mg/g)为响应值的多元函数回归方程为:
Y2=-13.944+1.067X1+0.842X2+0.242X3-4.467×10-3X1X2+1.028×10-3X1X3+2.189×10-3X2X3-8.103×10-3X12-8.937×10-3X22-3.787×10-3X32

表2 响应面实验方案及结果Table 2 Response surface design and results
对上述方程进行方差分析,结果如表3所示。
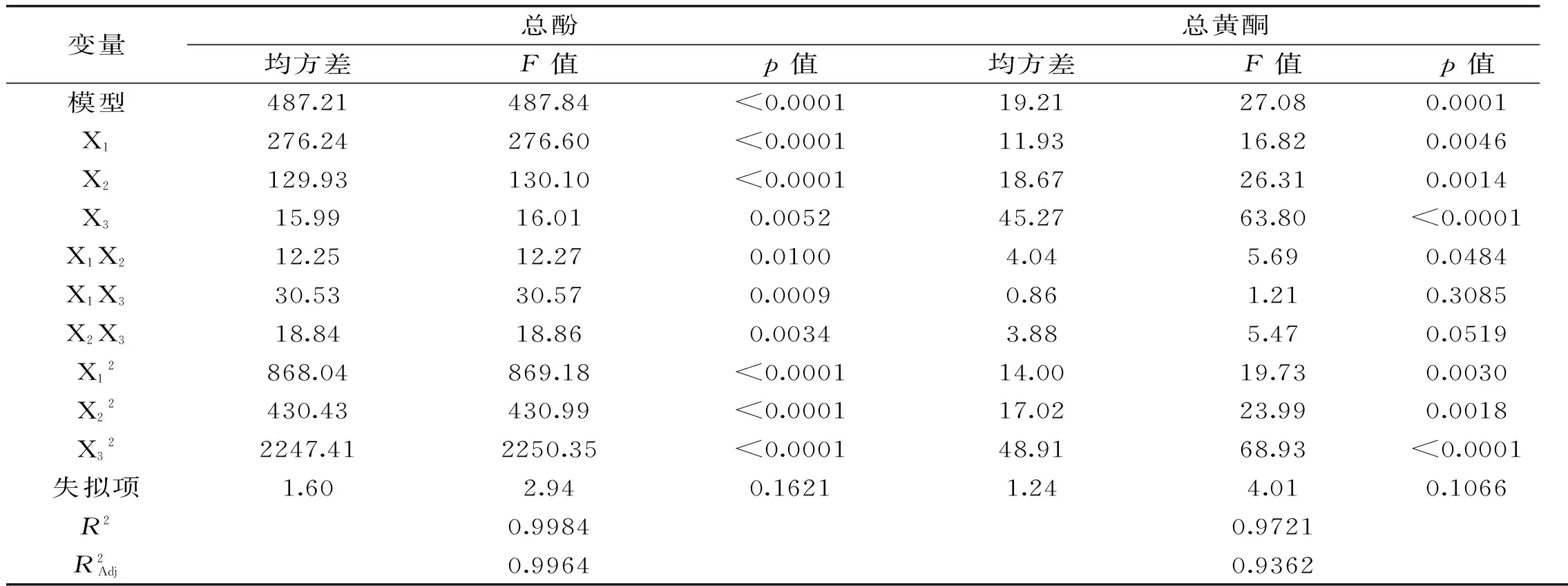
表3 总酚总黄酮提取量的方差分析Table 3 ANOVA statistics of the model for extraction yields of total phenolics and flavonoids
从表3中香茶藨子叶片中总酚以及总黄酮的提取量的二次模型方差统计分析的结果能够看出其实验模型模拟具有良好的相关性,R2值分别为0.9984和0.9721,p值分别为<0.0001、0.0001,并且失拟项p值分别为0.1621、0.1066,模型拟合显著(p<0.05)并且失拟项不显著(p>0.05),表明建立的此模型为有效模型。
对于指标总酚,各项的方差分析表明,一次项、二次项及平方项总酚提取量均有极显著的影响。对于指标总黄酮一次项、平方项对总黄酮提取量影响极显著,二次项X1X2显著,X1X3、X2X3不显著。此外,各因素F值可以反映出其对响应值的重要性,若F值越大,则该因素对实验结果的影响越大。由表3中F值可知各单因素对香茶藨子叶片中总酚提取量的影响程度大小依次为:提取温度>液固比>乙醇浓度;各单因素对香茶藨子叶片中总黄酮提取量的影响程度大小依次为:乙醇浓度>液固比>提取温度;每两因素交互作用对香茶藨子叶片中总酚提取量的影响程度最显著的是提取温度和乙醇浓度;每两因素交互作用对香茶藨子叶片中总黄酮提取量的影响程度最显著的是提取温度和液固比。
2.3.2 响应面分析与优化 根据模型绘制出交互因素响应面图如图7。
从图7A曲面图可以看出,沿提取温度方向较液固比方向的曲面陡,等高线密集,说明提取温度对香茶藨子叶片中总酚提取量的影响较液固比显著。从图7B曲面图可以看出,其等高线趋向于椭圆形,且坡度最陡,说明提取温度和乙醇浓度的交互作用最为显著;从图7C曲面图可以看出,其等高线趋向于椭圆形,坡度较缓,说明液固比和乙醇浓度有较显著的交互作用但弱于提取温度和乙醇浓度。
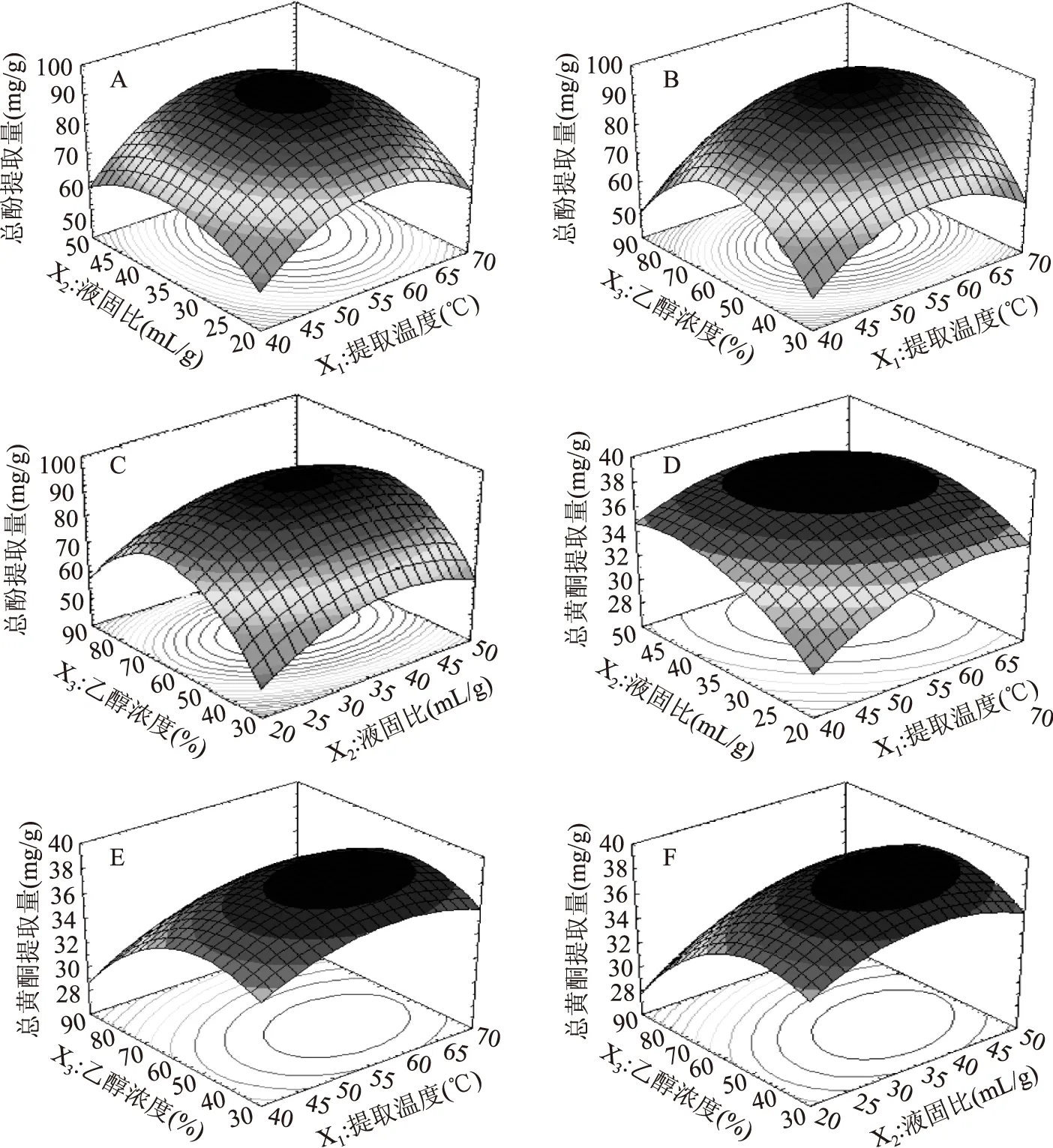
图7 香茶藨子叶片中总酚(A~C)、总黄酮(D~F)提取量的响应面曲线图Fig.7 Response surfaces for total phenolics(A~C)and total flavonoids(D~F)contents in the leaf of Ribes odoratum Wendl
从图7D曲面图可以看出,其等高线趋向于椭圆形,坡度最陡,且由表3可知,X1X2的p值小于0.05,说明提取温度和液固比的交互作用显著;从图7E曲面图可以看出,响应面最为平缓,其等高线也更趋向于圆形,且X1X3的p值大于0.05,说明提取温度和乙醇浓度的交互作用不显著;从图7F曲面图可以看出,其等高线趋向于椭圆形,坡度较缓,且X2X3的p值大于0.05,说明液固比和乙醇浓度的交互作用较不显著。与F值大小比较得到的结果相符。
通过Design-Expert.V8.0.6.1软件对香茶藨子叶片中总酚、总黄酮的微波辅助提取工艺条件进行优化,得到较优工艺参数为:提取温度58.37 ℃,液固比38.9∶1 mL/g,乙醇浓度57.32%,提取时间15 min和微波功率600 W。在此条件下,总酚、总黄酮提取量的预测值为99.38、39.58 mg/g。为便于实际操作,在实际操作中将以上工艺参数修正为:提取温度58 ℃,液固比39∶1 mL/g,乙醇浓度57%,提取时间15 min和微波功率600 W。
2.3.3 模型验证 为验证优化设计所得结果,将会在最优条件下进行验证性实验。提取香茶藨子叶片中总酚、总黄酮的最优条件:提取温度58 ℃,液固比39∶1 mL/g,乙醇浓度57%,提取时间15 min和微波功率600 W。在此优化条件下进行3次平行实验,取平均值,得到的香茶藨子叶片中总酚、总黄酮的平均提取量分别为99.89 mg/g和38.16 mg/g,与预测值相差很小,说明该模型与实际拟合度良好,用于预测实验结果比较可靠,可用于香茶藨子叶片中总酚、总黄酮提取工艺的优化。
2.4 香茶藨子叶片提取物的抗氧化活性测定
2.4.1 对DPPH自由基清除率的测定 由图8可以看出,微波法辅助提取香茶藨子叶片提取物对DPPH自由基有明显的清除作用,在0.0125~0.8 mg/mL的浓度范围内,香茶藨子叶片提取物清除DPPH自由基的能力为15.35%~89.09%,随着浓度的增加,其对DPPH自由基的清除能力增强,对DPPH自由基的清除率具量效关系。

图8 DPPH自由基清除能力的测定Fig.8 The mensuration of DPPH radical scavening activity
VC、微波辅助提取物、超声辅助提取物、索氏提取物对DPPH自由基清除能力的IC50值分别为0.0339、0.0445、0.0562和0.0797 mg/mL。由此可见,三种提取方法获得的提取物对DPPH自由基的清除能力分别为:VC>微波提取物>超声提取物>索氏提取物,微波辅助提取得到的提取物对DPPH自由基具有更好的清除效果。
2.4.2 FRAP法测定总抗氧化能力 采用FRAP法测定不同方法下得到的香茶藨子叶片提取物的抗氧化能力,结果如图9所示,抗氧化能力由高到低为:微波提取>超声提取>索氏提取。结果表明对于抗氧化活性物质的提取,微波辅助提取效果最好,索氏提取效果最差。

图9 不同提取方法的抗氧化能力比较Fig.9 The comparation of antioxidant ability between different extraction method
3 结论
本实验分别运用微波提取、超声提取、索氏提取对香茶藨子叶片中酚及黄酮类化合物进行提取,相较于其他两种方法,微波提取时间短且提取量高,因此微波提取法适于从香茶藨子叶片中提取酚及黄酮类化合物,具有提取速度快,效率高,避免长时间高温接触而导致的化合物降解等优点[22]。
通过响应面法优化微波提取香茶藨子叶片中总酚及总黄酮,得到最佳提取工艺条件为:提取温度58 ℃,液固比39∶1 mL/g,乙醇浓度57%,提取时间15 min和微波功率600 W,此条件下总酚及总黄酮的实际提取量分别为99.89 mg/g和38.16 mg/g。微波提取得到的活性物质较超声提取、索氏提取具有更好的DPPH自由基清除能力和FRAP抗氧化能力,本文为香茶藨子叶片的开发利用提供了一定的理论依据。
[1]修荆昌,张辉,赵伟光,等.长白山区茶藨子属资源及其开发利用[J].吉林农业大学学报,2002,24(5):75-77,85.
[2]邓运川,王文军.香茶藨子栽培管理技术[N].中国花卉报,2013-07-23(16).
[3]李明.香茶藨子栽培管理[J]. 中国花卉园艺,2014(18):38-39.
[4]王志涛.优良生态型经济观赏树种——香茶藨子[J].林业实用技术,2012,30(8):49-50.
[5]TABART J,KEVERS C,PINCEMAIL J,et al.Antioxidant capacity of black currant varies with organ,season,and cultivar[J].Journal of Agricultural and Food Chemistry,2006,54(17):6271-6276.
[6]李广哲.新疆黑果茶藨化学成分及其抗氧化活性的研究
[D].大连:大连理工大学,2009.
[7]PEEV C,DEHELEAN C,ANTAL D,et al.Tilia tomentosa foliar bud extract:phytochemical analysis and dermatological testing[J]. Studia Universitatis Vasile Goldis Seria Stiintele Vietii(Life Sciences Series),2009,19(1):163-165.
[8]孟雪莲,徐成斌.黄酮类化合物的药理学作用研究进展[J].宁夏农林科技,2012,53(2):63-64,119.
[9]GARBACKI N,TITS M,ANGENOT L,et al. Inhibitory effects of proanthocyanidins fromRibesnigrumleaves on carrageenin acute inflammatory reactions induced in rats[J]. BMC Pharmacology,2004,4(1):25.
[10]TABART J,FRANCK T,KEVERS C,et al.Antioxidant and anti-inflammatory activities ofRibesnigrumextracts[J].Food Chemistry,2012,131(4):1116-1122.
[11]张晶晶,马明呈,徐宗才,等.茶藨属植物研究综述[J].青海大学学报:自然科学版,2013,31(3):17-22.
[12]张自萍,黄文波,王玉炯. 枸杞黄酮提取方法的比较研究[J].宁夏大学学报:自然科学版,2007,28(1):60-62.
[13]杨光明,王栋,张芳芳,等.镰形棘豆总黄酮和总酚的含量测定[J].药学与临床研究,2009,17(5):376-379.
[14]韩志萍,崔海燕,张志琪.响应曲面法优化甜杏仁皮总黄酮提取工艺[J].安徽农业科学,2015,43(28):278-281,284.
[15]陈源,杨道富,范丽华,等.响应面法优化微波提取茂谷橘橙皮总黄酮工艺[J]. 中国食品学报,2013,13(4):80-86.
[16]YAO X H,ZHANG D Y,ZU Y G,et al.Free radical scavenging capability,antioxidant activity and chemical constituents ofPyrolaincarnataFisch.leaves[J]. Industrial Crops and Products,2013,49:247-255.
[17]YAO X H,ZHANG D Y,LUO M,et al.Negative pressure cavitation-microwave assisted preparation of extract ofPyrolaincarnataFisch.rich in hyperin,2′-O-galloylhyperin and chimaphilin and evaluation of its antioxidant activity[J].Food Chemistry,2015,169:270-276.
[18]陈恩赞,苏海佳,谭天伟.微波提取酱渣中总异黄酮的实验研究[J].环境工程学报,2010,4(2):427-430.
[19]杜艳,李荣,姜子涛.白苏叶黄酮的微波辅助提取及其纯化的研究[J].食品工业科技,2016,37(6):280-286.
[20]卢赛赛,许凤,王鸿飞,等.杨梅叶中总黄酮提取及其抗氧化能力研究[J].果树学报,2015,32(3):460-468.
[21]杨娟霞,董伟,韩林磊,等. 响应面法优化微波法提取甘青青兰总黄酮工艺[J].食品工业科技,2015,36(1):216-219,225.
[22]梁丹霞,顾霞敏,许海丹. 合欢花总黄酮不同提取工艺的比较[J].食品与发酵科技,2015,51(5):23-26.
Extraction of total phenolics and flavonoids from the leaf ofRibesodoratumWendl. and its antioxidant activity
ZOU Wei-na1,2,3,WANG Wei1,2,3,*,XU Qi-jiang4,*,DU Wei-wei1,2,3,LI Ling-yu1,2,3
(1.Key Laboratory of Forest Plant Ecology,Ministry of Education,Northeast Forestry University,Harbin 150040,China;2.Engineering Research Center of Forest Bio-preparation,Ministry of Education,Northeast Forestry University,Harbin 150040,China;3.State Engineering Laboratory for Bio-Resource Eco-Utilization,Northeast Forestry University,Harbin 150040,China;4.The State Key Laboratory of Tree Genetics and Breeding,College of Life Sciences,Northeast Forestry University,Harbin 150040,China)
Objective:To obtain the optimum microwave-assisted extraction process for total phenolics and flavonoids from the leaf ofRibesodoratumWendl. and to examine the antioxidant activity. Method:Based on single factor tests,effects of various factors on total phenolics and flavonoids contents were analyzed through response surface methodology(RSM).The optimal conditions for microwave extraction of total phenolics and flavonoids from the leaf ofRibesodoratumWendl. were discussed.And the comparison between different extraction methods,such as ultrasonic extraction and soxhlet extraction were also investigated. Moreover,the DPPH radical scavenging capacity and FRAP total antioxidant activity tests were carried out to determine its potential antioxidant activity. Result:The optimum conditions for microwave-assisted extraction were determined as follows:extraction temperature 58 ℃,liquid-to-solid ratio 39∶1 mL/g,ethanol concentration 57%,extraction time 15 min and microwave power 600 W. The extraction yields of total phenolics and flavonoids were up to 99.89 mg/g and 38.16 mg/g under the optimal conditions. The antioxidant tests showed that the total phenolics and flavonoids extracted from the leaf ofRibesodoratumWendl. had a potent scavenging effect on DPPH free radicals with IC50value of 0.0445 mg/mL and FRAP ferric reducing antioxidant power with value of 4.832 mmoL/g. Conclusion:The microwave-assisted extraction of total phenolics and flavonoids from the leaf ofRibesodoratumWendl. was stable and feasible,and the extracts by this method also exhibited a better antioxidant activity. The study could provide a certain scientific basis for research and development ofRibesodoratumWendl..
RibesodoratumWendl.;total phenolics;total flavonoids;response surface methodology;microwave-assisted extraction;antioxidant activity
2016-06-15
邹维娜(1992-),女,在读硕士研究生,研究方向:生药学,E-mail:fht1167@126.com。
*通讯作者:王微(1978-),女,副研究员,研究方向:植物药提取及活性研究,E-mail:wangwping780110@163.com。 徐启江(1970-),男,教授,研究方向:植物分子系统发育生物学,E-mail:249904367@qq.com。
E类中央高校基本科研业务费专项资金项目(创新团队与重大项目培育资金项目)(2572014EA03-03)。
TS201.1
B
1002-0306(2017)02-0266-07
10.13386/j.issn1002-0306.2017.02.043
