添加扩增内标的PCR方法快速检测食品中的阪崎克罗诺杆菌
2017-03-08张德福赵禹宗仪淑敏赵文竹汤轶伟励建荣
张德福,赵禹宗,张 明,仪淑敏,赵文竹,汤轶伟,李 春,励建荣,*
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071;3.渤海大学数理学院,辽宁锦州 121013)
添加扩增内标的PCR方法快速检测食品中的阪崎克罗诺杆菌
张德福1,2,赵禹宗1,张 明1,仪淑敏1,赵文竹1,汤轶伟1,李 春3,励建荣1,*
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071;3.渤海大学数理学院,辽宁锦州 121013)
为了解决常规PCR方法检测阪崎克罗诺杆菌时因检测过程中环境和食品理化因素的影响而导致的假阴性结果的产生,本研究以细菌16S rRNA基因为扩增内标对照,以阪崎克罗诺杆菌特异性基因grxB为靶基因设计了一对特异性引物,并通过优化PCR反应条件,最终建立了一种添加扩增内标的阪崎克罗诺杆菌PCR检测方法,可以指示PCR过程中因存在DNA聚合酶抑制剂而导致的假阴性结果。通过对20种细菌进行PCR检测显示,该方法对阪崎克罗诺杆菌具有良好的特异性。灵敏度实验结果表明,该检测方法对阪崎克罗诺菌纯DNA模板的检测灵敏度为2.15×102fg/μL,对阪崎克罗诺杆菌纯培养物的检测灵敏度为9.4×103CFU/mL。对人工污染婴幼儿奶粉的检测结果显示,阪崎克罗诺杆菌接种量为0.94 CFU/g的婴幼儿奶粉样品经过8 h增菌培养后,即可检出。食品样品检测结果表明,不添加扩增内标的PCR检测方法中出现的假阴性结果可被本方法检出。该检测方法特异性强、灵敏度较高,能消除阪崎克罗诺杆菌常规PCR检测方法中可能出现的假阴性结果,适用于婴幼儿配方乳粉、乳制品等食品中阪崎克罗诺杆菌的快速检测。
阪崎克罗诺杆菌,扩增内标,假阴性,PCR检测
阪崎克罗诺杆菌(Cronobactersakazakii)(旧称阪崎肠杆菌)是婴幼儿配方奶粉中发现的一种能够引起婴幼儿死亡的肠杆菌科条件致病菌[1-3]。目前研究发现,阪崎克罗诺杆菌广泛存在于多种食品中[4-5],如奶制品[6]、肉制品[7]、蔬菜[8]、水果[9]、谷类[10]等。在某些情况下,由阪崎克罗诺杆菌引发疾病而导致的死亡率可达40%~80%[11-12]。因此,加强对阪崎克罗诺杆菌的检测对保障食品安全非常重要。目前,阪崎克罗诺杆菌传统的培养——生化鉴定法比较复杂、检测周期长、灵敏度低,远远不能满足现代对快速检测的要求[13]。基于PCR方法的快速、灵敏度高、特异性强、适合高通量操作等优点,而成为快速检测时的常用方法。研究表明,采用PCR检测方法对食品样品中的致病菌进行实际检测时,会受到环境因素和食品理化性质的影响,其中食品基质复杂、培养基成分和DNA提取试剂残留等原因都会影响检测准确性,造成假阴性结果。研究表明,添加扩增内标对于食品样品中致病菌PCR检测方法体系中确保检测结果的可靠性具有重要的作用,一个有效、适用的食源性致病菌快速检测方法必须包含能够指示假阴性结果的扩增内标(Internal Amplification Control,IAC)[14-15]。本实验PCR反应体系中采用16S rRNA基因的通用引物27F和1492R作为扩增内标引物,若被检测样品中含有任意细菌DNA,即可在电泳结果中观察到一条大小为1500 bp的电泳条带,不需要添加扩增内标片段,就可以达到指示假阴性结果的目的。在反应体系中,若食品样品未受到阪崎克罗诺杆菌污染,应有扩增内标片段的扩增产物。而当PCR反应没有产生任何扩增产物时,说明反应可能受到了抑制,产生了假阴性,需重新处理待检食品样品。
谷氧还蛋白2(Glutaredoxin 2,GrxB)是肠杆菌体内一类对谷胱甘肽起氧化还原作用的蛋白质,研究人员通过将阪崎克罗诺杆菌与其他细菌grxB基因序列比对及特异性实验发现,grxB基因对阪崎克罗诺杆菌具有很强的特异性[16-17]。因此,本研究以grxB作为检测靶基因设计引物,以16S rRNA序列作为扩增内标,建立了一种添加扩增内标的阪崎克罗诺杆菌PCR检测方法,并从特异性、纯DNA和纯培养物灵敏度、人工污染婴幼儿奶粉样品以及食品样品实际检测四个方面对该检测方法进行了评价。
1 材料与方法
1.1 材料与仪器
实验用菌株阪崎克罗诺杆菌(ATCC 29004、ATCC 29544)、大肠杆菌O157∶H7(ATCC 43889)、腐败希瓦氏菌(ATCC 8071)、铜绿假单胞菌(ATCC 9027)、副溶血弧菌(ATCC 33847)、粘质沙雷氏菌(ATCC 14041)和地衣芽孢杆菌(ATCC 14580) 购自美国模式菌种保藏中心;福氏志贺氏菌(CMCC(B)51572)、金黄色葡萄球菌(CMCC(B)26001)、沙门氏菌(CMCC(B)50041)及蜡样芽胞杆菌(CMCC 63301) 均购自中国普通微生物菌种保藏管理中心;单增李斯特菌(ATCC 19115) 由浙江大学动物科学学院方维焕教授赠送;鲁氏耶尔森氏菌、哈维弧菌、河流弧菌、温和气单胞菌、创伤弧菌、溶藻弧菌、嗜水气假单胞菌和荧光假单胞菌 由本实验室分离、鉴定、保存;人工污染及实际检测用的新鲜肉、婴幼儿奶粉、水产品、豆制品、鸡蛋、乳制品等6类共51份样品 均采购自本地商场;Taq-PCR Master Mix、细菌基因组DNA提取试剂盒、DNA Marker D2000 生工生物工程(上海)股份有限公司;LB等培养基 北京奥博星生物技术有限公司;琼脂糖 Sigma公司。
DYY-8C型电泳仪 北京市六一仪器厂;LRH系列生化培养箱 上海一恒科学仪器有限公司;Mastercycler pro梯度PCR仪、5424R冷冻离心机 德国Eppendorf公司;Cheimd Doc XRS型凝胶成像仪 美国Bio-Rad公司;NanoDrop 2000超微量分光光度计 美国Thermo公司;DL-CJ-2N型超级洁净工作台 东联哈尔(北京)仪器制造有限公司。
1.2 实验方法
1.2.1 阪崎克罗诺杆菌的培养及DNA的提取 将实验室冷冻保存的阪崎克罗诺杆菌接种于LB平板上活化后,采用细菌基因组DNA提取试剂盒提取基因组DNA,经NanoDrop 2000超微量分光光度计测定浓度为2.15×102ng/μL,置于-20 ℃备用。
1.2.2 特异性引物的设计和筛选 选择阪崎克罗诺杆菌特异性基因grxB(GenBank:FN543093.2)作为靶基因,利用软件Primer 5.0设计引物,经PCR反应验证筛选出一对特异性良好的阪崎克罗诺杆菌检测引物:grxBF/grxBR。采用细菌16S rRNA扩增通用引物27F和1492R作为PCR反应内标对照引物。实验所用引物序列如表1所示。

表1 引物序列Table 1 Sequences of primers
1.2.3 PCR检测方法的建立 根据TaqPCR Master Mix说明书所建议的PCR反应体系对PCR反应体系的各组分含量以及扩增程序进行优化调整,最终确定PCR反应最佳条件为:总体系25 μL,其中TaqPCR Master Mix 12.5 μL,DNA模板2 μL,10 μmol/L的引物27F/1492R和grxBF/grxBR各1 μL,补充无菌水至25 μL。以无菌水作为空白对照。
PCR反应程序:94 ℃预变性4 min后进行35个循环,每个循环包括94 ℃变性30 s、61.6 ℃退火30 s、72 ℃延伸90 s,最后72 ℃延伸10 min。PCR产物使用1%的琼脂糖凝胶进行核酸电泳,使用EB染色后置于凝胶成像仪下观察结果。
1.2.4 特异性验证 使用细菌基因组DNA提取试剂盒提取表1中细菌的基因组DNA,并用建立的含扩增内标的PCR检测方法对所有细菌的基因组DNA进行检测,验证该方法的特异性。
1.2.5 灵敏度评价
1.2.5.1 纯DNA灵敏度评价 将提取的阪崎克罗诺杆菌基因组DNA用无菌去离子水进行10倍系列梯度稀释,使用建立的PCR检测方法对浓度为1~106fg/μL的DNA溶液进行PCR扩增。PCR产物电泳结果中能得到肉眼可见大小为333 bp条带的最低浓度DNA溶液,视为该PCR检测方法对阪崎克罗诺杆菌的纯基因组DNA检测灵敏度。
1.2.5.2 纯培养物灵敏度评价 将活化的阪崎克罗诺杆菌于37 ℃振荡培养10 h后,用无菌生理盐水进行10倍系列梯度稀释,取适当浓度的菌悬液倾倒平板计数,每个稀释度再取1 mL置于1.5 mL离心管中,用试剂盒提取基因组DNA,作为模板进行PCR扩增,检测该方法对阪崎克罗诺杆菌纯培养物的灵敏度。
1.2.6 人工污染食品样品实验 无菌操作取10份婴幼儿奶粉,每份10 g,接种适当稀释浓度的阪崎克罗诺杆菌菌液1 mL,使奶粉中的菌液浓度分别为0~1、1~10、10~100 CFU/g,每组做3个平行,另取一份加入无菌生理盐水做为空白对照。分别将人工污染的奶粉样品加入到90 mL LB液体培养基中,混匀后37 ℃振荡培养,每隔2 h取1 mL菌液置于1.5 mL离心管中,用试剂盒提取基因组DNA作为模板进行PCR检测。
1.2.7 食品样品检测 新鲜肉、婴幼儿奶粉、水产品、豆制品、鸡蛋、乳制品等样品每份取25 g或25 mL。鲜肉、水产品及豆制品样品加入到盛有225 mL LB培养基的无菌袋中均质2 min,婴幼儿奶粉、鸡蛋及乳制品直接与225 mL LB培养基混匀,37 ℃振荡培养10 h后提取基因组DNA,并用建立的添加扩增内标的PCR检测方法进行检测。所有样品同时根据GB 478940-2010《食品安全国家标准 食品微生物学检验 阪崎肠杆菌检验》的方法进行阪崎克罗诺杆菌的确认。
2 结果与分析
2.1 特异性验证
PCR检验结果如图1所示,只有阪崎克罗诺杆菌基因组DNA能全部扩增出大小为333 bp的检测条带和大小为1500 bp的扩增内标对照条带,而其它细菌基因组DNA只能扩增出大小为1500 bp的扩增内标对照条带。表明实验所设计建立的PCR检测方法特异性良好。
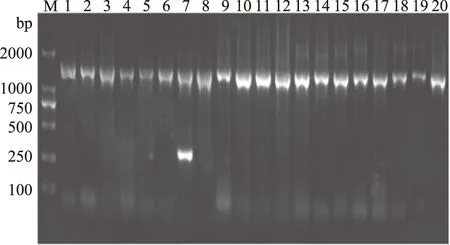
图1 阪崎克罗诺杆菌特异性试验Fig.1 Agarose(1%)gel electrophoresis of DNA productsamplified from Cronobacter sakazakii and non-Cronobacter species by PCR using the primers注:M:D2000 DNA marker;1:副溶血性弧菌;2:大肠杆菌O157∶H7;3:肠炎沙门氏菌;4:福氏志贺氏菌;5:单增李斯特菌;6:蜡样芽孢杆菌;7:阪崎克罗诺杆菌;8:金黄色葡萄球菌;9:腐败希瓦氏菌;10:铜绿假单胞菌;11:粘质沙雷氏菌;12:嗜水气单胞菌;13:温和气单胞菌;14:荧光假单胞菌;15:地衣芽孢杆菌;16:鲁氏耶尔森氏菌;17:哈维弧菌;18:溶藻弧菌;19:创伤弧菌;20:河流弧菌。
2.2 灵敏度评价
2.2.1 纯DNA灵敏度实验 如图2所示,阪崎克罗诺杆菌基因组DNA经10倍梯度稀释至2.15×102fg/μL时,PCR检测结果仍有肉眼可见条带,表明阪崎克罗诺杆菌基因组DNA的检测灵敏度为2.15×102fg/μL。
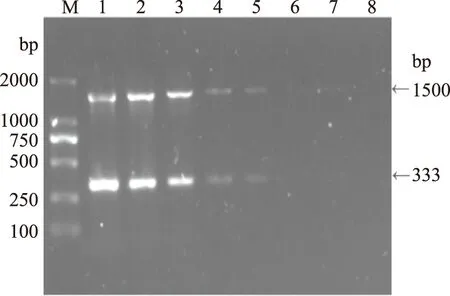
图2 阪崎克罗诺杆菌基因组DNA检测灵敏度Fig.2 Agarose gel electrophoresis showing sensitivity of detection of the PCR amplified Cronobacter sakazakii genomic DNA from various concentrations注:M:D2000 DNA ladder marker;1~7:阪崎克罗诺杆菌基因组DNA浓度分别为2.15×106~2.15 fg/μL;8:阴性对照。
2.2.2 纯培养物灵敏度实验 对培养好的阪崎克罗诺杆菌菌液进行平板菌落计数,阪崎克罗诺杆菌液浓度为9.4×108CFU/mL。如图3所示,阪崎克罗诺杆菌菌液稀释到9.4×103CFU/mL时,PCR检测结果仍有肉眼可见条带,可视为阪崎克罗诺杆菌纯培养物检测限为9.4×103CFU/mL。

图3 阪崎克罗诺杆菌纯培养物检测灵敏度Fig.3 Agarose gel electrophoresis showing sensitivity of detection of the PCR amplified Cronobacter sakazakii pure cultures注:M:D2000 DNA ladder marker;1~8:阪崎克罗诺杆菌浓度分别为9.4×106~9.4 CFU/mL;8:阴性对照。
2.3 人工污染食品样品实验
婴幼儿奶粉样品中接种的阪崎克罗诺杆菌的三个浓度分别为94、9.4、0.94 CFU/g。PCR检测结果如表2所示,接菌量为94 CFU/g的奶粉样品,在增菌培养4 h后即可检出,接菌量为9.4 CFU/g的奶粉样品,在增菌培养6 h后可以检出,接种量为0.94 CFU/g的奶粉样品需要增菌8 h才可以检出。这表明,该PCR检测方法最多经8 h增菌培养后,即可从染菌量为0.94 CFU/g的奶粉样品中检出阪崎克罗诺杆菌。
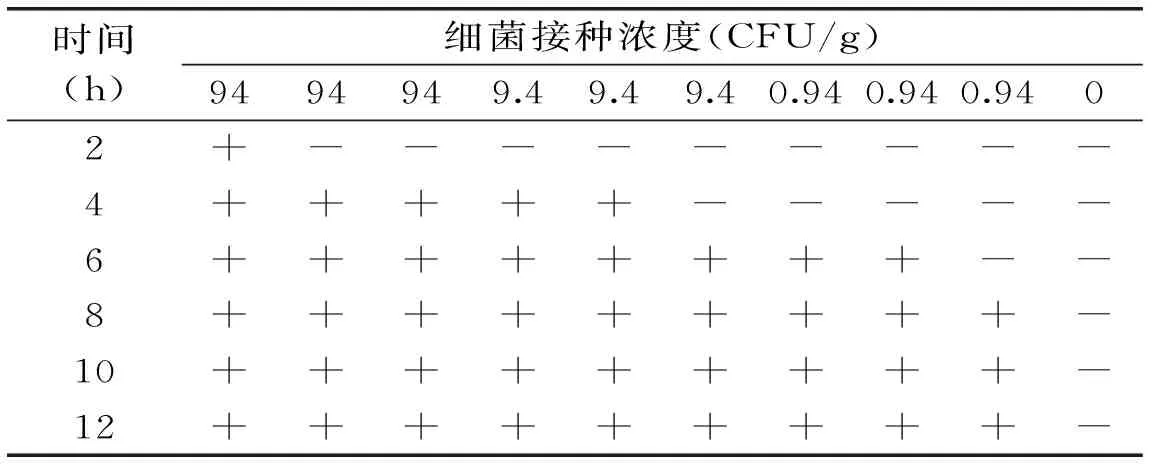
表2 人工污染食品样品检测结果Table 2 Detection for Cronobacter sakazakiiin artificially contaminated food samples
2.4 食品样品检测结果
从锦州菜市场随机取51份食品检测结果如表3所示,总计51份样品中19份扩增出目的条带和扩增内标条带,其中5份是未添加扩增内标的PCR检测方法中产生的假阴性,经本方法检测出,表明食品样品受阪崎克罗诺杆菌污染;32份样品中只扩增出扩增内标条带,无目的条带,表明食品未受阪崎克罗诺杆菌污染。
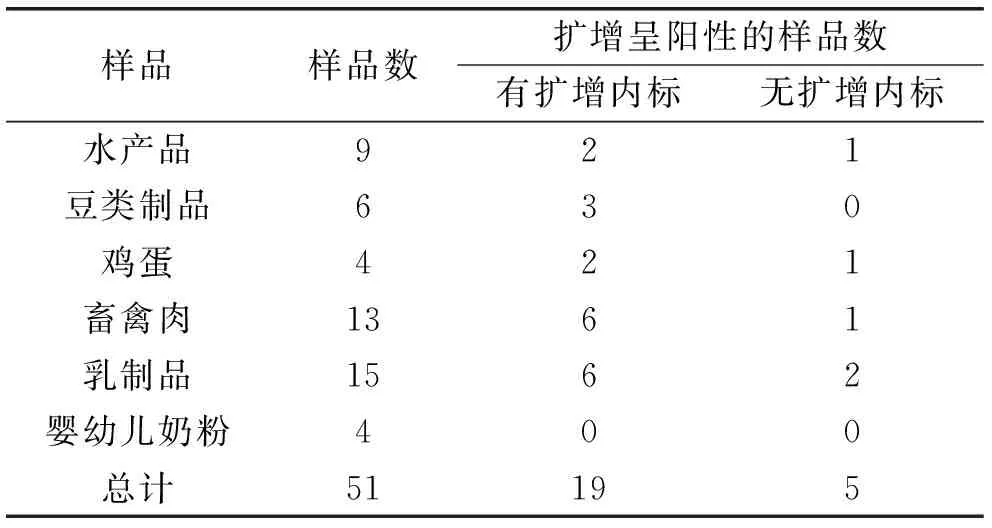
表3 食品样品检测结果Table 3 Detection of food samples
3 结论
实验结果表明,以细菌16S rRNA为扩增内标对照,以阪崎克罗诺杆菌的谷氧还蛋白2基因grxB为靶基因设计的引物具有良好的的特异性,引物grxBF/grxBR与引物27F/1492R之间没有交叉反应。
本研究建立的含扩增内标的PCR检测方法对阪崎克罗诺杆菌基因组纯基因组DNA检测灵敏度为2.15×102fg/μL,纯培养物检测灵敏度为9.4×103CFU/mL,与Dong[16]和Wang[18]建立的阪崎克罗诺杆菌检测方法灵敏度103CFU/mL处于同一检测水平。
人工污染实验结果表明,阪崎克罗诺杆菌染菌量为0.94 CFU/g的奶粉样品,经过8 h增菌培养后,可被本研究检测方法检出。污染阪崎克罗诺杆菌的食品样品最多经过8 h增菌培养后即可被检出,整个检验流程可在12 h内完成,检测周期短,适用于阪崎克罗诺杆菌的快速检测鉴定。食品样品检测结果表明,添加扩增内标的检测方法能够检测出样品中的阪崎克罗诺杆菌,并能够避免假阴性对检测结果造成的影响。
[1]Farmer JJ,Asbury M,Hickman F,et al.Cronobactersakazakii:a new species of “Enterobacteriaceae” isolated from clinical specimens[J]. I Int J Syst Evol Microbiol,1980,30(3):569-584.
[2]Jaradat ZW,Al Mousa W,Elbetieha A,et al.Cronobacterspp. -opportunistic food-borne pathogens. A review of their virulence and environmental-adaptive traits[J]. J Med Microbiol,2014,63(Pt 8):1023-1037.
[3]Farmer JJ 3rd. My 40-year history withCronobacter/Enterobactersakazakii-lessons learned,myths debunked,and recommendations[J]. Front Pediatr,2015(3):84.
[4]Beuchat LR,Kim H,Gurtler JB,et al.Cronobactersakazakiiin foods and factors affecting its survival,growth,and inactivation[J]. Int J Food Microbiol,2009,136(2):204-213.
[5]Friedemann M.Cronobactersakazakiiinin food and beverages(other than infant formula and milk powder)[J]. Int J Food Microbiol,2007,116(1):1-10.
[6]Yan QQ,Condell O,Power K,et al.Cronobacterspecies(formerly known asEnterobactersakazakii)in powdered infant formula:a review of our current understanding of the biology of this bacterium[J]. J Appl Microbiol,2012,113(1):1-15.
[7]Molloy C,Cagney C,O’Brien S,et al. Surveillance and characterisation by pulsed-field gel electrophoresis ofCronobacterspp. in farming and domestic environments,food production animals and retail foods[J]. Int J Food Microbiol,2009,136(2):198-203.
[8]Belal M,Al-Mariri A,Hallab L,et al. Detection ofCronobacterspp.(formerlyEnterobactersakazakii) from medicinal plants and spices in Syria[J]. J Infect Dev Ctries,2013,7(2):82-89.
[9]Santo D,Graca A,Nunes C,et al. Survival and growth ofCronobactersakazakiion fresh-cut fruit and the effect of UV-C illumination and electrolyzed water in the reduction of its population[J]. Int J Food Microbiol,2016,231:10-15.
[10]Huang Y,Pang Y,Wang H,et al. Occurrence and characterization ofCronobacterspp. in dehydrated rice powder from Chinese supermarket[J]. PLoS One,2015,10(7):e0131053.
[11]Mullane NR,Murray J,Drudy D,et al. Detection ofCronobactersakazakiiin dried infant milk formula by cationic-magnetic-bead capture[J]. Appl Environ Microbiol,2006,72(9):6325-30.
[12]Kucerova E,Clifton SW,Xia XQ,et al. Genome sequence ofCronobactersakazakiiBAA-894 and comparative genomic hybridization analysis with otherCronobacterspecies[J]. PLoS One,2010,5(3):e9556.
[13]Iversen C,Forsythe SJ. Comparison of media for the isolation ofCronobactersakazakii[J]. Appl Environ Microbiol,2007,73(1):48-52.
[14]Hoorfar J,Malorny B,Abdulmawjood A,et al. Practical considerations in design of internal ampilification controls for diagnostic PCR assays[J]. J Clin Microbiol,2004,42(5):1863-1868.
[15]Hoorfar J,Cook N,Malorny B,et al. Making internal amplification control mandatory for diagnostic PCR[J]. J Clin Microbiol,2003,41(12):5835.
[16]Dong X,Wu Q,Zhang J,et al. Sequencing of thegrxB gene ofCronobacterspp. and the development of a PCR assay for its identification[J]. Foodborne Pathog Dis,2013,10(8):711-717.
[17]Vlamis-Gardikas A,Aslund F,Spyrou G,et al. Cloning,overexpression,and characterization of glutaredoxin 2,an atypical glutaredoxin fromEscherichiacoli[J]. J Biol Chem,1997,272(17):11236-11243.
[18]Wang X,Zhu C,Xu X,et al. Real-time PCR with internal amplification control for the detection ofCronobacterspp.(Cronobactersakazakii)in food samples[J]. Food Control,2012,25(1):144-149.
Establishment of a PCR method with an internal amplication control for detection ofCronobactersakazakiiin foods
ZHANG De-fu1,2,ZHAO Yu-zong1,ZHANG Ming1,YI Shu-min1,ZHAO Wen-zhu1,TANG Yi-wei1,LI Chun3,LI Jian-rong1,*
(1.College of Food Science and Project Engineering,Bohai University,Food Safety Key Lab of Liaoning Province,National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China;2.Institute of Microbiology and Epidemiology,Academy of Military Medical Sciences,State Key Laboratory of Pathogen and Biosecurity,Beijing 100071,China;3.College of Mathematics and Physics,Bohai University,Jinzhou 121013,China)
The traditional detection method ofCronobactersakazakiiwas time-consuming,operation-complicated,low sensitivity and was often influenced by the environmental factors,and the physical and chemical properties of food,which might lead to false negative results. In this study,we used 16S rRNA gene as an internal amplification control,designed primers targetinggrxB ofC.sakazakii,optimized the reaction conditions and finally,established a PCR method with an internal amplication control forC.sakazakiidetection. The results of detection of 20 strains includingCronobacterand non-Cronobacterby this method showed that these primers were specific forC.sakazakiidetection. The sensitivity of established detection assay forC.sakazakiipurified genomic DNA and pure cultures were 2.15×102fg/μL and 9.4×103CFU/mL,respectively. The detection for artificially contaminated infant milk powder showed thatC.sakazakiicould be detected after 8 h enrichment culture when theC.sakazakiiinoculation was 0.94 CFU/g. This detection method demonstrated a good specificity and sensitivity,and could eliminate false-negative results caused by inhibitor of DNA polymerase in the PCR reaction reagents,and suitable for rapid detection of foodborneC.sakazakii.
Cronobactersakazakii;internal amplification control;false-negative;PCR detection
2016-06-28
张德福(1983-),男,博士,讲师,研究方向:食品安全与质量控制,E-mail:zhangdf@bhu.edu.cn。
*通讯作者:励建荣(1964-),男,博士,教授,研究方向:水产品和果蔬贮藏加工,食品安全,E-mail:lijr6491@163.com。
辽宁省教育厅项目(LY2016001);辽宁省重点实验室开放课题(LNSAKF2013018);辽宁省高等学校创新团队项目(LT2014024)。
TS201.6
A
1002-0306(2017)02-0049-05
10.13386/j.issn1002-0306.2017.02.001
