木犀草素对东莨菪碱所致大鼠学习记忆障碍的改善作用
2017-03-08张永亮陈海龙王婷梅王艳利冀国华李莹辉曲丽娜
张永亮,陈海龙,王婷梅,王艳利,冀国华,李莹辉,*,曲丽娜*
(1.西北工业大学生命学院,陕西 西安 710072;2.中国航天员科研训练中心 航天医学基础与应用国家重点实验室,北京 100094)
木犀草素对东莨菪碱所致大鼠学习记忆障碍的改善作用
张永亮1,陈海龙2,王婷梅1,王艳利1,冀国华2,李莹辉1,2*,曲丽娜2*
(1.西北工业大学生命学院,陕西 西安 710072;2.中国航天员科研训练中心 航天医学基础与应用国家重点实验室,北京 100094)
研究了木犀草素对东莨菪碱所致大鼠学习记忆障碍的改善作用。将SD大鼠随机分为6组:正常对照组、模型组、多奈哌齐组和不同剂量(30 mg·kg-1、60 mg·kg-1、120 mg·kg-1)木犀草素组,腹腔注射东莨菪碱建立大鼠学习记忆障碍模型,采用Morris水迷宫实验和避暗实验测试大鼠学习记忆能力,同时测定大鼠海马组织超氧化物歧化酶(SOD)活性、乙酰胆碱酯酶(AchE)活性及丙二醛(MDA)含量。结果表明:与模型组比较,木犀草素(120 mg·kg-1)处理可显著缩短大鼠在Morris水迷宫实验中的逃避潜伏期(P<0.05或P<0.01),增加大鼠穿台次数、目的象限时间比和游程比(P<0.05),延长避暗实验中大鼠的入暗潜伏期(P<0.01);同时木犀草素(120 mg·kg-1)处理可提高大鼠海马组织SOD活性(P<0.01),降低AchE活性(P<0.05)及MDA含量。木犀草素可通过抑制海马区氧化损伤和增强胆碱能功能改善东莨菪碱所致大鼠学习记忆障碍。
木犀草素;东莨菪碱;学习记忆;改善作用
阿尔茨海默病(Alzheimer′sdisease,AD)是老年性痴呆的一种,记忆障碍和认知功能下降是AD的典型症状,其发病率日趋上升,严重威胁着人类的身心健康。在对AD患者治疗的过程中发现胆碱能疗法是一种比较有效的改善方法[1],提高大脑中乙酰胆碱(acetylcholine,ACh)水平对AD的预防非常重要,通过补偿胆碱能神经元的流失可以防止神经退化。此外在AD患者脑中也观察到了氧化损伤和脂质蛋白质氧化的发生[2],而抗氧化剂可以通过抑制自由基的生成来防止神经退化[3],使用抗氧化剂治疗可预防学习记忆障碍[4]。因此调节胆碱能系统的平衡和减少氧化应激可能是治疗AD的有效措施。乙酰胆碱酯酶(AchE)抑制剂如他克林、多奈哌齐和石杉碱甲等是目前临床治疗AD的首选药物,但是其价格昂贵且存在一定的不良反应。因此从天然产物和中草药中发掘治疗AD的药物已成为当下的研究热点。
木犀草素是一种天然的黄酮类化合物,具有多种药理学活性,如抗氧化、抗炎、减少氧化应激损伤、修复细胞及抗凋亡等,已被广泛应用于药理学和临床实践中。本课题组前期研究发现,木犀草素可以通过抑制活性氧、一氧化氮、3-硝基酪氨酸水平的增加以及提高抗氧化能力来防护回转模拟失重条件下神经细胞的氧化损伤[5];通过PI3K-Akt-NF-κB-ERK信号通路来抑制神经细胞的氧化应激[6]。 但是关于木犀草素对AD样学习记忆障碍及胆碱能紊乱的影响却鲜有报道。基于此,作者通过腹腔注射东莨菪碱建立大鼠学习记忆障碍模型,研究木犀草素对学习记忆障碍、胆碱能系统、氧化损伤的改善作用,以期为木犀草素治疗学习记忆障碍相关疾病提供依据。
1 实验
1.1 实验动物
SPF级健康雄性SD大鼠,体重200~220 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。大鼠购入后首先在室内光照12 h、室温25 ℃、湿度(55±5)%的条件下自由进水饮食适应性饲养3 d,备用。
1.2 药品、试剂与仪器
木犀草素(批号150703),上海融禾医药科技发展有限公司;多奈哌齐(批号1407016),卫材(中国)药业公司;东莨菪碱,Sigma公司。
超氧化物歧化酶(SOD)测试盒、丙二醛(MDA)测试盒、乙酰胆碱酯酶(AchE)测试盒、考马斯亮蓝试剂盒均由南京建成生物工程研究所提供;其它试剂均为分析纯。
电子天平,德国Sartorius公司;Morris水迷宫和避暗计算机图像实时检测分析处理系统,中国航天员科研训练中心与中国医学科学院药用植物研究所;高速低温离心机,美国Thermo Scientific公司;紫外分光光度计,美国BioTek公司。
1.3 方法
1.3.1 动物分组及给药
SD大鼠随机分为6组,每组10只:正常对照组、模型组、多奈哌齐组(阳性对照)、3种剂量(30 mg·kg-1、60 mg·kg-1、120 mg·kg-1)木犀草素组。
正常对照组和模型组用生理盐水灌胃;多奈哌齐组灌服1 mg·kg-1多奈哌齐;木犀草素组分别灌服30 mg·kg-1、60 mg·kg-1、120 mg·kg-1木犀草素,每天上午8点给药,连续给药28 d,给药时间保持一致。在给药第21 d进行行为学测试,测试时间在每天上午10点至下午4点之间,其中第21~26 d进行Morris水迷宫实验,第27~28 d进行避暗实验。行为学测试前30 min 除正常对照组外其余组均腹腔注射东莨菪碱(1 mg·kg-1),建立大鼠学习记忆障碍模型。腹腔注射及灌胃体积均为0.01 mL·g-1。
1.3.2 Morris水迷宫实验
大鼠Morris水迷宫计算机图像实时检测分析处理系统硬件部分包含可移动圆形恒温水池(直径180 cm,高40 cm)、配套圆柱形防滑平台(直径9 cm,高25 cm)、温控系统、水循环系统、视频摄像系统,系统软件可自动记录大鼠运动轨迹并实现图像的实时检测分析与处理。
Morris水迷宫实验参照文献[7]进行,包括定航实验和探索实验。前5 d为定航实验,每天训练3次,每次从不同的入水点将大鼠面向池壁放入水池。水面高出平台1.5 cm,水中加入适量墨汁,使大鼠看不到平台,温度维持在22~24 ℃。测试时间为90 s,在平台上停留超过2 s即为寻台成功。每次测试前大鼠在平台上有10 s的前适应,测试完毕无论成功与否还有10 s的后适应。大鼠从入水到寻台成功所需时间记作逃避潜伏期,寻台失败则逃避潜伏期记作90 s。第6 d为探索实验,撤去平台,选择平台所在象限对角象限作为入水点,记录90 s内大鼠的穿台次数及在原目的象限的时间比和游程比。
1.3.3 避暗实验
大鼠避暗计算机图像实时检测分析处理系统由以避暗测试箱为主的硬件系统和配套的图像采集分析系统组成。其中避暗测试箱为封闭结构,分明、暗两室。明室上方以钨灯照明,暗室底部有不锈钢栅栏可独立控制通断电,两室之间有一小洞相连。
避暗实验在邓敏贞等[8]基础上有所改进,共进行2 d。第1 d,先将大鼠放入避暗测试箱中,使其在明、暗两室间自由适应3 min后取出;然后将大鼠背对洞口放入明室,同时向暗室底部栅栏通电(电刺幅度:电压65 V),时间为5 min。大鼠由于趋暗避明的习性很快通过洞口进入暗室,受电击后立即逃回明室,反复数次后形成条件反射。第2 d,重复第1 d操作,但暗室底部不通电,记录大鼠第1次从明室进入暗室的时间(入暗潜伏期) 和5 min内大鼠受到的电击次数(错误次数)。若5 min内大鼠未进入暗室,错误次数记为0次,入暗潜伏期记为300 s。
1.3.4 海马组织生化指标测定
行为学测试完毕,将大鼠断头后迅速于冰上取出脑组织并分离出海马,然后置于4 ℃预冷的生理盐水中,冲洗干净,加入9倍体积生理盐水制成10%的组织匀浆液。将匀浆液离心15 min(3 500 r·min-1),取上清液分装低温保存。采用考马斯亮蓝法测定蛋白含量后,分别测定SOD活性、AchE活性和MDA含量。
1.4 数据统计处理
2 结果与讨论
2.1 木犀草素对东莨菪碱模型大鼠Morris水迷宫定航实验的影响(表1)
表1

Tab.1

Effect of luteolin on escaping latency of place navigation test in rats induced by ±s,n=10)
注:与正常对照组比较,*表示P<0.05,**表示P<0.01;与模型组比较,#表示P<0.05,##表示P<0.01,下同。
由表1可知,随着时间的延长,各组大鼠的逃避潜伏期均逐渐缩短。与正常对照组比较,模型组大鼠的逃避潜伏期显著延长(P<0.05或P<0.01)。与模型组比较,在定航实验第5 d,多奈哌齐组和60 mg·kg-1木犀草素组大鼠的逃避潜伏期均显著缩短(P<0.05);在定航实验第3、4、5 d,120 mg·kg-1木犀草素组大鼠的逃避潜伏期显著缩短(P<0.05或P<0.01);30 mg·kg-1木犀草素处理对大鼠逃避潜伏期的缩短并无显著作用。
2.2 木犀草素对东莨菪碱模型大鼠Morris水迷宫探索实验的影响(表2)
由表2可知,与正常对照组比较,模型组大鼠90 s内的穿台次数和在目的象限时间比及游程比显著减少(P<0.05或P<0.01);与模型组比较,多奈哌齐和120 mg·kg-1木犀草素处理均能显著增加大鼠的穿台次数及其在目的象限时间比和游程比(P<0.05);30 mg·kg-1及60 mg·kg-1木犀草素处理虽能改善以上3个指标,但与模型组之间差异并无统计学意义。
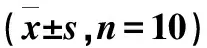
Tab.2 Effect of luteolin on spatial probe test in rats

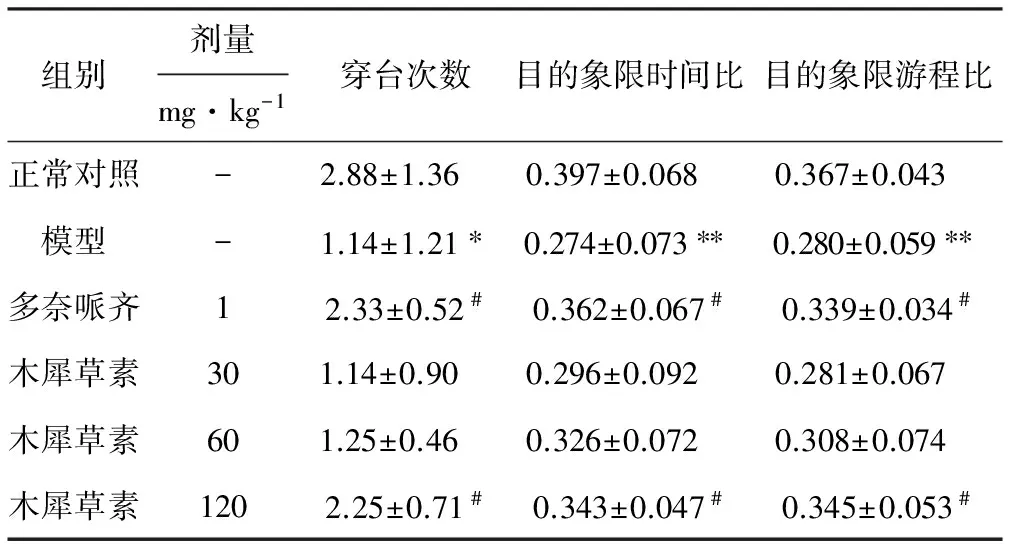
组别剂量mg·kg-1穿台次数目的象限时间比目的象限游程比正常对照-2.88±1.36 0.397±0.068 0.367±0.043 模型-1.14±1.21∗0.274±0.073∗∗0.280±0.059∗∗多奈哌齐12.33±0.52#0.362±0.067#0.339±0.034#木犀草素301.14±0.90 0.296±0.092 0.281±0.067 木犀草素601.25±0.46 0.326±0.072 0.308±0.074 木犀草素1202.25±0.71#0.343±0.047#0.345±0.053#
2.3 木犀草素对东莨菪碱模型大鼠避暗实验的影响(表3)
由表3可知,与正常对照组比较,模型组的入暗潜伏期极显著缩短(P<0.01),错误次数有所增加;与模型组比较,各给药组入暗潜伏期显著延长(P<0.05或P<0.01),错误次数有减少趋势,但差异无统计学意义。
Tab.3 Effect of luteolin on step-through test in rats


组别剂量mg·kg-1入暗潜伏期/s错误次数正常对照- 298.48±6.630.11±0.32模型- 222.34±122.36∗∗0.31±0.48多奈哌齐1 270.12±73.25#0.15±0.38木犀草素30 290.41±30.22##0.13±0.35木犀草素60 285.41±42.74##0.11±0.32木犀草素120 283.68±43.57##0.13±0.35
2.4 木犀草素对东莨菪碱模型大鼠海马组织SOD活性、AchE活性及MDA含量的影响(表4)


Tab.4Effect of luteolin on activities of SOD,AchE and MDA content in rat
由表4可知,与正常对照组比较,模型组大鼠海马组织SOD活性极显著下降(P<0.01),MDA含量和AchE活性显著升高(P<0.05或P<0.01)。与模型组比较,多奈哌齐组和120 mg·kg-1木犀草素组大鼠海马组织的SOD活性显著升高(P<0.05或P<0.01);多奈哌齐处理可使大鼠海马组织MDA含量和AchE活性显著下降(P<0.05);120 mg·kg-1木犀草素处理可以显著降低东莨菪碱模型大鼠海马组织AchE活性(P<0.05或P<0.01)。
2.5 讨论
目前研究认为学习记忆功能与中枢胆碱能系统的关系密切,其功能降低可能导致学习记忆障碍。乙酰胆碱(ACh)在学习记忆功能中发挥着重要作用,而东莨菪碱作为一种非选择性M受体阻断剂,可以透过血脑屏障阻断中枢乙酰胆碱与其受体的结合,破坏大脑皮层和海马等部位的胆碱能神经信号传递,进而降低学习记忆功能[9]。相较于其它动物模型,腹腔注射东莨菪碱建立学习记忆障碍模型具有简单、经济、方便等优点,故其常被用来进行抗AD药物或保健品的初筛[10]。本研究大鼠腹腔注射东莨菪碱1 mg·kg-1后,其在Morris水迷宫实验和避暗实验中学习记忆能力相比于正常对照组均明显下降,说明大鼠学习记忆障碍模型构建成功。
Morris水迷宫是一种经典的学习记忆功能评价方法,定航实验和探索实验分别反映了动物的空间学习能力和空间记忆能力。本研究中,与正常对照组比较,模型组大鼠的逃避潜伏期显著延长;与模型组比较,60 mg·kg-1、120 mg·kg-1木犀草素组大鼠的逃避潜伏期缩短,说明木犀草素有改善AD模型大鼠空间学习能力的作用。本研究模型组大鼠在原平台象限的活动(穿台次数、目的象限时间比和游程比)明显减少,而120 mg·kg-1木犀草素处理可以显著增加大鼠在原平台象限的活动,这表明木犀草素也可以改善AD模型大鼠的空间记忆能力。考虑到行为学结果的可参考性,本研究采用避暗实验进一步研究木犀草素对东莨菪碱模型大鼠学习记忆障碍的改善作用。结果表明,东莨菪碱模型大鼠入暗潜伏期显著缩短,木犀草素处理可以显著延长大鼠的入暗潜伏期,表明木犀草素同样可以改善AD模型大鼠在被动回避任务中的表现。
氧化损伤在AD的发生和发展中发挥重要作用[11],目前认为记忆减退的重要原因包含抗氧化酶活性的降低、自由基的积累及由此导致的氧化应激损伤[12]。研究表明,脑内胆碱能系统损伤及胆碱能神经丢失导致的乙酰胆碱减少是造成学习记忆功能下降的直接原因。在中枢神经系统中,海马是与学习记忆功能密切相关的重要脑区,因此本研究对大鼠海马组织中与氧化损伤和胆碱能系统相关指标进行了检测,并试图发现木犀草素对这两方面的改善效应。SOD作为机体内主要的抗氧化酶,其活性高低间接反映了机体清除氧自由基的能力。MDA是机体内脂质过氧化反应的最终分解产物, 其含量多少可以反映体内自由基的多少及反应强度。乙酰胆碱合成及代谢的关键酶分别为胆碱乙酰转移酶(ChAT)和乙酰胆碱酯酶(AchE),通过促进合成酶或抑制代谢酶活性可维持突触间隙高水平的乙酰胆碱,增强胆碱能神经传递,提高学习记忆能力。本研究结果表明,腹腔注射东莨菪碱后,大鼠海马组织SOD活性下降,MDA含量和AchE活性升高,提示东莨菪碱诱导的学习记忆障碍与高氧化应激反应和脑内胆碱能功能降低有关。木犀草素处理能够有效逆转痴呆大鼠海马组织SOD活性的下降,并可降低MDA含量,抑制AchE活性升高,提示木犀草素可能通过对抗脑内氧化应激损伤和维持胆碱能系统稳定来改善AD模型大鼠的学习记忆功能,但其作用机制还有待于进一步深入研究。
近来研究发现,木犀草素对其它因素导致的学习记忆障碍也有改善作用。在慢性脑低灌注不足损伤中,木犀草素可以保护突触,引发长时程增强,并且缩短大鼠在Morris水迷宫实验中的逃避潜伏期[13]。通过灌服木犀草素可以抑制海马小胶质细胞相关的炎症反应,从而增强老年小鼠的空间工作记忆[14]。木犀草素可通过消除活性氧改善胆碱能系统,促进BDNF和TrkB表达,改善由Aβ(25-35)诱导的认知障碍[15]。木犀草素可以改善由高脂饮食所致肥胖模型小鼠的学习记忆障碍,这可能与木犀草素的抗炎、抗氧化以及提高BDNF和突触后致密蛋白表达水平有关[16]。木犀草素通过抑制氧化应激水平和胆碱酯酶活性的升高来改善糖尿病大鼠的学习记忆障碍[17]。由此可见,对抗氧化损伤和保持胆碱能功能稳定是木犀草素改善学习记忆障碍的重要途径。
3 结论
木犀草素可以改善东莨菪碱诱导的AD模型大鼠的学习记忆障碍,其作用是通过调节胆碱能系统平衡和抑制氧化损伤实现的。木犀草素在神经保护方面有巨大潜力,可以作为治疗包括AD在内的多种学习记忆障碍病症的有效候选药物。
[1] RUAN C J,LI Z,ZHANG L,et al.Protective effects oftrans-2,4-dimethoxystibene on cognitive,impairments induced by A beta(25-35) in hypercholesterolemic rats[J].Brain Research Bulletin,2010,82(5/6):251-258.
[2] CHOI J,LEVEY A I,WEINTRAUB S T,et al.Oxidative modifications and down-regulation of ubiquitin carboxyl-terminal hydrolase L1 associated with idiopathic Parkinson′s and Alzheimer′s diseases[J].Journal of Biological Chemistry,2004,279(13):13256-13264.
[3] CHOI S J,KIM M J,HEO H J,et al.Ameliorating effect of Gardenia jasminoides extract on amyloid beta peptide-induced neuronal cell deficit[J].Molecules and Cells,2007,24(1):113-118.
[4] BAGHERI M,JOGHATAEI M-T,MOHSENI S,et al.Genistein ameliorates learning and memory deficits in amyloidβ(1-40) rat model of Alzheimer′s disease[J].Neurobiology Learning and Memory,2011,95(3):270-276.
[5] QU L,CHEN H,LIU X M,et al.Protective effects of flavonoids against oxidative stress induced by simulated microgravity in SH-SY5Y cells[J].Neurochemical Research,2010,35(9): 1445-1454.
[6] ZHOU F,QU L,LV K,et al.Luteolin protects against reactive oxygen species-mediated cell death induced by zinc toxicityviathe PI3K-Akt-NF-κB-ERK-dependent pathway[J].Journal of Neuroscience Research,2011,89(11):1859-1868.
[7] 卜兰兰,石哲,武宏伟,等.达玛烷苷元对睡眠干扰所致小鼠学习记忆障碍的改善作用[J].中国比较医学杂志,2014,24(10):48-53.
[8] 邓敏贞,黄丽平,方永奇.石菖蒲挥发油联合人参总皂苷对D-半乳糖联合氯化铝致阿尔茨海默病模型小鼠学习记忆能力及脑组织细胞凋亡的影响[J].中药材,2015,38(5):1018-1023.
[9] KLINKENBERG I,BLOKLAND A.The validity of scopolamine as a pharmacological model for cognitive impairment:a review of animal behavioral studies[J].Neuroscience & Biobehavioral Reviews,2010,34(8):1307-1350.
[10] XIANG G Q,TANG S S,JIANG L Y,et al.PPARγagonist pioglitazone improves scopolamine-induced memory impairment in mice[J].Journal of Pharmacy and Pharmacology,2012,64(4):589-596.[11] REDDY P H.Amyloid precursor protein-mediated free radicals and oxidative damage:implications for the development and progression of Alzheimer′s disease[J].Journal of Neurochemistry,2006,96(1):1-13.
[12] MASSAAD C A,WASHINGTON T M,PAUTLER R G,et al.Overexpression of SOD-2 reduces hippocampal superoxide and prevents memory deficits in a mouse model of Alzheimer′s disease[J].Proceedings of the National Academy of Sciences,2009,106(32):13576-13581.
[13] XU B,LI X X,HE G R,et al.Luteolin promotes long-term potentiation and improves cognitive functions in chronic cerebral hypoperfused rats[J].European Journal of Pharmacology,2010,627(1/2/3):99-105.
[14] JANG S B,DILGER R N,JOHNSON R W.Luteolin inhibits microglia and alters hippocampal-dependent spatial working memory in aged mice[J].Journal of Nutrition,2010,140(10):1892-1898.
[15] LIU R,GAO M,QIANG G F,et al.The anti-amnesic effects of luteolin against amyloid beta(25-35) peptide-induced toxicity in mice involve the protection of neurovascular unit[J].Neuroscience,2009,162(4):1232-1243.
[16] LIU Y,FU X,LAN N,et al.Luteolin protects against high fat diet-induced cognitive deficits in obesity mice[J].Behavioural Brain Research,2014,267:178-188.
[17] LIU Y,TIAN X,GOU L S,et al.Luteolin attenuates diabetes-associated cognitive decline in rats[J].Brain Research Bulletin,2013,94(9):23-29.
Ameliorative Effects of Luteolin on Learning and Memory Impairment Induced by Scopolamine in Rats
ZHANG Yong-liang1,CHEN Hai-long2,WANG Ting-mei1,WANG Yan-li1, JI Guo-hua2,LI Ying-hui1,2*,QU Li-na2*
(1.SchoolofLifeSciences,NorthwesternPolytechnicalUniversity,Xi′an710072,China; 2.StateKeyLabofSpaceMedicineFundamentalandApplication,ChinaAstronautResearchandTrainingCenter,Beijing100094,China)
Ameliorativeeffectsofluteolinonlearningandmemoryimpairmentinducedbyscopolamineinratswerestudied.SDratswererandomlydividedintosixgroups:controlgroup,modelgroup,donepezilgroupandluteolingroups(30mg·kg-1,60mg·kg-1,120mg·kg-1).Scopolaminewasintraperitoneallyinjectedtoestablishlearningandmemoryimpairmentmodelinrats.Morriswatermazetestandstep-throughtestwereappliedtoinvestigatelearningandmemoryabilityofrats.Meanwhile,SODactivity,AchEactivityandMDAcontentinrathippocampustissueswerealsodetected.Resultsindicatedthat,comparedwiththemodelgroup,luteolin(120mg·kg-1)treatmentsignificantlydecreasedtheescapinglatency(P<0.05orP<0.01),increasedcrossingtimesandthepercentageoftimeintheplatformquadrantofratsinMorriswatermazetest(P<0.05),extendedthedarklatencyinstep-throughtest(P<0.01).Ontheotherhand,luteolin(120mg·kg-1)treatmentenhancedSODactivityinrathippocampustissues(P<0.01),whileAchEactivity(P<0.05)andMDAcontentweredepressed.Throughinhibitingoxidativedamageinhippocampustissuesandenhancingcholinergicfunction,luteolintreatmentcouldsignificantlyamelioratethelearningandmemoryimpairmentinducedbyscopolamineinrats.
luteolin;scopolamine;learningandmemory;ameliorativeeffect
国家科技重大专项(2012ZX09J12201),全军医药卫生“十二五”科研项目(BWS11J052),航天医学基础与应用国家重点实验室自主研究项目(SMFA15B01)
2016-09-22
张永亮(1985-),男,河南人,博士研究生,研究方向:航天医学工程、神经药理,E-mail:zhangyongliang1985@126.com;通讯作者:曲丽娜,研究员,E-mail:linaqu@263.net;李莹辉,研究员,E-mail:yinghuidd@vip.sina.com。
10.3969/j.issn.1672-5425.2017.02.008
R 285.5
A
1672-5425(2017)02-0033-05
张永亮,陈海龙,王婷梅,等.木犀草素对东莨菪碱所致大鼠学习记忆障碍的改善作用[J].化学与生物工程,2017,34(2):33-37,49.
