富锂锰基正极材料Li[Li0.2Ni0.2Mn0.6]O2的纳米TiO2掺杂改性*
2017-03-08王伟刚胡国荣周兴华彭忠东杜柯
王伟刚 胡国荣 周兴华 彭忠东 杜柯†
(1.中南大学 冶金与环境学院, 湖南 长沙 410083; 2.湖南晟通科技集团有限公司, 湖南 长沙 410200)
随着高速电动车行业的快速发展,对于高速电动车的“心脏”——锂离子动力电池的性能提出了更高的要求,其能量密度和安全性能指标都亟待提高.在锂离子电池产品组件中,正极材料占据着核心地位,其性能的好坏直接决定了锂离子电池产品的性能[1- 3].近年来,一种通式为xLi2MnO3·(1-x)LiMO2(M=Ni,Co,Mn)的富锂锰基固溶体正极材料凭借其250 mAh/g以上的高容量获得了学术界和产业界的广泛关注.该材料具有类似于LiCoO2的结构,充电电压高于4.5 V时,材料中的Li2MnO3组分被激活,Li和O以Li2O的形式脱出,从而获得高于一般层状材料的容量[4- 5].同时,和LiCoO2及三元材料相比,该材料锰含量相对较高,因此不但成本优势明显,而且具有更优异的安全性,同时也对环境更友好.
虽然富锂锰基固溶体材料具有上述优点,却也具有其自身的不足,严重制约了它的工业应用.比如该材料的结构在循环过程中会变得不稳定,进而导致容量的衰减;此外该材料在循环过程中还会表现出较差的倍率性能和明显的中值电压衰减.目前有大量文献[6- 9]报道富锂锰基固溶体材料在充电至4.5 V以上时会发生层状结构到尖晶石结构的相变和晶格畸变/非晶化,这是由Li2MnO3中的Li空位、Mn迁移和氧损失一起导致的.再加上高电压下电解液中的酸性物质会腐蚀电极,这进一步恶化了该材料的循环性能[4,6- 7].由此可以看出,提高富锂锰基固溶体材料的结构稳定性是改善其电性能的有效途径.
掺杂是改善锂离子电池正极材料电化学性能的一种有效手段,包括阴离子掺杂和阳离子掺杂.根据不同的需要选择合适的掺杂离子,取代原材料结构中的目标元素,从而达到提高电导率、稳定材料结构等目的.对富锂锰基固溶体材料进行金属离子掺杂能达到稳定其结构的目的.Nayak等[8]对Li1.2Ni0.16-Mn0.56Co0.08O2进行Al3+掺杂,掺杂后的材料在0.1C倍率下循环100周,容量保持率达到96%,相比未掺杂的材料(容量保持率为68%)有了显著改善.Li等[9]对Li1.2Mn0.54Co0.13-Ni0.13O2材料进行原位K+掺杂,掺杂后的材料循环110周后的容量保持率仍可达85%,同时K+可有效抑制尖晶石结构的形成,从而达到抑制中值电压衰减的目的.
纳米TiO2具有大的比表面积和纳米活性,在纺织、涂料、航天等领域具有广泛应用.Tao等[10]将纳米级的TiO2包覆至LiNi0.5Mn1.5O4表面,在高达15C的倍率下仍可获得74.5 mAh/g的放电容量,2C倍率下循环500周的容量保持率为88.5%.Feng等[11]用Ti4+对Li1.2Mn0.54Co0.13Ni0.13O2进行掺杂取代,所得的材料首次放电容量达到了320 mAh/g,循环300周的容量保持率为71%.文中通过采用共沉淀法制得的金属碳酸盐Mn0.75Ni0.25CO3前驱体,与Li2CO3和不同量的纳米Ti02制备Li[Li0.2Ni0.2-Mn0.6-xTix]O2(x=0.01,0.02,0.05,0.10)正极材料,并对不同Ti掺杂量的材料的性能进行了研究.
1 实验
1.1 材料的制备
1.1.1 实验原材料
过渡金属硫酸盐MnSO4·H2O、NiSO4·6H2O和Na2CO3,分析纯,购自天津大茂试剂厂;NH4HCO3,工业级,购自长沙唐华化工贸易有限公司;Li2CO3,电池级,购自四川天齐锂业股份有限公司;纳米TiO2,工业级,购自徐州捷创新材料有限公司.
1.1.2 前躯体及正极材料的改性制备
金属碳酸盐的前驱体Mn0.75Ni0.25CO3采用共沉淀法制得:将过渡金属硫酸盐MnSO4·H2O和NiSO4·6H2O用去离子水配成2 mol/L的金属盐混合液(其中Mn2+和Ni2+的摩尔比为3∶1),将其和沉淀剂(0.5 mol/L的Na2CO3溶液)以及络合剂(0.25 mol/L的NH4HCO3溶液)用蠕动泵同时加入反应釜中,从而制得碳酸盐共沉淀产物Ni0.25Mn0.75CO3,将该前驱体过滤干燥后和过量6%(质量分数)的Li2CO3及不同量的TiO2混合均匀,在900 ℃下烧结10 h制得Li[Li0.2Ni0.2Mn0.6-xTix]O2(x=0.00,0.01,0.02,0.05,0.10),所得产物分别记为P0.00、P0.01、P0.02、P0.05和P0.10.
1.2 材料性能表征
用Bruker Inc.AXS D8 ADVANCE型X射线衍射仪(德国Bruker公司生产)测定各产物的结构,扫描范围为10°~80°,用Jade软件读取各产物的晶胞参数.产物的表面形貌和颗粒大小用日本JEOL公司生产的JSM-5600LV型扫描电子显微镜进行观察.材料中的Ti含量用Varian Inc.AA240FS-GTA 120型原子吸收光谱仪(美国瓦里安公司生产)测定.
材料的电化学性能用CR2025纽扣式电池进行测定.电池组装采用传统的涂浆工艺,即将产物正极材料Li[Li0.2Ni0.2Mn0.6-xTix]O2(x=0.00,0.01,0.02、0.05,0.10)、导电炭黑和粘结剂(聚偏二氟乙烯,PVDF)按质量比8∶1∶1混合,然后以N-甲基吡咯烷酮(NMP)为溶剂,充分混合均匀涂抹至铝箔上.之后置于120 ℃烘箱中真空干燥24 h,然后轧制成正极片.以金属锂为负极、Celgard 2400多孔聚乙烯膜为隔膜,1 mol/L的LiPF6的EC、DMC和EMC(体积比1∶1∶1)的混合溶液作为电解液,在水和氧的质量分数均低于1×10-6的充满氩气的Universal 2440/750型手套箱(上海米开罗那机电技术有限公司生产)中组装成纽扣式实验电池,用LANDCT2001A电池测试系统(武汉市金诺电子有限公司生产)对纽扣式电池进行恒电流循环充放电测试,电压范围为2.0~4.8 V.交流阻抗测试(EIS)采用CHI660D电化学工作站完成,测试频率为10 mHz~100 kHz,交流幅值为5 mV,所有电化学测试过程保持25 ℃恒温.
2 结果和讨论
2.1 前驱体表征
图1(a)是共沉淀法制得的Ni0.25Mn0.75CO3前驱体的XRD谱图,样品的衍射峰与MnCO3的标准卡片(JCPDS:44-1472)相一致,三方晶系属于R-3c[167]空间组群.XRD谱图中没有发现其他杂质峰,这表明镍元素能够很好地进入MnCO3的晶格,并均匀分布在其中.由图1(b)的SEM照片可以看出,金属碳酸盐前驱体的二次颗粒粒径在10 μm左右,且有少量颗粒发生了破碎.
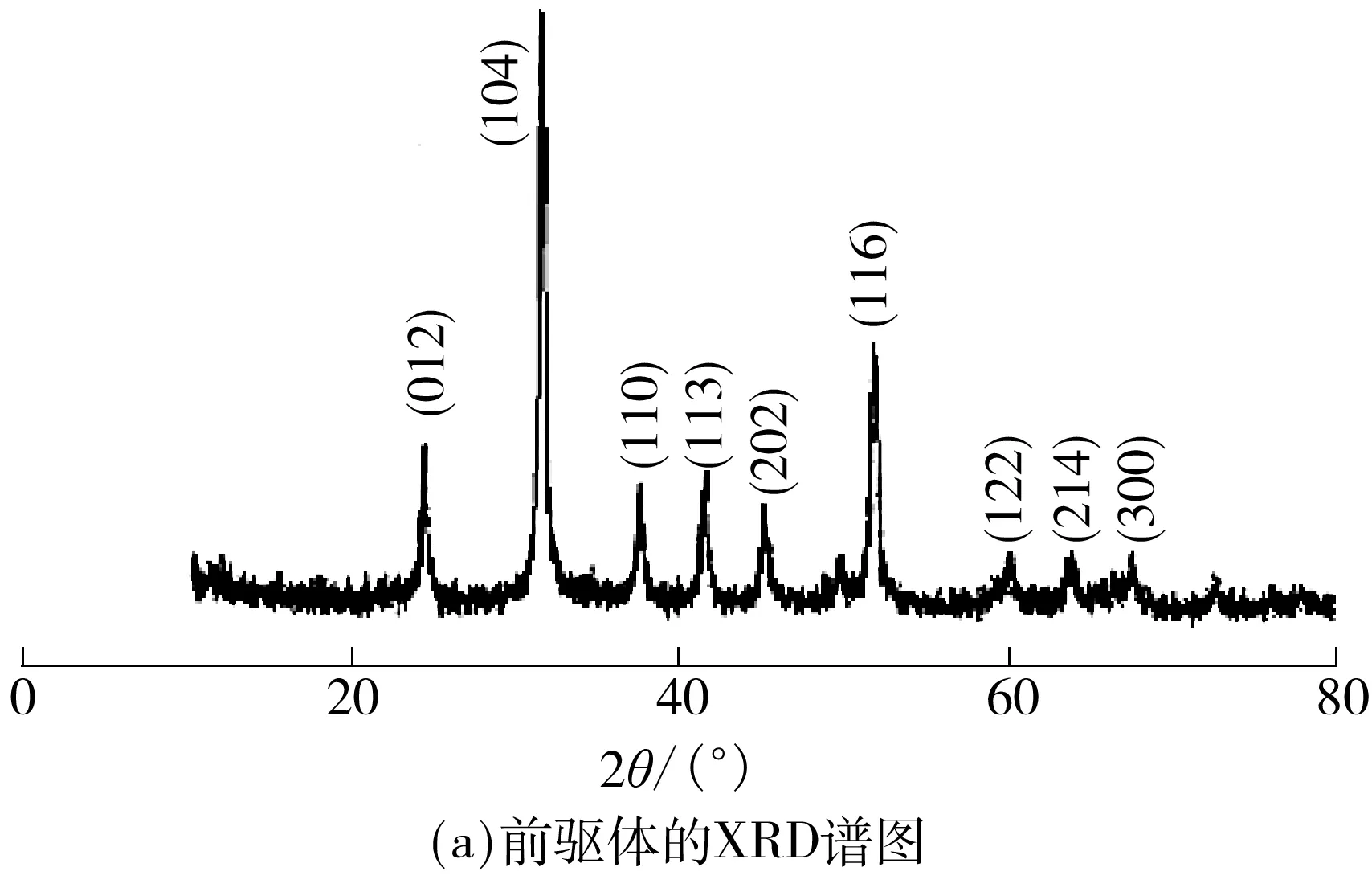

图1 金属碳酸盐前驱体的XRD谱图和SEM照片Fig.1 XRD pattern and SEM image of carbonate precursor
2.2 Ti掺杂对Li[Li0.2Ni0.2Mn0.6]O2结构和形貌的影响
图2是不同Ti掺杂量下合成的Li[Li0.2Ni0.2-Mn0.6-xTix]O2样品的XRD谱图.由图2可以看出,各样品均具有完整的层状结构,当Ti掺杂量为0.01、0.02时,所得产物的峰形和P0.00完全吻合,这说明少量Ti元素的掺杂不会改变原材料的晶体结构;当Ti掺杂量增加至0.05、0.10时,产物的XRD谱图上开始出现很明显的杂质峰,和标准卡片对比发现该杂质峰最有可能属于Li0.25MnTiO4,这表明掺杂过多的Ti会导致杂质相Li0.25MnTiO4的生成.
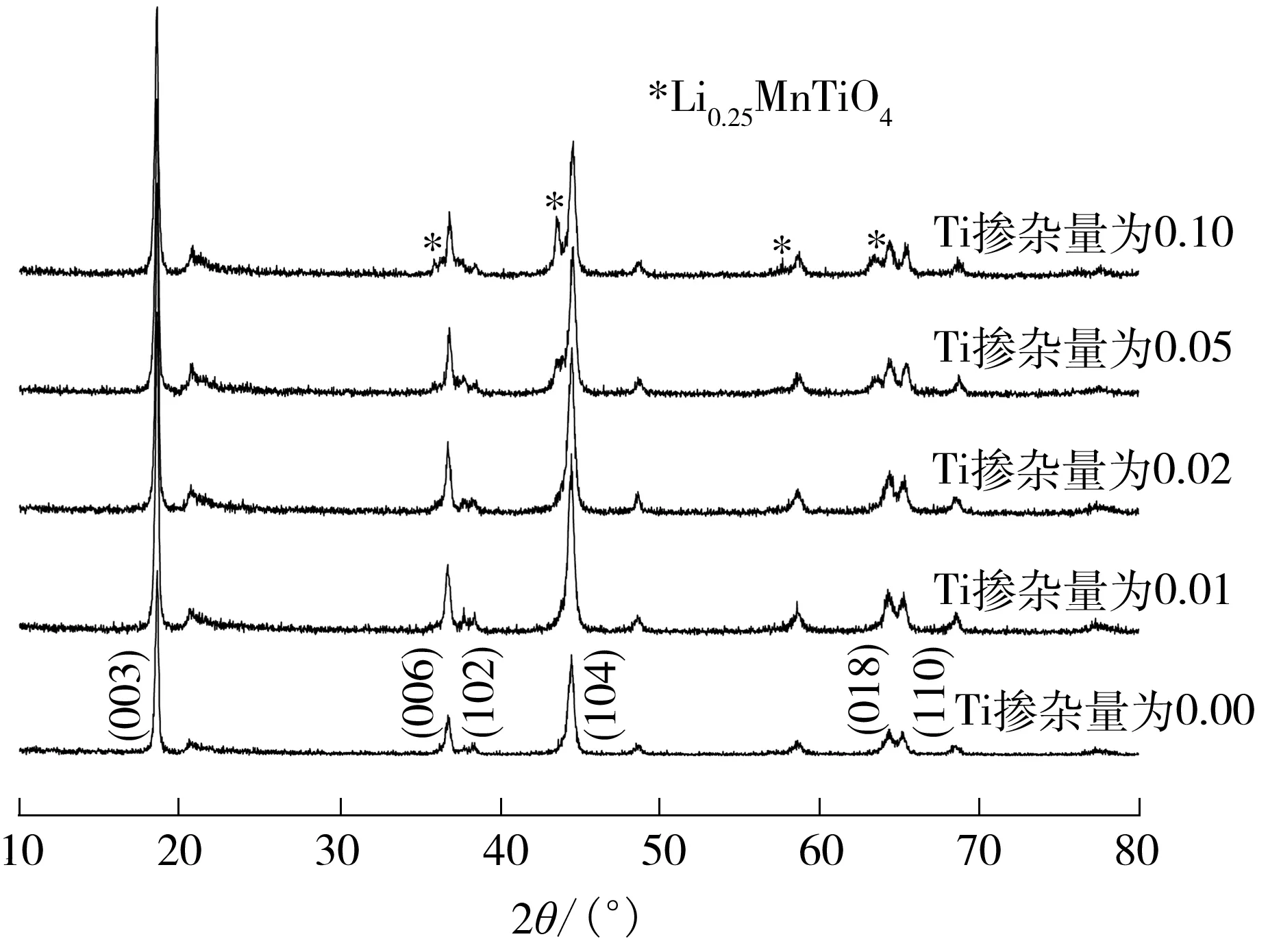
图2 不同Ti掺量Li[Li0.2Ni0.2Mn0.6]O2的XRD谱图
Fig.2 XRD patterns of Li[Li0.2Ni0.2Mn0.6]O2with different Ti doping amounts
表1是不同Ti掺杂量下合成的Li[Li0.2Ni0.2-Mn0.6-xTix]O2样品的晶胞参数(c、a)和强度(I003、I004)的比值,分析表中数据可知,对于各样品,c/a>4.899,I003/I104>1.2.随着Ti掺杂量的增多,c/a值和I003/I104值均呈现出增大的趋势,这表明各样品均具有良好的层状结构和较低的阳离子混排度[12- 15].此外掺杂Ti后,产物的晶胞参数a值略微减小,晶胞体积v缩小,这可能是因为少量的Ti可以取代晶体结构中的Mn,由此形成的Ti—O键键能(662.0 kJ/mol)大于Mn—O键键能(402.0 kJ/mol),Ti—O键键长小于Mn—O键键长,同时Ti4+半径比Mn4+大,因此材料的晶胞体积随Ti掺杂量的增加呈现出减小的趋势.
表1 Li[Li0.2Ni0.2Mn0.6-xTix]O2的晶胞参数和强度比值
Table 1 Lattice parameters and intensity ratios of Li[Li0.2Ni0.2-Mn0.6-xTix]O2
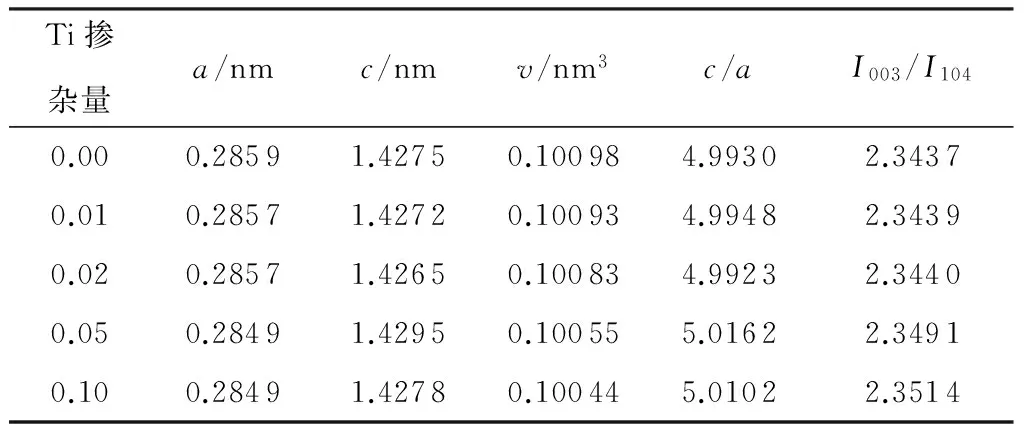
Ti掺杂量a/nmc/nmv/nm3c/aI003/I1040.000.28591.42750.100984.99302.34370.010.28571.42720.100934.99482.34390.020.28571.42650.100834.99232.34400.050.28491.42950.100555.01622.34910.100.28491.42780.100445.01022.3514
图3为不同Ti掺杂量合成的Li[Li0.2Ni0.2-Mn0.6-xTix]O2样品的SEM照片,从图中可以看出:当Ti掺杂量为0.01和0.02时,两样品的微观形貌与P0.00相差不大,少量颗粒团聚,粒径大小约为20 μm;当Ti掺杂量为0.05和0.10时,样品颗粒的粒径减小,呈现分散状,这表明Ti掺杂量较大时可能对样品的微观颗粒起到一定程度的分散作用,从而一定程度地减少颗粒间的团聚.
表2列出的是用原子吸收光谱仪测得的Li[Li0.2Ni0.2Mn0.6-xTix]O2正极材料中Ti含量的结果,将其与理论值进行对比,结果表明制备的材料组分基本符合最初的设计.





图3 不同Ti掺杂量Li[Li0.2Ni0.2Mn0.6]O2的SEM照片
Fig.3 SEM images of Li[Li0.2Ni0.2Mn0.6]O2with different Ti doping amounts
表2 Li[Li0.2Ni0.2Mn0.6-xTix]O2正极材料中Ti的含量
Table 2 Ti content of Li[Li0.2Ni0.2Mn0.6-xTix]O2cathode materials
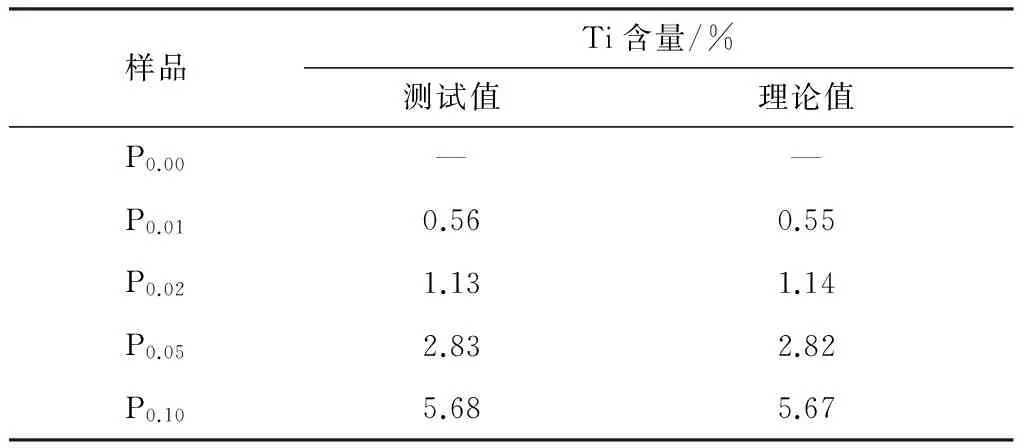
样品Ti含量/%测试值理论值P0.00——P0.010.560.55P0.021.131.14P0.052.832.82P0.105.685.67
2.3 Ti掺杂对Li[Li0.2Ni0.2Mn0.6]O2电化学性能的影响
图4为不同Ti掺杂量合成的Li[Li0.2Ni0.2-Mn0.6-xTix]O2样品在0.1C倍率下的首次充放电曲线和30次循环性能图.由图4(a)可知,掺Ti后材料的首次容量较未掺Ti的材料首次放电容量均有不同程度的降低,Ti掺杂量为0.02时首次放电比容量最高,达到226 mAh/g,Ti掺杂量为0.05和0.10时样品的放电比容量低至100 mAh/g以下,且充电曲线在4.5 V区域没有出现明显的充电平台.由图4(b)可以看出,和所有的富锂锰基固溶体材料一样,所有样品都需要一个容量活化的过程[16],但Ti掺杂量为0.05和0.10的材料即使经过活化,比容量也只能达到110 mAh/g左右.而合理的掺杂量可以在保证容量的前提下改善循环性能,当Ti掺杂量为0.02时,材料在经过30次循环后,容量仍保持230 mAh/g,无任何衰减,而未掺Ti的材料在循环30次以后,容量保持率为93%.据此再结合图2中的XRD谱图分析,掺入过量的Ti无法全部形成对目标材料中Mn元素的取代,在高温条件下生成杂质相Li0.25MnTiO4,最终导致电化学性能的恶化.
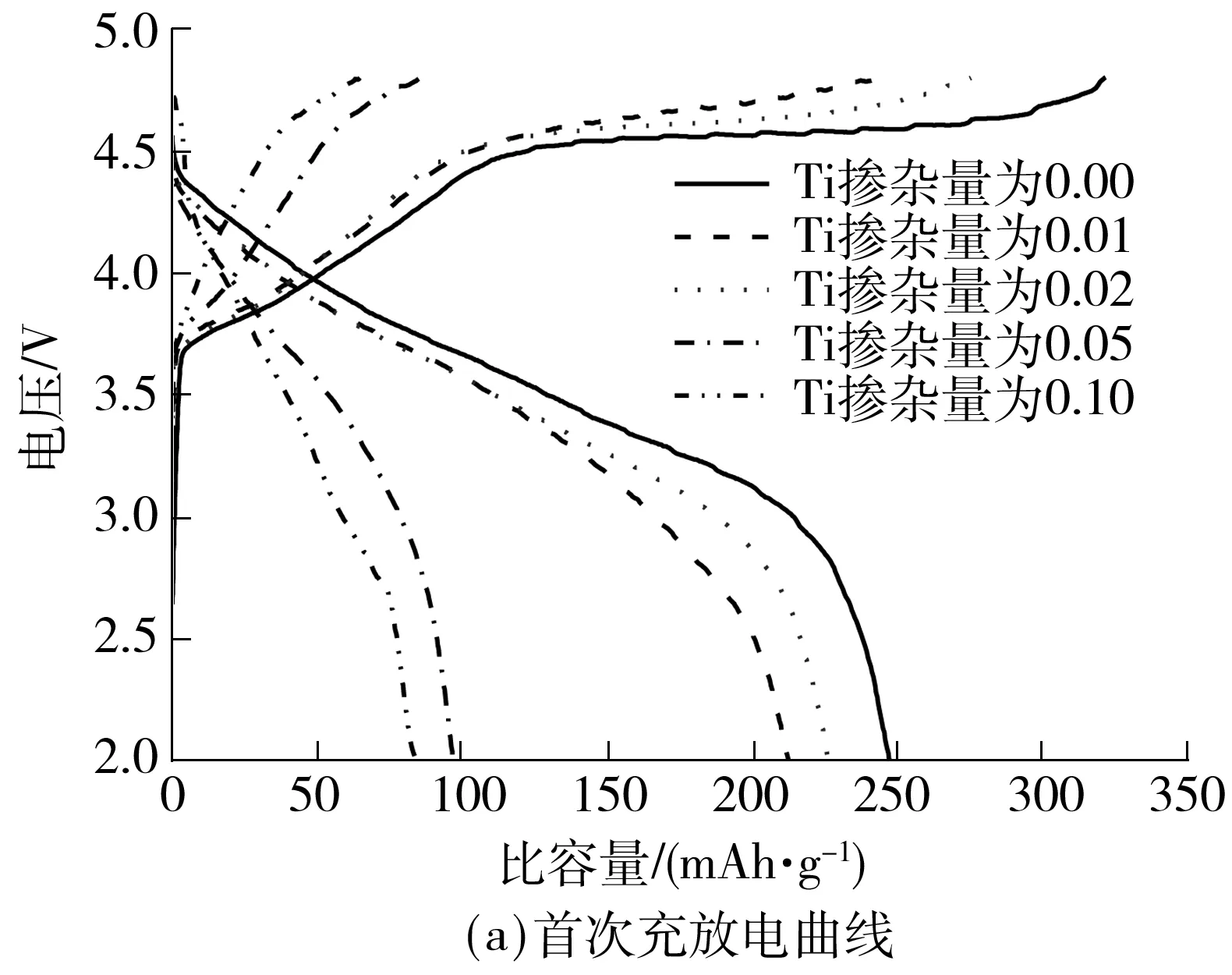
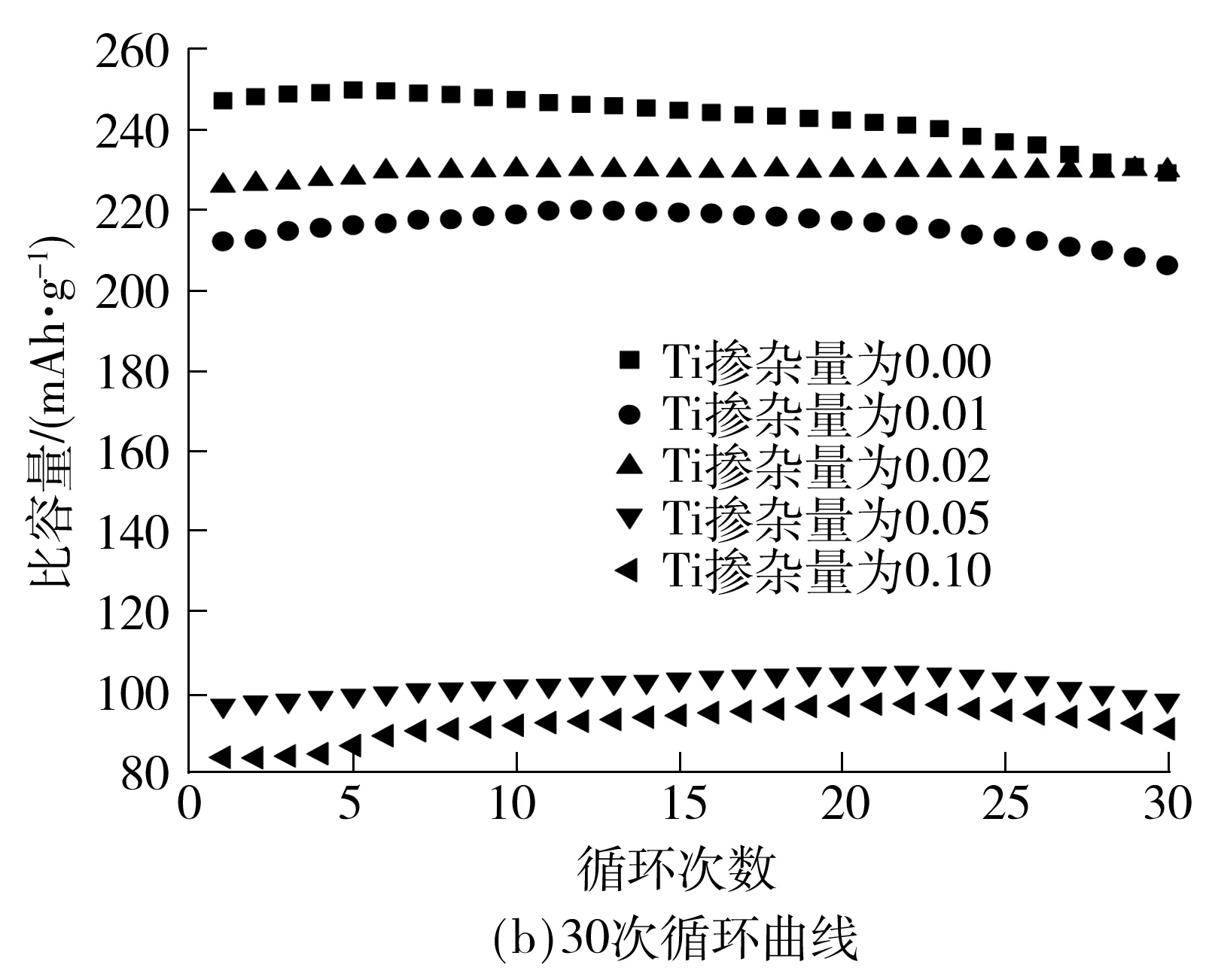
图4 不同Ti掺杂量的Li[Li0.2Ni0.2Mn0.6]O2在0.1C倍率下的首次充放电曲线和30次循环曲线
Fig.4 Initial charge-discharge curves and cycling curve for 30 cycles at 0.1C rate of Li[Li0.2Ni0.2Mn0.6]O2with diffe-rent Ti doping amounts
为了进一步了解Ti掺杂对Li[Li0.2Ni0.2Mn0.6]O2性能的影响,对P0.00和P0.02在不同倍率下的放电情况和0.1C倍率下循环30次过程中的中值电压变化进行对比.由图5(a)可以看出,P0.00和P0.02在0.1C、0.2C、0.5C、1.0C倍率下的放电容量分别为247、225、207、194 mAh/g和236、234、220、201 mAh/g,除了低倍率(0.1C),在其他倍率下P0.02的放电容量均比P0.00高出7~13 mAh/g,这表明合理的Ti掺杂量对Li[Li0.2Ni0.2Mn0.6]O2的倍率性能同样具有改善的作用.由图5(b)可见,经过30次循环后,P0.00和P0.02的中值电压分别从3.56 V和3.55 V降低到3.43 V和3.47 V,差值分别为0.13 V和0.08 V,这说明Ti的掺杂可以对材料在充放电过程中的中值电压起到稳定作用,这是因为 Ti—O键的键能大于Mn—O键,在将晶格中部分Mn元素取代后,一定程度上抑制了充放电过程中的Jahn-Teller效应,形成了更稳定的层状结构[7].
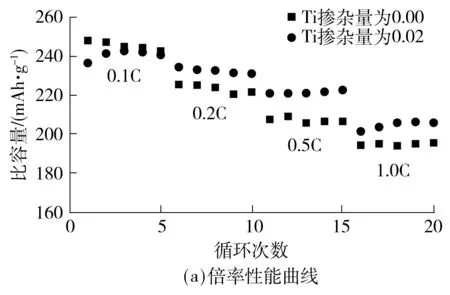
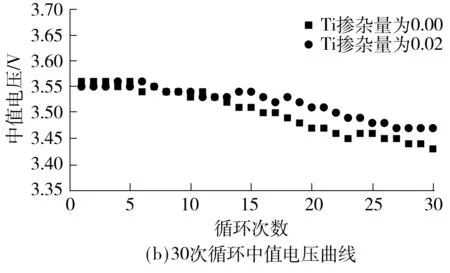
图5 P0.00和P0.02材料的倍率性能曲线和30次循环中值电压曲线
Fig.5 Rate capability plots and average voltage versus 30 cycle plots of P0.00and P0.02
为了就Ti掺杂对Li[Li0.2Ni0.2Mn0.6]O2倍率性能的影响机理进行研究,对循环0、20和30次的P0.00和P0.02分别进行交流阻抗(EIS)测试,拟合后各交流阻抗曲线及等效电路图如图6所示,其中Z′为阻抗实部,Z″为阻抗虚部.对此类电极的EIS进行定性分析可以表明结构的稳定性,进而区分体相和表面效应并反映循环过程中的变化趋势[8].文中据此对图6进行分析,富锂锰基固溶体材料的交流阻抗谱一般包括两部分,即两个半圆:高频区对应锂离子穿过材料表面SEI膜电阻R1的半圆和中低频区对应电荷转移阻抗R2的半圆,充电过程中在中低频区还可以观察到一条代表Warburg阻抗的斜线,该斜线通常被认为代表Li+在活性材料中的固态扩散系数,Rs为电池中各组件的固有电阻.由图6可以看出,掺Ti后的材料的各阻抗除了Rs均有增大,尤其是代表电荷转移阻抗的R2,电荷转移阻抗通常被认为与材料的倍率性能有关[8,12],而实际结果却是P0.02的倍率性能优于P0.00,这可能与Ti掺杂对材料结构稳定性的改善有关.
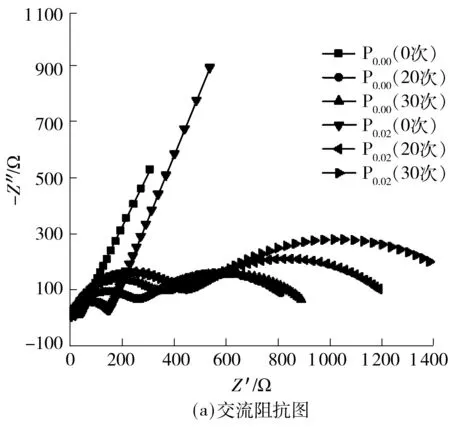
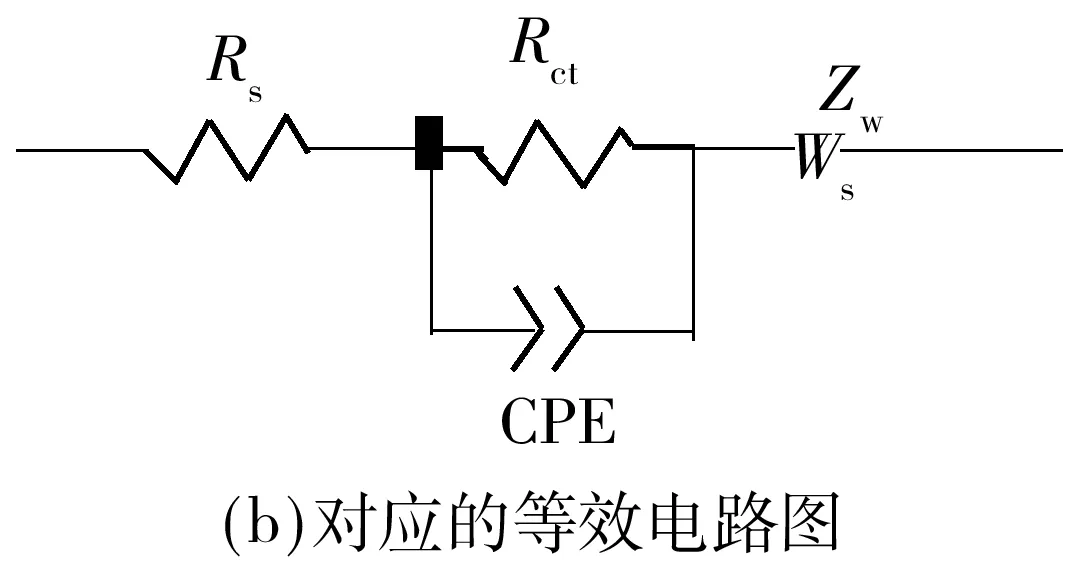
图6 P0.00和P0.02正极材料的交流阻抗图及等效电路图Fig.6 Nyquist plots and equivalent circuit of P0.00 and P0.02
3 结语
采用纳米TiO2对Li[Li0.2Ni0.2Mn0.6]O2正极材料进行掺杂改性,并研究了Ti掺杂对目标材料的结构、形貌和电化学性能的影响.结果表明:掺杂少量Ti时Ti可以均匀地进入目标材料的晶格中,而过量掺杂则会生成Li0.25MnTiO4杂质相;SEM分析表明Ti对目标材料的微观颗粒具有一定程度的分散作用;电化学性能测试表明Ti掺杂量为0.02时所得的材料具有最佳的循环和倍率性能,中值电压衰减得到了有效改善,这与Ti4+进入目标材料晶格中形成了更稳定的结构有关.
纳米TiO2掺杂可以有效改善Li[Li0.2Ni0.2-Mn0.6]O2正极材料的综合电化学性能,但改善机理还不是十分清楚,还需要依靠更先进的检测手段进行更深入的分析,以期为实现富锂锰基正极材料的产业化提供理论依据与技术参考.
[1] GOODENOUGH J B,PARK K S.The Li-ion rechargeable battery:a perspective [J].Journal of the American Che-mical Society,2013,135(4):1167- 1176.
[2] CROY J R,ABOUIMRANE A,ZHANG Z.Next-generation lithium-ion batteries:the promise of near-term advancements [J].MRS Bulletin,2014,39(5):407- 415.
[3] 杨晓西,王铁军,丁静,等.锂离子电池及其材料的发展近况 [J].华南理工大学学报(自然科学版),1999,27(5):52- 58.
YANG Xiao-xi,WANG Tie-jun,DING Jing,et al.Recent development of lithium-ion batteries and their materials [J].Journal of South China University of Technology(Natural Science Edition),1999,27(5):52- 58.
[4] JOHNSON C S,KIM J S,LEFIEF C,et al.The significance of the Li2MnO3component in ‘composite’xLi2MnO3·(1-x)LiMn0.5Ni0.5O2electrodes [J].Electrochemistry Communications,2004,6(10):1085- 1091.
[5] THACKERAY M M,KANG S H,JOHNSON C S,et al.Li2MnO3-stabilized LiMO2(M=Mn,Ni,Co) electrodes for lithium-ionbatteries [J].Journal of Materials Chemistry,2007,17(30):3112- 3125.
[6] KIM J M,TSURUTA S,KUMAGAI N.Electrochemical properties of Li(Li((1-x))/3CoxMn(2-2x)/3)O2(0≤x≤1) solid solutions prepared by poly-vinyl alcohol(PVA) method [J].Electrochemistry Communications,2007,9(1):103- 108.
[7] KANG S H,THACKERAY M M.Enhancing the rate capability of high capacityxLi2MnO3·(1-x)LiMO2(M=Mn,Ni Co) electrodes by LiNiPO4treatment [J].Electrochemistry Communications,2009,11(4):748- 751.
[8] NAYAK P K,GRINBLAT J,LEVI M,et al.Al doping for mitigating the capacity fading and voltage decay of layered Li and Mn-rich cathodes for Li-ion batteries [J].Advanced Energy Materials,2016,6(8):n/a-n/a.
[9] LI Q,LI G,FU C,et al.K+-doped Li1.2Mn0.54Co0.13Ni0.13-O2:a novelcathode materialwith an enhanced cycling stability for lithium-ion batteries [J].Applied Materials & Interfaces,2014,6(13):10330- 10341.
[10] TAO S,KONG F J,WU C Q,et al.Nanoscale TiO2membrane coating spinel LiNi0.5Mn1.5O4cathode material for advanced lithium-ion batteries [J].Journal of Alloys and Compounds,2017,705:413- 419.
[11] FENG X,GAO Y R,BEN L B,et al.Enhanced electrochemical performance of Ti-doped Li1.2Mn0.54Co0.13-Ni0.13O2for lithium-ion batteries [J].Journal of Power Sources,2016,317:74- 80.
[12] QING R P,SHI J L,ZHAI Y B,et al.Synthesis and electrochemical properties of a high capacity Li-rich cathode material in molten KCl-Na2CO3flux [J].Electrochimica Acta,2016,196:749- 755.
[13] 李节宾,徐友龙,熊礼龙,等.纳米MgO掺杂改善LiNi1/3Co1/3Mn1/3O2正极材料 [J].物理化学学报,2011,27(11):2593- 2599.
LI Jie-bin,XU You-long,XIONG Li-long,et al.Improvement of LiNi1/3Co1/3Mn1/3O2cathode materials by nano-MgO doping [J].Acta Physico-Chimica Sinica,2011,27(11):2593- 2599.
[14] MIAO X W,YAN Y,WANG C G,et al.Optimal microwave-assisted hydrothermal synthesis of nanosizedxLi2MnO3·(1-x)LiNi1/3Co1/3Mn1/3O2cathode materials for lithiumion battery [J].Journal of Power Sources,2014,247:219- 227.
[15] FAN J M,LIG S,LUO D,et al.Hydrothermal-assisted synthesis of Li-rich layered oxide microspheres with high capacity and superior rate-capability as acathode for lithium-ion batteries [J].Electrochimica Acta,2015,173:7- 16.
[16] 杜柯,黄霞,杨菲,等.锂离子电池正极材料Li[Li0.2-Ni0.2Mn0.6]O2的酸浸改性研究 [J].无机化学学报,2012,28(5):983- 988.
DU Ke,HUANG Xia,YANG Fei,et al.Modification of Li[Li0.2Ni0.2Mn0.6]O2as cathode material for rechargeable lithium batteries by acid-leaching [J].Chinese Journal of Inorganic Chemistry,2012,28(5):983- 988.
