活血方与阳和汤抗apoE-/-小鼠动脉粥样硬化并发非酒精性脂肪肝的比较研究❋
2017-03-08袁晓雯陶旭光乔艳雪李玉梅胡镜清马雅銮
姜 楠,袁晓雯,薛 欣,陶旭光,乔艳雪,李 蕊,陈 冰,李玉梅,胡镜清△△,马雅銮△
(1. 中国中医科学院中医基础理论研究所,北京 100700; 2. 首都医科大学附属北京地坛医院传染病研究所,北京 100015; 3. 新发突发传染病研究北京市重点实验室,北京 100015)
高脂血症(hyperlipidemia, HP)的发生与长期摄入高脂饮食、脂质代谢障碍有关。高血脂不仅触发和加速动脉粥样硬化(atherosclerosis,AS),还可引起肝脏脂质代谢负担加重,导致非酒精性脂肪性肝病(none- alcholic fatty liver disease,NAFLD)[1-2]。高脂血症引发机体全身慢性的炎症反应,与炎性细胞因子、单核/巨噬细胞为基础的免疫损伤过程密切相关[3]。因此,采用药物减轻高脂所致的免疫损伤,可以抑制或延缓高脂血症向AS和NAFLD的发生发展。
祛痰化瘀方是中国中医科学院中医基础理论研究所胡镜清研究员多年来治疗高脂血症/AS与心脑疾病等痰瘀互结证的经验方。前期研究证实,祛痰化瘀方具有抗炎和抗AS作用[4-5]。活血方是祛痰化瘀方的精简方,主要包括桃仁、生地、丹皮、干姜、羌活等活血类药物。AS斑块可由气血虚而寒痰凝滞所致,呈现漫肿无头、色泽不变、不热不疼的阴疽症状。治疗阴疽的代表方阳和汤出自《外科证治全生集》为温里剂,具有温阳补血、散寒通滞之功效,文献报道其对AS和冠心病具有治疗作用[6-8]。本文采用apoE-/-小鼠高脂喂养,探讨并比较活血方与阳和汤能否缓解高脂所致的免疫压力,以及延缓AS斑块形成和NAFLD的发生发展。
1 材料与方法
1.1 药物与试剂
活血方组成:桃仁、生地、丹皮、干姜、羌活、黄连,阳和汤组成:熟地、肉桂(去皮研粉)、麻黄、鹿角胶、白芥子、姜炭、生甘草,活血方和阳和汤药材购于北京同仁堂药店;抗小鼠CD11b-PercpCy5.5、Gr1-APC、CD48-FITC、TLR4-PE抗体和红细胞裂解液为美国BD Pharmingen公司产品;小鼠细胞因子Bio-Plex悬液芯片试剂盒购自MERCK公司;RNA提取试剂盒购自Quagen公司;逆转录试剂盒、实时荧光定量PCR试剂盒、小鼠实时荧光定量PCR探针甘油醛-3-磷酸脱氢酶(glyceralde hyde-3-phosphate dehydrogenase, GAPDH)、肿瘤坏死因子-a(Tumor Necrosis Factor-a, TNF-a)、白介素1β(Interleukin-1β, IL-1b)、IL-6、单核细胞趋化蛋白(monocyte chemo- attractant protein-1, MCP-1)、干扰素-g(interferon-g, IFN-g)和一氧化氮合酶-2(nitric oxide synthase-2, NOS-2) 购自ABI公司;生化试剂购于日本和光公司;FACS Callibur流式细胞仪为美国BD公司产品;Bio-PlexTM 200 System悬液芯片检测仪和C1000TMThermal Cycler实时定量PCR仪为美国BIO-RAD公司产品;BECKMAN CX4全自动生化分析仪为美国贝克曼库尔特公司产品。
1.2 分组及处理
所有实验用鼠均购自北京大学实验动物中心(动物许可证号SCXK(京)2011-0012),并饲养于SPF条件下。实验采用10周龄野生C57BL/6和apoE-/-雌性小鼠,体质量(20±2 g),每组8只。高脂饲料含78.85%基础饲料,0.15%胆固醇,21%脂肪。C57BL/6+普食为对照;apoE-/-小鼠分为apoE-/-+普食、apoE-/-+高脂、apoE-/-+高脂+活血方、apoE-/-+高脂+阳和汤干预组。干预组每天给予临床等效剂量,其他小组采用等量纯净水灌胃。
18周后,小鼠在异戊烷吸入麻醉下摘眼球采EDTA抗凝血,离心800 g 10 min后获取血浆,-80 ℃保存,用于生化检测和细胞因子悬液芯片检测备用。血细胞用于流式细胞仪检测,剥离胸腹主动脉和肝脏用于病理检测和实时定量PCR检测。
1.3 血脂水平测定
BECKMAN CX4全自动生化分析仪,日本和光公司试剂,常规测定各组血浆胆固醇(cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)、谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate transaminase,AST)水平。
1.4 外周血单核细胞及表面受体TLR4的表达检测
血细胞加入获取血浆等量的PBS,加1X红细胞裂解液裂解红细胞后,应用抗小鼠CD11b-PercpCy5.5、Gr-1-APC、CD48-FITC和TLR4-PE抗体直接法标记外周血白细胞,FACS Callibur流式细胞仪检测各组动物外周血单核细胞、单核细胞亚型比例及其表面toll样受体(Toll-like receptor 4, TLR4)的表达[5]。
1.5 细胞因子测定
各组动物血浆应用小鼠细胞因子悬液芯片试剂盒测定,严格按试剂盒说明书进行操作,Bio-PlexTM 200 System悬液芯片检测仪检测细胞因子IL-10、Il-1β、IL-6、MCP-1、巨噬细胞集落刺激因子(Macrophage colony stimulating factor, M-CSF)和TNFα的表达水平。
1.6 病理染色
剥离胸腹主动脉用4%多聚甲醛固定,经脱水、透明浸蜡、包埋、切片、摊片、HE染色后观察。取肝脏右上叶用4%多聚甲醛固定,经20%蔗糖脱水,OCT包埋、冰冻切片油红O染色。
1.7 实时定量PCR检测
剥离胸腹主动脉,剪取其主动脉弓少量的胸主动脉约1 cm,TRIzol法提取总RNA,逆转录成cDNA,应用C1000TMThermal Cycler实时定量PCR仪荧光定量PCR检测炎性因子TNF-a、IL-6、MCP-1、IFN-γ、NOS2和IL-1b 表达,使用ABI SDS 7500软件分析结果。
1.8 统计学方法
2 结果
2.1 血脂和肝功能水平变化
表1显示,普食状态下apoE-/-小鼠血脂TC和LDL水平显著高于C57BL/6小鼠,HDL水平显著低于野生小鼠(P<0.01)。18周高脂饮食apoE-/-模型小鼠的TC和LDL水平显著增高(P<0.01);给予活血方和阳和汤干预后,模型小鼠TC、TG、LDL和HDL水平未见明显改变(P>0.05)。C57BL/6小鼠比较,apoE-/-普食小鼠肝功能ALT水平升高(P<0.05),AST水平无明显改变(P>0.05);18周高脂饮食apoE-/-模型小鼠的ALT和AST水平无明显改变(P>0.05);活血方和阳和汤干预后模型小鼠ALT、AST水平未见明显改变(P>0.05)。
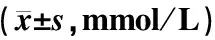
表1 各组小鼠血脂和肝功能水平比较
注:与野生普食组比较:*P<0.05,**P<0.001;与apoE-/-高脂组比较:▲▲P<0.001
2.2 外周血单核细胞及其炎症亚型比例以及表面受体TLR4表达水平比较
表2显示,饲养18周后apoE-/-普食小鼠与C57BL/6小鼠比较,外周血单核细胞及其Ly6C++比例无明显变化(P>0.05),表面受体TLR4表达水平无明显影响。18周的高脂饮食显著增加apoE-/-鼠外周血单核细胞比例(P<0.05)和Ly6C++比例(P<0.05),其表面受体TLR4表达有增高趋势,但差异无统计学意义(P>0.05)。活血方干预18周后,单核细胞及其炎症亚型Ly6C++比例显著降低(P<0.05),单核细胞和Ly6C++表面受体TLR4水平显著降低(P<0.05);阳和汤干预后,单核细胞比例无明显改变,但Ly6C++比例显著降低(P<0.05),单核细胞和Ly6C++表面受体TLR4水平显著降低(P<0.05)。
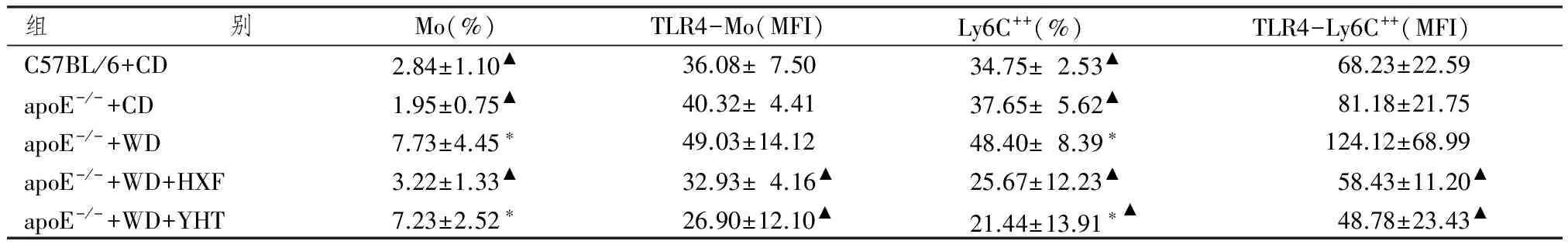
表2 各组动物单核细胞及Ly6C++亚型比例与表面受体TLR4表达水平比较
注:与野生普食组比较:*P<0.05;与apoE-/-高脂组比较:▲▲P<0.01
2.3 血浆细胞细胞因子表达水平的比较
表3显示,我们采用悬液芯片检测各组小鼠外周血细胞因子表达水平。结果发现,与C57BL/6小鼠比较,apoE-/-普食小鼠血浆细胞因子IL-10、Il-1β、IL-6、MCP-1、M-CSF和TNFα表达无明显改变(P>0.05),高脂饮食的apoE-/-小鼠除MCP-1和M-CSF表达水平显著增高外(P<0.05),IL-10、IL-1b和TNFα水平增加,但差异无统计学意义(P>0.05);活血方干预后,小鼠血浆细胞因子M-CSF水平显著降低(P<0.05),Il-1β、IL-10、MCP-1和TNFα水平降低,但差异无统计学意义(P>0.05);阳和汤干预后,细胞因子水平与高脂饮食组比较无明显改善。
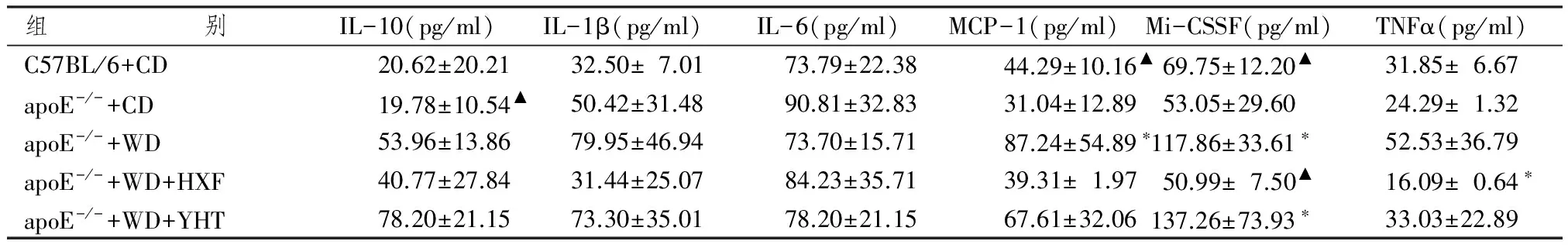
表3 各组动物血浆细胞因子表达水平
注:与野生普食组比较:*P<0.05;与apoE-/-高脂组比较:▲P<0.05
2.4 各组动物主动脉细胞因子mRNA表达水平比较
图1表4显示,10周龄apoE-/-小鼠普食饲养18周后,病理检测可见明显的主动脉粥样硬化斑块。因主动脉血管粥样硬化斑块不规则且分布不均匀,难以镜下定量比较,因此我们取主动脉根部1 cm组织提取mRNA,实时定量PCR检测主动脉血管局部炎症因子表达。
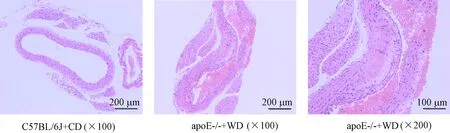
图1 HE染色检测主动脉病理组织变化比较
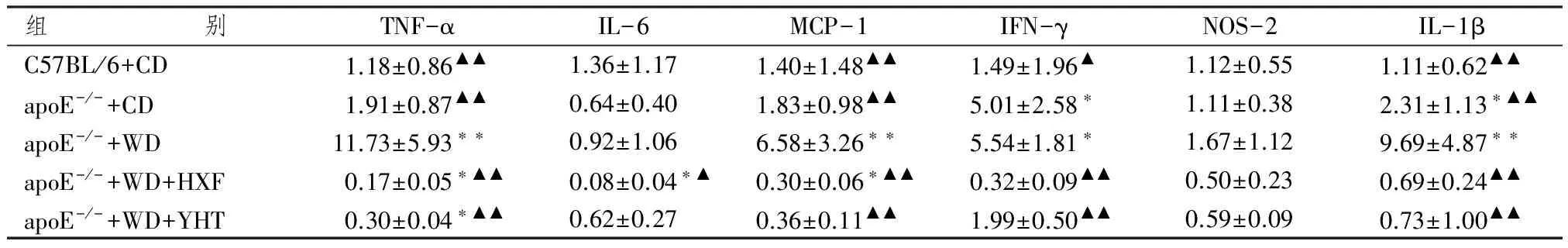
组 别TNF-αIL-6MCP-1IFN-γNOS-2IL-1βC57BL/6+CD1.18±0.86▲▲1.36±1.171.40±1.48▲▲1.49±1.96▲1.12±0.551.11±0.62▲▲apoE-/-+CD1.91±0.87▲▲0.64±0.401.83±0.98▲▲5.01±2.58∗1.11±0.382.31±1.13∗▲▲apoE-/-+WD11.73±5.93∗∗0.92±1.066.58±3.26∗∗5.54±1.81∗1.67±1.129.69±4.87∗∗apoE-/-+WD+HXF0.17±0.05∗▲▲0.08±0.04∗▲0.30±0.06∗▲▲0.32±0.09▲▲0.50±0.230.69±0.24▲▲apoE-/-+WD+YHT0.30±0.04∗▲▲0.62±0.270.36±0.11▲▲1.99±0.50▲▲0.59±0.090.73±1.00▲▲
注:与野生普食组比较:*P<0.05,**P<0.01;与apoE-/-高脂组比较:▲P<0.05,▲▲P<0.01
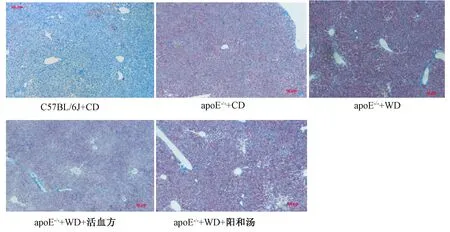
图2 油红O染色检测肝脏病理组织变化比较
与既往研究结果一致,野生普食小鼠比较,apoE-/-普食小鼠主动脉血管壁炎症因子IL-1b和 IFN-g mRNA水平显著升高(P<0.05);而接受高脂饮食后,apoE-/-小鼠主动脉血管壁炎症因子TNFα、Il-1b、MCP-1和 IFN-γ mRNA水平显著升高(P<0.01和P<0.05),提示高脂血症导致显著的血管炎症反应。活血方干预18周后,TNFα、Il-1b、MCP-1、IFN-γ和NOS-2 mRNA水平显著降低(P<0.01和P<0.05),阳和汤干预后,TNFα、Il-1b、IL-6、MCP-1、IFN-γ和NOS-2 mRNA水平显著降低(P<0.01和P<0.05),提示活血方和阳和汤均可减轻高脂导致的主动脉血管局部免疫损伤,活血方对血管局部的作用较阳和汤显著。
2.5 各组动物肝脏病理检测细胞因子mRNA表达水平比较
图2显示,10周龄apoE-/-小鼠普食饲养18周后,肝脏油红O染色可见肝细胞内富含脂滴,油红O染色呈阳性,给予高脂饮食后,可见油红O染色阳性增强;活血方组肝细胞内脂滴含量减少,而油红O染色呈现以血管为中心油红O染色减弱;阳和汤组肝脏油红O染色较模型组稍弱。
表5显示,实时定量PCR检测各组肝脏组织炎症因子与主动脉血管组织结果一致。与野生普食小鼠比较,apoE-/-普食组小鼠肝脏组织炎症因子TNFα、MCP-1和IL-1b mRNA水平显著升高(P<0.01),IL-6、IFN-γ和NOS-2 mRNA水平显著降低(P<0.01和P<0.05);而接受高脂饮食后,apoE-/-小鼠肝脏组织炎症因子TNFα、MCP-1和IL-6 mRNA水平进一步升高(与apoE-/-普食组比较P<0.01和P<0.05),提示apoE-/-基因敲除导致显著的肝脏炎症反应,高脂饮食进一步加重肝脏免疫损伤。活血方干预18周后,TNFα、MCP-1、IL-1b、IL-6、IFN-γ和NOS-2mRNA水平显著降低(P<0.01和P<0.05);阳和汤干预后,TNFα、MCP-1、IL-1b、IL-6和NOS-2mRNA水平显著降低(P<0.01和P<0.05),提示活血方与阳和汤均可以减轻高脂导致的肝脏免疫损伤,活血方减轻肝脏损伤效果较阳和汤显著。
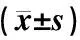
表5 各组动物肝脏炎症因子相对mRNA表达水平比较
注:与野生普食组比较:*P<0.05,**P<0.01;与apoE-/-高脂组比较:▲P<0.05,▲▲P<0.01
3 讨论
高脂血症促进AS和NAFLD形成[1-2],其中LDL-C是CHD及AS的危险因素,且与肝脏TG含量密切相关[9]。肝脏脂肪病变会通过提高血浆中TC、LDL-C的浓度,降低HDL-C的浓度加重AS的进展[10]。免疫损伤是AS和NAFLD的共性特征[11]。长期高血脂促进氧化应激、ox-LDL造成血管内皮细胞损伤,促进单核细胞趋化并分化成巨噬细胞吞噬脂质形成泡沫细胞沉积于血管壁形成AS[12]。同时大量的游离脂肪酸、甘油进入肝脏,超过肝脏的消化、转化、代谢能力,大量的脂肪在肝细胞内蓄积,并通过Kupffer细胞、细胞因子等复杂的炎症和免疫机制诱导NAFLD的形成[13]。因此,高脂血症导致慢性全身性炎症状态,加重血管和肝脏局部炎性病变[9],加剧AS和NAFLD的发生发展。
本研究采用apoE-/-小鼠18周高脂饮食,从模型组血脂水平和主动脉血管HE染色检测到AS斑块,说明AS模型成功。同时我们发现,模型组小鼠肝组织油红O染色阳性,病理特征有明显的肝细胞脂肪病变。结合模型组血脂,参考中华医学会2010年所推荐的NAFLD诊断标准[14],可将模型组小鼠诊断为NAFLD。在上述研究基础上,我们采用高脂饮食喂饲apoE-/-小鼠,分别给予活血方和阳和汤干预18周,探讨和比较2种方剂对于AS并发NAFLD小鼠的作用。结果我们发现,活血方能减轻高脂所致的免疫损伤,不仅改善AS还可抑制NAFLD;阳和汤的免疫调节作用较活血方弱,对AS和NAFLD抑制作用也不如活血方显著。我们前期研究还发现,活血方与阳和汤对于AS和NAFLD防治作用并不依赖于降脂,而是通过调节免疫发挥作用。另外给药干预18周,肝功能无明显改变,说明18周活血方与阳和汤干预未造成药物性肝损伤。
研究证明,免疫损伤在AS和NAFLD发生发展中在起重要作用,表现为一系列的全身和局部炎症反应[13]。对于系统炎症反应,活血方降低外周血单核细胞、炎症型单核细胞比例及其表面受体TLR4表达,阳和汤仅仅降低炎症型单核细胞比例和表面受体TLR4表达;对于血浆炎症因子,活血方降低炎症因子M-CSF、IL-10、IL-1b、MCP-1和TNF-a水平,阳和汤仅仅降低TNF-a水平,可见对于系统性炎症反应活血方抗炎作用强且全面,阳和汤作用弱且局限。对于血管和肝脏局部的免疫损伤,活血方和阳和汤明显降低主动脉血管炎症因子TNF-a、MCP-1、IFN-γ、NOS2和IL-1b表达,活血方降低效果更为显著。活血方和阳和汤的抗炎机制不同、作用强度不同,导致的作用结果也不相同。长期干预活血方减轻肝细胞脂质沉积,阳和汤改善血管肝脏病理损伤不如活血方明显。我们推测,活血方因活血行气,气行则血行,通过气行和血行广泛作用于全身血管乃至微血管,且作用直接而快速。阳和汤温阳疏布,作用于整体缓慢而温和,相形之下抗炎抗AS效果较慢且弱,不如活血方立竿见影。
虽然活血方与阳和汤免疫调节的作用机制、作用强度不同,但是我们发现,不论是活血方还是阳和汤对于局部炎症反应影响要优于对其全身炎症反应的影响,我们推测与选择的疾病模型、疾病发生部位直接相关,治疗的目标是改善病变部位,所以活血方与阳和汤的主要免疫调节靶点在血管和肝脏局部。
综上所述,活血方干预主要抑制apoE-/-小鼠
关。AD自噬的激活影响β-分泌酶(BACE1)转运到溶酶体降解,增加了轴突BACE1积累,使得β-淀粉样前体(APP)在BACE1作用下裂解产生过多的Aβ[17]。已有学者提出, AD病人大脑皮层和海马神经细胞体内存在数量较多的自噬体,LC3-Ⅱ表达升高[18];老龄AD小鼠脑内自噬高于正常,LC3-Ⅱ蛋白水平也增加[19]。Beclin1也参与Aβ代谢,所以自噬参与 Aβ生成和代谢。本研究AD模型大鼠海马LC3、Beclin1表达升高,自噬上升可影响神经元Aβ水平[19],使用GB后AD大鼠海马LC3和Beclin1降低。结合上述讨论认为,GB降低自噬可能是通过减少神经元自噬体数量及Aβ及其前体APP、提高突触蛋白表达、减少突触丢失、改善学习记忆的。自噬与AD联系密切,GB通过调控自噬改善AD相关学习记忆,但其中的具体作用机制尚需进一步探讨,以期为阐明GB改善AD学习记忆能力的机制奠定理论和实验基础。
[1] WEI L, JIA Y, YONG L, et al. Elevation of brain magnesium prevents synaptic loss and reverses cognitive deficits in Alzheimer’s disease mouse model[J]. Molecular Brain, 2014, 7(1):8423-8441.
[2] POZUETA J, LEFORT R, SHELANSKI ML. Synaptic changes in Alzheimer’s disease and its models[J]. Neuroscience, 2013, 251:51-65.
[3] LIPINSKI MM, ZHENG B, LU T, et al. Genome wide analysis reveals mechanisms modulating autophagy in normal brain aging and in Alzheimer’s disease.[J] Proc Natl Acad Sci USA, 2010, 107:14164-14169.
[4] SANCHEZ-VARO R1, TRUJILLO-ESTRADA L, SANCHEZ-MEJIAS E, et al. Abnormal accumulation of autophagic vesicles correlates with axonal and synapticpathology in young Alzheimer’s mice hippocampus[J]. Acta Neuropathol, 2012,123(1):53-70.
[5] CHEN Y, WEI G, NIE H, et al. beta-Asarone prevents autophagy and synaptic loss by reducing ROCK expression in asenescence-accelerated prone 8 mice[J]. Brain Res,2 014, 1552: 41-54.
[6] BATE C, TAYBEI M, WILLIAMS BA. Ginkgolides protect against amyloid-β1-42-mediated synapse damage in vitro[J]. Mol Neurodegeneration, 2008, 3(1): 127-131.
[7] YANG P, CAI X, ZHOU K, et al. A novel oil-body nanoemulsion formulation of ginkgolide B: pharmacokinetics study and in vivo pharmacodynamics evaluations[J]. J Pharm Sci, 2014,103(4): 1075-1084.
[8] CLAUDIA FEREZ-CRUZ. Reduced spine density in specific regions of CA1 pyramidal neurons in two transgenic mouse models of Alzheimer’s disease[J]. J Neurosci, 2011, 31 (10): 3926-3934.
[9] CLARE R, KING VG, WIRENFELDT M, et al. Synapse loss in dementias[J]. J Neurosci Res, 2010,88 (10): 2083-2090.
[10] 张均田. 神经元—突触丢失与老年痴呆[J]. 神经药理学报, 2011,1(1):1-15.
[11] SCHEFF SW, PRICE DA, SCHMITT FA, et al. Hippocampal synaptic loss in early Alzheimer’s disease and mild cognitive impairment[J]. Neurobiol Aging, 2006,27(10): 1372-1384.
[12] 罗磊,杜艳军. Aβ1-40、Aβ1-42与Aβ25-35在阿尔茨海默病模型复制中的评价[J]. 中国老年学杂志, 2014,9:2585-2587.
[13] 唐睿. 阿尔茨海默病发病机理与治疗策略[J]. 中山大学研究生学刊:自然科学医学版,2013,34(2):31-42.
[14] 郝莉,贺改英,张志雄. 银杏酮酯对小鼠学习记忆能力及海马神经炎症反应的影响[J] . 中国中医药信息杂志, 2014,21(8):49-53.
[15] 郝莉,徐玉英,任秀花,等. 银杏酮酯对自然衰老大鼠学习记忆及海马、前额叶皮层c-fos、Caspase-3和Caspase-8表达的影响[J]. 中药药理与临床, 2015,31(3):96-100.
[16] KENJI SUGAWARA,NOBUO N. SUZUKI. The crystal structure of microtubule-associated protein light chain 3, a mammalian homologue of Saccharomyces cerevisiae Atg8[J]. Genes Cells,2004,9(7): 611-618.
[17] FENG T, TAMMINENI P, AGRAWAL C, et al. Autophagy-Mediated Regulation of BACE1 Trafficking and Degradation[J]. J Biol Chem, 2017,292(5): 1679-1690.
[18] ZHANG X,HENG X,LI T,et al. Longterm treatment with lithium alleviates memory deficits and reduces amyloid-β production in an aged Alzheimer’s disease transgenic mouse model[J].J Alzheimers Dis, 2011,24(4): 739-749.
[19] 李丽喜, 章素芳, 张鑫,等. 阿尔茨海默病小鼠大脑和脊髓自噬变化的研究[J]. 上海交通大学学报:医学版, 2012,32(5): 536-542.
