左归降糖解郁方对糖尿病并发抑郁症大鼠HPA轴及海马糖皮质激素受体表达的影响❋
2017-03-08韩远山赵洪庆王宇红
韩远山,赵洪庆,杨 蕙,杜 青,孟 盼,柳 卓,王宇红△
(1. 湖南中医药大学第一附属医院,长沙 410007; 2. 湖南省中药粉体与创新药物省部共建国家重点实验室培育基地,长沙 410208)
糖尿病是一种以高血糖为主要特征的代谢性疾病,影响着全球3.82亿人的生活[1]。糖尿病患者易产生多种并发症,其中糖尿病并发抑郁症(diabetes mellitus with depression, DD)是导致患者自杀率最高的慢性并发症之一[2]。据报道,DD患者自杀的可能性高达10%,远远大于普通人群的0.01%~0.03%[3]。因此,开展DD发病机制研究并进行药物防治具有重要意义。
研究表明,糖尿病和抑郁症患者都存在显著的神经内分泌改变,表现为下丘脑-垂体-肾上腺轴(HPA轴)功能亢进,即HPA轴分泌的表现为肾上腺分泌的糖皮质激素代谢紊乱,在海马、下丘脑等部位与其受体结合,介导HPA轴负反馈功能障碍[3]。海马组织作为最易受2型糖尿病高血糖影响的脑内组织,对糖皮质激素的过度表达异常敏感,糖皮质激素代谢紊乱可能是DD发生的重要原因[4]。然而,DD状态下HPA轴是否依然存在亢进现象,糖皮质激素及其受体(glucocorticoid receptor, GR)在关键靶部位海马中是否会有明显改变,均未见有相关研究。因此,本研究以HPA经典指标及海马GR表达为切入点,探讨左归降糖解郁方对DD大鼠海马组织的保护作用是否与调节HPA轴及糖皮质激素受体有关,对DD的发病机制研究及其临床防治都具有重要意义。
1 材料与仪器
1.1 药物
左归降糖解郁方由贯叶连翘、姜黄、熟地黄、黄芪、菟丝子等药物组成,原药材购买于湖南中医药大学第一附属医院。二甲双胍购自湖南湘雅制药有限公司(0.25 g/片×20片,批号1402115),氟西汀购自礼来苏州制药有限公司(20 mg/粒×28粒,批号2087 A)。
1.2 实验动物
雄性SD大鼠75只,体质量180~200 g,购自湖南斯莱克景达实验动物公司[SCXK(湘)2013-0004],饲养于湖南中医附一院SPF级实验动物中心[SYXK(湘)2015-0003]。购入大鼠后先适应性喂养3 d,期间自由饮水摄食。
1.3 试剂
促肾上腺皮质激素释放激素(Corticotropin releasing hormone, CRH)、促肾上腺皮质激素(Adrenocorticotropic hormone, ACTH)、皮质酮(Corticosterone, CORT)试剂盒均购自美国R&D公司,STZ购自美国Sigma公司,兔抗鼠GR一抗购自英国Abcam公司,RIPA裂解液、BCA试剂盒购自美国Thermo公司,辣根过氧化物酶标记的羊抗兔二抗购自武汉博士德公司。
1.4 主要仪器
血糖测量仪、血糖试纸(Johnson);MK3型酶标仪(Thermo),5417R低温高速离心机(Eppendorf),倒置荧光显微镜(Olympus),手动轮转式切片机(Leica),电泳槽、电泳仪、凝胶成像分析系统(Bio-Rad)。
2 方法
2.1 大鼠分组及模型制备
75只SD大鼠中取10只作为正常对照组,剩余大鼠全部用于制备糖尿病模型。采用高脂灌胃联合尾静脉注射STZ(38 mg/kg)建立糖尿病模型,于STZ注射72 h后测定所有大鼠空腹血糖值。根据血糖测定结果,选取≥16.00 mmol/L的大鼠作为糖尿病模型大鼠,并将其随机分为模型组、左归降糖解郁方高、中、低剂量组和阳性药组。分组完成后,继续给予模型大鼠慢性不可预见性应激(CUMS),应激方法主要包括禁食或禁水24 h、冰水浴4 min、噪音4 h、50 V电击3 min、光照或黑暗24 h、倾笼24 h、夹尾1 min、潮湿垫料24 h,每天随机采用1~2种刺激,持续28 d,在抑郁造模期间所有大鼠均采用单笼饲养方法。
2.2 给药
所有大鼠均在抑郁造模的同时给予灌胃给药,其中左归降糖解郁方高、中、低剂量对应药物浓度分别为32.82、16.41、8.20 g/kg,阳性药为临床一线降糖药二甲双胍和抗抑郁药氟西汀,对应浓度分别为0.18 g/kg、1.8 mg/kg,正常组和模型组则分别给予蒸馏水,给药体积均为10。末次给药结束后1 h,对所有大鼠进行血糖值、行为学测定,测试完成后采用水合氯醛(3 mL/kg)麻醉大鼠,抗凝管中收集大鼠血浆,并取脑、海马组织保存待用。
2.3 空腹血糖值测定
于测定前禁食6 h,采用剪尾取血法剪取大鼠尾根部动脉血,血糖仪测定各组大鼠的空腹血糖值。
2.4 强迫游泳实验
参照课题组前期发表的强迫游泳实验方法进行检测[5]。
2.5 HE染色
取固定于4%甲醛溶液中的脑组织,常规石蜡包埋后切片,经苏木精-伊红染色(HE染色)后显微镜下观察、拍片,分析各组大鼠脑内海马组织的病理损伤情况。
2.6 ELISA检测
采用ELISA试剂盒检测各组大鼠血浆HPA轴指标CRH、ACTH、CORT的含量,整个操作过程严格按照说明书进行。
2.7 Western-blotting实验
取冷冻保存的海马组织,按每mg组织5ul比例加入RIPA裂解液,冰上匀浆、4 ℃12000 r/min离心15 min后,取上清液制备组织蛋白提取液,BCA试剂盒测定蛋白含量。按照Western-blotting实验方法检测大鼠海马组织中GR蛋白表达量,采用ImageJ图像分析软件扫描各条带,以目的蛋白和内参蛋白对应灰度值的比值,作为蛋白的相对表达水平。
2.8 统计学方法

3 结果
3.1 血糖值及行为学测试结果
表1显示,与正常组比较,DD模型组大鼠血糖值显著升高,强迫游泳测试不动时间显著增加(P<0.01)。与模型组大鼠比较,左归降糖解郁方高、中剂量组大鼠血糖值均显著降低(P<0.01或P<0.05),高剂量组大鼠的不动时间显著降低(P<0.05)。
3.2 HE染色结果
图1显示,正常组大鼠海马神经元形态规则,排列整齐,神经元间隙正常。模型组大鼠海马神经元胞体肿胀,核固缩,胞浆浓缩深染,呈一定的空泡状,神经元之间排列紊乱无序,间隙拉长。阳性药和左归降糖解郁方高剂量组大鼠海马空泡细胞数明显减少,排列趋于整齐,神经元损伤程度明显减轻。
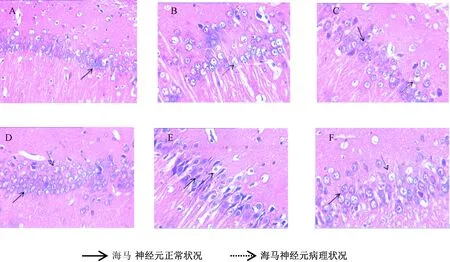
图1 大鼠海马组织HE染色结果(×400)注:A. 正常组;B. 模型组;C. 阳性药组;D. 左归降糖解郁方高剂量组;E. 左归降糖解郁方中剂量组;F. 左归降糖解郁方低剂量组
3.3 ELISA试剂盒检测结果
表1显示,与正常组比较,模型组大鼠血浆CRH、ACTH、CORT含量均显著增加,HPA轴亢进明显(P<0.05)。与模型组比较,左归降糖解郁方高剂量组大鼠血浆ACTH、CORT含量显著降低(P<0.05),CRH含量无明显变化(P>0.05),说明模型大鼠的HPA轴亢进状态得到一定缓解。
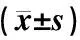
表1 大鼠血糖值、行为学及HPA轴指标结果比较
注:与正常组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01
3.4 Western-blotting检测结果
图2显示,模型大鼠海马GR表达显著降低(P<0.01)。在给予高剂量及中剂量的左归降糖解郁方干预后,GR表达均有不同程度的回升(P<0.01或P<0.05)。
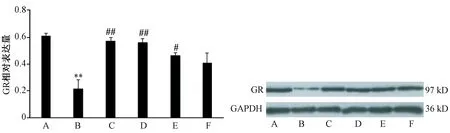
图2 大鼠海马GR蛋白的表达情况注:与正常组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01A. 正常组;B. 模型组;C. 阳性药组;D. 左归降糖解郁方高剂量组;E. 左归降糖解郁方中剂量组;F. 左归降糖解郁方低剂量组
4 讨论
糖尿病属于中医“消渴”范畴,其病机为阴虚燥热,与肺、脾、肾有关;抑郁症属于中医“郁证”范畴,病位在肝,与心相关,气血失调是其病机关键;而糖尿病并发抑郁症继发于糖尿病,其中医病机可用“虚、瘀、郁”概括,表现为气阴两虚、瘀阻脑络、血瘀肝郁、情志异常等。中医药理论指导下的中药复方治疗具有多环节、多靶点的特性,且毒副作用小、疗效持久,治疗并发症有独特优势[6]。左归降糖解郁方是以《景岳全书》中左归丸为基础方,经载化而得到的临床经验方。前期研究发现,左归降糖解郁方能明显减轻DD大鼠的糖脂代谢紊乱及抑郁行为,增强海马神经元突触可塑性,降低其凋亡水平,延缓海马损伤[5-7]。本实验通过检测DD大鼠血浆HPA轴相关指标以及海马中GR蛋白的表达,探讨左归降糖解郁方保护海马神经元的作用机制。
血糖值作为糖尿病的一项关键指标,与糖尿病患者抑郁的发病率密切相关[8]。强迫游泳实验则是使动物处于行为绝望状态,被广泛用于抗抑郁药物的筛选[9]。本实验发现,左归降糖解郁方能明显降低模型大鼠血糖值及不动时间,具有良好的降血糖及抗抑郁效果。同时在给予药物干预后,DD模型大鼠海马神经元排列紊乱、胞体肿胀等病理损伤情况得到缓解,进一步说明左归降糖解郁方对海马组织的保护作用。
HPA轴是神经内分泌网络的枢纽,对维持机体内环境平衡起重要作用。研究表明,糖尿病与抑郁症之间的一个共同发病机制是HPA轴功能紊乱[3,10]。糖尿病时,由于HPA轴基础活性增高,使肾上腺分泌糖皮质激素增多,透过血脑屏障进入到脑,而海马是脑中最易受糖皮质激素影响的组织,当海马中皮质醇含量异常升高时会产生神经毒性,影响大脑的认知功能进而诱发抑郁产生[11]。
GR是一种广泛分布于海马组织内的糖皮质激素受体。生理情况下,海马局部糖皮质激素水平的升高通过与GR结合,发挥其对HPA轴的负反馈抑制作用。而糖尿病状态下海马GR表达下降,使其对HPA轴的抑制作用减弱,导致HPA轴昼夜节律消失,持续亢进,分泌糖皮质激素增加[12]。本实验发现,在给予左归降糖解郁方干预后,模型大鼠血浆ACTH、CORT水平下降,海马GR表达回升,说明左归降糖解郁方能通过上调GR表达保护海马组织,发挥抗抑郁作用,与文献报道的抗抑郁药物上调海马GR水平相符合[13]。
综上所述,本实验研究发现,左归降糖解郁方发挥抗抑郁作用与缓解HPA轴高亢、上调海马GR水平密切相关。本研究阐明了左归降糖解郁方保护海马组织的部分机制,为中药复方治疗糖尿病合并症的临床应用提供了重要的实验依据。但该复方由多种中药组成,具有多靶点、多环节等作用特点,其发挥治疗作用的药效物质基础以及更多潜在的分子机制,仍有待进一步的深入研究。
[1] NASCIMENTO A, CHAVES E, GROSSI S, et al. The relationship between polipharmacy,chronic complications and depression in individuals with Type 2 Diabetes Mellitus[J]. Rev Esc Enferm USP, 2010, 44(1):39-45.
[2] WEINGER K, LEE J. Psychosocial and psychiatric challenges of diabetes mellitus[J]. Nursing Clinics of North America, 2006, 41(4): 667-680.
[3] ANNA ALEXANDER. Diabetes and depression-is there a link to the hpa axis?[J]. Occupational Medicine, 2008, 58(4):308.
[4] LEI AN, YOU-ZHI ZHANG, XIN-MIN LIU, et al. Total Flavonoids Extracted from Xiaobuxin-Tang on the Hyperactivity of Hypothalamic-Pituitary-Adrenal Axis in Chronically Stressed Rats[J]. Evidence-based Complementary and Alternative Medicine, 2011, 8(1): 1-7.
[5] 赵洪庆, 杜青, 凌佳, 等. 左归降糖解郁方对糖尿病并发抑郁症大鼠海马神经元 JNK/Elk-1 /c-fos通路的调控作用[J]. 中国临床药理学与治疗学, 2016, 21(6): 625-629.
[6] 郭齐, 吴丹, 田昕, 等. 中医组方配伍研究的思路与方法[J]. 中国中医基础医学杂志, 2012, 18(7): 727-728.
[7] WANG Y H, YIN L T, YANG H, et al. Hypoglycemic and antidepressant effects of Zuogui Jiangtang Jieyu formulation in a model of unpredictable chronic mild stress in rats with diabetes mellitus[J]. Experimental and Therapeutic Medicine, 2014, 8(1): 281-285.
[8] ASTLE F. Diabetes and depression: a review of the literature[J]. Nurs Clin North Am, 2007, 42(1): 67-78.
[9] 李家洲, 卢海啸, 蒙飞燕, 等. 海木醇提物对小鼠抑郁模型的抗抑郁作用[J]. 中药材, 2010, 33(10):1605-1608.
[10] AEED KALANTARI, ALIREZA JAFARINEZHAD, BEHZAD ZOHREVAND. Association of depression with type 2 diabetes and relevant factors[J]. Adv Biomed Res, 2014, 29(3): 244.
[11] FOURNIER J C, DERUBEIS R J, HOLLON S D, et al. Antidepressant Drug Effects and Depression Severity[J]. American Medical Association, 2010, 303(1): 47-53.
[12] AE HOON SHIN, JE KYUNG SEONG, SUN SHIN YI. Sequential alterations of glucocorticoid receptors in the hippocampus of STZ-treated type 1 diabetic rats[J]. Journal of Veterinary Science, 2014, 15(1):19-26.
[13] JOVICIC MJ, LUKIC I, RADOJCIC M. Modulation of c-Jun N-terminal kinase signaling and specific glucocorticoid receptor phosphorylation in the treatment of major depression[J]. Med Hypotheses, 2015, 85(3):291-294.
