胃上皮内瘤变内镜活检与内镜下黏膜剥离术标本病理对比分析
2017-03-08许宝才张烁吕宾张春丽倪贵宝
许宝才 张烁 吕宾 张春丽 倪贵宝
胃上皮内瘤变内镜活检与内镜下黏膜剥离术标本病理对比分析
许宝才 张烁⋆吕宾 张春丽 倪贵宝
目的 比较胃镜活检标本与内镜下黏膜剥离术(ESD)后标本病理结果间的关系。方法 2013年8月至2015年8月接受ESD 治疗的患者563 例,将其中活检标本病理诊断为胃上皮内瘤变患者148例患者行回顾性分析,与ESD病理结果进行比较。结果 148例胃上皮内瘤变患者镜下活检诊断低级别上皮内瘤变85例,ESD术后病理检查证实低级别上皮内瘤变55例,标本病理符合率64.71%(58/85)。镜下活检诊断高级别上皮内瘤变63例,ESD术后病理检查证实高级别上皮内瘤变45例,标本病理符合率71.43%(45/63)。其中低级别上皮内瘤变组25.88%的病理结果存在不同程度的升级现象,高级别上皮内瘤变组有14.29%(9/63)的病理结果存在升级现象。在胃上皮内瘤变的检出位置中,胃窦检出率最高,其次为胃体、胃角。结论 胃上皮内瘤变ESD术后与胃镜活检病理结果相比存在升级现象,在临床中应结合胃镜形态特征与活检结果进行积极随访甚至内镜治疗,避免漏诊和误诊。
内镜下黏膜剥离术 上皮内瘤变 病理
内镜下黏膜剥离术(ESD)是在内镜下黏膜切除术(EMR)基础上发展而来的新技术。ESD能够安全地将较大病灶完整剥离切除,减少并发症,缩短住院时间及费用,并能提供完整的病理诊断,病变局部的复发率也较低[1-3]。目前越来越多的国内医院开展ESD治疗早期胃癌。浙江中医药大学附属第一医院近年来开展了ESD技术治疗消化道黏膜病变和黏膜下病灶时,发现活检标本与ESD术后标本病理存在前后不符合及升级现象的情况,本文特以内镜活检病理示胃上皮内瘤变行ESD治疗患者为例,报道如下。
1 临床资料
1.1 一般资料 收集2013年8月至2015 年8月浙江中医药大学附属第一医院经电子胃镜病理诊断为胃上皮内瘤变的148例患者的临床资料,其中男83例,女65 例;年龄35~81岁,平均58.9岁。所有患者检查血小板计数、凝血功能等排除凝血障碍性疾病,术前签署知情及手术同意书,告知治疗可能存在的风险和益处。
1.2 方法 (1)胃镜活检方法:所有操作均由高年资内镜医师完成,内镜医师通过白光内镜观察,结合窄带内镜、放大内镜、色素内镜观察可疑病变,并对病灶形态、色泽和范围等作详细记录,病灶形态按日本胃癌学会(JGCA)第13版日本胃癌指南与食管、胃、结肠浅表性肿瘤的巴黎共识进行分类。在进行胃镜活检的过程中,应根据患者病情选择正确的活检部位。如属于隆起型,则取隆起的顶端以及基底部的组织细胞进行活检。如属于凹陷型病变,则应取溃疡周围部位的组织细胞进行活检[4]。所有标本均送病理科进行处理,由两名资深病理医生进行分析。(2)ESD方法:①标记:距离病变周围外侧5mm处用氩气刀电凝标记,每个标记点间隔2~3 mm。②黏膜下注射:用甘油果糖、亚甲蓝混合液在标记点附近对病变行黏膜下注射,注射后病变基底部明显隆起(抬举征阳性)方可行剥离术。③边缘切开与剥离:应用Dual刀沿标记点外侧缘将病变与周围黏膜切开,反复黏膜下注射,对病变进行剥离[5-6]。标本送病理检查。
1.3 统计学方法 采用SPSS 16.0 统计软件,以统计描述的方法进行统计分析。
2 结果
2.1 胃上皮内瘤变病变分布位置情况 胃上皮内瘤变发生部位以胃窦部检出率最高,其次依次为为胃体、胃角。见表1。
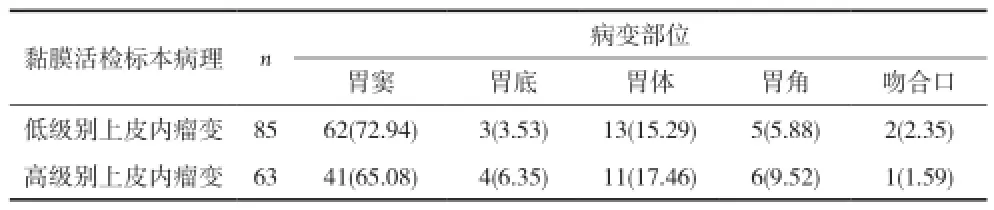
表1 胃上皮内瘤变病变分布位置情况[n(%)]
2.2 胃上皮内瘤变活检与ESD术后标本病理分析比较 85例ESD术前活检诊断低级别上皮内瘤变的患者中有55例经ESD术后仍诊断为低级别瘤变,活检诊断准确率为64.71%,25.88%的病理结果存在升级现象。其中ESD病理诊断为高级别上皮内瘤变21例,诊断为癌1例。63例ESD术前活检诊断高级别上皮内瘤变的患者中有45例经ESD术后仍诊断为低、高级别瘤变,活检诊断准确率71.43%,14.29%的病理结果存在升级现象,ESD病理诊断为癌9例。见表2。

表2 胃上皮内瘤变活检标本与ESD术后标本病理分析比较
3 讨论
胃恶性肿瘤是消化系统常见的恶性肿瘤之一,最新的全球流行病学资料显示,胃癌每年的发病率和病死率均位居所有恶性肿瘤的前5位[7]。因此对于胃癌的早期诊断和早期治疗尤为重要。胃上皮内瘤变是一种肿瘤性、非浸润性的改变,主要描述上皮细胞的细胞学和结构改变,是目前较为公认的胃癌前病变,与胃癌的发生关系密切。2010年第四版消化系肿瘤WHO分类法建议将上皮内瘤变分为低级别上皮内瘤变(LIN)和高级别上皮内瘤变(HIN)。LIN 包括轻中度异型增生,主要是黏膜结构的轻微改变,而HIN 包括重度异型增生和原位癌,是增生腺体有明显异型性,但并无间质内的浸润。对于HIN的患者,目前主要的治疗方法是通过EMR 或ESD切除病变组织,而LIN的患者,目前只推荐LIN 长期存在的患者行手术治疗。ESD是近10年来被应用于临床的一项新的内镜技术,使早期癌在内镜下剥离切除成为可能,较之外科手术更易被患者接受[8-9]。同时可以提供完整的标本,有利于病理科医师对病变组织形态观察分析,作出明确的病理诊断,必要时加做免疫组织化学,以进一步明确组织起源。因此精准的胃镜下活检是正确处理胃上皮内瘤变的关键。
然而,尽管新的内镜技术如窄带内镜、放大内镜、自体荧光和红外线成像技术在临床不断应用,以提高胃镜诊断水平[10],但胃镜下活检与大块组织病理检查并不一致。本资料提示在病变检出部位中,胃窦检出率最高,其次为胃体、胃角,因此在胃镜检查时应重点关注胃窦、胃体、胃角的病理变化。术后切除标本病理中低级别上皮内瘤变组低级别上皮内瘤变55例,标本病理符合率64.71%,HIN及进展癌22例,25.88%的病理结果存在升级现象;HIN组HIN 45例,标本病理符合率为71.43%。进展癌9例,有14.29%的病理结果存在升级现象,这提示活检标本病理精确性有限,并不总是反映整个病变组织的病理改变,存在病变升级现象。新近研究表明胃镜下黏膜活检病理诊断与大块组织病理诊断的符合率仅为49%[11],胃镜活检病理符合率低的原因主要有以下几方面:(1)病灶分化不一致;镜下活检标本的分化程度未能反映病灶整体分化程度,潜在的恶性病变可能存在于病灶的其它部分而被忽视[12]。(2)内镜医生技术差异;如取材表浅、活检钳口未能准确指向病灶或将病灶周围发红的再生上皮误认为癌组织。
因此,对于初次活检病理诊断为胃上皮内瘤变的患者,应根据其内镜下形态学表现综合分析。内镜医生应熟识早期癌大体形态的各种表现,准确估计病变范围,避免观察中以偏概全,应活检足够大且深达肌层,并增加活检的数量,考虑癌的病灶至少取材三块,为避免出现活检假阴性的情况,对于胃炎样癌、微小或片状糜烂、斑片状充血、浅表溃疡、黏膜粗糙或触之易出血、息肉癌变和假性愈合、局部病变僵硬变形等更应注意[13],活检取材第一块应取准,否则会因出血影响再次活检的准确性,并且隆起型病灶应从隆起不规则结节灶中央钳取,溃疡凹陷型病灶在溃疡边缘内侧下钳取。有条件的内镜中心还可以结合其他辅助方法,如染色内镜、超声内镜、自体荧光内镜和窄光谱成像等,指导内镜活检的部位、范围,从而确保内镜下活检取材的准确性及提高活检的阳性率[14]。对于ESD术后病理中未见术前活检阳性病灶的患者,除考虑灶性上皮内瘤变及部分自然逆转外,内镜医生必须与病理医生充分沟通,保证通过病理检查确实回答出病变边缘、基底和脉管情况,是否需进一步行外科手术治疗[15],值得注意和探讨。另外,对于ESD术后病理中升级为进展期胃癌患者,尚无法判断是因活检定位失准造成的漏诊还是因为经过多久具体时间进展所致。对此,还需更多病例及更加详实的资料进行统计分析。
[1] Lee TH, Cho JY, Chang YW, et al. Appropriate indications for endoscopic submucosal dissection of early gastric cancer according to tumor size and histologic type.Gastrointest Endosc, 2010, 71(6):920-926.
[2] Chiu PW, Teoh AY, To KF, et al. Endoscopic submucosal dissection (ESD)compared with gastrectomy for treatment of early gastric neoplasia:a retrospective cohort study.Surg Endosc, 2012, 26(12):3584-3591.
[3] Matsui N, Akahoshi K, Nakamura K, et al. Endoscopic submucosal dissection for removal of superficial gastrointestinal neoplasms:A technical review.World J Gastrointest Endosc, 2012, 4(4):123-136.
[4] 上海市早期胃癌临床协作组.上海不同等级10个医疗机构早期胃癌的筛选结果比较.中华消化内镜杂志, 2007, 24(1):19-22.
[5] Kang KJ, Kim KM, Min BH, et al. Endoscopic submucosal dissection of early gastric cancer. Gut Liver 2011, 5:418-426.
[6] Kantsevoy SV, Adler DG, Conway JD, et al. Endoscopic mucosal resection and endoscopic submucosal dissection. Gastrointest Endosc 2008, 68: 11-18.
[7] Ahmedin Jemal, Freddie Bray, Melissa M, et al. GIobal cancer statistics.CA CancerJ Clin, 201l 61:69-90.
[8] Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gastric Cancer. 2011 Jun, 14(2):113-123.
[9] Toyonaga T, Mani M, East JE, et al. 1, 635 Endoscopic submucosal dissection cases in the esophagus, stomach, and colorectum:complication rates and long-term outcomes. Surg Endosc, 2013 Mar, 27(3):1000-1008.
[10] Mine T. The role of magnifying endoscopy in the diagnosis of early gastric carcinoma. J Gastroenterol, 2006 Apr, 41(4):397-398.
[11] Takao M, Kakushima N, Takizawa K , et al. Discrepancies in histologic diagnoses of early gastric cancer between biopsy and endoscopic mucosal resection specimens.Gastric Cancer, 2012, 15(1):91.
[12] Jung MK, Jeon SW, Park SY, et al. Endoscopic characteristics of gastricadenomas suggesting carcinomatous transformation.Surg Endosc, 2008, 22:2705~2711.
[13] Arisawa T, Tahara T, Shiroeda H, et al. Functional promoter polymorphisms of NFKBI influence susceptibility to the diffuse type of gastric cancer.Oncol Rep, 2013, 30(6):3013-3019.
[14] Nagahama T, Yao K, Maki S, et al. Usefulness of magnifyingendoscopy with narrow-band imaging for determining the horizontal extent of early gastric cancer when there is an unclear margin by chromoendoscopy (with video). Gastrointest Endosc, 2011, 74: 1259-1267.
[15] Nari Shin, Tae-Yong Jeon, Gwang Ha Kim, et al. Unveiling lymph node metastasis in early gastric cancer.World J Gastroenterol, 2014, 20(18): 5389-5395.
Objective To compare the results of endoscopic with endoscopic submucosal dissection(ESD)postoperative pathology. Method A total of 563 cases were be treated by ESD at endoscopy center of the First Affiliated Hospital to Zhejiang Chinese Medical University between 2013.8 and 2015.8,148 cases diagnosed by biopsy pathology as gastric intraepithelial neoplasia were retrospectively analyzed and compared with ESD pathological results. Result Of the 148 cases,85 cases biopsy pathology was low-grade gastric intraepithelial neoplasia,and ESD postoperative pathology proved 55 cases was low-grade gastric intraepithelial neoplasia,its coincidence rate was 64.71%(58/85). 63 cases biopsy pathology was high-grade gastric intraepithelial neoplasia,and ESD postoperative pathology proved 45 cases was high-grade gastric intraepithelial neoplasia,its coincidence rate was 71.43%(45/63). 25.88%(22/85)pathological results showed that there were upgraded of different levels in low-grade gastric intraepithelial neoplasia group. 14.29%(9/63)pathological results showed that there were upgrade in highgrade gastric intraepithelial neoplasia group. The detection rate of gastric intraepithelial neoplasia was the highest in Gastric antrum,and the next was gastric body and gastric angle. Conclusion Gastric intraepithelial neoplasia diagnosed by endoscopic biopsy pathology has a high possibility of cancer coexistence,thus we should positively follow-up or appropriate endoscopic interventions by combining morphological characteristics with biopsy pathology to avoid misdiagnosis.
Endoscopic mucosal dissection Intraepithelial neoplasia Pathology
2015年浙江省医药卫生平台计划(2015RCA020);
2015年浙江省中医药重点研究项目(2015ZZ012);
2014年浙江省中医药科技计划项目(2014ZA030)
324002 浙江省衢州市中医医院(许宝才)
310006 浙江中医药大学附属第一医院(张烁 吕宾张春丽 倪贵宝)
*通信作者
