高效液相色谱法测定芒柄花素磺酸钠有关物质
2017-03-06潘星燕陆云霞
潘星燕,陆云霞,姚 军,2
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药用分子化学重点实验室-省部共建国家重点实验室培育基地,河北石家庄 050018)
高效液相色谱法测定芒柄花素磺酸钠有关物质
潘星燕1,陆云霞1,姚 军1,2
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药用分子化学重点实验室-省部共建国家重点实验室培育基地,河北石家庄 050018)
为建立测定芒柄花素磺酸钠有关物质的方法,采用高效液相色谱法,色谱柱为Agilent HC-C18(250 mm × 4.6 mm,5 μm),流动相A为乙腈,流动相B为0.01 mol/L的磷酸二氢钾,流速为0.8 mL/min,按照梯度洗脱,进样量为10 μL,检测波长为250 nm,柱温为30 ℃。结果表明:主药与各杂质、各杂质之间分离度良好,各杂质均能被有效检出;芒柄花素磺酸钠及杂质A,B,C,D,E,F和G的质量浓度分别在0.060~4.004(r=0.999 8),0.056~3.756(r=0.999 3),0.039~3.902(r=0.999 6),0.060~4.026(r=0.999 5),0.058~3.878(r=0.999 3),0.058~3.869(r=0.999 5),0.060~3.977(r=0.999 5)和0.040~3.952 μg/mL(r=0.999 4)范围内与各自峰面积呈良好的线性关系;仪器精密度、中间精密度、稳定性试验的RSD值小于2.0%;各杂质测定的平均回收率为98.49%~101.76%,RSD值为0.37%~1.37%(n=9)。本方法专属性强、准确度高、耐用性良好,可用于芒柄花素磺酸钠有关物质的测定。
色谱分析;芒柄花素磺酸钠;高效液相色谱法;梯度洗脱;有关物质
芒柄花素磺酸钠为天然异黄酮经结构改造后的全新化合物[1],是具有自主知识产权的国家Ⅰ类新药,在心脑血管中的药理活性已通过药理药效学试验并得到了很好的证实[2-4]。已完成的安全性评价研究证明,芒柄花素磺酸钠的毒副作用小,安全性优于其他溶栓药和抗血栓药[5-6]。芒柄花素磺酸钠为临床治疗心脑血管疾病提供了一种新的选择,具有良好的市场前景。
芒柄花素磺酸钠为临床治疗缺血性脑中风提供了一种新的选择,具有良好的市场前景,对其有关物质的研究具有重要的意义。目前,只有高效液相色谱法测定芒柄花素含量[7-11]。为规范该候选药物的临床前研究,为临床实验提供质量可控的大量样品,本研究对其有关物质的分析方法进行了系统研究,采用高效液相色谱(HPLC)法,以对甲氧基苯乙酸和间苯二酚为起始物料,合成过程共3个步骤[12-13],产生的副产物及中间体共有7种杂质[14],各杂质化学结构见图1。
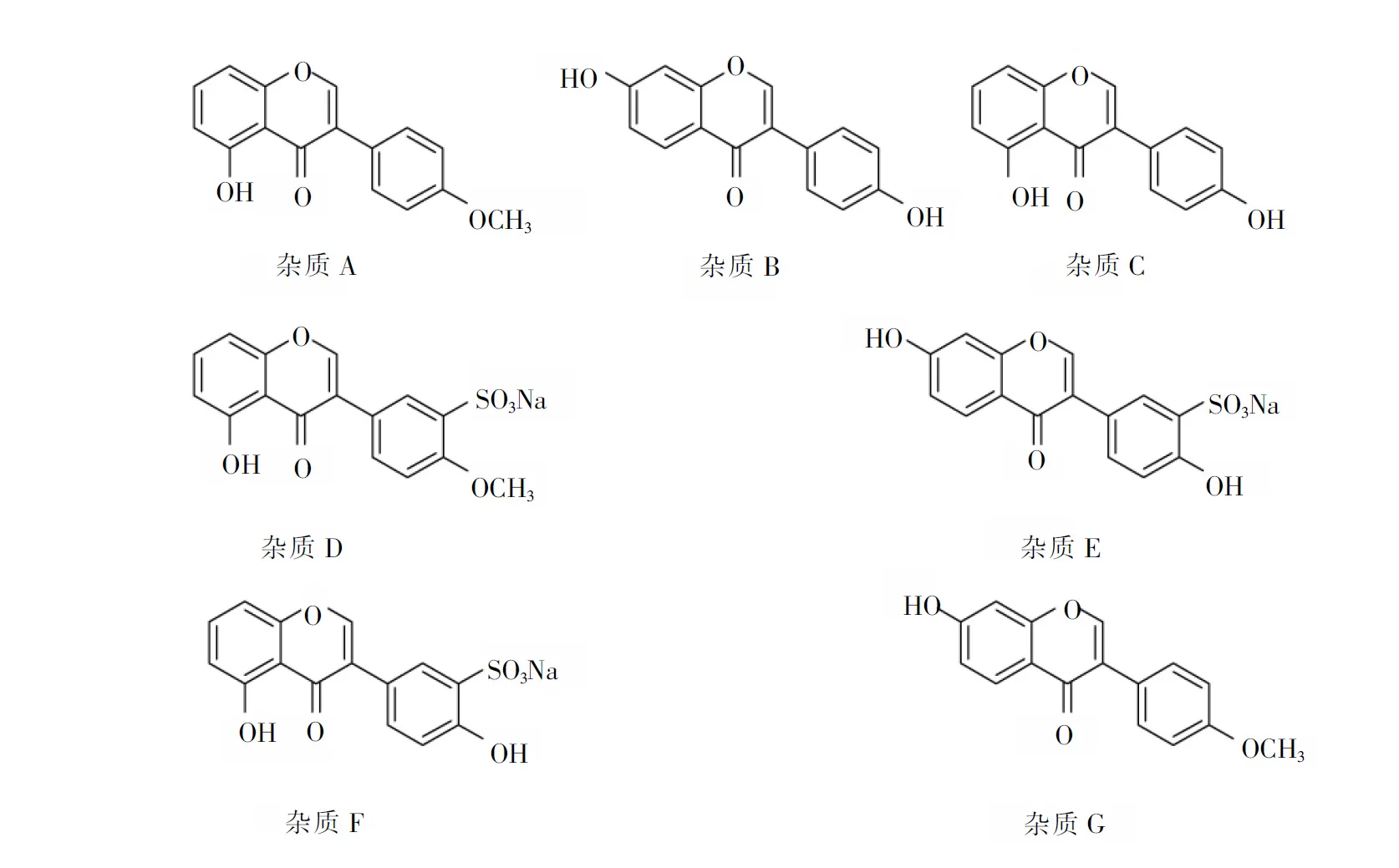
图1 芒柄花素有关物质的化学结构
Fig.1 Chemical structure of formononetin related impurities
1 主要仪器与试药
1.1 主要仪器
2695-2996型HPLC仪,包括2695分离单元、2996二极管阵列检测器(美国Waters公司提供);XA-105U型电子分析天平(梅特勒-托利多公司提供)。
1.2 试剂与药品
芒柄花素磺酸钠(自制,批号分别为160301,160501,160502和160503,纯度分别为98.38%,98.31%,98.22%和98.43%);芒柄花素磺酸钠对照品(自制,批号为DZ160301,纯度为98.89%);杂质A,B,C,D,E,F,G对照品(自制,批号分别为Z16031,Z16032,Z16033,Z16034,Z16035,Z16036和Z16037,纯度分别为92.88%,97.54%,99.61%,95.43%,96.16%,98.54%和97.84%);乙腈,色谱纯;磷酸二氢钾,氢氧化钠,均为分析纯;水为自制超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent HC-C18(250 mm×4.6 mm,5 μm);流动相A:乙腈;流动相B:0.01 mol/L磷酸二氢钾溶液;采用梯度洗脱(0~10 min,25%A→32%A;10~28 min,32%A→78%A;28~45 min,78%A;45~50 min,78%A→25%A;50~60 min,25%A);流速:0.8 mL/min;检测波长:250 nm;柱温:30 ℃;进样量:10 μL。
2.2 溶液配制
1)供试品溶液 精密称取芒柄花素磺酸钠(批号为160501)适量,加入空白溶剂溶解并稀释,制成1 mL约含芒柄花素磺酸钠0.4 mg的溶液,作为供试品溶液。
2)对照品溶液 精密称取芒柄花素磺酸钠(批号为DZ160301)适量,加空白溶剂溶解并稀释,制成1 mL约含芒柄花素磺酸钠0.4 mg的溶液,作为对照品溶液。
3)对照溶液 精密量取供试品溶液1 mL,置于200 mL容量瓶中,加入空白溶剂并稀释至刻度,摇匀作为对照溶液。
4)杂质储备溶液 精密称取杂质A,B,C,D,E,F,G对照品各适量,分别用空白溶剂溶解,制成1 mL中含相应杂质约0.1 mg的溶液,作为各杂质储备溶液。
5)杂质对照品溶液 精密量取上述杂质储备溶液各1 mL,置于同一50 mL容量瓶中,用空白溶剂溶解并制成1 mL中含杂质A,B,C,D,E,F,G约为2.0 μg的溶液,作为杂质对照品溶液。
6)系统适用液 精密称定芒柄花素磺酸钠20 mg,精密量取上述杂质储备溶液各1 mL,置于同一50 mL容量瓶中,用空白溶剂溶解,制成1 mL中含有杂质A,B,C,D,E,F,G约为2.0 μg,含芒柄花素磺酸钠约0.4 mg的溶液,作为系统适用液。
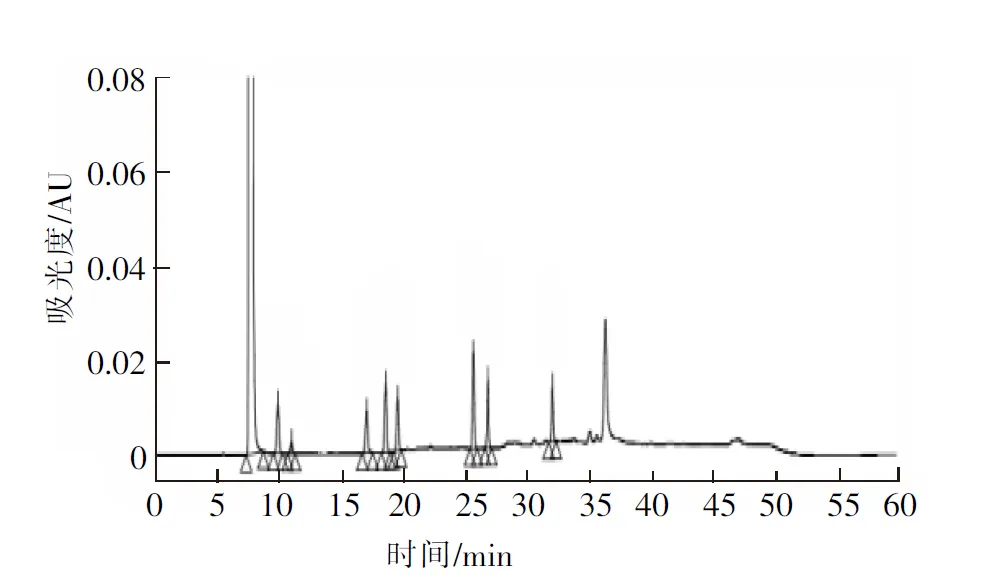
图2 系统适用性试验高效液相色谱图
Fig.2 HPLC chromatogram of system suitability test
7)空白溶剂 甲醇-水(1︰1,体积比),作为空白溶剂。
2.3 系统适用性及专属性试验
2.3.1 系统适用性试验
精密量取“2.2”项下空白溶剂、供试品溶液和系统适用液各10 μL,注入HPLC仪,记录色谱图,见图2。
图2结果表明,空白溶剂不干扰芒柄花素磺酸钠有关物质检测,各杂质及芒柄花素磺酸钠之间能够达到基线分离。各杂质相对于主成分的相对保留时间详见表1。
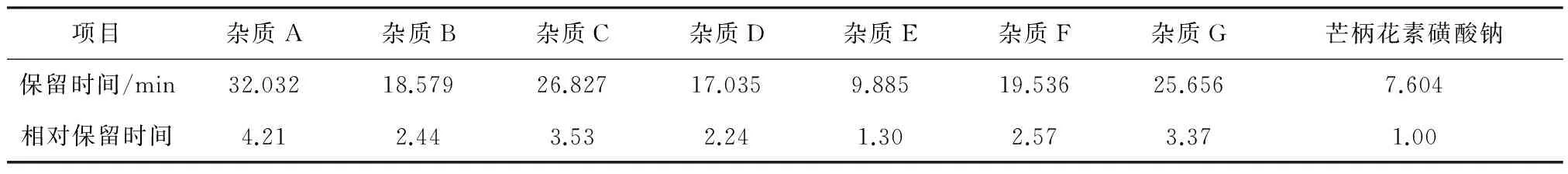
表1 各杂质相对于主成分的相对保留时间
2.3.2 专属性试验
1)酸破坏 取芒柄花素磺酸钠(批号为160501)约10 mg,精密称定,置于25 mL量瓶中,加入1 mol/L盐酸溶液1 mL溶解,于60 ℃水浴条件下放置2 h后取出,放冷,加入1 mol/L氢氧化钠溶液1 mL中和,加空白溶剂稀释至刻度,摇匀,作为酸破坏溶液。
2)碱破坏 取芒柄花素磺酸钠(批号为160501)约10 mg,精密称定,置于25 mL量瓶中,加入1 mol/L氢氧化钠溶液1 mL溶解,室温放置10 min后,加入1 mol/L盐酸溶液1 mL中和,加空白溶剂稀释至刻度,摇匀,作为碱破坏溶液。
3)氧化破坏 取芒柄花素磺酸钠(批号为160501)约10 mg,精密称定,置于25 mL量瓶中,加入体积分数为30%的双氧水溶液1 mL溶解,室温放置1 h后,加空白溶剂稀释至刻度,摇匀,作为氧化破坏溶液。
4)高温(固体)破坏 取芒柄花素磺酸钠(批号为160501)适量,置于称量瓶中,于80 ℃条件下放置24 h后取出,放冷,精密称定10 mg,置于25 mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀,作为高温(固体)破坏溶液。
5)光照破坏 取芒柄花素磺酸钠(批号为160501)适量,置于称量瓶中,在光照度为(4 500±500)lx的条件下照射48 h后取出,精密称定10 mg,置于25 mL量瓶中,加空白溶剂溶解并稀释至刻度,摇匀,作为光照破坏溶液。分别量取10 μL,注入HPLC仪,记录色谱图,结果详见图3。
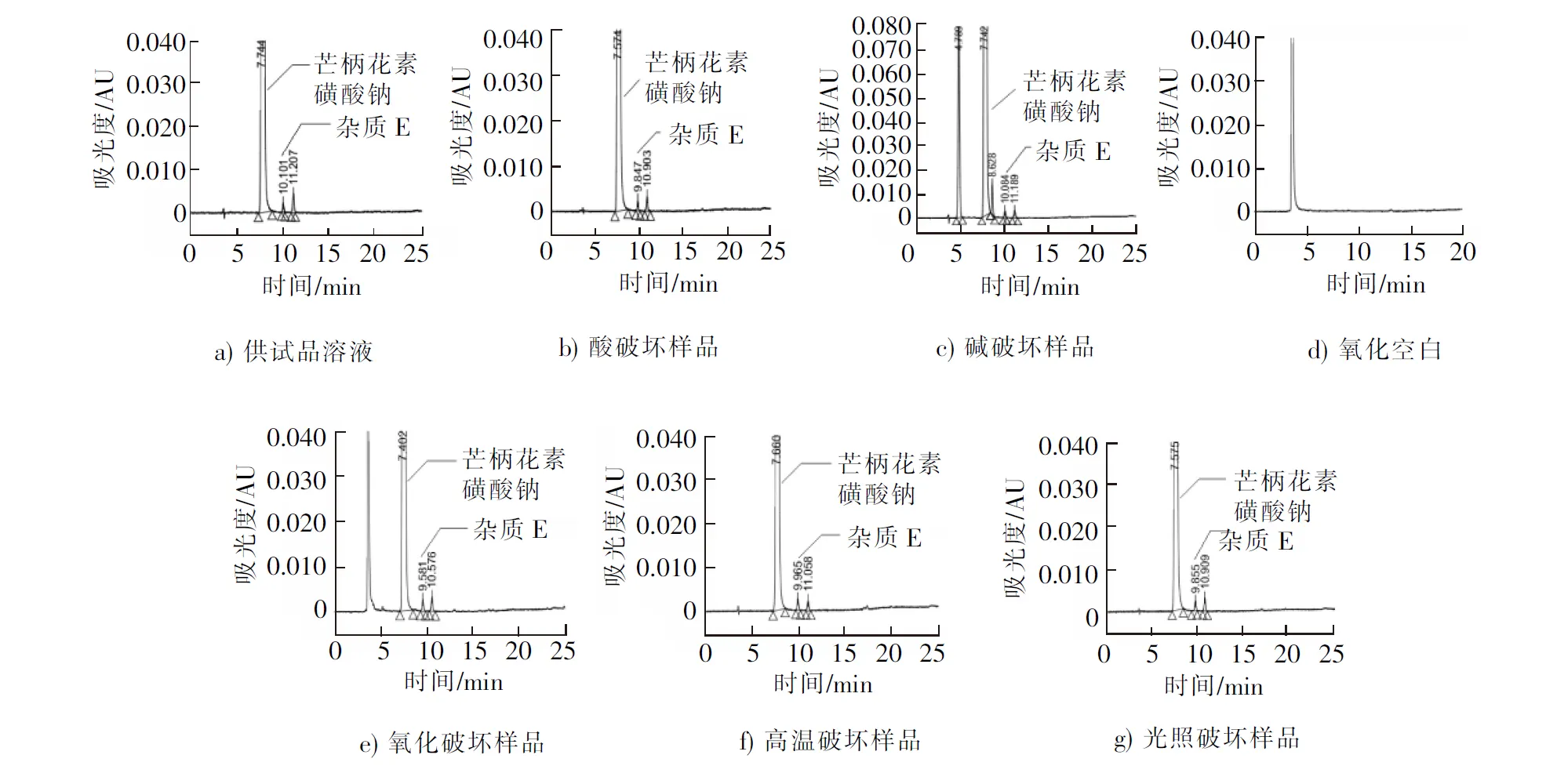
图3 专属性试验色谱图
Fig.3 Chromatograms of specificity test
结果表明,芒柄花素磺酸钠在酸、氧化、高温、光照破坏条件下稳定,不降解;碱破坏后,各降解产物与主峰能够良好地分离,且能与各个杂质达到基线分离,说明本方法的专属性良好。
2.3.3 线性关系考察
精密量取“2.2”项下芒柄花素磺酸钠对照品溶液和各杂质的对照品溶液适量,分别用空白溶剂进行稀释,制成一系列浓度的线性试验溶液。分别精密量取10 μL,注入HPLC仪,记录色谱图。以质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归。线性试验溶液质量浓度、回归方程及校正因子详见表2。

表2 线性试验溶液质量浓度、回归方程及校正因子
2.3.4 检测限与定量限
分别取“2.2”项下芒柄花素磺酸钠对照品溶液和各杂质对照品溶液适量,进行逐级稀释后进样。当峰高
约为基线噪音的10倍时测得定量限,当峰高约为基线噪音的3倍时测得检测限,结果见表3。
2.3.5 仪器精密度试验
取“2.2”项下芒柄花素磺酸钠对照溶液,精密量取10μL,按“2.1”项下色谱条件连续进样6次,记录峰面积。结果得知,芒柄花素磺酸钠峰面积的RSD值为1.1%,说明仪器的精密度良好。
2.3.6 重复性试验
称取芒柄花素磺酸钠适量,精密称定,加空白溶剂溶解并稀释制成1mL中含有芒柄花素磺酸钠0.4mg的溶液,平行配制6个样品溶液进行检测,记录峰面积。结果得知,芒柄花素磺酸钠峰面积的RSD值为1.2%。
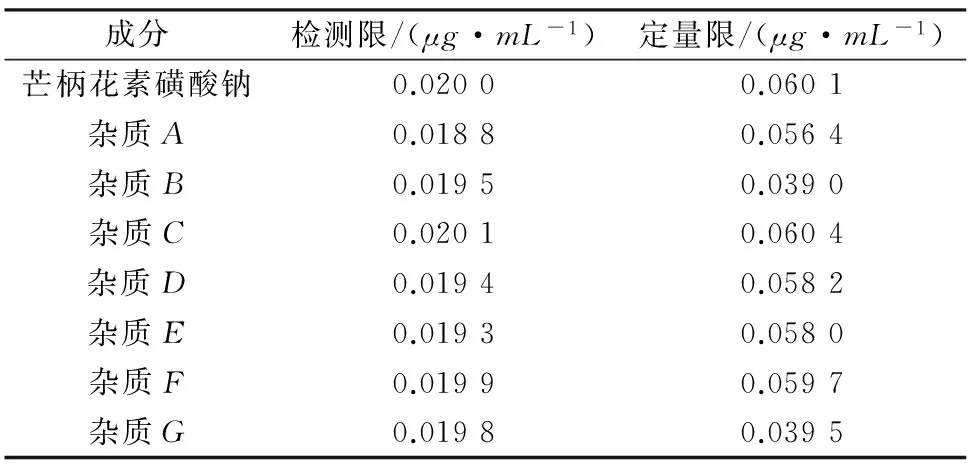
表3 检测限与定量限考察结果
2.3.7 中间精密度试验
按“2.3.6”项下方法,另配制6个供试品溶液,由不同的分析人员,在不同的日期、使用不同的仪器进行检测,记录峰面积。结果得知,重复性与中间精密度共12次进样的RSD值为1.7%,说明本方法的中间精密度良好。
2.3.8 稳定性试验
取“2.2”项下供试品溶液及杂质对照品溶液,于室温放置0,2,4,8,12,24,36,48h,分别精密量取10μL,按“2.1”项下色谱条件进样,记录峰面积。结果得知,供试品溶液主峰面积的RSD值为1.24%(n=8),各杂质峰面积的RSD值分别为1.68%,1.35%,1.44%,1.48%,1.45%,1.40%和1.38%(n=8),说明供试品溶液及杂质对照品溶液在室温条件下放置48h是稳定的。
2.3.9 回收率试验
精密称取芒柄花素磺酸钠供试品10份(每份约20mg,置于10个不同的50mL量瓶中),其中1份加空白溶剂溶解并稀释至刻度,摇匀,过滤,作为供试品溶液;另外9份中分别加入“2.2”项下杂质储备溶液各0.8mL×3,1.0mL×3,1.2mL×3,加空白溶剂制成不同浓度的供试品溶液。分别精密量取10μL,按“2.1”项下色谱条件进样,记录峰面积,计算回收率,结果见表4。
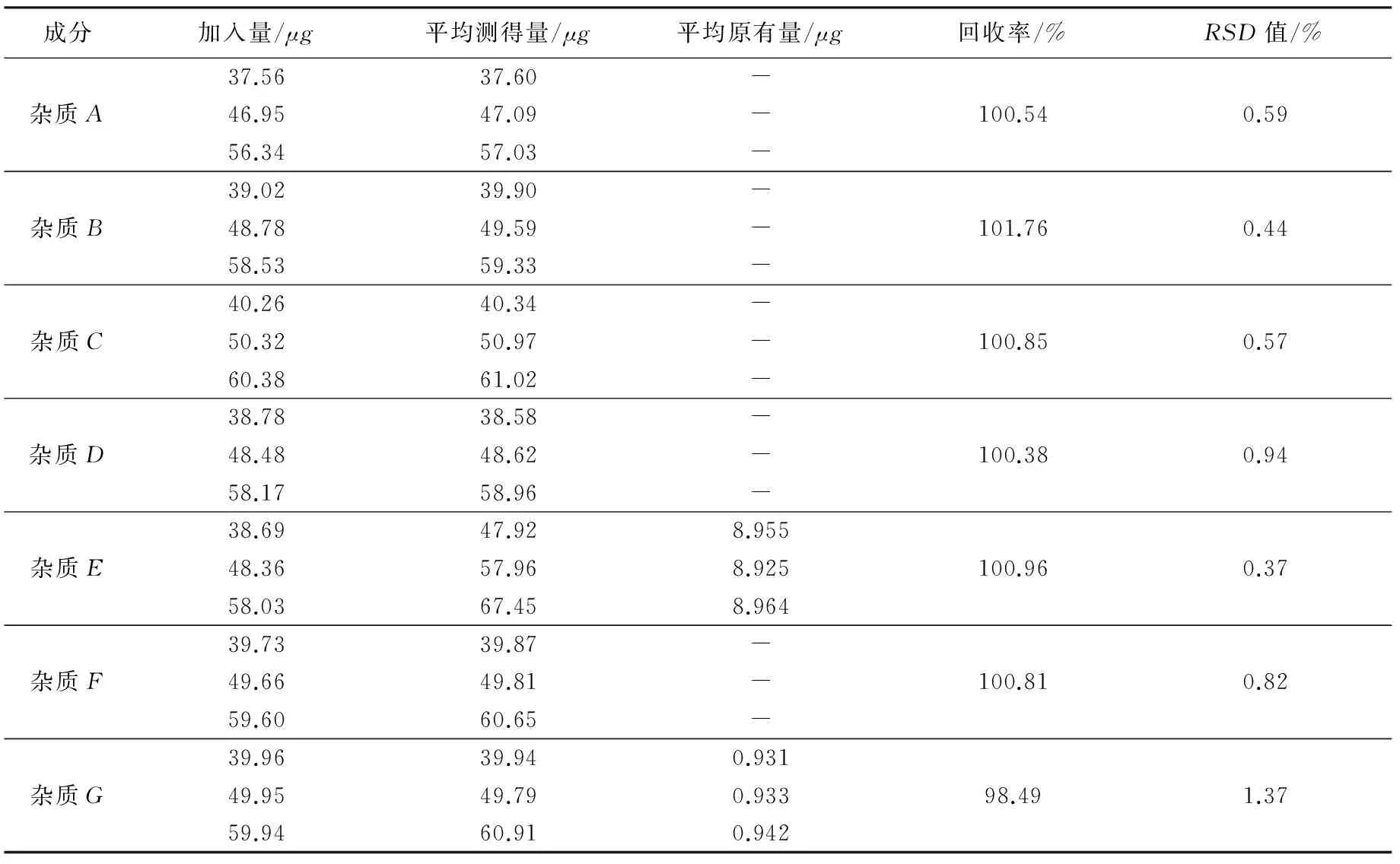
表4 回收率试验结果(n=9)
注:-表示未检出。
2.3.10 耐用性试验
改变有关物质测定色谱条件中的柱温(±2 ℃)、流速(±0.1mL/min)、波长(±2nm)、pH值(±0.2)和色谱柱(不同批次),分别测定同一批样品。结果表明,杂质测得量基本不变,杂质个数也无变化。这说明本方法的耐用性良好。
2.4 样品测定
取4批样品适量,分别按“2.2”项下的方法制备供试品溶液和对照品溶液,按“2.1”项下色谱条件进样测定。已知杂质A,B,C,D,E,F和G采用相对保留时间定位,所含各杂质采用自身对照法,按校正后的峰面积(分别乘以校正因子)进行计算。供试品中如有已知杂质峰,则均不得大于对照溶液主峰面积,其他单个杂质峰面积亦不得大于对照溶液的主峰面积,各杂质校正后峰面积之和不得大于对照主峰面积的2倍。样品有关物质结果见表5。
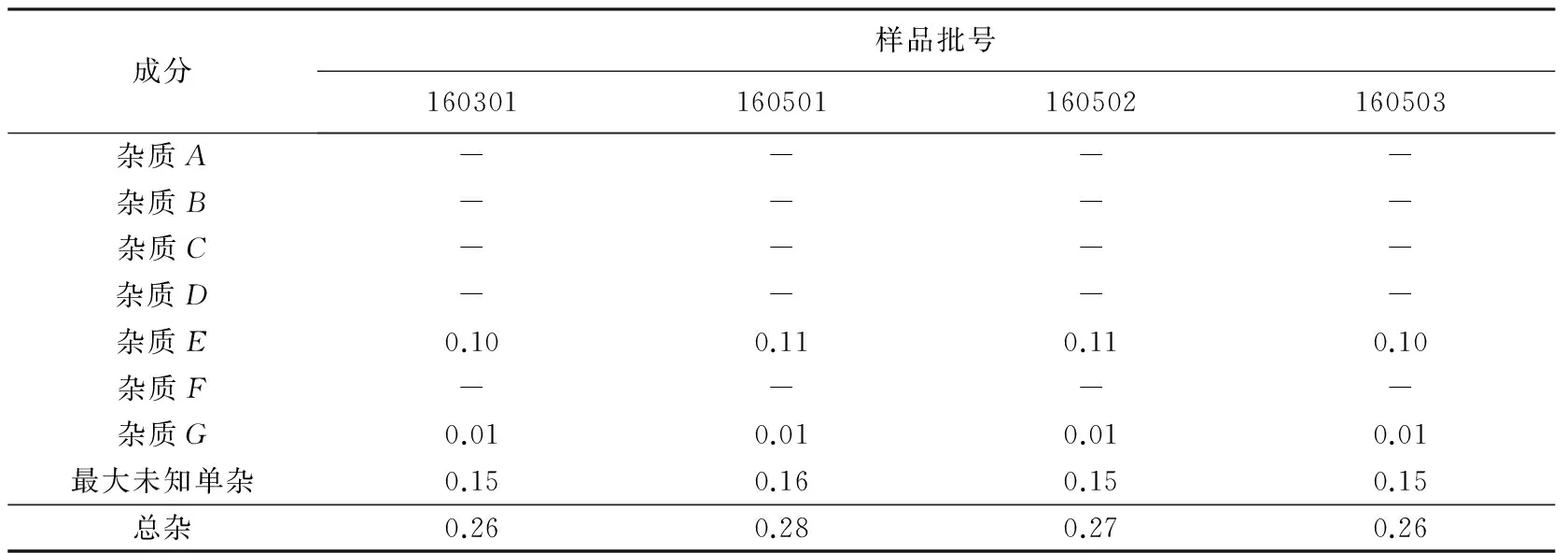
表5 样品有关物质测定结果
注:-表示未检出。
3 讨 论
3.1 色谱条件的优化
前期试验中,笔者参考相关文献[15-17],采用甲醇-0.01mol/L磷酸二氢钾(二者体积比为20∶80)为流动相时,杂质不能全部检出。为此将等度洗脱变为梯度洗脱,但发现杂质B与杂质F的分离度不符合要求。为改善杂质B与杂质F的分离度,将甲醇更换为洗脱能力更强的乙腈,同时调节乙腈的比例,结果发现两杂质的分离度满足要求,主成分峰的峰形良好,理论塔板数较高。按照此梯度条件,将磷酸二氢钾浓度变为0.005mol/L,杂质D与杂质B的拖尾因子分别为1.994和2.331,不符合要求,故缓冲盐的浓度不宜再降低。此检测方法主成分峰与各杂质峰均能实现有效分离,破坏试验中的降解杂质不影响芒柄花素磺酸钠杂质的测定。
3.2 色谱柱的选择
分别对安捷伦公司AgilentHC-C18柱、AgilentTC-C18柱、Thermo-Fisher公司HypersilBDSC18柱(规格均为250mm×4.6mm,5μm)共3根色谱柱进行考察。按照“2.1”项下色谱条件进行检测。结果表明,3根色谱柱对主成分及杂质均能良好分离。
3.3 校正因子和杂质计算
根据标准曲线斜率的比值计算得出各杂质相对于主成分的校正因子[18-19]。杂质的计算采用加入校正因子的自身对照法[20],既可以解决杂质对照品获取难的问题,又可计算出产品中杂质的真实含量。
4 结 语
本研究建立的高效液相色谱法专属性强,精密度、准确度和耐用性良好,可有效检出芒柄花素磺酸钠中的有关物质,为芒柄花素磺酸钠的质量控制提供了重要依据。由于部分杂质的对照品有限,故只采用了加入校正因子主成分自身对照法来控制原料药中杂质的含量,而没有采用定量更为准确的外标法。今后还需要对芒柄花素磺酸钠的后期稳定性进行深入研究。
/
:
[1] 张尊听, 王春燕, 田振军, 等. 芒柄花素-3'-磺酸钠、樱黄素-3′-磺酸钠及其制备方法和药物用途[P].中国专利:101020684, 2007-08-22.
[2] 万彦军, 庄朋伟, 张艳军. 芒柄花素磺酸钠抗血栓作用及机制研究[J]. 中国新药杂志, 2016, 25(12): 1355-1358.WANYanjun,ZHUANGPengwei,ZHANGYanjun.Antithromboticactivityofformononetinsodiumanditsmechanism[J].ChineseJournalofNewDrugs, 2016, 25(12): 1355-1358.
[3] 顾民华, 洪文, 唐传其, 等. 芒柄花素保护前脑缺血再灌注损伤中的血脑屏障并抑制神经炎症[J]. 暨南大学学报(自然科学与医学版), 2015, 36(1): 34-39.GUMinhua,HONGWen,TANGChuanqi,etal.Formononetinprotectsblood-brainbarrierandinhibitsneuroinflammationduringfocalcerebralischemiaandreperfusion[J].JournalofJinnanUniversity(NaturalScience&MedicineEdition), 2015, 36(1): 34-39.
[4] 张淑敏.Sul-F对心肌损伤的保护作用及其机制研究[D]. 青岛: 中国海洋大学, 2011.ZHANGShumin.StudiesonProtectiveEffectsandMechanismsofSul-FonMyocardialInjury[D].Qingdao:OceanUniversityofChina, 2011.
[5] 周耘, 万维勤, 张卫东, 等. 芒柄花素衍生物的合成及其初步生物活性[J]. 中国药物化学杂志, 2000, 10(3): 24-27.ZHOUYun,WANWeiqin,ZHANGWeidong,etal.Synthesisandstudiesonthepreliminarybioactivitiesofderivativesofformononetin[J].ChineseJournalofMedicinalChemistry, 2000, 10(3): 24-27.
[6] 刘辉. 运动训练与芒柄花素磺酸钠对高脂膳食大鼠降血脂效果的生物学研究[D]. 西安: 陕西师范大学, 2007.LIUHui.ExperimentResearchofExerciseTrainingandFormononetinDroppingHypercholesterolemic[D].Xi’an:ShaanxiNormalUniversity, 2007.
[7] 黄志勤, 程齐来, 李洪亮.HPLC测定黄芪药材芒柄花素[J]. 光谱实验室, 2012, 29(5): 3026-3029.HUANGZhiqin,CHENGQilai,LIHongliang.DeterminationofformononetininAstragalus membranaceus(Fisch.)Bge.byHPLC[J].ChineseJournalofSpectroscopyLaboratory, 2012, 29(5): 3026-3029.
[8] 李莹, 陈晓辉, 张天虹, 等.RP-HPLC法测定鸡血藤中芒柄花素的含量[J]. 沈阳药科大学学报, 2009, 26(12): 975-977.LIYing,CHENXiaohui,ZHANGTianhong,etal.DeterminationofcontentofformononetininSpatholobus suberectusDunn.byRP-HPLC[J].JournalofShenyangPharmaceuticalUniversity, 2009, 26(12): 975-977.
[9] 代丽萍, 刘孟奇, 石任兵.HPLC测定芪芍方有效部位中芒柄花素的含量[J]. 中国实验方剂学杂志, 2012, 18(11): 109-111.DAILiping,LIUMengqi,SHIRenbing.QuantitativedeterminationofformononetinintheeffectivefractionofqishaoformulabyHPLC[J].ChineseJournalofExperimentalTraditionalMedicalFormulae, 2012, 18(11): 109-111.
[10] 王思路, 龚苏晓, 张铁军, 等.HPLC法测定黄芪不同炮制品中芒柄花素[J]. 现代药物与临床, 2013, 28(4): 550-552.WANGSilu,GONGSuxiao,ZHANGTiejun,etal.Determinationofformononetinindifferentprocessedproductsofastragaliradix[J].Drugs&Clinic, 2013, 28(4): 550-552.
[11] 王波, 周围, 刘小花, 等. 基于超高效合相色谱对黄芪中5种主要黄酮类化合物的快速检测[J]. 分析化学, 2016, 44(5): 731-739.WANGBo,ZHOUWei,LIUXiaohua,etal.Rapidseparationanddeterminationof5kindsflavonoidsinastragaliradixbasedonultra-performanceconvergencechromatography[J].ChineseJournalofAnalyticalChemistry, 2016, 44(5):731-739.
[12]MUTAIP,PAVADAIE,WIIDI,etal.Synthesis,antimycobacterialevaluationandpharmacophoremodelingofanaloguesofthenaturalproductformononetin[J].Bioorganic&MedicinalChemistryLetters, 2015, 25(12): 2510-2513.
[13] 王秋亚, 孟庆华, 张尊听, 等. 芒柄花素磺化物的合成、溶解性能及降脂保肝活性[J]. 药学学报, 2009, 44(4): 386-389.WANGQiuya,MENGQinghua,ZHANGZunting,etal.Synthesis,solubility,lipids-loweringandliver-protectionactivitiesofsulfonatedformononetin[J].ActaPharmaceuticaSinica, 2009, 44(4): 386-389.
[14] 朱百鸣, 张小林. 金雀异黄酮和刺芒柄花素的合成及表征[J]. 江西科学, 2011, 29(4): 477-479.ZHUBaiming,ZHANGXiaolin.Thesynthesisandcharacterizationofgenisteinandformononetin[J].JiangxiScience, 2011, 29(4): 477-479.
[15] 戎欣玉, 高倩, 陈涛, 等. 阿奇霉素纳米晶体片剂的制备及其质量评价[J]. 河北科技大学学报, 2015, 36(6): 606-612.RONGXinyu,GAOQian,CHENTao,etal.Preparationandevaluationoftabletsofazithromycinnanocrystals[J].JournalofHebeiUniversityofScienceandTechnology, 2015, 36(6): 606-612.
[16] 吉刚峰, 熊学敏, 曾建伟, 等. 高效液相色谱法测定黄芪精口服液中芒柄花素的含量[J]. 中医药导报, 2007, 13(1): 66-67.JIGangfeng,XIONGXuemin,ZENGJianwei,etal.DeterminationofformononetininHuangqijingoralliquidwithHPLC[J].ChinaMedicalHerald, 2007, 13(1): 66-67.
[17] 李云静, 何忠梅.HPLC梯度洗脱法同时测定阿胶益寿晶中的二苯乙烯苷、大黄素甲醚、毛蕊异黄酮苷、芒柄花苷、毛蕊异黄酮和芒柄花素[J]. 中国实验方剂学杂志, 2016, 22(23): 68-72.LIYunjing,HEZhongmei.Simultaneousdeterminationofstibeneglucoside,physcione,calycosin-7-o-β-D-glucoside,ononin,calycosinandfermlononetininejiaoyishoujingbyHPLCgradientelutionmethod[J].ChineseJournalofExperimentalTraditionalMedicalFormulae, 2016, 22(23):68-72.
[18] 任春, 武洋, 张迪, 等. 泮托拉唑钠杂质校正因子测定[J]. 解放军药学学报, 2012, 28(4): 323-324.RENChun,WUYang,ZHANGDi,etal.Determinationofimpuritiesinpantoprazolesodium[J].PharmaceuticalJournalofChinesePeople’sLiberationArmy, 2012, 28(4): 323-324.
[19] 张哲峰.HPLC法校正因子研究中的几个问题[EB/OL].http://www.cde.org.cn/dzk-w.do?method=largePage&id=312552, 2011-12-07.
[20] 余振喜, 庾莉菊, 黄海伟, 等. 浅谈HPLC法测定有关物质时已知杂质的计算方法[J]. 中国药品标准, 2010, 11(4): 278-282.YUZhenxi,YULiju,HUANGHaiwei,etal.DiscussiononthecalculationmethodsoftheknownimpuritiesinrelatedsubstancesdeterminedbyHPLC[J].DrugStandardsofChina, 2010, 11(4): 278-282.
Related substance determination of formononetin by HPLC
PAN Xingyan1, LU Yunxia1, YAO Jun1,2
(1.School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China; 2.State Key Laboratory Breeding Base-Key Laboratory of Molecular Chemistry for Drug of Hebei Province, Shijiazhuang, Hebei 050018, China)
To establish a method for the related substance determination of formononetin, HPLC is performed on the column of Agilent HC-C18(250 mm × 4.6 mm,5 μm) with the mobile phase A of acetonitrile and mobile phase B of potassium dihydrogen phosphate solution at the flow rate of 0.8 mL/min. According to gradient elute, the sample size is 10 μL, the detection wavelength is 250 nm, and the column temperature is 30 ℃. The result shows that the main drug and related substances could be well separated and detected effectively, different impurities can be detected effectively, and there is a good linear relationship between the mass concentration of formononetin and impurity A, B, C, D, E, F and G and peak area in the range of 0.060~4.004 μg/mL(r=0.999 8), 0.056~3.756 μg/mL(r=0.999 3), 0.039~3.902 μg/mL(r=0.999 6), 0.060~4.026 μg/mL(r=0.999 5), 0.058~3.878 μg/mL(r=0.999 3), 0.058~3.869 μg/mL(r=0.999 5), 0.060~3.977 μg/mL(r=0.999 5) and 0.040~3.952 μg/mL(r=0.999 4), respectively. The RSD of instrument precision, intermediate precision and stability test is no more than 2.0%, and the average recovery of impurities is in the range of 98.49%~101.76% with the RSD in the range of 0.37%~1.37%(n=9). The method is simple, reliable and accurate, and can be used to detect related substance in sodium formononetin-3'-sulfonate.
chromatography;formononetin;HPLC;gradient elute;related substances
1008-1542(2017)01-0032-07
10.7535/hbkd.2017yx01006
2016-11-04;
2016-12-12;责任编辑:张士莹
科技部重大专项(2013ZX09103001-002)
潘星燕(1991—),女,河北石家庄人,硕士研究生,主要从事药物分析方面的研究。
姚 军教授。E-mail:twobright@163.com
R917
A
潘星燕,陆云霞,姚 军.高效液相色谱法测定芒柄花素磺酸钠有关物质[J].河北科技大学学报,2017,38(1):32-38. PAN Xingyan, LU Yunxia, YAO Jun.Related substance determination of formononetin by HPLC[J].Journal of Hebei University of Science and Technology,2017,38(1):32-38.
