CTA原图像对急性脑梗死出血性转化的预测价值
2017-03-06杨晓莹
张 敏 许 倩 吴 琛 杨晓莹 稽 昀 徐 凯
出血性转化(hemorrhagic transformation,HT)是指由脑血管闭塞或血流动力学障碍导致的缺血、缺氧和坏死的脑组织继发的出血现象。出血性转化的发生,加重了急性脑梗死患者的病情,也给临床治疗带来了更大的难题和挑战。目前,并没有很好的方法来预测出血性转化的发生。通过分析多种影像资料及相关的临床指标,达到对出血性转化的预测,将有助于临床上合理选择急性脑梗死患者的治疗方案,大大改善病人的预后状况。本文我们将通过ΔHU、rADC值、FLAIR信号强度差别、最大梗死面积等多种影像及临床资料来预测出血性转化的发生。
方 法
1.病例选择
2016年9月至2016月11月来我院连续就诊的166名患者,男性108名(65%),女性58名(35%),平均年龄(63.9±10.3)岁。入组标准:①年龄均大于18岁;②均符合中国急性脑卒中诊断指南2014诊断标准[1];③首次发病或既往发病没有留下明显后遗症者。排除标准:①有严重的肝肾疾病;②有增加出血性风险的其他疾病;③没有完善的影像学检查资料;④既往有腔隙性梗死者。
2.检查方法
MR检查均采用美国GE公司Discovery MR750W 3.0T机器。扫描序列:T1WI,T2WI,T2 FLAIR,DWI。原始数据经ADW4.6工作站处理,2名放射科医生遵循盲法原则,对HT组与无HT组在出血区及缺血区分别选取感兴趣区域(region of interest,ROI),使用Functiontool测量获得ADC值、FLAIR信号强度。以大脑纵裂为对称轴,通过镜像工具,分别测量出对侧半球相应部位的ADC值及FLAIR信号强度值,并计算出:rADC值=ROI ADC值/对侧正常ADC值×100%;ADC差值=对侧正常ADC值-ROI ADC值;信号差值=正常部位信号强度-ROI信号强度。
CTA检查采用Philips 256排Brilliance iCT机。CTA原始图像采集层厚为1.25mm。对CTA原图像进行数据处理,低密度的程度:ΔHU=对侧正常区域HU值-ROI HU值。
病变处面积测量为最大梗死区域面积。
我们同时收集了以下临床指标进行统计分析:年龄,性别,既往病史(高血压、糖尿病、心房颤动、冠心病),吸烟史,随机血糖,随机血压,同型半胱氨酸,高密度脂蛋白(high density lipoprotein,HDL),低密度脂蛋白(low density lipoprotein,LDL),糖化血红蛋白,超敏C反应蛋白。
3. 统计学方法
采用SPSS16.0统计软件进行统计学处理。定量资料以(均数±标准差)表示,正态分布方差齐性数据采用t检验,方差不齐采用t’检验;非正态分布数据采用非参数秩和检验;定性资料采用计数的形式表示,两样本间比较采用χ2检验或Fisher确切概率法。P<0.05差异具有统计学意义。
结 果
1. HT的发生率及发病类型
166例急性脑梗死患者中,30例发生出血性转化。根据欧洲急性卒中合作组织标准[2],按照出血性转化在影像学上的表现,分为以下四种类型。HT1:梗死区边缘有小的出血点;HT2:梗死区内部有融合的小片状出血点,但是没有占位效应;PH1:有占位效应,出血区域占梗死区面积<30%;PH2:有明显占位效应,出血区域占梗死区面积>30%。30 例患者中,HI1 11例(6.6%),HI2 10例(6%),PH1 7例(4.2%),PH2 2例(1.2%)。
2. HT组与无HT临床资料比较(表1)
根据患者的性别、年龄、既往病史、糖化血红蛋白、HDL、LDL、同型半胱氨酸等多项临床指标分析与HT的发生有关的因素。临床指标分析结果得出低水平的HDL和LDL更易发生HT。
3.HT组与无HT组影像资料比较(表2)
根据有无出血性转化将急性脑梗死患者分为HT组和无HT组,分别比较两组间梗死区域的rADC、ADC差值、最大梗死区面积、FLAIR上信号强度差异,ΔHU。影像资料分析结果得出ΔHU值高、梗死面积较大的患者更易发生HT。
4.出血性转化的预测指标结果
临床相关指标的单因素分析比较可以得出,HT组HDL与LDL普遍低于无HT组;影像资料分析中,ΔHU值高、大面积梗死者更易发生HT,其他指标差异上无统计学意义。
讨 论
出血性转化是急性脑梗死患者最严重的并发症,
它的发生给临床治疗增加了一个难题。目前并没有任何一种检查方法可以准确判断出血性转化的发生。但是,通过对现有数据进行合理的分析,找出相关危险因素,对探讨急性脑梗死患者出血性转化的发生有重要的预测价值[3]。
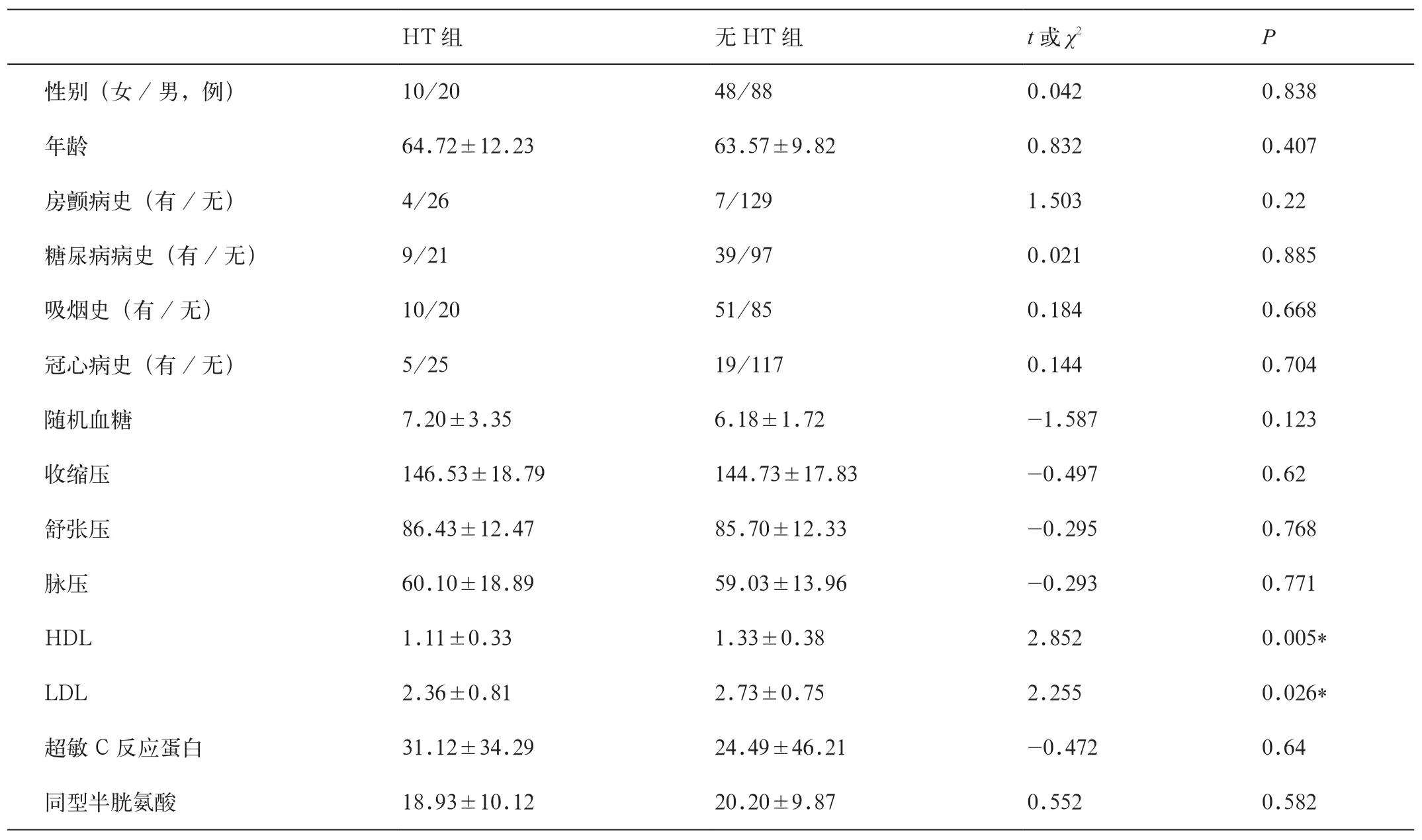
表1 HT组与无HT组临床资料分析
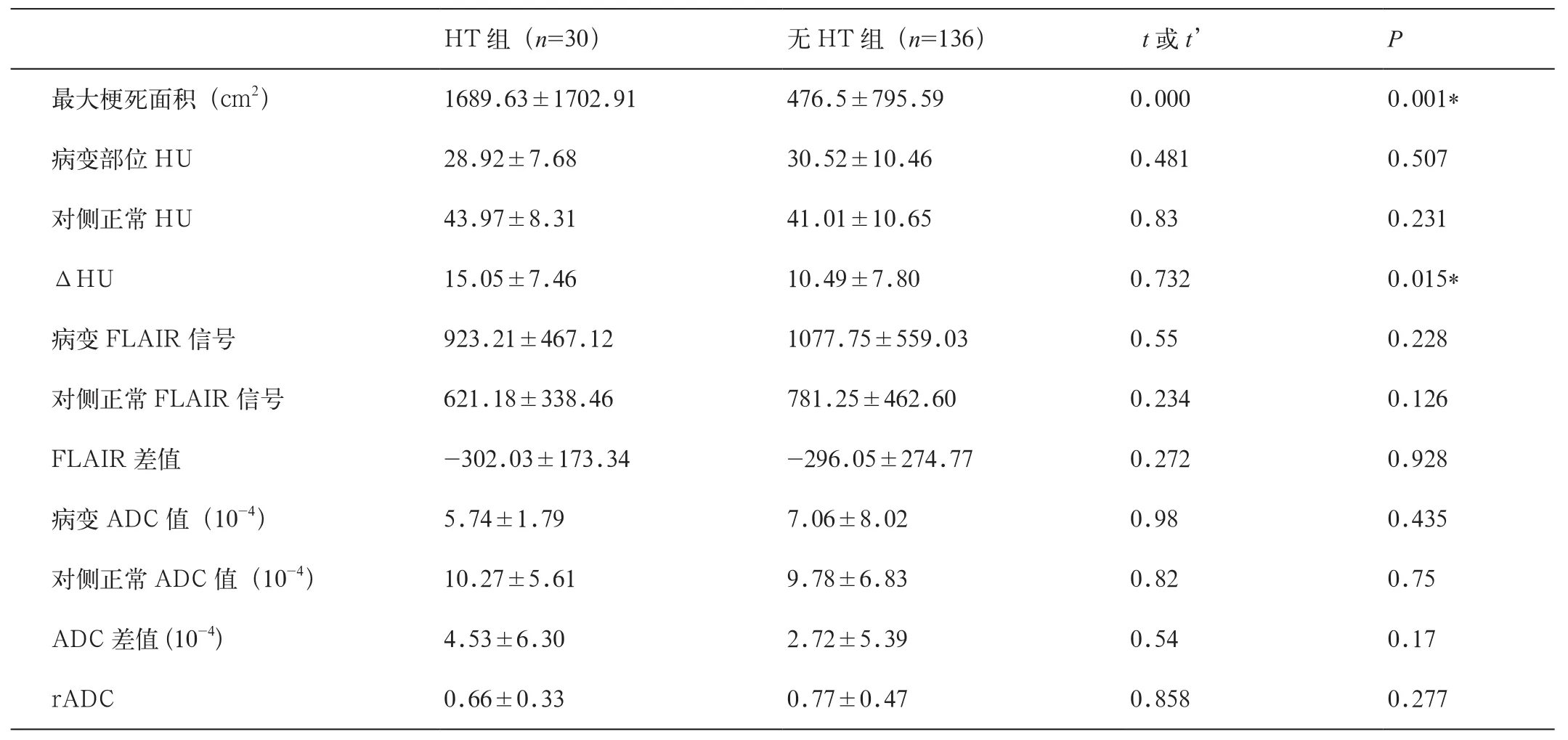
表2 HT组与无HT组影像资料分析(均数±标准差)
导致出血性转化的发生原因有很多,血脑屏障破坏、缺血再灌注等与HT的发生密切相关[4-7]。主要发生机制有:①基质的蛋白水解酶降解了构成血脑屏障的层粘连蛋白、纤维链接蛋白等成分,使得血脑屏障发生破坏;②缺血再灌注后,脑磷脂分解产生花生四烯酸,它是自由基的主要构成部分,自由基的聚集破坏了细胞的蛋白质、脂质、核酸,启动了细胞信号传导,破坏了局部血脑屏障;③再灌注后脑组织产生大量活性氧,激活一系列细胞因子,从而进一步促进白细胞聚集和炎症反应,导致局部微血管通透性改变。
本次研究对CTA原始图像进行了分析处理,通过测量病变处与对侧的HU差值来预测出血性转化发生,与Schwamm等[8]学者做的研究结果一致。由此可以得出,CTA原图像上低密度的程度对出血性转化的发生有预测价值。同时,本次研究证实了Yang等[9]、Lapergue等[10]学者的观点,由于LDL、HDL影响了动脉管壁弹性,导致动脉粥样硬化的形成,所以低水平的LDL和HDL会导致HT的发生。本次研究还发现大面积梗死灶患者更容易发生出血性转化,考虑是由于大面积梗死造成颅内大血管的堵塞,当临床治疗恢复血流供应时,血流流量较大、流速较快,使已发生梗死的大血管及分支更容易破裂出血[11-12]。
既往的研究认为,FLAIR上的信号强度[13]、rADC值、ADC差值、超敏C反应蛋白、同型半胱氨酸、高血压[14]等既往病史均与HT的发生密切相关。本文与之前的研究结果相反,考虑是由于收集样本量过少、回顾性研究的局限性所致。
除了上述分析中提到的缺陷之外,我们的研究还存在以下局限:①对于脑梗死患者采取的是最大梗死面积的测量而没有进行体积的评估;②选取ROI测量的时候受主观因素影响较大。在接下来的研究中,应选取更广的研究时段,用更大、更可靠的数据样本来探讨影像资料对HT的预测价值,从而可以更好地协助临床治疗方案的选择。
结合以上研究发现,我们可以使用CTA原图像及相关临床指标来预测急性脑梗死患者出血性转化的发生。对于较大的ΔHU、较低水平的HDL及LDL和较大梗死灶面积的患者,应慎重选择治疗方案,警惕出血性转化的发生。
[1]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性脑卒中诊断指南2014诊断标准. 中华神经科杂志,2015,48:246-257.
[2]Larrue V, von Kummer RR, Müller A, et al. Risk factors for severe hemorrhagic transformation in ischemic stroke patients treated with recombinant tissue plasminogen activator: a secondary analysis of the European-Australasian Acute Stroke Study (ECASS II). Stroke, 2001,32: 438-441.
[3]Paciaroni M, Agnelli G, Corea F, et al. Early hemorrhagic transformation of brain infarction: rate, predictive factors, and influence on clinical outcome results of a prospective multicenter study. Stroke, 2008, 39: 2249-2256.
[4]Yu S, Liebeskind DS, Dua S, et al. Postischemic hyperperfusion on arterial spin labeled perfusion MRI is linked to hemorrhagic transformation in stroke. J Cereb Blood Flow Metab, 2015, 35: 630-637.
[5]黄银辉,李明媚,陈振杰,等. 急性缺血性脑卒中静脉溶栓后出血性转化危险因素分析.中国神经精神疾病杂志,2013,39:581-586.
[6]Bang OY, Saver JL, Alger JR, et al. Patterns and predictors of bloodbrain barrier permeability derangements in acute ischemic stroke.Stroke, 2009, 40: 454-461.
[7]Renú A, Amaro S, Laredo C, et al. Relevance of blood-brain barrier disruption after endovascular treatment of ischemic stroke: dualenergy computed tomographic study. Stroke, 2015, 46: 673-679.
[8]Schwamm LH, Rosenthal ES, Swap CJ, et al. Hypoattenuation on CT angiographic source images predicts risk of intracerebral hemorrhage and outcome after intra-arterial reperfusion therapy. AJNR, 2005, 26:1798-1803.
[9]Yang N, Lin M, Wang BG, et al. Low level of low-density lipoprotein cholesterol is related with increased hemorrhagic transformation after acute ischemic cerebral infarction. Eur Rev Med Pharmacol Sci,2016, 20: 673-678.
[10]Lapergue B, Dang BQ, Desilles JP, et al. High-density lipoproteinbased therapy reduces the hemorrhagic complications associated with tissue plasminogen activator treatment in experimental stroke. Stroke,2013, 44: 699-707.
[11]Liu C, Dong Z, Xu L, et al. MR image features predicting hemorrhagic transformation in acute cerebral infarction: a multimodal study. Neuroradiology, 2015, 57: 1145-1152.
[12]华 荣,师毅冰,徐 凯,等. 磁共振弥散加权成像预测出血性转化实验研究. 中国医学计算机成像杂志,2016,22:384-388.
[13]Ahn SH, Kim BJ, Kim YJ, et al. Fluid-attenuated inversion recovery hyperintensity is associated with hemorrhagic transformation following reperfusion therapy. J Stroke Cerebrovasc Dis, 2008, 39: 3424-3426.
[14]Ko Y, Park JH, Yang MH, et al. The signi fi cance of blood pressure variability for the development of hemorrhagic transformation in acute ischemic stroke. Stroke, 2010, 41: 2512-2518.
