三聚体纳米颗粒自组装过程的分子动力学模拟
2017-03-04周进杰DeepakBhopatkarOsvaldoCampanellaBruceHamakerMarceloCarignano庄海宁
冯 涛,王 珂,周进杰,Deepak Bhopatkar,陈 枫, Osvaldo Campanella,Bruce R. Hamaker,Marcelo Carignano,庄海宁
三聚体纳米颗粒自组装过程的分子动力学模拟
冯 涛1,2,王 珂1,周进杰1,Deepak Bhopatkar2,陈 枫3, Osvaldo Campanella2,Bruce R. Hamaker2,Marcelo Carignano4,庄海宁5
(1. 上海应用技术学院香料香精技术与工程学院,上海 201418;2. 普度大学食品科学系惠斯特勒碳水化合物研究中心,西拉法耶特市47906-2009;3. 普度大学信息技术中心罗森高级计算中心,西拉法耶特市47907-21084;4. 卡塔尔环境与能源研究所,多哈 5825;5. 上海市农业科学院食用菌研究所国家食用菌工程技术研究中心,上海 201403)
为了更深入理解直链淀粉/-乳球蛋白/-亚油酸三元复合物体系自组装行为的机制,该研究借助Gromacs软件,采用分子动力学模拟对玉米直链淀粉、-乳球蛋白、-亚油酸三者在373 K温度下的结合过程进行研究。通过三元纳米粒子在500 ns内的自组装快照图,可以得出直链淀粉、-亚油酸、-乳球蛋白3种组分的结合顺序。通过三元纳米粒子的自由能曲面图,可知该三元纳米粒子的形成是热力学自发的过程。进一步对其水合半径及溶剂可接触表面积的分析表明,该三元复合物纳米颗粒溶解性良好。研究阐释了水溶性自组装纳米颗粒的形成机理,为纳米科学领域寻找合适的壁材提供了一种新的研究途径。
纳米颗粒;分子动力学;自组装;直链淀粉;-乳球蛋白;-亚油酸
0 引 言
许多食物中含有纳米级成分,它们通常是很重要的原料,如淀粉、蛋白质和脂肪等。在食品加工过程中,这些分子会在纳米或微米尺寸上发生结构变化。直链淀粉作为主要的食物成分,可以用作增稠剂、稳定剂、吸附剂[1]等。直链淀粉现在已经在主-客体包合[2-3]、提高碳纳米管的生物相容性[4]、药物和风味成分[5]方面取得了显著的成功。淀粉颗粒被加热后可以释放出生物聚合物,这些生物聚合物能够重结晶形成纳米结构,例如,重结晶的直链淀粉区域约为10~20 nm。-乳球蛋白因具有优良的凝胶性、持水性、起泡性而广泛被用做食品赋型剂、稳定剂。此外,-乳球蛋白还具有转运脂肪酸、脂质和脂溶性维生素等功能[6]。天然的-乳球蛋白,长度约为 3.6 nm,在pH值、温度、压力等条件变化时可变性,在酸奶中,变性的-乳球蛋白可以聚集成凝胶网状结构[8]。脂肪的主要成分为甘油三酯,是由1个甘油分子和3个长链的脂肪酸分子组成。甘油的分子比较简单,而脂肪酸的种类和长短却不相同。脂肪酸可以分两大类:饱和脂肪酸和不饱和脂肪酸,其中不饱和脂肪酸还可分为单元不饱和脂肪酸、多元不饱和脂肪酸。王存芳等[7]探讨不同压力条件及不同加热方式对崂山奶山羊乳中各脂肪酸、短链脂肪酸、饱和脂肪酸、不饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸组成的影响,表明超高压处理能够更好的保持羊乳中脂肪酸的含量及组成。脂肪,例如单甘酯可以组装形成甘油三酯结晶(10~100 nm)[8]。目前已有研究者将单一形成纳米材料的淀粉、蛋白质、脂肪组合在一起进行研究。
Zhang等[9]发现由淀粉、乳清蛋白、游离脂肪酸组成的较稀三元体系,在沸水浴中不断搅拌加热后形成了一种水溶性三元体系。根据他们的高效体积排阻色谱(high- performance size exclusion chromatography,HPSEC)检测、碳水化合物和碘亲和力分析,发现淀粉/蛋白质曲线没有迹象表明复合物形成,只有当淀粉、蛋白质、游离脂肪酸三种组分都存在时,一种新的淀粉/游离脂肪酸/蛋白质分子复合物才会形成,这说明游离脂肪酸在连接淀粉和蛋白质方面发挥了重要的作用,但尚不清楚这种现象发生的机制。Zhang等[10]还用不同的谷物面粉进行试验,发现分别来自高粱、玉米、大米、小米、小麦的5种面粉在快速黏度分析仪测得的曲线上有相似的冷却阶段黏度峰值。这种在冷却阶段出现的黏度峰值,与糊化曲线上在95 ℃出现的黏度峰值不同,是由于面粉中淀粉/游离脂 肪酸/蛋白质的相互作用。这说明淀粉、蛋白质和游离脂肪酸这3种成分的相互作用在食品体系中是一个普遍的现象。Zhang等[11]进一步研究发现,游离脂肪酸是连接热力学不相容的直链淀粉和蛋白质分子的桥梁,游离脂肪酸的羧基官能团是形成这种复杂的三元体系的必需结构。此外,盐处理和pH值的影响表明蛋白质所带的正电荷和游离脂肪酸羧基所带的负电荷之间的静电相互作用可能是复合物自组装的基础。这种自组装的复合物可以用作控释的疏水性功能物质的纳米载体,来保持疏水性功能物质的水溶性、生物活性等。尽管直链淀粉--乳球蛋白-游离脂肪酸水溶性纳米粒子体系已在实验室进行研究,但在分子水平上对其形成机理的研究还很少。
计算机模拟为研究复杂体系的自组装行为提供了另一种途径,通过模拟可以研究直链淀粉的折叠和络合行为。Sattelle和Almond12]通过图形处理器(graphic processing unit,GPU)加速全原子模拟来探索直链淀粉单螺旋和双螺旋在水中运动的微秒动力学,经过10s的模拟,得出在微秒时间范围内双螺旋比单螺旋稳定,双螺旋平行构象比反平行构象稳定。López等[13]利用分子动力学技术研究了直链淀粉在脂质存在下的折叠和络合行为。经研究发现,在水溶液中直链淀粉片段保持一个扩展左手螺旋结构,再往体系中加入脂质后,可以观察到直链淀粉链自发折叠成螺旋结构。Lee等[14]利用分子动力学模拟研究了均一的两亲性肽(peptide amphiphile,PA)的混合水溶液,两亲性肽分子进入柱形纤维胶束起点的自组装过程,发现PA分子首先形成球状微胶束,接着微胶束在范德华力作用下形成三维网络结构,然后三维网络结构消失,出现了一种直径为8×10-9m的纤维结构。Wang等[15]为了了解紫杉醇被壳聚糖/水杨酸(chitosan oligosaccharide/salicylic acid,COS/SA)包埋的过程,进行了全原子分子动力学模拟来分析COS/SA分子聚合物,发现范德华力和疏水相互作用是紫杉醇包埋过程中的主要作用力。Xie和Soh[16]使用分子动力学技术探讨直链淀粉和单壁纳米管片段之间的相互作用,发现范德华力是两者之间的主要作用力,直链淀粉与纳米管的包埋受纳米管大小的影响。Bhopatkar[17]等为了研究直链淀粉/-乳球蛋白/亚油酸三聚体纳米胶囊包埋1-萘酚的作用机制,利用Gromacs软件进行了分子动力学模拟,得出直链淀粉、亚油酸、-乳球蛋白组装成四聚体复合物的过程吉布斯自由能变小于零,是热力学有利的,1-萘酚位于直链淀粉的螺旋空腔里,并接近亚油酸的疏水尾部。
分子动力学研究可以揭示三元聚合物纳米粒子的原子结构。分子模拟是目前常用的一种对分子行为进行解释或预测的研究方法,广泛地应用于各学科领域中[18]。分子动力学模拟是生物大分子理论研究的一种主要工具。目前,利用分子动力学模拟进行生物大分子的研究,主要集中在蛋白质和核酸上,对于淀粉及其与其他生物大分子形成纳米粒子的研究很少。在本研究中,我们用Gromacs模拟了玉米直链淀粉-乳球蛋白--亚油酸三元体系的自组装过程。与之前研究的直链淀粉与风味分子体系相比,模拟时间由1 ns增加到了500 ns,使所得到的结果更有说服力;在之前研究的直链淀粉、-亚油酸体系的基础上,又引入了-乳球蛋白,利用全原子模拟分析三元体系的动态行为,深入了解直链淀粉/-乳球蛋白/-亚油酸三元复合物的结构和形成过程,研究-乳球蛋白和-亚油酸对直链淀粉构象的影响,三元复合物的溶解性质和三元复合物形成过程中的结构和自由能变化,为直链淀粉/-乳球蛋白/-亚油酸三元复合物作为壁材输送不饱和脂肪酸等营养物质提供理论基础。同时该研究为纳米科学领域寻找合适的壁材提供了一种新的研究途径。
1 材料与方法
1.1 材料
50%(质量分数)直链玉米淀粉(美国Cargill公司);-乳球蛋白;亚油酸(C18:3)(美国Sigma化学公司)
1.2 三元纳米粒子的制备和成像
根据Zhang等[10]的方法制备纳米粒子悬浮液,以20 : 2 : 1的质量比,将热水提直链淀粉上清液和-乳球蛋白(10 mg/mL)溶液,亚油酸混合。混合物置于沸水浴加热20 min,搅拌转速450 r/min,然后25 ℃下搅拌冷却4 h。
利用高效体积排阻色谱(high-performance size exclusion chromatography,HPSEC)-多角度光散射(multi angle lightscatter,MALS)和折光率(refractive index,RI)检测器联用,纯化纳米粒子。纯化条件:悬浮液过0.45m微孔滤膜,取100L注射到Sephacryl HR-500(美国通用电气医疗集团)填充柱,流动相为0.02% 叠氮化钠水溶液,流速1.3 mL/min。光散射检测系统,配有658 nm GaAs激光二极管的Dawn Heleos-II型MALS检测器和OptilabrEx RI检测器(美国怀亚特科技公司)。数据收集和分析软件为检测器自带的ASTRA 5.3.4.10。光散射数据利用Zimm法,即1.46d/d(d/d为纳米粒子悬浮液的折射梯度)来计算纳米粒子的平均分子质量和平均半径根。
此外,注射500L纳米粒子悬浮液到相同的HPSEC系统中利用馏分收集器收集而得纯化样品,用于成像分析。取3.5L悬浮液涂布到碳涂层栅格,并在液态乙烷(-135 ℃)中玻璃化。用Philips CM200 FEG透射电镜(荷兰飞利浦公司)对栅格检测,图片放大38 000倍。
1.3 直链淀粉、-乳球蛋白和-亚油酸的模型
本研究采用由Gregor博士提供的V-型直链淀粉分子模型进行研究[19],该模型具有一个由55个葡萄糖残基组成6个每圈的左手螺旋结构,螺旋结构的内径约55 nm,外径约135 nm,长度约738 nm。
本模拟中采用的-乳球蛋白为Uhrinova等[20]确定的核磁共振(nuclear magnetic resonance,NMR)结构,所在蛋白质数据库的文件名为1DV9.pdb。根据Zhang等[11]的报道,我们选择从67号-101号氨基酸的肽段(LYS LYS ILE ILE ALA GLU LYS THR LYS ILE PRO ALA VAL PHE LYS ILE ASP ALA LEU ASN GLU ASN LYS VAL LEU VAL LEU ASP THR ASP TYR LYS LYS)以简化体系,本段肽链含有大量的LYS残基,可以和游离脂肪酸的羧基之间产生静电相互作用。然后用PRODRG服务器(http://davapc1.bioch.dundee.ac.uk/prodrg/)[21]生成-乳球蛋白起始结构。
-亚油酸的蛋白质数据库(protein data bank,PDB)文件下载自:http://xray.bmc.uu.Se /hicup/EIC/。然后用PRODRG服务器(http://davapc1.bioch.dundee.ac.uk/ prodrg/)[21]生成-亚油酸起始结构。
1.4 力场
根据Damm等[22]和Kony等[23]确定葡萄糖的力场参数,所有的模拟由葡萄糖对直链淀粉的力场设定而计算。原子的标注如图1所示,原子的变化如表1所示。由于糖苷键的不同,GLC、GLM和GLK分别被命名代表直链淀粉上葡萄糖残基的起点、中间和末端。LA代表-亚油酸,LGP代表-乳球蛋白肽链。图1中的数字标号对应于表1最后一列的原子编号。
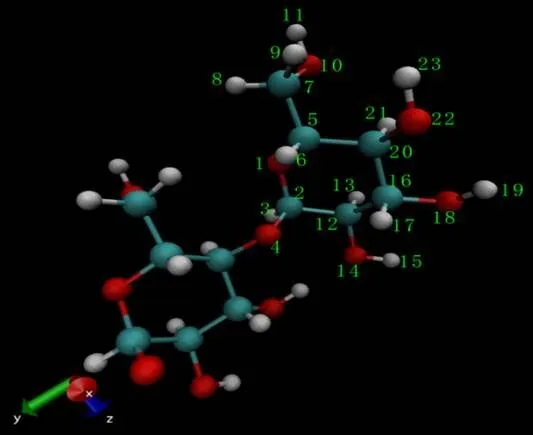
注:碳原子被染成绿色,氧原子被染成红色,氢原子被染成灰色。图1中的数字标号对应于表1中的原子编号。
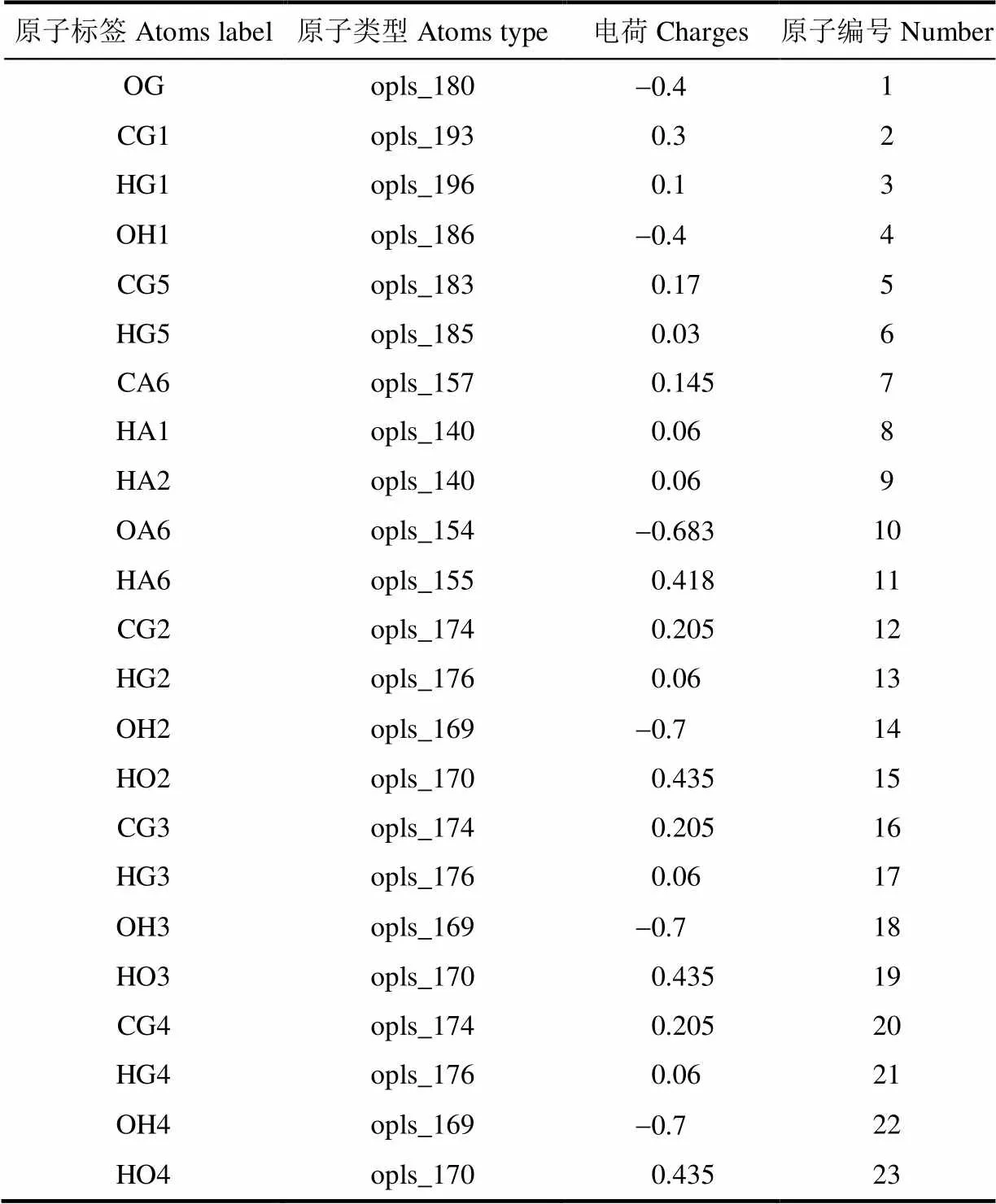
表1 葡萄糖力场中葡萄糖拓扑结构原子变化
1.5 分子动力学模拟过程
蛙跳式运动路线由Gromacs 4.6.1(欧洲研究委员会生命科学可扩展软件服务事务中心)分子动力学(MD)软件进行设定,使用2×10-15s时间步长。模拟步数为 250 000 000,总运行时间为500 ns。利用LINCS算法限制所有的键长(迭代次数,用于lincs约束精度)=1,(约束耦合矩阵阶次,用于lincs精度)=4。调整不同组间的Berendsen热电偶,弛豫时间为0.1 ps,保持温度为 373 K,压力保持在1.0×105Pa,松弛时间2×10-12s。利用相邻栅格切除方案处理非化学键相互作用。短距离内的相邻分子列表截止距离为0.9 nm,计算列表中每个时间步之间的相互作用。伴随每队列表的更新,分别同时计算短距静电截止半径0.9 nm,长距范德华力截止半径1.4 nm[13]。
1.6 三元纳米粒子模拟和分析
三元纳米粒子由55个葡萄糖残基的直链淀粉链、-乳球蛋白肽链和-亚油酸组成,该粒子被放在充满 11 272 mol水分子的10 nm × 6 nm × 6 nm长方体内。水的模拟模型为TIP4P,直链淀粉链在-亚油酸附近与-乳球蛋白肽或-亚油酸进行预结合,由于整个体系静电荷为+4,加入4 mol氯离子以中和初始状态。在分子动力模拟产生时间之前,利用最速下降算法将链的内能最小化。然后,模拟运行500 ns以获得此三元结构在水环境中的平衡结构。模拟的起始结构如图2所示,模拟起始结构的搭建是根据试验结果进行的,接近于现实,符合物理原理,亲水基团亲水。该模型的运算和分析均在Gromacs 4.6.1软件上执行。
1.7 自由能曲面图分析
利用0~500 ns间三元纳米粒子体系上-亚油酸和直链淀粉主链之间的均方根偏差(Root mean square deviation,RMSD)和回转半径(Radius of gyration,())制作出体系的自由能曲面图。图生成后,在0、100、200、300、400和500 ns处分别填上它们的RMSD和()值。因此,可以画出500 ns内系统的自由能变化曲线,其他具体信息参照Felts等[24]的报道。
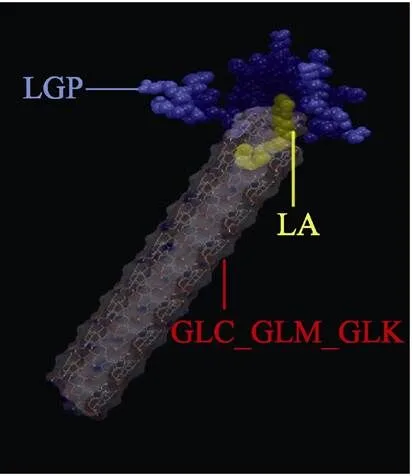
注:直链淀粉中氧原子被染成红色,碳为白色,氢为蓝色。图中着重强调使用主链(GLC_GLM_GLK)和α-亚油酸(LA)、主链和β-乳球蛋白肽(LGP),β-乳球蛋白肽和α-亚油酸之间的距离作为标记位点,以估算主链和LA、主链和LGP以及LA和LGP区域间距离,下同。
2 结果与分析
2.1 纳米粒子
图3a显示了纯化纳米粒子的冷冻透射电镜视图,图上圆圈内密集的纳米粒子表示较少的包埋和单个的纳米粒子。图上的纳米粒子结构方向各异,但当看到全部的水平视野时,它们便呈现出统一的形态和大小(棒状,宽10 nm,长40 nm)。虽然在笔者之前的试验中已经证实了直链淀粉、蛋白质和-亚油酸自组装的纳米复合体(20~40 nm)存在,但均一的纳米粒子是否是由其非特异性聚集或是自组装而形成的,并不清楚。使用冷冻透射电镜,虽然图a,b两者的放大倍数不同,但由于标尺线的差异,仍可看出两者的微观结构上的差异,经观察发现纳米粒子显示均一大小,这一现象表示在指定条件下这些大分子发生高度特异性的自组装缔结。图3b显示了只有直链淀粉的溶液中的非特异性聚集。
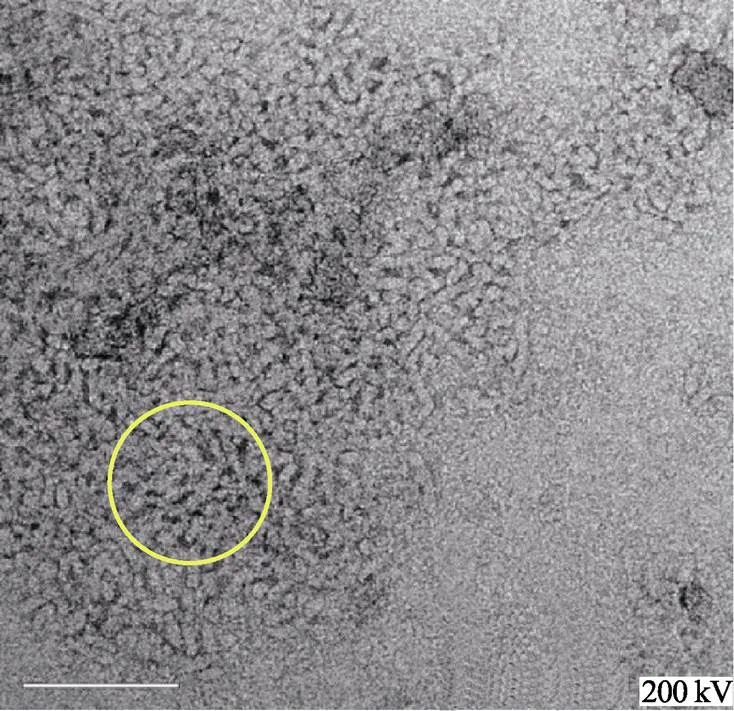
a. 直链淀粉-蛋白质-脂肪酸纳米粒子(×38 000)
a. Amylose-protein-fatty acid nanoparticles (×38 000)
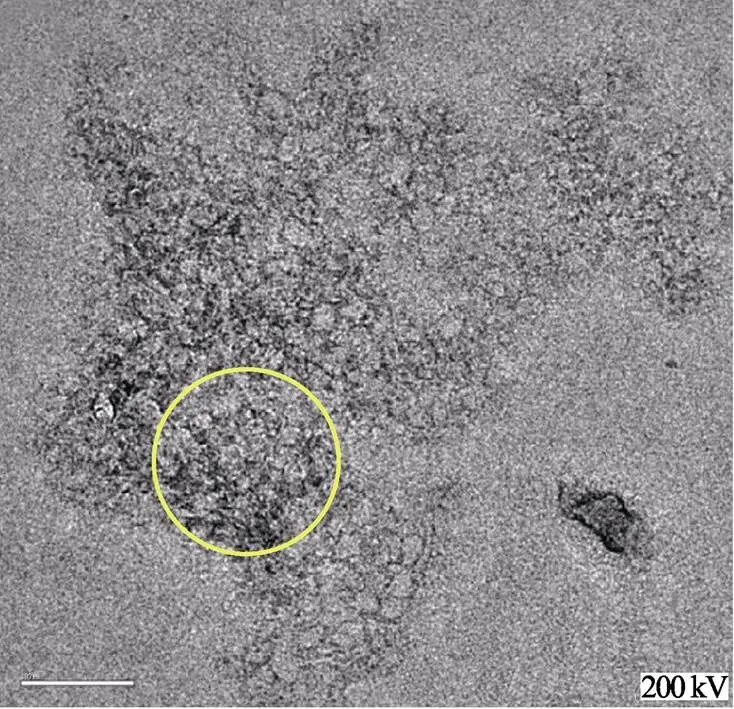
b.淀粉(直链淀粉)上清液(×27 500)
b.Starch (amylose)supernatant (×27 500)
注:a图圆圈内可以看到离散的、均匀的棒状结构;b图圆圈内可以看到无定型聚集结构。
Note: It can be seen as discrete, regular, rod-shaped structures in the circle of Fig. 3a; an amorphous aggregated structures can be seen in the circle of Fig.3b
图3 纯化的三元纳米粒子和淀粉上清液冷冻透射电镜图
Fig.3 Cryo-TEM images of purified ternary nanoparticles and starch supernatant
2.2 三元纳米结构的动力学模拟
运行三元体系500 ns 分子动力学模拟,起点为理论构象的柱形3D结构(由葡萄糖构成的3D柱形螺旋结构, 每圈6个葡萄糖)。选择此柱形结构的依据为:1)试验证明直链淀粉在水中的构象是由多于100个葡萄糖单位组成的螺旋片段构成,2)该结构为络合物中直链淀粉模拟提供了模板,这对阐明三元纳米粒子的自组装中-乳球蛋白肽和-亚油酸的作用具有重要的意义。如材料与方法部分1.6中所讲,在直链淀粉中-乳球蛋白肽和-亚油酸都发生预络合,模拟过程涵盖了所有的原子。
图4a显示了三元纳米粒子在500 ns内的自组装快照图。该模拟显示了所有结构的实质性重组,所产生的结构和初始状态的柱形3D结构(图2)不同。在100 ns内LA从直链淀粉上分开;在200 ns时LA从直链淀粉另一侧再次进入直链淀粉,LGP将LA和直链淀粉环绕;接着,300 ns时LA被包裹在直链淀粉片段的中部,而LGP从LA和直链淀粉上分出;400 ns时,LA仍被包裹在淀粉片段的中间位置,LGP靠近直链淀粉和LA;最终,在500 ns时,LA保持在原有位置,LGP再次将LA和直链淀粉环绕,形成棒状构象。该结构与图3a中的纳米粒子图相当一致。
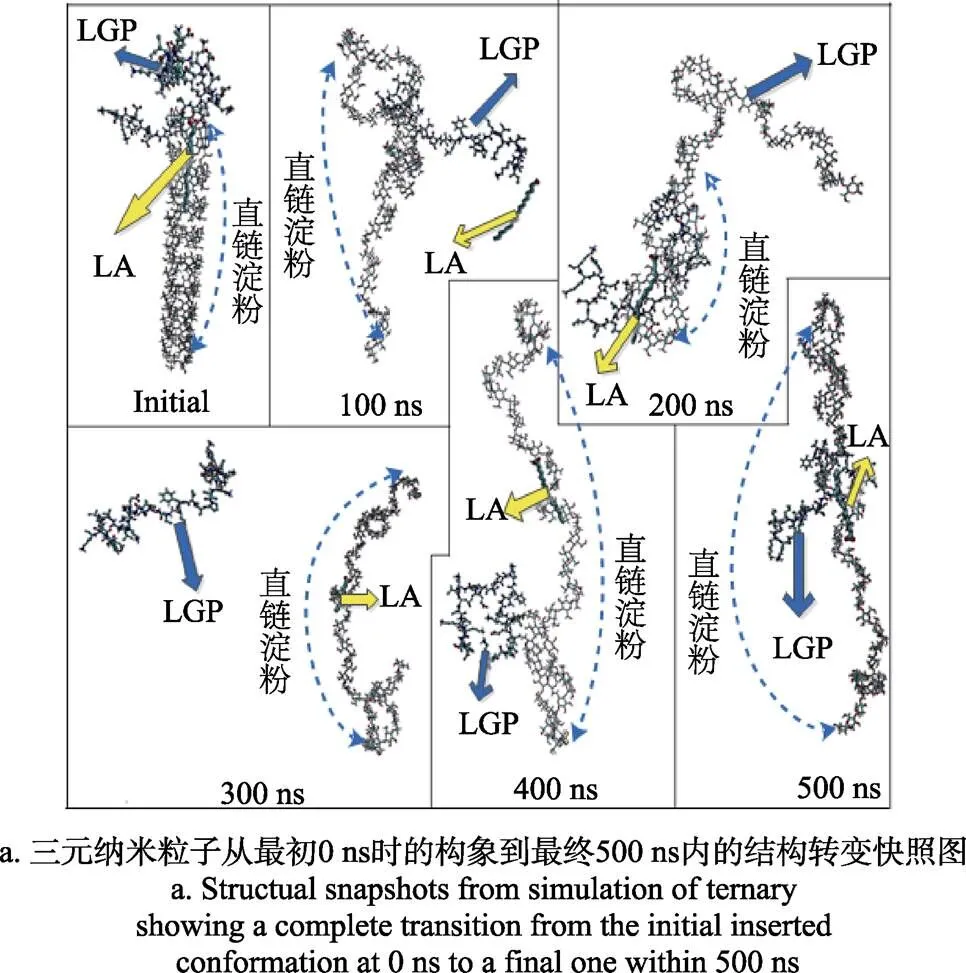
为定量分析构象的转变过程,分别测定了主链(GLC-GLM-GLK)、LA和LGP之间的相互间距(图4b)。500 ns内主链与LA之间距离从约3.5 nm降低到0.5 nm,而主链与LGP间距由5.0 nm降低到2.0 nm,LA与LGP间距由3.0 nm减少到2.0 nm。域间距离轨迹图(图4b)说明LA相对于直链淀粉主链的移动在200 ns处存在转折点,表明LA再次进入直链淀粉螺旋结构;LGP相对于直链淀粉主链移动在100 ns处存在转折,而LA相对于LGP移动在100 ns时距离最近,并直到150 ns时才增加,在220 ns时两者再次接近,并直到250 ns才增加,350 ns处第三次接近,随后直到500 ns结束,其距离才略增加2 nm。表明LA在稳定体系方面发挥着比LGP更重要的作用。因此,我们的模拟可以得出在500 ns内可以达到平衡状态。模拟轨迹和Zhang等[9]的研究结果游离脂肪酸在连接淀粉和蛋白质方面发挥了重要的作用相吻合,表明分子动力学模拟可以精确地表现出-乳球蛋白肽和亚油酸对直链淀粉构象的影响。根据构型中观察到的LA-依赖性变化,可以推测出V型直链淀粉和游离脂肪酸之间稳定的结构,并不依赖于小分子特定的初始络合位点和方向,而是在直链淀粉上有最终稳定的络合位点。
2.3 三元体系的溶剂可接触表面
模拟过程一开始三元纳米粒子的疏水区域面积立刻变小,接着便保持在42.5 nm2左右,其变小原因为三元结构的扩展,促进了链与水分子之间的接触。疏水区域面积的降低意味着疏水性受到影响,随着暴露的疏水性区面积减小,疏水区域周围的水分子释放到本体溶液中。从图5可以看出,亲水区域面积在模拟过程中,一直大于疏水区域面积,所以宏观上来看,直链淀粉/-乳球蛋白/-亚油酸三元复合物表现出亲水特性大于疏水特性的特点,即该三元复合物是水溶性的。溶剂可接触总面积最后稳定在90 nm2左右,与模拟初始相比,总面积明显降低,溶剂可接触面积的降低是由于三元体系构象折叠,使其与水接触的表面积减少。
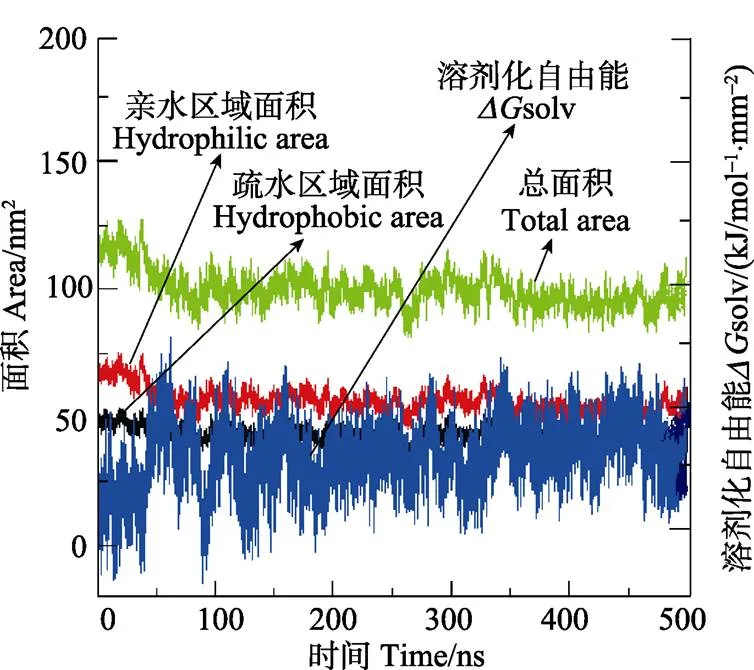
图5 三元纳米体系溶剂可接触表面积(SASA)
solv代表三元复合物溶解在水中的自由能,当solv小于0时,溶剂化作用将是热力学有利的,在该 研究中,solv是一个负值,在图5中显示出来的solv是一个绝对值,三元体系的溶剂化过程表现出溶剂化自由能先降低后增加,最终稳定的一个趋势,这说明直链淀粉/-乳球蛋白/-亚油酸三元复合物溶剂化过程是一个复杂的热力学自发过程。自发过程的驱动力及组分之间的相互作用力将在以后进行深入研究。
2.4 三元体系的回转半径
回转半径是直接反映三元复合物溶解性质的主要特征之一。依据三元纳米粒子回转半径的变化,可以阐明三元体系更多的信息。图6显示了水溶液中三元纳米粒子的回转半径与模拟时间的变化曲线。为观察水对直链淀粉主链、LGP和LA回转半径大小的影响,图6分别绘制了这3种结构域在水溶液中的回转半径变化趋势图。水溶液中直链淀粉主链的回转半径可以分为3个阶段,与构象的变化相对应。第一阶段(0<<200 ns),水溶液中三元纳米粒子中直链淀粉主链的回转半径降到最低,()=2.25 nm。()减小的原因可能是因为LA和LGP从主链上分离,而造成主链缩紧(图4b)。第二阶段(200 ns<<350 ns),因为LA与主链之间的作用力大于LA与LGP间的作用力,所以当主链再次包裹LA时,立即引起主链扩展,直链淀粉的回转半径渐渐增加(图4a)。当三元体系中直链淀粉的回转半径增加到最大4.13 nm后略有降低。第三阶段(350 ns<<500 ns),主链的回转半径便在4 nm处上下振动,没有大幅度变化。在平衡阶段,水溶液中纳米粒子的主链回转半径均值约为4 nm,这表明三元纳米粒子在水中被拉长。试验结果与水溶液中聚丙烯酰胺和十二烷基硫酸钠自组装分子动力学模拟结果相吻合[25],这说明在模拟过程中,可以通过监测分子的回转半径来反应模拟体系的特性。

注: 直链淀粉,LGP,LA。
至于LA,其回转半径基本没有变化,()值一直在0.7 nm左右,表明不论模拟时间怎样变化,LA的回转半径都不会受到体系中其他结构域的影响。而LGP的()值变化就比较复杂,三元水合物中LGP的回转半径在1.0~2.5 nm,这也许和不同构象变化有关。
2.5 三元纳米粒子自由能曲面图
图7显示了从初态到终态(500 ns)间,3种组分在自组装过程中自由能曲面图,快照间隔时间为100 ns。图7中横坐标均方根偏差(root mean square deviation, RMSD)表示均方根偏差,左侧纵坐标轴表示回转半径,右侧纵坐标轴表示自由能。与自由能的关系是ln(),是和RMSD的或然率。依据图1所列的成分,初始状态时(图7,区域1)自由能为41.0 kJ/mol,大于0,是热力学不利的;到第2区域(图7,区域2)自由能迅速变为32.6 kJ/mol,此时的复合物分离成直链淀粉主链-LGP和LA两部分;接着在第3区域(图7,区域3)3个组分重新聚集,自由能降低为20.9 kJ/mol;在自由能为8.8 kJ/mol时,LA和直链淀粉连在一起,而LGP脱离了三元体系(图7,区域4);然后,当三类成分将完成自组装时,自由能进一步降低到4.0 kJ/mol(图7,区域5);最终,在500 ns时,自由能为0.13 kJ/mol(图7,区域6),LA位于直链淀粉中部螺旋结构内,LGP环绕在LA羧基所在位置的直链淀粉附近。3种组分自发的自组装过程对应的自由能降低,表明该过程是一个热力学自发的过程。这与田耀旗[26]的报告直链淀粉与-环糊精的相互作用能在达到一极小值时,直链淀粉与-环糊精分子能进行最佳的复合相一致。

注:图中数字代表如图3a所示的每隔100 ns快照图。
3 结 论
本文利用Gromacs软件进行分子动力学模拟,揭示了直链淀粉/-乳球蛋白/-亚油酸这一三元复合物自组装的机制,得到以下结论:直链淀粉、-乳球蛋白、-亚油酸三者结合过程中构象发生了大规模的转变,这种转变是在直链淀粉上自然发生的。-亚油酸 (-linoleic acid,LA)是直链淀粉螺旋结构形成所必需的。LA促进形成直链淀粉螺旋结构对稳定直链淀粉具有重要作用。-乳球蛋白(-lactoglobulin, LGP)由LA吸引,增加了纳米粒子的稳定性。直链淀粉、-乳球蛋白、-亚油酸三者结合形成三元纳米粒子的过程是一个热力学自发的过程且该三元纳米粒子溶解性良好。
致谢:感谢国家自然科学基金(31371736)对本研究支持。感谢美国普度大学罗森高级计算机中心为我们提供超级计算机方面的GPU资源。
[1] 林旭辉,董世瑞,郭俊杰,等. 玉米直链回生淀粉吸附含羟基红曲红色素的动力学[J]. 农业工程学报,2016,32(2): 294-299. Lin Xuhui, Dong Shirui, Guo Junjie, et al. Adsorption kinetics of monascus red pigments with hydroxyls by retrograded corn starch[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(2): 294-299. (in Chinese with English abstract)
[2] Nomura S, Kyutoku T, Shimomura N, et al. Preparation of inclusion complexes composed of amylose and biodegradable poly(glycolic acid-co-|[epsiv]|-caprolactone) by vine-twining polymerization and their lipase-catalyzed hydrolysis behavior[J]. Polymer Journal, 2011, 43(12): 971-977.
[3] Kumar K, Woortman A J J, Loos K. Synthesis of Amylose– Polystyrene Inclusion Complexes by a Facile Preparation Route[J]. Biomacromolecules, 2013, 14(6): 1955-60.
[4] Sapsford K E, Algar W R, Berti L, et al. Functionalizing nanoparticles with biological molecules: developing chemistries that facilitate nanotechnology[J]. Chemical reviews, 2013, 113(3): 1904-2074.
[5] Obiro W C, Sinha Ray S, Emmambux M N. V-amylose structural characteristics, methods of preparation, significance, and potential applications[J]. Food Reviews International, 2012, 28(4): 412-438.
[6] 孟祥河,潘秋月,邵平,等. 酶解膜分离两步分离乳清中β-乳球蛋白的研究[J]. 农业工程学报,2008,24(5): 280-283. Meng Xianghe, Pan Qiuyue, Shao Ping, et al. Isolation of β-lactoglobulin from whey by proteolysis coupled with membrane separation technology[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE), 2008, 24(5): 280-283. (in Chinese with English abstract)
[7] 王存芳,娄新曼,王建民. 超高压及加热处理对羊乳脂肪酸组成的影响[J].农业工程学报,2015,31(23):308-314. Wang Cunfang, Lou Xinman, Wang Jianmin. Effect of ultra- high pressure and heating treatment on fatty acid composition of goat milk[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(23): 308-314. (in Chinese with English abstract)
[8] Sekhon BS. Food nanotechnology-an overview[J]. Nanotechnology, Science and Applications, 2010, 3(1): 1-15.
[9] Zhang GY, Maladen MD, Hamaker BR. Detection of a novel three component complex consisting of starch, protein, and free fatty acids[J]. Journal of Agricultural and Food Chemistry, 2003, 51(9): 2801-2805.
[10] Zhang GY, Hamaker B. Sorghum (Sorghum bicolor L. Moench) flour pasting properties influenced by free fatty acids and protein 1[J]. Cereal Chemistry, 2005, 82(5): 534-540.
[11] Zhang GY, Maladen MD, Campanella OH, et al. Free fatty acids electronically bridge the self-assembly of a three-component nanocomplex consisting of amylose, protein, and free fatty acids[J]. Journal of Agricultural and Food Chemistry, 2010, 58(16): 9164-9170.
[12] Sattelle B M, Almond A. Microsecond kinetics in model single-and double-stranded amylose polymers[J]. Physical Chemistry Chemical Physics, 2014, 16(17): 8119-8126.
[13] López C A, de Vries A H, Marrink S J. Amylose folding under the influence of lipids[J]. Carbohydrate Research, 2012, 364: 1-7.
[14] Lee O-S, Cho V, Schatz G. Modeling the self-assembly of peptide amphiphiles into fibers using coarse-grained molecular dynamics[J]. Nano Letters, 2012, 12(9): 4907-4913.
[15] Wang X Y, Zhang L, Wei X H, et al. Molecular dynamics of paclitaxel encapsulated by salicylic acid-grafted chitoan oligosaccharide aggregates[J]. Biomaterials, 2013, 34(7): 1843-1851.
[16] Xie Y H, Soh A. Investigation of non-covalent association of single-walled carbon nanotube with amylose by molecular dynamics simulation[J]. Materials Letters, 2005, 59(8): 971-975.
[17] Bhopatkar D, Feng T, Chen F, et al. Self-assembled nanoparticle of common food constituents that carries a sparingly soluble small molecule[J]. Journal of Agricultural & Food Chemistry, 2015, 63(17): 4312-4319.
[18] 冯涛,刘芳芳,荣志伟,等. 基于分子动力学模拟的直链淀粉风味分子包合物形成机理的研究[J]. 现代食品科技,2015,31(3):126-132. Feng Tao, Liu Fangfang, Rong Zhiwei, et al. Mechanism of amylose-flavor molecule-inclusion compound formation simulated by molecular dynamics[J]. Modern Food Science & Technology, 2015, 31(3): 126-132. (in Chinese with English abstract)
[19] Tusch M, Krüger J, Fels G. Structural Stability of V-Amylose Helices in Water-DMSO Mixtures Analyzed by Molecular Dynamics[J]. Journal of Chemical Theory & Computation, 2011, 7(9): 2919-2928.
[20] Uhrinova S, Smith MH, Jameson GB, et al. Structural changes accompanying pH-induced dissociation of the beta-lactoglobulin dimer[J]. Biochemistry, 2000, 39(13): 3565-3574.
[21] Lemkul JA, Allen WJ, Bevan DR. Practical considerations for building GROMOS-compatible small-molecule topologies[J]. Journal of Chemical Information and Modeling, 2010, 50(12): 2221-2235.
[22] Damm W F A, Tirado-Rives J, Jorgensen WL. OPLS all-atom force field for carbohydrates[J]. Journal of Computational Chemistry, 1997, 18(6): 1955-1970.
[23] Kony D, Damm W, Stoll S, et al. An improved OPLS-AA force field for carbohydrates[J]. Journal of Computational Chemistry, 2002, 23(15): 1416-1429.
[24] Felts A K, Harano Y, Gallicchio E, et al. Free energy surfaces of-hairpin and α-helical peptides generated by replica exchange molecular dynamics with the AGBNP implicit solvent model[J]. Proteins: Structure, Function, and Bioinformatics, 2004, 56(2): 310-321.
[25] Wang H, Zhang H, Liu CB, et al. Coarse-grained molecular dynamics simulation of self-assembly of polyacrylamide and sodium dodecylsulfate in aqueous solution[J]. Journal of Colloid and Interface Science, 2012, 386(1): 205-211.
[26] 田耀旗. 淀粉回生及其控制研究[D]. 无锡:江南大学,2011.Tian Yaoqi. Research and Inhibitory Techniques of Starch Retrogradation[D]. Wuxi: Jangnan University, 2011. (in Chinese with English abstract)
Molecular dynamics simulation of self-assembling process of ternary nanoparticle
Feng Tao1,2, Wang Ke1, Zhou Jinjie1, Deepak Bhopatkar2, Chen Feng3, Osvaldo Campanella2, Bruce R. Hamaker2, Marcelo Carignano4, Zhuang Haining5
(1.201418,;2.47906-2009,;3.47907-2108,;4.5825,; 5.201403,)
Ternary complex system of amylose/whey protein/free fatty acid has attracted significant interest in food nutraceuticals or functional compounds in food delivery systems due to the well-known low toxicity, excellent biocompatibility, and solubility. Maize amylose,-lactoglobulin,-linoleic acid were self-assembled and characterized by the TEM. Then, in order to understand the mechanism of the self-assembling actions of such a ternary system (interaction among amylose,-lactoglobulin and-linoleic acid) deeply, all-atom molecular dynamics simulations were performed to analyze the self-assembling of the 3 components by the Gromacs software. An amylose segment of 55 glucose residues was used to form a 6-fold left-handed helix with 55 nm inner diameter and 135 nm outer diameter approximately and a length of 738 nm. A-lactoglobulin peptide segment was used on the basis of the three-dimensional (3D) structure determined from an NMR (nuclear magnetic resonance) analysis. The PDB (protein data bank) file for-linoleic acid was obtained from the Heterocompound Information Centre in Uppsala, Sweden. The glucose force field was chosen and all simulations for the amylose-like molecule were carried out using the glucose force field. The Gromacs 4.6.1 MD package (ScalaLife Competence Center, European Research Council) was used for the simulation. The MD simulations were performed using the leapfrog motion routine with a 2×10-15s time step. A total of 250 000 000 simulation steps (for a total of 500 ns simulation time) were performed to assess the progression of the self-assembly process. The LINCS algorithm was used to constrain all bond lengths. In the simulation, the temperature was set at 100 °C, necessary for the initial formation of the nanoparticle. This was performed using the modified Berendsen thermocouple between the different groups with a relaxation time of 0.1 ps, and the pressure was maintained at 1.0×105Pa using the Parrinello−Rahman coupling to a pressure bath via an isotropic coordinate scaling with a relaxation time of 2×10-12s. Non-chemical bond interactions were handled using a neighboring grid cell cutoff scheme. Within a neighboring molecules list’s cutoff distance of 0.9 nm in a short range, the interactions were evaluated at every time step based on a pair list. A short-range electrostatic cutoff radius of 0.9 nm and a long-range Van der Waals’ cutoff radius of 1.4 nm were evaluated simultaneously with each list updating. The binding order of the 3 components could be obtained through the self-assembly snapshot diagram of ternary nanoparticles within 500 ns. The TEM images showed that ternary nanoparticles had a rod-like conformation, which could be confirmed by the snapshot at 500 ns of ternary system from molecular dynamic simulation. Further analyses of their gyration radius and solvent accessible surface area showed that the ternary nanoparticles were highly hydrosoluble, which indicated that the nanoparticles could significantly enhance the aqueous solubility of some hydrophobic nutraceuticals or functional compounds. It also indicated that the formation of the ternary nanoparticles was a thermodynamically spontaneous process among amylose,-lactoglobulin and-linoleic acid interaction through the free energy curved-surface map of the ternary nanoparticle. The present work provides insights into the mechanism of the atomic structures of aqueous soluble self-assembled nanoparticles and presents new perspective for the design of nutraceuticals delivery systems with desirable properties.
nanoparticles; molecular dynamics; self assembly; amylose;-lactoglobulin;-linoleic acid
10.11975/j.issn.1002-6819.2017.03.041
TS231
A
1002-6819(2017)-03-0300-07
2016-08-07
2016-12-22
国家自然科学基金资助项目(31371736)
冯 涛,男,教授,博士,2012年赴美国普度大学做访问学者,主要从事淀粉科学和食品风味化学的研究。Email:fengtao@sit.edu.cn
冯 涛,王 珂,周进杰,Deepak Bhopatkar,陈 枫,Osvaldo Campanella,Bruce R. Hamaker,Marcelo Carignano,庄海宁.三聚体纳米颗粒自组装过程的分子动力学模拟[J]. 农业工程学报,2017,33(3):300-306. doi:10.11975/j.issn.1002-6819.2017.03.041 http://www.tcsae.org
Feng Tao, Wang Ke, Zhou Jinjie, Deepak Bhopatkar, Chen Feng, Osvaldo Campanella, Bruce R. Hamaker, Marcelo Carignano, Zhuang Haining. Molecular dynamics simulation of self-assembling process of ternary nanoparticle[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(3): 300-306. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2017.03.041 http://www.tcsae.org
