畸胎瘤术后卵巢储备功能正常患者辅助生殖治疗过程及结局分析
2017-03-02宋天然孙海翔王玢
宋天然,孙海翔,王玢
(南京大学医学院附属鼓楼医院生殖医学中心,南京 210008)
畸胎瘤术后卵巢储备功能正常患者辅助生殖治疗过程及结局分析
宋天然,孙海翔*,王玢
(南京大学医学院附属鼓楼医院生殖医学中心,南京 210008)
目的 探讨畸胎瘤及其手术治疗对辅助生殖治疗过程及结局的影响。 方法 回顾性分析 2012年1月至2015年12月在我院生殖医学中心行体外受精胚胎移植/卵胞浆内单精子注射技术(IVF/ICSI)助孕的畸胎瘤术后患者70例(A组),对照组为输卵管积水术后不孕患者78例(B组),对两组患者的一般情况、首次超促排卵过程及妊娠结局进行比较。 结果 畸胎瘤术后患者与对照组间的取卵周期促性腺激素用量、获卵数、正常受精率、卵裂率及有效胚胎数差异均无统计学意义(P>0.05)。两组间的鲜胚周期临床妊娠率、着床率、流产率亦无显著性差异(P>0.05)。对照组冻胚移植周期临床妊娠率(82.14%)、着床率(64.71%)均显著高于A组(58.14%,37.50%)(P<0.05),而两组间累计临床妊娠率差异无统计学意义(P>0.05)。 结论 卵巢储备功能正常的畸胎瘤剥除术后患者所获卵母细胞数量及胚胎质量均无明显下降,提示畸胎瘤及其手术治疗对卵母细胞质量无明显影响。但冻胚周期临床妊娠率及着床率明显降低,建议这些患者尽可能采用可鲜胚移植的促排方案。
卵巢畸胎瘤; 辅助生育; 卵巢反应; 临床结局
(JReprodMed2017,26(2):133-137)
卵巢成熟性畸胎瘤(mature teratomas)是最常见的卵巢生殖细胞肿瘤,约占全部卵巢肿瘤的5%~25%,绝大多数发生于育龄期女性,以20~40岁多见,而这些患者多数仍有生育要求[1-3]。目前卵巢畸胎瘤治疗仍以手术为主[4],但畸胎瘤及其手术治疗是否对卵母细胞发育及其后胚胎发育产生影响研究尚少。为此,本文回顾性分析了我中心2012年1月至2015年12月,畸胎瘤术后卵巢储备功能正常患者辅助生育促排过程及妊娠结局,将其与输卵管积水术后患者相比,探讨其卵母细胞及胚胎发育情况。
资料与方法
一、研究对象及分组
回顾性分析2012年1月至2015年12月在本院生殖医学中心行体外受精胚胎移植/卵胞浆内单精子注射技术(IVF/ICSI)助孕的畸胎瘤术后患者70例,年龄23~37岁。畸胎瘤患者(A组)纳入标准:(1)既往有手术剥除畸胎瘤病史,且病理诊断为卵巢成熟性畸胎瘤;(2)辅助治疗前评估卵巢储备功能正常:年龄<40岁,基础血清卵泡刺激素(bFSH)<10 U/L,双侧卵巢基础窦状卵泡(bAFC)之和>7个[5];(3)采用长方案促排。对照组输卵管积水患者78例(B组)入选标准为:(1)因输卵管积水行输卵管切除或结扎手术的不孕患者;(2)按上述标准卵巢储备功能正常;(3)采用长方案促排。排除标准:(1)有过IVF助孕病史;(2)子宫腺肌症患者;(3)子宫内膜异位症患者;(4)子宫肌瘤患者;(5)子宫内膜损伤患者;(6)盆腔结核患者;(7)无卵巢手术病史。本研究经过本院医学伦理委员会批准,患者均签署了知情同意书。
二、研究方法
1.刺激方案:两组患者均采用长方案,降调药物为促性腺激素释放激素激动剂(GnRH-a,曲普瑞林,达必佳,辉凌制药,德国),降调满意后(E2≤146.4 pmol/L;FSH≤5 U/L;LH≤5 U/L;内膜厚度≤5 mm;卵泡直径<10 mm),给予重组卵泡刺激素(rFSH,果纳芬,雪兰诺,瑞士)150~300 U/d启动,4~5 d后B超监测,调整促性腺激素(Gn)用量。当2~3个主导卵泡直径≥18 mm,注射HCG,36~38 h后取卵[6]。
2.胚胎培养及移植:取卵后4~6 h加入处理后精子进行IVF或ICSI。体外培养2~3 d后评估胚胎质量,选择优质胚胎移植或冷冻。优质胚胎标准:发育速度正常,如体外培养第2天的4细胞或第3天的6~8细胞;胚胎形态评分3~4分[7]。受精率为受精胚胎数与获卵数之比,正常受精率为正常受精胚胎数与获卵数之比。卵裂率为正常受精后有卵裂的胚胎与正常受精的胚胎数之比。
3.冻融移植周期(FET):激素替代周期从月经第1天开始,给予雌激素14~20 d,内膜厚度≥8 mm时,给予孕激素4~5 d后进行胚胎移植。自然周期监测卵泡发育和LH值,在LH峰出现的第4天或排卵后的第3天进行胚胎移植。
4.随访及妊娠结局的判定:胚胎移植后继续黄体支持,移植2周血β-HCG升高,初步判断可能妊娠;移植4周后宫内、外探及孕囊者,为临床妊娠;妊娠28周前分娩者,为流产。累计妊娠率=(鲜胚移植妊娠数+冻胚移植妊娠数)/取卵周期数。
三、观察指标及判断标准
年龄、bFSH值、bAFC数反映患者卵巢储备功能,与原发或继发不孕、IVF或ICSI助孕方式一起反映患者一般生育情况。促排过程主要通过促排天数、Gn用量、HCG日E2水平、获卵数反映。促排结果判断指标主要有获卵数、受精率、正常受精率、卵裂率、有效胚胎数、临床妊娠率(临床妊娠周期数/移植周期数)、着床率(着床胚胎总数/移植胚胎总数)、流产率(流产数/临床妊娠数)及累计妊娠率。
四、统计学分析

结 果
一、一般情况比较
本中心符合纳入标准的畸胎瘤患者(A组)共70例,输卵管积水患者(B组)78例。IVF周期130个(占87.84%),ICSI周期18个(占12.16%);原发性不孕79周期(53.38%),继发性不孕69周期(46.62%)。
A组与B组比较,患者年龄、bFSH值、bAFC均无显著性差异(P>0.05),两组间原发不孕及IVF方式所占比例亦无显著性差异(P>0.05)(表1)。
二、促排过程及卵母细胞受精与胚胎情况比较
A组与B组比较,组间促排天数及Gn用量、HCG日E2水平、内膜厚度均无统计学差异(P>0.05),两组间取卵数、受精率、正常受精率、卵裂率及有效胚胎数的差异亦无统计学意义(P>0.05)(表2)。
三、临床结局比较
鲜胚周期A组有56个移植周期,B组有60个移植周期,A组鲜胚移植率与B组无统计学差异(P>0.05);两组间移植胚胎数、临床妊娠率、着床率、流产率差异均无统计学意义(P>0.05),但胚胎评分A组略高于B组,且有显著性差异(P<0.05)。其中A组有2例异位妊娠,B组无异位妊娠发生(表3)。
至2015年12月底A组共有43个冻胚移植周期,B组有28个冻胚移植周期,两组间移植胚胎数、胚胎评分、流产率无统计学差异(P>0.05),但B组临床妊娠率及着床率显著高于A组(P<0.05)。其中A组有1例异位妊娠(表4)。但统计累计妊娠率显示A组为60(85.71%),B组为65(83.33%),两组比较无显著性差异(P>0.05)。


组别例数年龄(岁)bFSH(U/L)bAFC(个)原发性不孕IVF助孕A组7029.70±3.747.29±1.727.68±3.6545/70(64.29)58/70(82.86)B组7829.83±3.907.25±1.816.87±2.6534/78(43.59)72/78(92.31)
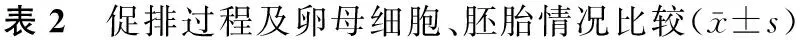

组别例数Gn天数(d)Gn用量(U)HCG日E2(pmol/L)内膜(mm)A组7010.74±1.952267.32±754.4116177.69±7356.6311.12±1.98B组7810.36±1.632188.94±733.9818198.28±9773.6110.52±1.97组别例数取卵数(个)受精率(%)正常受精率(%)卵裂率(%)有效胚胎数(个)A组7011.96±5.0688.88±14.4278.26±17.0595.77±7.775.49±2.81B组7810.99±5.1687.58±15.3873.38±18.5892.61±13.234.73±2.97


组别例数移植周期率移植胚胎数(个)胚胎评分临床妊娠率着床率流产率异位妊娠A组7056/70(80.00)1.96±0.193.71±0.3935/56(62.50)53/110(48.18)1/35(2.86)2B组7860/78(76.92)1.97±0.183.58±0.53*42/60(70.00)61/118(51.69)1/42(2.38)0
注:与A组相比,*P<0.05


组别例数移植周期数内膜(mm)移植胚胎数(个)胚胎评分A组70439.30±0.821.86±0.353.61±0.37B组78289.25±1.261.82±0.393.59±0.38组别例数临床妊娠率着床率流产率异位妊娠A组7025/43(58.14)30/80(37.50)2/25(8.00)1B组7823/28(82.14)*33/51(64.71)*1/23(4.35)0
注:与A组相比,*P<0.05
讨 论
研究认为畸胎瘤来源于生殖细胞,这些全能细胞在胚胎第4~7周由卵黄囊后壁经背侧肠系膜向生殖嵴迁移,形成性腺;若因某些原因停留在不恰当的位置,如骶前、尾骨、卵巢等处,则可形成包括畸胎瘤、无性细胞瘤、卵黄囊癌、胚胎癌在内的各种生殖细胞肿瘤。畸胎瘤有家族聚集倾向,且在不同种族间发病部位及病理类型有显著差异,提示遗传因素在发病中起一定的作用,但具体机制尚不清楚,生长因子及类固醇激素可能会影响其大小和稳定性。95%以上的卵巢畸胎瘤为良性,称为成熟性畸胎瘤,由分化好的外、中、内胚层来源的组织构成[8]。对直径大于3 cm的卵巢畸胎瘤应行手术治疗,传统治疗以开腹手术为主,现主要采取腹腔镜下卵巢囊肿剥除术[9-11]。大的肿瘤可压迫卵巢组织或影响周围卵母细胞发育,手术治疗也可造成正常卵巢组织的丢失,影响卵巢储备功能[12]。本研究实验组均为成熟性畸胎瘤术后患者,辅助治疗前评估卵巢储备功能正常,但这种正常只是反映了残余卵泡数量正常,而卵母细胞质量及其对促排药物的反应是否受到畸胎瘤及手术治疗的影响并不清楚,为此本研究比较了其与输卵管因素不孕患者的促排过程、胚胎情况及妊娠结局。本文对照组选用的是因输卵管积水行输卵管切除或结扎手术的不孕患者,且这些患者卵巢未行手术、卵巢储备评估正常,这样可以消除腹腔手术带来的非特异性卵巢功能损伤,更能反映畸胎瘤及其剥除术对卵巢的影响。
理论上卵巢手术均可能损伤卵巢功能,原因有:(1)手术剥除了过多的卵巢组织;(2)腹腔镜下电凝止血使组织发生凝固性坏死,也造成了周围卵巢组织的热损伤;(3)阻断卵巢皮质部分血供,影响术后卵巢功能的恢复;(4)手术后局部炎症引发机体氧化应激及免疫反应,影响卵母细胞质量。临床表现为卵巢储备减少和控制性促排卵反应性降低。Somigliana等[13]对卵巢囊肿剥除侧与非手术侧进行了比较,显示手术侧基础卵巢体积减小,促排后成熟卵泡明显少于对侧,提示囊肿剥除手术本身可能损伤卵巢储备。王磊等[14]的研究显示卵巢手术会使Gn用量增加,获卵数减少,但对妊娠率无影响。Ragni等[15]的研究表明腹腔镜卵巢子宫内膜异位囊肿切除术对卵巢功能的影响只限于卵泡数量减少,对受精率、优胚率无影响。目前对卵巢畸胎瘤及其手术对卵巢的影响研究尚少。本研究排除了子宫内膜异位症、子宫腺肌症、内膜损伤等可能影响卵母细胞质量及胚胎着床的因素,结果显示与单纯输卵管手术患者相比,畸胎瘤术后患者促排天数、Gn用量、HCG日E2水平、获卵数两组间无统计学差异,提示两组患者对Gn反应无差异。受精率、正常受精率、卵裂率、有效胚胎数、鲜胚周期妊娠率、着床率、流产率两组间亦无统计学差异,提示卵母细胞质量两组间无明显差异。虽然冻胚移植周期中输卵管组临床妊娠率及着床率明显高于畸胎瘤组,但统计累计妊娠率时两组间无差异。分析可能原因有:(1)冻融过程放大了配子质量对胚胎发育的影响。胚胎冻融技术的发展极大地促进了辅助生殖的进步,但不管是传统的慢速程序化冷冻还是现在广泛使用的玻璃化冷冻,都可能对胚胎的发育潜能造成损伤。这与冻融过程中渗透压变化、冷冻保护剂化学毒性作用等有关,解冻后胚胎会出现卵裂球受损现象、妊娠结局受到影响。因此,冻融过程对胚胎要求更高。畸胎瘤组冻胚周期妊娠率、着床率降低可能与该组解冻后胚胎发育潜能低于输卵管因素组有关,提示畸胎瘤及其手术治疗可能对卵母细胞质量有不良影响。(2)本研究样本量偏少,冻胚周期移植数更少,可能会带来统计误差。畸胎瘤及其手术治疗对卵母细胞的影响有待更大样本的研究。
综上所述,本研究显示与输卵管手术后IVF/ICSI助孕患者相比,卵巢储备功能正常的畸胎瘤剥除术后患者长方案促排时其对Gn的反应无明显变化,所获卵母细胞数量亦无下降,鲜胚周期临床妊娠率及累计妊娠率两组间无明显差异,提示畸胎瘤及其手术治疗对卵母细胞质量无明显影响。但冻胚周期临床妊娠率及着床率明显低于输卵管因素者,提示其胚胎质量可能仍略有不同,建议这些患者尽可能采用可鲜胚移植的促排方案。
[1] Lee KH,Song MJ,Jung IC,et al.Autoamputation of an ovarian mature cystic teratoma: a case report and a review of the literature[J].World J Surg Oncol,2016,14:217-223.
[2] Park CH,Jung MH,Ji YI.Risk factors for malignant transformation of mature cystic teratoma[J].Obstet Gynecol Sci,2015,58:475-480.
[3] Koonings PP,Campbell K,Mishell DR,et al.Relative frequency of primary ovarian neoplasms: a 10-year review[J].Obstet Gynecol,1989,74:921-926.
[4] Sinha A,Ewies AA.Ovarian mature cystic teratoma: challenges of surgical management[J].Obstet Gynecol Int,2016,2016:2390178.
[5] Ferraretti AP,La Marca A,Fauser BC,et al.ESHRE consensus on the definition of 'poor response' to ovarian stimulation for in vitro fertilization: the Bologna criteria[J].Hum Reprod,2011,26:1616-1624.
[6] 王玢,孙海翔,刘景瑜,等.长方案垂体降调节时间对卵泡发育的影响[J].生殖医学杂志,2013,22: 753-756.
[7] 宋天然、孙海翔、王玢.卵巢储备功能下降患者减量长效及短效长方案疗效的比较[J].南京医科大学学报(自然科学版),2016,36:1143-1146.
[8] Baek J.Synchronous occurrence of mature cystic teratoma of the fallopian tube and ovary: A case report[J].Oncol Lett,2016,12:911-914.
[9] Morelli M,Mocciaro R,Venturella R,et al.Mesial side ovarian incision for laparoscopic dermoid cystectomy: a safe and ovarian tissue-preserving technique[J].Fertil Steril,2012,98:1336-1340.
[10] Park JY,Kim DY,Suh DS,et al.Laparoendoscopic single-site versus conventional laparoscopic surgery for ovarian mature cystic teratoma[J].Obstet Gynecol Sci,2015,58:294-301.
[11] Godinjak Z,Bilalovic N,Idrizbegovic E.Laparoscopic treatment of ovarian dermoid cysts is a safe procedure[J].Bosn J Basic Med Sci,2011,11:245-247.
[12] Li CZ,Liu B,Wen ZQ,et al.The impact of electrocoagulation on ovarian reserve after laparoscopic excision of ovarian cysts: a prospective clinical study of 191 patients[J].Fertil Steril,2009,92:1428-1435.
[13] Somigliana E,Ragni G,Infantino M,et al.Does laparoscopic removal of nonendometriotic benign ovarian cysts affect ovarian reserve?[J].Acta Obstet Gynecol Scand,2006,85:74-77.
[14] 王磊,邵小光,李晓霞.卵巢囊肿及囊肿核除术后对卵巢储备功能、妊娠率的影响[J].中国妇幼保健,2008,23:4765-4767.
[15] Ragni G,Somigliana E,Benedetti F,et al.Damage to ovarian reserve associated with laparoscopic excision of endometriomas: a quantitative rather than a qualitative injury[J].Am J Obstet Gynecol,2005,193:1908-1914.
[编辑:侯丽]
IVF/ICSI treatment process and result in patients with normal ovary reserve function after teratoma operation
SONGTian-ran,SUNHai-xiang*,WANGBin
ReproductiveMedicalCenter,DrumTowerHospitalAffiliatedtoNanjingUniversitySchoolofMedicine,Nanjing210008
Objective:To study the influence of teratoma and its surgical treatment on outcome of assisted reproductive therapy.Methods:The data of 70 patients who had normal ovary reserve function after teratoma operation and underwent the first IVF/ICSI cycle(group A) in our hospital from Jan.2012 to Dec.2015 were analyzed.Meanwhile,78 patients after hydrosalpinx surgery were selected as the controls(group B).The general condition,the first induced ovulation process and pregnancy outcomes were compared between the two groups.Results:There were no significant differences in gonadotropin(Gn) doses,number of oocytes retrieved,normal fertilization rate,cleavage rates and number of available embryo between the patients after teratoma operation and the control group(P>0.05).In the fresh embryo cycle,there was no significant differencesin clinical pregnancy rate,implantation rate and abortion rate between the two groups(P>0.05).In the frozen embryo transfer cycle,the clinical pregnancy rate(82.14%) and implantation rate(64.71%)of group B were significantly higher than those of group A(58.14%,37.50%)(P<0.05).However,there was no significant difference of cumulative clinical pregnancy rate between the two groups(P>0.05).Conclusions:The number of oocytes retrieved and the embryo quality are not significantly decreased in the patients with normal ovary reserve function after teratoma operation.These results indicate that teratoma and its surgical treatment have no significant effect on oocyte quality.However,the pregnancy rate and implantation rate in FET cycle of this group are significantly lower,which suggests that these patients should receive fresh embryo transfer as far as possible.
Ovary teratoma; Assisted reproductive; Ovarian response; Clinical outcomes
10.3969/j.issn.1004-3845.2017.02.006
2016-09-23;
2016-10-25
国家自然科学基金青年基金(81200410);江苏省临床医学科技专项(BL2014003)
宋天然,女,江苏苏州人,博士,生殖医学专业.(*
)
