高孕激素状态下促排卵方案用于卵巢正常反应患者IVF-ET的自身对照研究
2017-03-02郭丽娜贾新转吕翠婷王楠董翠
郭丽娜,贾新转,吕翠婷,王楠,董翠
(河北医科大学第四医院生殖医学科,石家庄 050011)
高孕激素状态下促排卵方案用于卵巢正常反应患者IVF-ET的自身对照研究
郭丽娜*,贾新转,吕翠婷,王楠,董翠
(河北医科大学第四医院生殖医学科,石家庄 050011)
目的 探讨第一周期采用降调节长方案行体外受精/卵胞浆内单精子注射-胚胎移植(IVF/ICSI-ET)未获成功的卵巢正常反应患者,改用高孕激素状态下促排卵(PPOS)方案的临床效果。 方法 回顾性分析2014年1月至2015年11月我科第一周期长方案促排卵后助孕治疗未获成功,第二周期PPOS方案后行冻融胚胎移植(FET)的卵巢正常反应患者共42例,自身对照两种促排卵方案中激素水平、药物使用、获卵及胚胎情况以及PPOS方案后FET的妊娠结局。 结果 PPOS方案中Gn天数[(10.33±2.00)d]、Gn总量[(2 325.00±449.08)U]显著低于长方案[分别为(13.00±2.27)d、(3 182.98±904.91)U](P<0.05);PPOS方案扳机日血清LH水平[(1.64±1.31)U/L]显著高于长方案[((0.91±1.01)U/L]、孕酮(P)水平[(2.25±0.86)nmol/L]显著低于长方案[(3.87±1.68)nmol/L](P均<0.05);PPOS方案的平均获卵数、成熟卵母细胞数、正常受精数、可利用胚胎数与长方案比较无显著性差异(P>0.05),正常受精率[(71.82±17.64)%]、优胚数[(3.62±1.97)枚]和优胚率[(62.21±24.04)%]均显著高于长方案[分别为(63.75±15.77)%、(2.79±1.65)枚、(48.48±22.53)%](P<0.05)。PPOS方案中有3例患者因无冷冻胚胎取消周期;39例患者行FET(共46个周期),22个周期获得临床妊娠,周期临床妊娠率47.83%,种植率24.74%,显著高于长方案[分别为7.02%、3.64%](P<0.05)。 结论 对于长方案促排后助孕未获成功的卵巢正常反应患者,PPOS方案可获得较好的临床妊娠结局,为促排卵治疗提供了一种新的选择方案。
卵巢正常反应; 长方案; 孕激素; 卵巢刺激; 体外受精-胚胎移植
(JReprodMed2017,26(2):127-132)
卵巢正常反应人群使用促性腺激素释放激素激动剂(GnRH-a)降调节长方案行体外受精/卵胞浆内单精子注射-胚胎移植(IVF/ICSI-ET)可获得较高的临床妊娠率,是目前促排卵方案的首选,但仍有一部分患者经过常规治疗后未获成功。这类患者再次行促排卵方案的选择,目前尚无统一标准,临床上一般都尝试不同于第一周期的促排卵方式。高孕激素状态下促排卵(progestin primed ovarian stimulation,PPOS)方案是在早卵泡期持续应用孕激素抑制内源性黄体生成素(LH)结合促性腺激素(Gn)促排卵的一种新策略,已有文献报道其对卵巢储备功能正常的患者可获得较好的临床结局[1],但目前这种方案的临床应用尚不广泛,其能否作为一种常规促排卵选择还处于临床实践中。本文探讨了PPOS方案用于第一周期行长方案促排卵未获成功的卵巢正常反应患者的临床疗效,为PPOS方案的临床应用提供依据。
资料与方法
一、研究对象
回顾性分析2014年1月至2015年11月于我科行IVF/ICSI-ET助孕治疗,第1周期采用降调节长方案促排卵,鲜胚移植周期及冻融胚胎移植(FET)周期均未获活产,3~6个月后第2周期采用PPOS方案促排卵行FET助孕的卵巢正常反应的不孕患者共42例。患者纳入标准参照辅助生殖促排卵药物治疗专家共识[2]:(1)年龄<35岁;(2)卵巢储备功能正常:基础窦卵泡数(AFC)为7~14个,基础FSH<10 U/L;(3)既往无卵巢低反应或高反应的IVF周期取消史。排除标准:高龄、多囊卵巢综合征(PCOS)、高泌乳素血症、子宫内膜异位症(EMs)、反复种植失败、复发性流产、子宫畸形患者。所有夫妇均知情同意并签署PPOS治疗知情同意书。
二、研究方法
1.长方案:于监测排卵后7 d注射长效GnRH-a(贝依,上海丽珠)1.3 mg,21~28 d达到降调节标准后,开始皮下注射重组FSH(rFSH,75 U/支,默克雪兰诺,德国)或丽申宝(75 U/支,珠海丽珠医药)150~225 U/d,5 d后复查B超和血清E2、FSH、LH、孕酮(P)水平,根据卵泡大小及E2水平适时调整Gn用量,卵泡直径达14 mm后适当添加人绝经期促性腺激素(HMG,75 U/支,珠海丽珠医药)75~150 U/d,当1个以上卵泡直径>20 mm或者3个以上卵泡直径>18 mm时,注射重组人绒毛膜促性腺激素(rHCG,艾泽,250 μg,默克雪兰诺,德国)36 h后取卵。根据男方精液情况行IVF或ICSI受精,常规胚胎培养。选择1~2个优质胚胎移植,剩余胚胎行囊胚培养,如有囊胚形成,冷冻保存。
2.PPOS方案:月经第2~3天开始口服醋酸甲羟孕酮(MPA,2 mg/片,浙江仙琚制药)10 mg/d至扳机日,同时肌肉注射HMG 225 U/d,当1个以上卵泡直径>20 mm或者3个以上卵泡直径>18 mm时,同时注射短效GnRH-a(达必佳,辉凌,德国)0.1 mg及HCG(珠海丽珠)2 000 U,34~36 h后取卵。根据男方精液及上次受精情况行IVF或ICSI受精,常规胚胎培养。选择第3天(D3)优质胚冷冻,剩余胚胎行囊胚培养,如有囊胚形成,冷冻保存。
3.FET:采用自然周期或激素替代方案进行内膜准备。自然周期:月经第10天开始B超监测卵泡发育和子宫内膜情况,当主导卵泡直径达18 mm、尿LH阳性时,肌肉注射HCG 5 000 U,排卵后给予地屈孕酮(10 mg/片,雅培,荷兰)20 mg bid支持黄体,排卵后第3天移植卵裂期胚胎。激素替代方案:于月经第2~3天开始口服戊酸雌二醇(1 mg/片,补佳乐,拜耳医药,德国)4~6 mg/d,当子宫内膜厚度≥8 mm后,给予黄体酮注射液(20 mg/支,浙江仙琚)60 mg/d,或者黄体酮阴道缓释凝胶(雪诺酮,默克雪兰诺,德国)进行黄体支持。第4天行冻融卵裂期胚胎移植,第6天行冻融囊胚移植。FET后12 d测血β-HCG确定生化妊娠,移植后32 d B超可见妊娠囊确定为临床妊娠。
4.评价标准及指标:卵裂期胚胎评价标准:Ⅰ级胚胎:受精后D3细胞数6~10个,卵裂球均等,碎片≤15%;Ⅱ级胚胎:碎片比例占16%~29%,或卵裂球大小不均;Ⅲ级胚胎:碎片比例占30%~49%;Ⅳ级胚胎:碎片比例≥50%。Ⅰ~Ⅱ级胚胎为优质胚胎,Ⅰ~Ⅲ级为可利用胚胎。
本研究的主要评价指标为优质胚胎率,其次为获卵数、PPOS方案后FET周期妊娠率等。各指标的计算方法如下:正常受精率=正常受精卵母细胞总数/成熟卵母细胞总数;优质胚胎率=优质胚胎总数/卵裂胚胎总数;种植率=种植胚胎总数/移植胚胎总数;周期临床妊娠率=临床妊娠周期数/移植周期数;流产率=流产例数/妊娠例数;异位妊娠率=异位妊娠例数/妊娠例数。
三、统计学分析

结 果
一、患者一般情况比较
共纳入患者42例,平均年龄(30.64±3.37)岁,平均不育年限(4.48±2.30)年,平均体重指数(BMI)(22.15±2.77)kg/m2。PPOS方案与长方案启动前基础FSH、LH、E2及AFC比较无显著性差异(P>0.05)(表1)。
二、长方案及PPOS方案促排卵情况比较
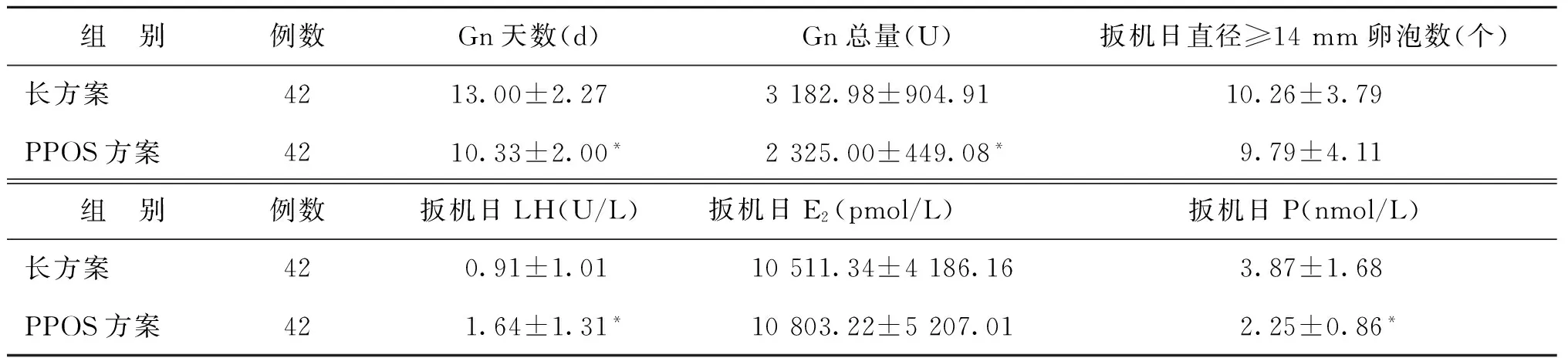
PPOS方案Gn天数、Gn总量显著低于长方案(P<0.05)。PPOS方案扳机日LH水平显著高于长方案组,P水平显著低于长方案组(P<0.05)。扳机日直径≥14 mm卵泡数、E2水平无显著性差异(P>0.05)(表2)。
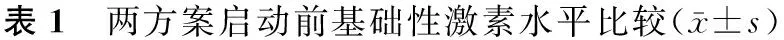

组别例数基础FSH(U/L)基础LH(U/L)基础E2(pmol/L)基础AFC(个)长方案427.00±1.784.15±1.68154.34±57.247.88±1.52PPOS方案426.90±1.914.14±1.68139.67±49.787.45±1.57

组 别例数Gn天数(d)Gn总量(U)扳机日直径≥14mm卵泡数(个)长方案4213.00±2.273182.98±904.9110.26±3.79PPOS方案4210.33±2.00*2325.00±449.08*9.79±4.11组 别例数扳机日LH(U/L)扳机日E2(pmol/L)扳机日P(nmol/L)长方案420.91±1.0110511.34±4186.163.87±1.68PPOS方案421.64±1.31*10803.22±5207.012.25±0.86*
注:与长方案比较,*P<0.05
三、长方案及PPOS方案获卵及胚胎发育情况比较
两种方案平均获卵数、成熟卵母细胞数、正常受精(2PN)数、可利用胚胎数比较无显著性差异(P>0.05),PPOS方案的正常受精率、优胚数、优胚率显著高于长方案(P<0.05)(表3)。
四、两组方案的临床结局比较
长方案时,1例患者因无胚胎可移植取消周期,共41个新鲜周期及16个FET周期,临床妊娠4个周期,3例单胎早期流产,1例异位妊娠终止妊娠。
PPOS方案中,均无早发LH峰及提前排卵出现,均取到卵母细胞,3例患者无可冷冻胚胎取消周期。39例患者行46个FET周期,22个周期妊娠,周期临床妊娠率47.83%,种植率24.74%,均显著高于长方案(P<0.05)。3例单胎早孕自然流产,流产率显著低于长方案(P<0.05);余19例中8例分娩,双胎2例,单胎6例;出生婴儿10名,男婴4名,女婴6名,随访新生儿状况均健康;至本文撰写时,余11例患者仍在继续妊娠中。PPOS方案中无异位妊娠发生(表4)。


组 别例数获卵数(个)MⅡ卵母细胞数(个)2PN数(个)可用胚胎数(个)长方案429.62±3.848.33±3.996.10±3.124.19±2.10PPOS方案428.79±4.227.93±4.016.05±3.365.10±2.99组 别例数优胚数(个)正常受精率(%)优胚率(%)长方案422.79±1.6563.75±15.7748.48±22.53PPOS方案423.62±1.97*71.82±17.64*62.21±24.04*
注:与长方案比较,*P<0.05

表4 长方案及PPOS方案临床结局比较 [n(%)]
注:与长方案比较,*P<0.05
讨 论
目前卵巢正常反应患者的定义尚无统一共识或指南,一般指年轻、单纯输卵管性因素和/或男性因素不育、卵巢内卵母细胞数目及质量较好、药物刺激可有较好卵巢反应性的患者,也为标准患者[2]。目前临床常用卵巢储备预测因子,如抗苗勒管激素(AMH)、AFC、基础FSH水平,预测卵巢反应性及确定药物剂量选择[3],这些患者控制性卵巢刺激(COS)的目标是获得一定数量(5~15个)高质量卵母细胞以达到最佳的妊娠结局[4]。GnRH-a长方案具有较好的抑制内源性LH峰、卵泡发育同步化、周期取消率低等优点,临床应用广泛、成熟。目前国内推荐卵巢正常反应人群首选GnRH-a降调节长方案,临床妊娠率可达50%左右,大多数患者可获得较满意的卵巢反应和临床妊娠率[5]。
但在临床治疗中,也可以见到一些标准患者通过常规治疗,所得胚胎质量欠佳,不能获得如期的临床妊娠。这些患者如何选择下一周期治疗方案,目前没有统一标准。相对来说卵巢正常反应人群可选择的促排卵方案比较多,可以根据患者病史、前一周期用药、卵泡生长、性激素变化、卵母细胞成熟度、受精及胚胎情况等,进行综合分析,并结合本中心治疗常规,再次选择促排卵方案和药物。可以再尝试减低GnRH-a剂量的长方案,或改用其它促排卵方案,如拮抗剂方案[6]、微刺激方案[7],总体目标为改善胚胎质量,获得较好的妊娠结局。
基于对卵泡波等基础内分泌理论的新认识[8],以及胚胎冷冻移植策略和技术的发展[9],近几年COS方案有了许多新进展,越来越趋向于多样化及个体化。为了克服GnRH-a降调节带来的卵巢过度抑制、Gn用量大、卵巢过度刺激综合征(OHSS)风险高等弊端,非垂体降调节方案的应用逐渐增多。在前期微刺激、温和刺激和黄体期促排卵方案应用的基础上[10],Kuang等[11]发现在一定雌激素基础上,孕激素抗正反馈机制可以抑制内源LH峰,并将这种早卵泡期持续应用孕激素抑制内源性LH峰结合Gn促排卵的方案定义为PPOS方案[11]。其后在尝试卵巢储备功能正常[1]、PCOS高反应[12]、卵巢储备功能下降[13]患者的应用中,均取得了良好临床妊娠结局。PPOS方案简单、方便、费用低,对出生子代的随访也肯定了其临床安全性[14]。但能否作为一种常规促排卵方案还有待临床应用验证。
本研究为回顾性自身对照研究,对卵巢正常反应、使用长方案促排卵后未获成功的患者,选择非垂体降调节的PPOS方案为第二周期治疗方案,自身对照前后两个周期的促排卵情况,发现PPOS方案的平均获卵数、MⅡ卵母细胞数、正常受精数、可利用胚胎数与长方案相当,但正常受精率及优质胚胎率显著高于长方案(P<0.05),提示PPOS方案可能改善了这些患者促排卵的胚胎质量。PPOS方案的Gn时间及剂量均显著低于长方案,促排卵过程中的LH水平显著高于长方案,P水平显著低于长方案(P均<0.05),考虑到这些患者前一周期胚胎质量欠佳,可能与GnRH-a降调节出现垂体过度抑制,相应Gn时间、剂量增大,影响卵母细胞质量,进而导致胚胎质量下降有关[15],同时伴随促排卵过程中P水平的升高,内膜同步性受到影响[16],也可能是长方案新鲜周期移植妊娠率降低的原因。PPOS方案中相对更高一些的LH水平或许更有利于这些患者获得优质胚胎[17]。PPOS方案后FET 的周期临床妊娠率为47.83%,种植率为24.74%,较前一周期有明显改善(P<0.05),流产率为13.64%,且已有8名患者分娩,出生10例健康婴儿,也证实PPOS方案可获得较好的临床妊娠结局,但因病例数较少,存在一定的局限性,后期需要扩大样本量进一步探讨验证。
PPOS方案因卵泡期使用MPA,使子宫内膜过早受到孕激素影响,胚胎与内膜发育不同步,因此新鲜周期不适宜胚胎移植,需全胚冷冻后行FET,这样就会出现延长患者治疗时间、增加胚胎冷冻费用,以及受到冷冻技术制约等临床问题[18]。另外,MPA是一种人工合成的孕激素,临床使用的安全性也有待进一步研究。目前,PPOS方案还是主要应用于高龄、卵巢低反应患者,其可以改善获卵数、减少周期取消率及医疗费用[19],在高反应人群应用的优势是降低OHSS发生率[12]。
综上所述,对于前一周期长方案促排卵未获成功的卵巢正常反应患者,使用PPOS方案可以改善胚胎质量及临床妊娠结局,PPOS方案可以作为这些患者下一周期促排卵的备选方案,但后期仍需开展大样本的随机对照研究进一步证实PPOS方案的临床效果。
[1] 叶静,陈秋菊,匡延平.卵巢功能正常患者高孕激素状态下促排卵的内分泌特征及IVF/ICSI临床结局的研究[J].生殖与避孕,2015,35:393-400.
[2] 乔杰,马彩虹,刘嘉茵,等.辅助生殖促排卵药物治疗专家共识[J].生殖与避孕,2015,35:211-223.
[3] La Marca A,Ferraretti AP,Palermo R,et al.The use of ovarian reserve markers in IVF clinical practice: a national consensus[J].Gynecol Endocrinol,2016,32: 1-5.
[4] Briggs R,Kovacs G,MacLachlan V,et al.Can you ever collect too many oocytes?[J].Hum Reprod,2015,30:81-87.
[5] Siristatidis CS,Gibreel A,Basios G,et al.Gonadotrophin-releasing hormone agonist protocols for pituitary suppression in assisted reproduction[DB].Chochrane Database Syst Rev,2015,(11): CD006919.doi: 10.1002/14651858.
[6] Alan B Copperman,Claudio Benadiva.关于GnRH拮抗剂最佳用法的文献综述[J].生殖医学杂志,2016,25:93-101.
[7] Zhang JJ,Merhi Z,Yang M,et al.Minimal stimulation IVF vs conventional IVF: a randomized controlled trial[J].Am J Obstet Gynecol,2016,214,96: e1-8.
[8] Baerwald AR,Adams GP,Pierson RA.Ovarian antral folliculogenesis during the human menstrual cycle: a review[J].Hum Reprod Update,2012,18:73-91.
[9] Wong KM,Mastenbroek S,Repping S.Cryopreservation of human embryos and its contribution to in vitro fertilization success rates[J].Fertil Steril,2014,102:19-26.
[10] Kuang Y,Hong Q,Chen Q,et al.Luteal-phase ovarian stimulation is feasible for producing competent oocytes in women undergoing in vitro fertilization/intracytoplasmic sperm injection treatment,with optimal pregnancy outcomes in frozen-thawed embryo transfer cycles[J].Fertil Steril,2014,101:105-111.
[11] Kuang Y,Chen Q,Fu Y,et al.Medroxyprogesterone acetate is an effective oral alternative for preventing premature luteinizing hormone surges in women undergoing controlled ovarian hyperstimulation for in vitro fertilization[J].Fertil Steril,2015,104:62-70.
[12] 叶红娟,陈秋菊,匡延平.多囊卵巢综合征患者在高孕激素超促排卵中LH与IVF/ICSI临床结局的相关性分析[J].生殖与避孕,2016,36:177-184.
[13] Kuang Y,Chen Q,Hong Q,et al.Double stimulations during the follicular and luteal phases of poor responders in IVF/ICSI programmes(Shanghai protocol)[J/OL].Reprod Biomed Online,2014,29:684-691.
[14] Chen H,Wang Y,Lyu Q,et al.Comparison of live-birth defects after luteal-phase ovarian stimulation vs.conventional ovarian stimulation for in vitro fertilization and vitrified embryo transfer cycles[J].Fertil Steril,2015,103:1194-1201.
[15] Johnson MH,Cohen J,Grudzenskas G.Accessible and affordable IVF: is Bob Edwards’ dream about to become reality?[J/OL].Reprod Biomed Online,2014,28:265-266.
[16] 王美仙,邵小光.超排卵中血清孕酮升高[J].生殖医学杂志,2015,24:811-815.
[17] 朱秀娴,章晓乐,傅永伦.孕激素抑制LH 峰在控制性卵巢刺激过程中的疗效观察[J].生殖与避孕,2015,35:384-388.
[18] 蔡学泳,徐阳.人类胚胎冷冻:真的到了由慢速向玻璃化方法过渡的时代?[J].生殖医学杂志,2012,21:288-292.
[19] 张锦,姜宏,倪丰,等.安宫黄体酮降调节在40 岁以上高龄妇女体外受精中的应用价值[J].现代妇产科进展,2016,25: 406-410.
[编辑:肖晓辉]
Progestin primed ovarian stimulation protocol in normal ovarian responders in IVF/ICSI: a self-controlled study
GUOLi-na*,JIAXin-zhuan,LYUCui-ting,WANGNan,DONGCui
DepartmentofReproductiveMedicine,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011
Objective:To explore the clinical effect of progestin primed ovarian stimulation(PPOS) protocol in normal ovarian responders who failed to get pregnancy in the first cycle IVF/ICSI with conventional long protocol.Methods:The data of 42 normal ovarian responders who failed to get pregnancy with long protocol at the first cycle,and then were administrated with PPOS protocol in the next cycle in our center from Jan.2014 to Nov.2015 were analyzed retrospectively.The levels of LH,E2,progesterone on the trigger day,duration and total dosage of gonadotropin(Gn) used,number of oocytes retrieved,MII oocytes,fertilization rate,high quality embryos rate,and implantation rate and clinical pregnancy rate were compared between the two groups.Results:The duration [(10.33±2.00) vs.(13.00±2.27)days] and total dosage of Gn used [(2 325.00±449.08)U vs.(3 182.98±904.91)U] with PPOS protocol were significantly less than those with long protocol(P<0.05).The LH levels [(1.64±1.31)U/L vs.(0.91±1.01) U/L] were significantly higher,and progesterone levels [(2.25±0.86)nmol/L vs.(3.87±1.68) nmol/L)] were significantly lower in PPOS protocol cycles compared with long protocol cycles(P<0.05).Although the number of oocytes retrieved,MII oocytes,2PN embryos,available embryo were not significantly different(P>0.05),the fertilization rate [(71.82±17.64)% vs.(63.75±15.77)%] and high quality embryos number [(3.62±1.97)vs.(2.79±1.65)] and rate [(62.21±24.04)% vs.(48.48±22.53)%] were significantly increased in PPOS protocol cycles(P<0.05).The clinical pregnancy rate(47.83% vs.7.02%) and implantation rate(24.74% vs.3.64%) were significantly improved in the FET cycles with PPOS protocol(P<0.05).Conclusions:PPOS protocol can provide better clinical outcome for the patients with ovarian normal response but failed to get pregnancy with long protocol in IVF/ICSI.It provides a new option for ovulation induction.
Normal ovarian responder; Long protocol; Progestin; Ovarian stimulation; IVF-ET
10.3969/j.issn.1004-3845.2017.02.005
2016-07-09;
2016-09-09
郭丽娜,女,河北栾城人,硕士,副主任医师,生殖医学专业.(*
,Email:sjzguolina@163.com)
