氧化应激相关基因Nme5在小鼠隐睾中参与生精细胞凋亡*
2017-03-02贾苗苗杨梦月尹丝璐
贾苗苗,杨梦月,尹丝璐,刘 刚
中南大学基础医学院生殖与干细胞工程研究所,长沙 410013
氧化应激相关基因Nme5在小鼠隐睾中参与生精细胞凋亡*
贾苗苗,杨梦月,尹丝璐,刘 刚△
中南大学基础医学院生殖与干细胞工程研究所,长沙 410013
目的 观察氧化应激相关基因Nme5在隐睾中的表达变化,探讨其在生精细胞凋亡中的作用。方法 建立单侧隐睾小鼠模型,采用TUNEL结合形态学观察确认小鼠隐睾模型是否建立成功并分析生精细胞凋亡情况。采用Real-time PCR、Western blot以及免疫组化分析隐睾手术后第1、2、3、4、5、6、9和15天与正常侧相比隐睾侧氧化应激相关基因Nme5 mRNA和蛋白表达情况。结果 免疫组化结果显示正常睾丸组织中,Nme5在生精上皮周期的Ⅱ~Ⅻ阶段均表达于粗线期初级精母细胞、圆形精子以及长形精子中;TUNEL结合形态学观察表明小鼠隐睾模型构建成功;Real-time PCR结果显示术后第4天Nme5 mRNA表达量轻微上升,第6天显著下降;Western blot结果显示术后第4天Nme5蛋白开始下降,至第9天急剧降低;免疫组化结果显示术后第4~6天隐睾侧Nme5在多核巨细胞中表达上调。结论 正常睾丸组织中Nme5在粗线期初级精母细胞、圆形精子以及长形精子中都有表达,参与了从减数分裂到精子变形的全部过程,在精子发生中起重要作用。隐睾状态下Nme5在新生圆形精子和由退行性圆形精子细胞组成的多核巨细胞中表达上调,可能通过调控氧化应激相关基因Gpx5来调控圆形精子细胞凋亡。
隐睾; Nme5; 凋亡
在哺乳动物中精子发生需要适宜的温度,隐睾和其他高温作用可引发氧化应激损伤从而导致生精细胞凋亡[1]。Nme5(NME/NM23 family member 5)作为一种氧化应激相关基因特异性表达于小鼠睾丸组织中,参与精子发生[2]。在生理状态下Nme5通过调节包括Gpx5在内的抗氧化物酶水平保护长形以及圆形精子细胞免受氧化应激损伤[3]。本实验通过手术建立小鼠隐睾模型,观察在术后不同天数中Nme5的表达变化,探讨其参与隐睾生精细胞凋亡的可能机制。
1 材料与方法
1.1 主要试剂
Nme5兔抗鼠多克隆抗体(Sigma公司),β-actin鼠抗人单克隆抗体(Sigma公司),PBS,SP Kit-0017 DAB染色液(链霉菌-生物素法,福州迈新生物技术有限公司)。
1.2 动物及处理
8周龄雄性BALB/C小鼠48只,行单侧隐睾手术。具体方法为:4%水合氯醛麻醉,将右侧睾丸推入腹腔后缝扎右侧腹股沟管,左侧不做任何处理,作为对照。所有小鼠均购自斯莱克实验动物有限公司(长沙,中国),室内温度(23±2)℃;光照周期12 h∶12 h(7:00~19:00光照)。
1.3 TUNEL法检测
采用TUNEL法检测生精细胞凋亡。石蜡切片常规脱蜡水化后PBS清洗3次,其余操作按试剂盒说明书进行。阴性对照未加末端转移酶。光镜下胞核着棕黄色者为凋亡阳性细胞,每个睾丸组织切片选取12个曲细精管断面(每个小鼠生精上皮阶段随机选取1个曲细精管断面),计算平均阳性细胞百分率即为凋亡指数(apoptosis index,AI)。
1.4 荧光定量PCR检测Nme5 mRNA相对表达量
按Trizol试剂盒(Invitrogen公司)说明书提取睾丸总RNA,取1.5 μg总RNA按照逆转录试剂盒步骤(Roche公司)反转录成cDNA。内参基因为甘油醛-3-磷酸脱氢酶(GAPDH)。引物由上海生工公司合成,Nme5上游引物:5′-CAGTTTAGTAGCCAAGGAG-3′,下游引物:5′-ATGGGTTCAATAATCACG-3′,扩增产物为150 bp;GAPDH上游引物:5′-GGTTGTCTCCTGCGACTTCAACAGC-3′,下游引物:5′-CGAGTTGGGATAGGGCCTCTCTTGC-3′,扩增产物为231 bp。按SYBR Green实时荧光定量PCR检测试剂盒(Roche公司)说明书设定反应程序:95℃、15 s预变性,59℃、15 s,72℃、1 min,共40个循环。mRNA相对表达水平分析采用2-ΔΔCt相对定量法;每组样本设3个复孔,结果按照2-ΔΔCt取均值,计算与内参GAPDH比较的相对表达强度。
1.5 免疫印迹检测Nme5蛋白相对表达量
加RIPA裂解液,电动匀浆机提取睾丸总蛋白。BSA法分光光度计测定总蛋白浓度,加入5×上样缓冲液,100 ℃煮沸变性10 min,储存于-20℃。质量分数为12%的丙烯酰胺分离胶,恒压100 V、90 min分离蛋白,总蛋白上样量为40 μg检测Nme5蛋白相对表达水平,内参为β-actin蛋白。采用半干电转仪转膜,恒流转膜26 min。5%脱脂奶粉溶液封闭2 h,一抗(Nme5和β-actin稀释体积比分别为1∶100与1∶1 000)4℃孵育过夜。TBST洗脱一抗,二抗(稀释体积比为1∶4 000)室温孵育1 h。TBST洗脱二抗后,化学发光试剂盒(ECL)显影。用Quantity One软件分析蛋白条带灰度值。
1.6 免疫组化染色
将睾丸组织常规石蜡包埋,制成厚3~4 μm的连续切片,切片经脱蜡、水化以及微波炉内抗原修复后,运用抗生素蛋白-生物素-过氧化物酶复合物法(SP法)进行酶组织化学染色(一抗:兔抗鼠多克隆抗体Nme5,按1∶100稀释),DAB显色,苏木精复染,0.1%盐酸乙醇分化,自来水返蓝。经梯度乙醇脱水干燥后用中性树脂封片。
1.7 统计学分析
2 结果
2.1 Nme5在成年小鼠睾丸组织中的表达模式
精子发生是一个循环过程,包含了生精细胞从精原干细胞到成熟精子的一系列发育阶段。在小鼠睾丸中精子发生的一个循环被叫做一个生精上皮周期。生精上皮周期根据生精细胞的发育阶段被分为12个阶段(StageⅠ-Ⅻ,图1A),每个阶段都含有特定种类和发育阶段的生精细胞,如图1B所示。我们通过免疫组化结合形态学观察Nme5在8周龄成年小鼠生精上皮周期中的表达规律。结果显示Nme5在生精周期第Ⅱ~Ⅻ阶段的粗线期(P)初级精母细胞,Ⅺ阶段的双线期(D)初级精母细胞,Ⅻ阶段的减数分裂细胞(M),Ⅰ~Ⅷ阶段的圆形精子细胞(S1-8),以及Ⅰ~Ⅻ阶段的长形精子(S9-16)中表达。因此Nme5在生精周期中的表达模式为从减数分裂间期的粗线期初级精母细胞开始到成熟精子结束(图1B)。
2.2 TUNEL检测隐睾细胞凋亡水平
TUNEL为晚期细胞凋亡检测方法,全称为末端脱氧核苷酸介导的dUTP缺口末端标记测定。检测原理为标记凋亡细胞断裂DNA的3’-OH末端,利用DAB显色系统显色。我们利用TUNEL凋亡检测隐睾手术后1、2、3、4、5、6、9以及15 d睾丸组织的细胞凋亡情况,结果如下。
2.2.1 凋亡指数的分析 TUNEL结果显示隐睾小鼠正常侧与隐睾侧都出现凋亡细胞,但隐睾侧凋亡细胞比例高于正常侧,并且随着隐睾天数增加隐睾侧生精细胞凋亡率显著增加。凋亡指数结果显示术后1 d正常侧凋亡指数为(0.10±0.06)%,隐睾侧凋亡指数为(2.80±0.28)%,高于正常侧,差异有统计学意义(P<0.05)。术后1~3 d隐睾侧凋亡指数没有明显变化,稳定在2.8%~3.9%之间,第4天显著上升为(15.6±1.91)%(P<0.05),第9天达到(44.0±1.08)%(P<0.05)。
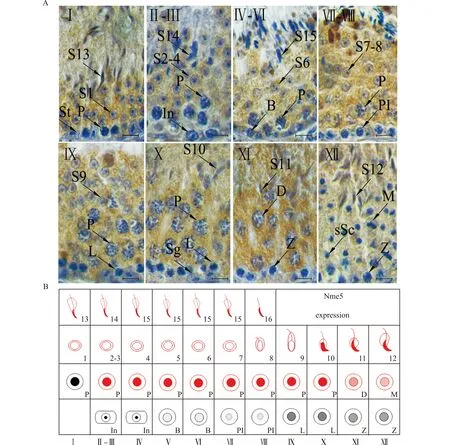
A:IHC检测不同生精阶段Nme5表达(×100);B:Nme5生精上皮周期表达模式图;支持细胞(St);精原细胞(Sg);细线前期精母细胞(PI);细线期初级精母细胞(L);粗线期初级精母细胞(P);偶线期初级精母细胞(Z);终变期初级精母细胞(D);减数分裂中的细胞(M);次级精母细胞(sSc);精子细胞的不同发生阶段(S1~16);中间型精原细胞(In);B型精原细胞(B);不同阶段精子细胞(1~16);Bar=10 μm图1 Nme5在成年小鼠生精上皮周期中的表达模式Fig.1 Expression pattern of Nme5 in seminiferous epithelium of adult mice at different stages of spermatogenesis
2.2.2 睾丸中凋亡细胞类型的分析 隐睾手术后处于不同发育阶段的生精细胞逐步发生凋亡,术后1~3 d隐睾侧只有少量生精上皮Ⅰ阶段的圆形精子和Ⅻ阶段的分裂期初级精母细胞发生凋亡(图2a~d)。术后4~6 d凋亡的生精细胞数目以及种类都明显增加,生精上皮Ⅰ~Ⅻ阶段都有大量圆形精子、长形精子以及初级精母细胞发生凋亡。术后第4天生精上皮Ⅵ~Ⅷ阶段的圆形精子出现退行性病变,相互融合形成多核巨细胞,但这些多核巨细胞并未出现凋亡阳性信号。术后第6天多核巨细胞数目增加并且出现凋亡阳性信号(图2e~f)。术后9~15 d生精细胞大量凋亡,生精小管管腔内未见圆形精子、长形精子和多核巨细胞,只剩余少量初级精母细胞、精原干细胞以及支持细胞(图2g~h)。
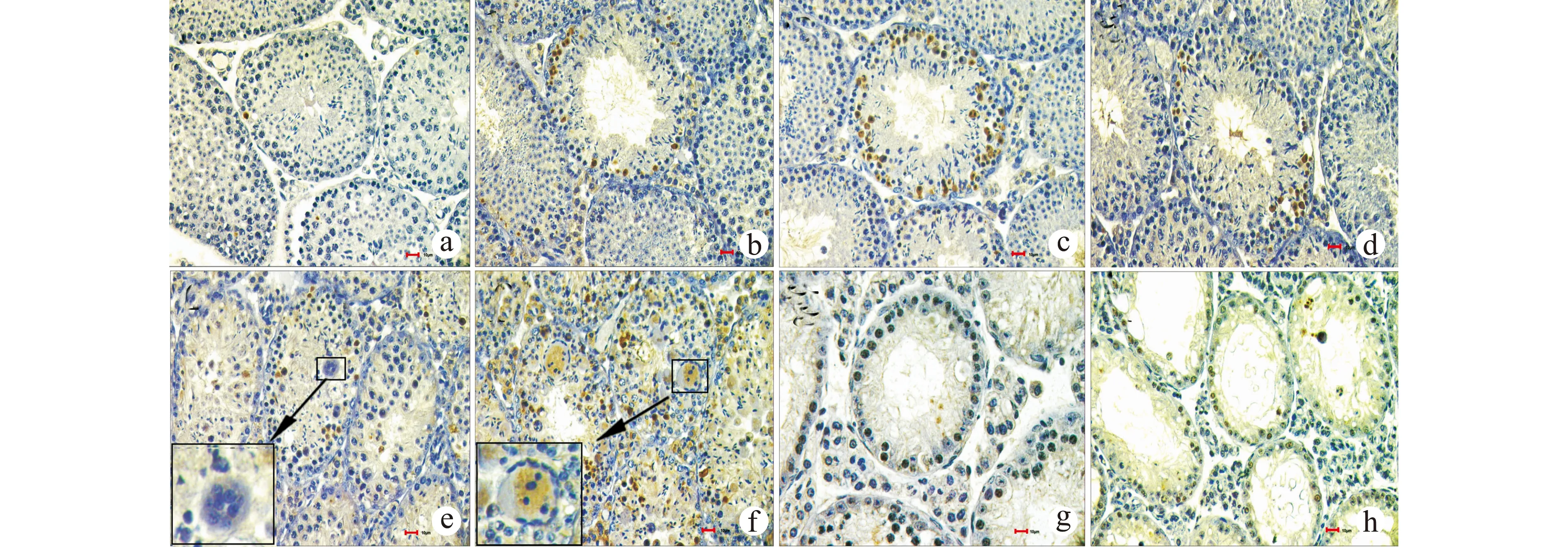
a:正常对照;b~h:隐睾手术后的不同时期,分别为术后1 、2 、3、4、6、9、15 d,箭头所示为多核巨细胞;Bar=10 μm图2 TUNEL凋亡检测隐睾小鼠睾丸组织Fig.2 Expression of NME5 in testes of mice with cryptorchidism by TUNEL
2.3 Nme5 mRNA在隐睾侧睾丸组织中的表达
选取隐睾手术后1、3、4、5、6、9和15 d小鼠每组5只,抽提正常侧与隐睾侧睾丸组织RNA,逆转录为cDNA。利用Real-time PCR检测相对正常侧,隐睾侧Nme5随着隐睾天数增加表达量的变化。结果显示术后第1天隐睾侧Nme5的mRNA表达量轻微上升,在第4天的时候达到最高值约为正常侧的1.6倍(P<0.05)。术后第5天Nme5的mRNA表达量开始下降约为正常侧的0.7倍,在第9天的时候急剧下降变为正常侧的0.04倍(P<0.01)(图3)。
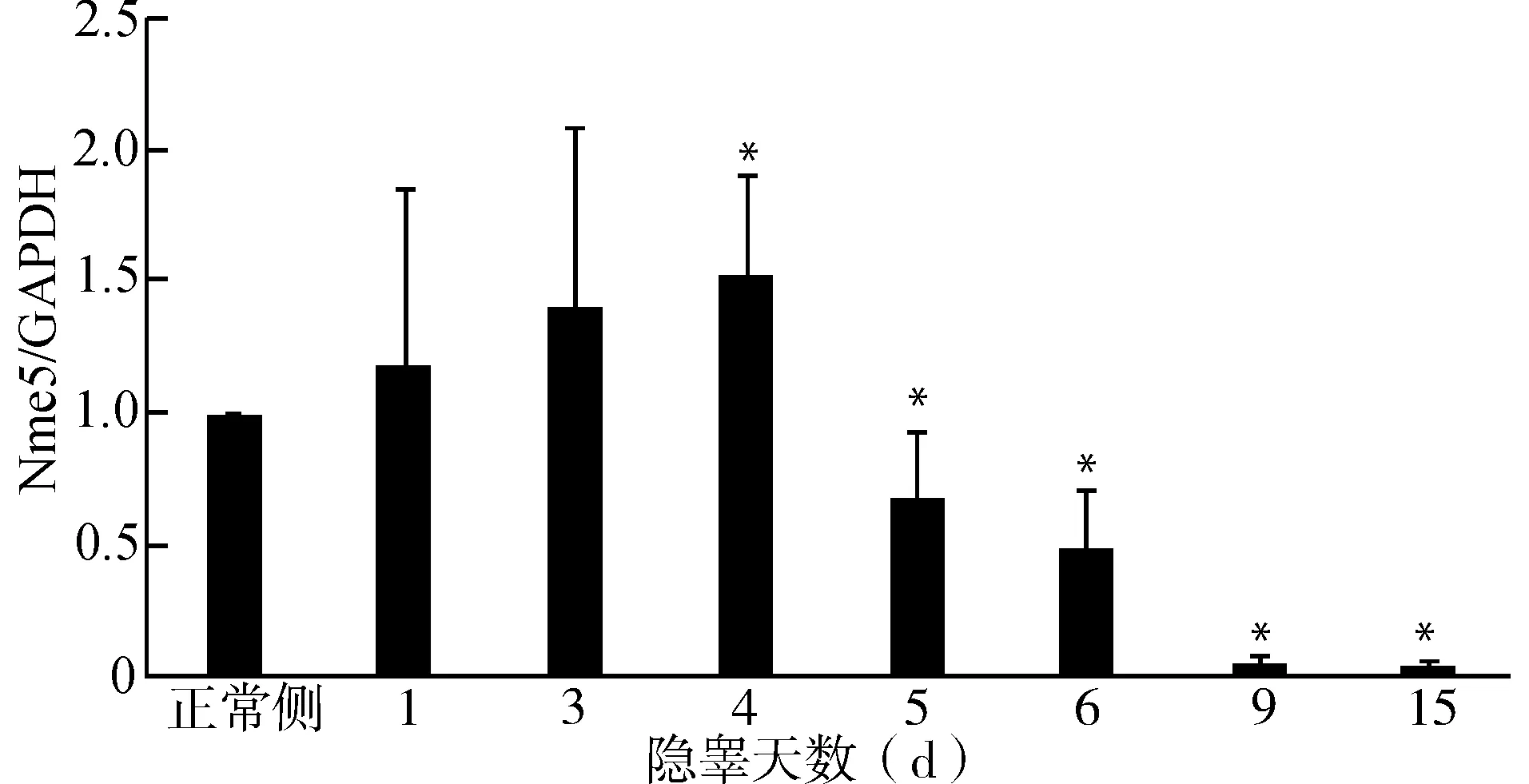
与正常侧比较,*P<0.05;n=5图3 Real-time PCR检测单侧隐睾手术后隐睾侧Nme5的mRNA相对正常侧表达量的变化Fig.3 Expression of Nme5 mRNA in testes of mice with unilateral cryptorchid by quantitative real-time PCR
2.4 Nme5蛋白在隐睾侧睾丸组织中的表达
为了研究Nme5在隐睾中的蛋白表达,取隐睾手术后1、3、4、5、6、9以及15 d小鼠每组3只,抽提蛋白利用Western blot技术检测隐睾侧Nme5的蛋白表达量随着隐睾天数的变化。结果显示隐睾手术后1~3 d与正常侧相比隐睾侧Nme5的蛋白表达量没有明显变化,一直到术后第4天显著下降为正常侧的0.4倍,差异有统计学意义(P<0.05)。术后第15天隐睾侧Nme5的蛋白表达量急剧下降,为正常侧的0.07倍(图4)。
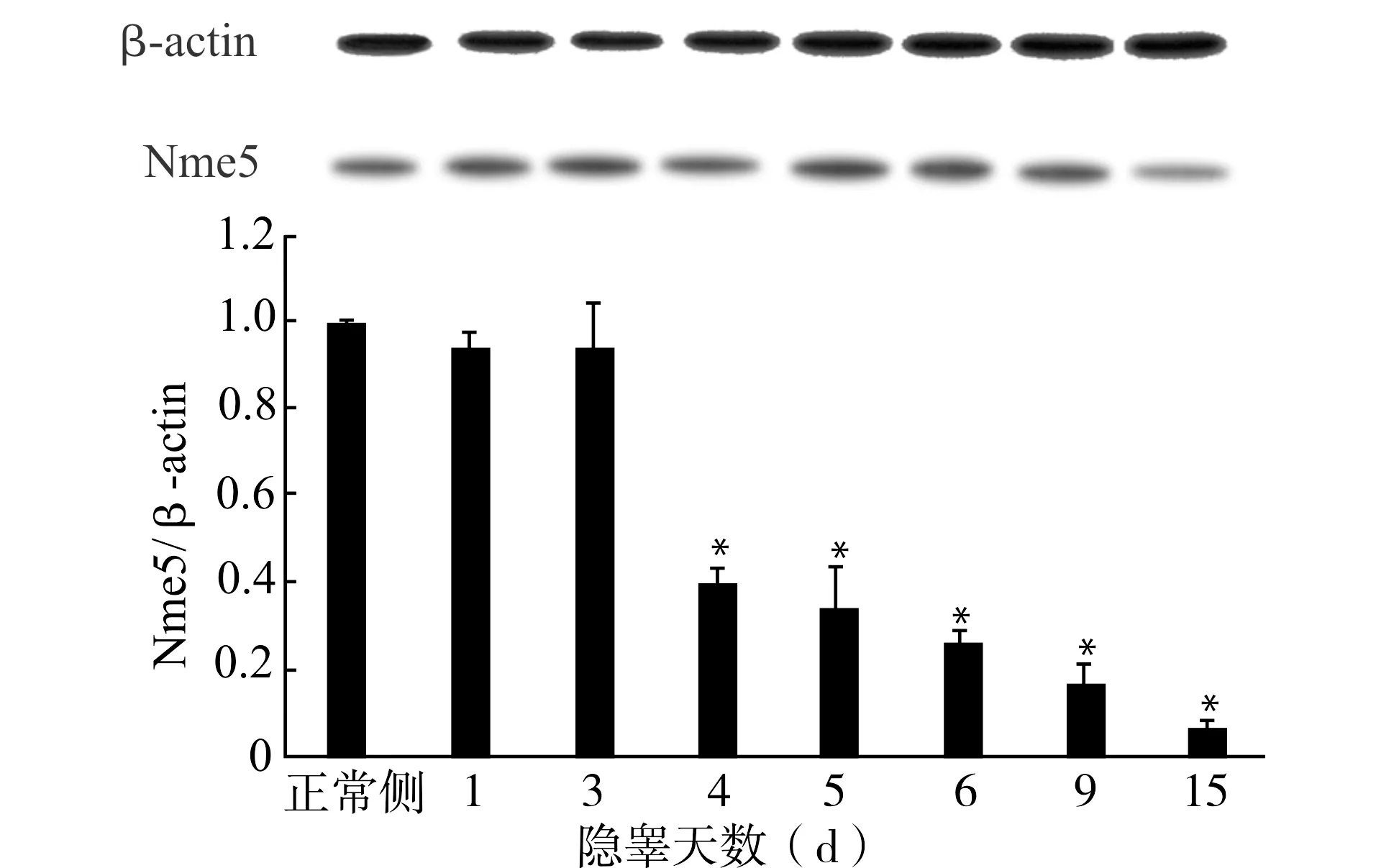
与正常侧比较,*P<0.05;n=3图4 Western blot检测单侧隐睾手术后Nme5蛋白表达量的变化Fig.4 Expression of Nme5 protein in testes of mice with unilateral cryptorchid by Western blotting
2.5 Nme5蛋白在隐睾手术后不同生精细胞中的表达
为了明确隐睾手术后生精细胞中Nme5蛋白的表达量以及分布是否发生变化,我们利用IHC技术进一步检测了隐睾手术后1、2、3、4、6、9和15 d Nme5蛋白在睾丸中的表达模式。
术后1~3 d隐睾侧生精细胞凋亡并不明显,只有部分Ⅰ阶段的圆形精子和Ⅻ阶段的分裂期初级精母细胞出现凋亡,凋亡指数维持在2.8%~3.9%。这一时期的免疫组化结果显示:与正常侧相比隐睾侧Nme5的分布发生显著变化,隐睾侧Nme5则在Ⅰ阶段的圆形精子和Ⅻ阶段的分裂期初级精母细胞中均表达增强(图5a~d)。
术后4~6 d随着隐睾天数增加,生精小管管腔内凋亡的生精细胞逐渐增加,凋亡指数从3.9%上升到15.6%,生精上皮Ⅵ~Ⅷ阶段的生精小管管腔内出现多核巨细胞。术后4 d Nme5蛋白在还未发生凋亡的多核巨细胞中表达增强(图5e~f),并持续强表达于术后第6天的凋亡的多核巨细胞中。
术后9~15 d生精细胞大量凋亡,Nme5在初级精母细胞中有微弱表达(图5g~h)。
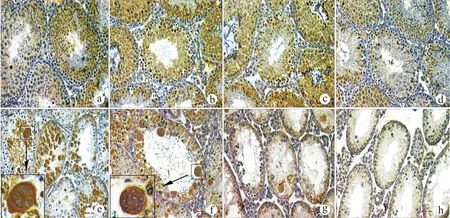
a:正常对照;b~h:隐睾手术后的不同时期,分别为1、2、3、4、6、9、15 d,箭头所示为多核巨细胞;Bar=10 μm图5 IHC检测不同时期隐睾小鼠睾丸组织Nme5的表达Fig.5 Immunolocalization of Nme5 in testes after cryptorchidism at different stages
3 讨论
3.1 Nme5在小鼠生精细胞中的定位
精子发生是一个复杂的过程,主要包括3个阶段:有丝分裂,即精原干细胞的自我增殖;减数分裂,即初级精母细胞经过细线期、偶线期、粗线期、双线期、次级精母细胞最终形成圆形精子;精子形成,即圆形精子变形为长形精子并逐渐释放入生精小管管腔最终排出体外[4]。有文献[1]报道,Nme5在生精细胞中的表达具有阶段和生精细胞特异性。他们观察到在生精上皮Ⅻ阶段的晚期精子细胞里Nme5蛋白的量要高于其在其他类型的生精细胞中的表达量。但在本实验中Nme5在小鼠睾丸中的表达没有明显的阶段或生精细胞特异性。Nme5从减数分裂间期开始表达,到精子变形结束,最后定位于成熟精子尾部。这种表达模式表明Nme5可能参与生精细胞减数分裂以及精子变形这两个重要的精子发生过程,并与成熟精子的运动密切相关。
3.2 Nme5参与热应激状态下的生精细胞凋亡
氧化应激导致的细胞DNA损伤被认为是隐睾中引起生精细胞凋亡的主要原因[1]。超氧化物歧化酶1(superoxided ismutasel,SOD1)是生物体内最主要的抗氧化酶之一,敲除SOD1基因后,小鼠生精细胞内氧化应激反应增加,对热损伤的抵抗能力下降,在对睾丸进行实验性高温作用后,凋亡的生精细胞数目明显增加[5]。Ahotupa与Peltola等[6-7]认为隐睾后生精细胞中脂质过氧化物明显增加,抗氧化物酶活力则有所降低,注射氧化酶抑制剂黄嘌呤可以减轻隐睾中生精细胞的凋亡。这些结果提示氧化应激反应参与了高温引发的生精细胞凋亡。
为了探究氧化应激相关基因Nme5是否参与隐睾状态下的生精细胞凋亡,以及参与了哪些发育阶段的生精细胞凋亡。本实验通过手术获得小鼠单侧隐睾模型,观察Nme5的mRNA以及蛋白在隐睾组织中的表达模式。
3.2.1 热休克状态凋亡指数和细胞类型 手术诱导隐睾后随着隐睾天数增加不同类型的生精细胞逐次发生凋亡。之前的相关研究结果显示在小鼠的隐睾中首先发生凋亡的生精细胞是初级精母细胞和圆形精子[8-10]。本实验中隐睾侧生精细胞凋亡指数从术后第1天起就明显增加,发生凋亡的细胞类型主要是生精上皮阶段Ⅰ的新生圆形精子和阶段Ⅻ的初级精母细胞,在术后1~3 d内生精细胞凋亡指数维持在2.8%~3.9%之间没有显著增加,凋亡的细胞类型也没有明显变化。但术后第4天生精细胞凋亡指数显著上升达到15.6%,发生凋亡的生精细胞类型也有所增加,包括生精上皮Ⅰ~Ⅻ阶段的圆形精子、长形精子以及初级精母细胞。这些结果显示不同类型的生精细胞对热刺激的耐受性并不完全相同,新生圆形精子和处于分裂期的初级精母细胞对热刺激最为敏感,其他类型的生精细胞对高温的耐受性要好于这2种细胞。但刘防等[11]发现在大鼠隐睾中最先发生凋亡的生精细胞是变形期的精子细胞,然后才是圆形精子和初级精母细胞。这表明不同类型的生精细胞对高温的耐受性在不同哺乳动物中有所不同。
3.2.2 Nme5 mRNA和蛋白的表达量变化 与正常侧相比隐睾侧Nme5的mRNA和蛋白的表达量在隐睾手术后1~3 d内没有明显变化,6 d时显著下降。这可能与隐睾侧的生精细胞在1~3 d内没有发生明显凋亡,而在第6天大量凋亡相关。1~3 d内生精细胞凋亡指数维持在2.8%~3.9%,凋亡细胞所占总细胞比例较少,所以尽管免疫组化结果显示Nme5蛋白分布发生变化,在凋亡细胞中表达上调,但是由于凋亡细胞占总细胞比例较少,隐睾侧Nme5的蛋白总量相对正常侧并没有发生明显改变。术后第6天生精细胞凋亡指数上升到24%,圆形精子和初级精母细胞大量凋亡,这些凋亡的生精细胞从生精小管管腔内脱落后被排出睾丸,最终导致隐睾侧与正常侧相比,表达Nme5基因的细胞比例显著下降。所以尽管部分生精细胞中Nme5呈强阳性表达,但与正常侧相比Nme5的总蛋白量呈下降趋势。
3.3 Nme5蛋白在不同类型生精细胞的表达变化
在不同的隐睾天数中Nme5的蛋白在圆形精子中的分布变化与圆形精子凋亡的情况相一致。隐睾初期1~3 d生精上皮Ⅰ阶段的新生圆形精子和Ⅻ阶段的初级精母细胞发生凋亡,Nme5在这2种细胞中表达增强。隐睾中期即隐睾手术后第4~6天生精上皮Ⅵ~Ⅷ阶段的退行性圆形精子相互融合形成多核巨细胞,Nme5在其中强表达。这些结果表明,Nme5可能与隐睾中高温引发的圆形精子凋亡相关,其机制可能与Nme5的抗氧化作用有关。
隐睾手术后高温导致生精细胞内氧化应激反应增加,为了保护生精细胞免受氧化应激导致的DNA损伤,大量的GPX、抗坏血酸以及维生素E等抗氧化物质聚集在凋亡的生精细胞中清除氧化应激反应产生的大量活性氧[12]。Gpx5作为其中的一种重要的抗氧化物质参与抑制活性氧诱导的生精细胞凋亡,而氧化应激相关基因Nme5则被认为通过调节抗氧化物质Gpx5来抑制Bax介导的生精细胞凋亡[13]。所以Nme5在隐睾圆形精子中的高表达很有可能是通过调节Gpx5在内的抗氧化物质水平来保护圆形精子免受氧化应激导致的DNA损伤,从而抑制隐睾状态下的圆形精子的凋亡。
综上所述,Nme5与正常的小鼠精子发生密切相关,参与了减数分裂以及精子变形这2个重要的精子发生过程。并且在高温引发的圆形精子凋亡过程中,Nme5可能通过调节Gpx5在内的圆形精子细胞内抗氧化物质水平来参与调控圆形精子细胞凋亡。同时以上结果也提示我们在隐睾中不同类型的生精细胞所参与的凋亡通路可能并不完全相同,进一步研究生精细胞凋亡的调控机制,将会对我们治疗由隐睾等因素导致的男性不育有重要意义。
[1] Hwang K C,Ok D W,Hong J C,et al.Cloning,sequencing,and characterization of the murine nm23-M5 gene during mouse spermatogenesis and spermiogenesis[J].Biochem Biophys Res Commun,2003,306(1):198-207.
[2] Jung K Y,Yon J M,Lin C,et al.Phospholipid hydroperoxide glutathione peroxidase is involved in the maintenance of male fertility under cryptorchidism in mice[J].Reprod Toxicol,2015,57(5):73-80.
[3] Lacombe M L,Milon L,Munier A,et al.The human Nm23/nucleoside diphosphate kinases[J].J Bioenerg Biomembr,2000,32(3):247-258.
[4] Bellve A R,Cavicchia J C,Millette C F.Spermatogenic cells of the prepuberal mouse:Isolation and morphologicalcharacterization[J].J Cell Biol,1977,74(1):68-85.
[5] Paul C,Murray A A,Spears N,et al.Asingle,mild,transient serotal heat stress causes DNA damage,subfertility and impairs formation of blastoeysts in mice[J].Reproduction,2008,136(1):73-84.
[6] Ahotupa M,Huhtaniemi I.Impaired detoxification of reactive oxygen and con-sequent oxidative stress in experimentally cryptorchid rat testis[J].Biol Reprod,1992,46(6):1114-1118.
[7] Peltola V,Huhtaniemi I,Ahotupa M.Abdominal position of the rat testis is associated with high level of lipid peroxidation[J].Biol Reprod,1995,53(5):1146-1150.
[8] Hou W,Hu J,Li Y,et al.Altered expression of NDRG2 in the testes of experimental rat model of cryptorchidism[J].Urology,2010,75(4):985-991.
[9] Ogi S,Tanji N,Yokoyama M,et al.Involvement of Fas in the apoptosis of mouse germ cells induced by experimental cryptorchidism[J].Urol Res,1998,26(1):17-21.
[10] Shikone T,Billig H,Hsueh A J.Experimentally induced cryptorchidism increases apoptosis in rat testis[J].Biol Reprod,1994,51(5):865-872.
[11] 刘防.大鼠实验性隐睾形态学观察及Hsfl、Hsf2和Tdag51对精母细胞凋亡的影响[D].北京:协和医学部.2011.
[12] Chaki S P,Misro M M,Ghosh D,et al.Apoptosis and cell removal in the cryptorchid rat testis[J].Apoptosis,2005,10(2):395-405.
[13] Choi Y J,Cho S K,Hwang K C,et al.Nm23 mediates round and elongated spermatid survival by regulating GPX-5 levels[J].FEBS Lett,2009,583(8):1292-1298.
(2016-09-21 收稿)
NME/NM23 Family Member 5 is Involved in Apoptosis of Germ Cells in Testis of Mice with Cryptorchidism
Jia Miaomiao,Yang Mengyue,Ying Siluetal
InstituteofReproductionandStemCellEngineering,SchoolofBasicMedicalScience,CentralSouthUniversity,Changsha410013,China
Objective We aimed to assess the functional significance of Nme5 in testis of mice with cryptorchidism.MethodsExperimental unilateral cryptorchidism mouse model was established.Whether the model was established successfully was confirmed by DNA end labeling(TUNEL)and morphological observation,and apoptotic characteristics of spermatogenic cells were analyzed.The expression levels of Nme5 mRNA and protein were spatiotemporally analyzed in testes 1,2,3,4,5,6,9 and 15 day(s)after modeling in mice by quantitative real-time PCR and Western blotting.Immunohistochemical analysis was used to detect changes of Nme5 in response to heat-stress from cryptorchidism.Results Morphological studies have shown that at the normal side of testes Nme5 are localized in primary spermatocytes and spermatids at stage Ⅱ~Ⅻ of eminiferous tubules.Under cryptorchidism,Nme5 mRNA was slightly increased at the 4th day and significantly decreased at the 6th day while its protein was slightly reduced in testes at the 4th day and greatly reduced at the 9th day.However,immunohistochemical staining showed that Nme5 protein was up-regulated in multinucleated giant cells and degenerative spermatids in testes at the 4-6th day.Conclusion Nme5 is expressed in first spermatocyte,round spermatid and long sperm at pachytene stage,is involved in all the process from meiosis to sperm deformation,and plays an important role in spermatogenesis.In mice with cryptorchidism,Nme5 is up-regulated in multinuclear giant cells(neonatal round sperm and degenerative round sperm cells);apoptosis of round sperm cells is regulated probably through regulating oxidative stress related gene Gpx5.
cryptorchidism; Nme5; apoptosis
*湖南省自然科学基金资助项目(No.13JJ2007)
贾苗苗,女,1991年生,硕士研究生,E-mail:826639890@qq.com
△通讯作者,Corresponding author,E-mail:616778747@qq.com
R697
10.3870/j.issn.1672-0741.2017.01.008
