hucMSCs源性外泌体对单核巨噬细胞生长及炎性因子IL-8、IL-12分泌水平的影响*
2017-03-02徐正阳李玉云
丁 娟,徐正阳,柴 烁,王 珏,张 强△,李玉云
1安徽省蚌埠医学院临床检验诊断学实验中心,蚌埠 233000 2安徽省蚌埠医学院第一附属医院检验科,蚌埠 233004 3安徽省蚌埠医学院医学检验系,蚌埠 233000
hucMSCs源性外泌体对单核巨噬细胞生长及炎性因子IL-8、IL-12分泌水平的影响*
丁 娟1,2,徐正阳1,柴 烁1,王 珏2,张 强2△,李玉云3△
1安徽省蚌埠医学院临床检验诊断学实验中心,蚌埠 2330002安徽省蚌埠医学院第一附属医院检验科,蚌埠 2330043安徽省蚌埠医学院医学检验系,蚌埠 233000
目的 初步探讨人脐带间充质干细胞(hucMSCs)来源的外泌体(exosome)对单核巨噬细胞生长及炎性因子IL-8、IL-12分泌的影响。方法 将hucMSCs来源的exosome与单核巨噬细胞(THP-1细胞株)共培养,利用MTT法和Annexin V-FIFC/PI双染法检测共培养后THP-1细胞的增殖及凋亡情况;PCR法和ELISA法分别检测THP-1细胞炎性因子IL-8、IL-12的mRNA及蛋白的表达情况。结果 MTT及流式细胞术检测结果显示hucMSCs来源的exosome对THP-1细胞具有促进增殖和抑制凋亡的作用,PCR及ELISA方法结果显示,exosome能够降低THP-1细胞IL-8、IL-12 mRNA及蛋白的表达水平。结论 hucMSCs源性exosome能够影响单核巨噬细胞的生长,并降低炎性因子IL-8、IL-12的分泌水平,而这可能是微环境中间充质干细胞调控单核巨噬细胞的机制之一。
炎症微环境; 单核巨噬细胞; 人脐带间充质干细胞; 外泌体
炎症反应是机体对致病因子及其所致损害作用产生的一种组织损伤及修复的过程,其本质是机体的相关炎性细胞(如免疫细胞及其他组织细胞)及其所分泌的细胞因子共同发挥的作用。适度的炎症免疫反应利于损伤部位的修复,然而过度反应则是许多系统性疾病的病理基础,特别是慢性炎症反应甚至会导致组织上皮细胞的恶性转化,进而形成肿瘤[1-2]。这也是近年来人们逐渐重视对可能引起肿瘤发生的炎症微环境进行研究的重要原因。炎症的最终转归取决于微环境中各种成分的相互作用,其中巨噬细胞及间充质干细胞(MSCs)之间的交流作用不容小视。然而,在正常情况或病理状态下,这种现象产生机制仍不十分清楚或仍存在许多争议,对它们的相互作用,特别是MSCs如何对巨噬细胞调控知之甚少。而外泌体(exosome)[3-4]是细胞以主动的方式向细胞外分泌的囊泡样小体,其包裹一定的生物活性物质,直径在30~100 nm之间,具有多种功能[5-6],在细胞与靶细胞或细胞与微环境之间扮演重要的信息传递的角色。因此,其也可能是间充质干细胞与单核细胞之间相互作用的方式之一。本研究主要通过人脐带间充质干细胞(hucMSCs)来源的exosome对THP-1单核巨噬细胞株的作用,来初步探讨hucMSCs对巨噬细胞相关炎性因子分泌功能的影响。
1 材料与方法
1.1 主要试剂与仪器
hucMSCs由本实验室分离培养(脐带组织来源于健康足月产妇,由蚌埠医学院第一附属医院妇产科提供);THP-1细胞株(蚌埠医学院免疫学实验室惠赠);DMEM/F12培养液(Hyclone公司);胎牛血清(Clark公司);MTT、DMSO(均购自Sigma公司);Annexin V-FIFC/PI(南京凯基生物科技发展有限公司);Trizol和逆转录试剂盒(均购自Thermo Fisher Scientific公司);荧光定量试剂盒(Clontech Laboratories公司);引物由南京金斯瑞生物科技有限公司合成,见表1;贝克曼高速、超速离心机;Eppendorf低速离心机;7500荧光定量PCR仪(英潍捷基贸易有限公司)
1.2 实验方法
1.2.1 原代hucMSCs获取及其exosome的提取采用组织块培养方法获得间充质干细胞。本实验室已经建立起成熟的间充质干细胞培养及鉴定方法[7]。收集hucMSCs 3代到6代的上清,采用多次离心的方法获取exosome[8]。具体步骤简述如下:先4 ℃,300 g低速离心15 min,去除死细胞,收集上清在4 ℃,16 500 g离心30 min,进一步去除细胞碎片及大分子蛋白,收集上清通过0.22 μm除菌滤器后,4 ℃,1.2×105g条件下超速离心70 min,弃上清,得到exosome,重悬于PBS或无血清培养液中,用BCA蛋白测定法检测exosome蛋白浓度,并调整浓度为0.1 μg/mL,-20℃或-80℃保存备用。
1.2.2 细胞培养 使用10%FBS的DMEM/F12培养液,在37℃、5% CO2饱和湿度培养箱中培养hucMSCs及THP-1细胞株。待hucMSCs细胞密度达到80%~90%,进行1∶3传代培养。THP-1细胞采用离心全量换液或半量换液,2~3次换液后传代。选择对数生长期的细胞进行各项实验。
1.2.3 MTT法检测hucMSCs来源的exosome与THP-1细胞共培养后细胞的增殖 THP-1细胞以102个/μL的浓度,毎孔100 μL接种于96孔板,实验设置对照组及实验组,实验组加入exosome,每组设置4个复孔。置于37 ℃、5% CO2的饱和湿度培养箱中培养48~72 h后,毎孔加入5 g/L的MTT 20 μL,继续培养3 h左右,离心后弃除上清,毎孔加DMSO 150 μL,振荡5 min左右,490 nm波长处检测吸光度值(A)。
1.2.4 流式细胞术检测细胞凋亡 hucMSCs与THP-1细胞共培养后,采用Annexin V-FIFC/PI双染法,进行凋亡分析,具体步骤参考说明书。同样的方法检测hucMSCs来源的exosome作用THP-1细胞48 h后细胞的凋亡。
1.2.5普通PCR半定量检测IL-8、IL-12的表达及实时荧光定量PCR进一步检测IL-8、IL-12 mRNA表达水平的变化 利用Trizol法提取共培养后的THP-1细胞及对照组(未经任何处理)的THP-1细胞的总RNA,紫外分光光度计检测RNA浓度后,每组取约2 μg的RNA,逆转录合成cDNA第一链。①普通PCR半定量检测:94℃预变性3 min;94℃变性30 s,退火30 s,72℃延伸1 min,共30个循环;然后72℃,5 min终止延伸,反应完成后取5 μL PCR产物,加入1.5%琼脂糖凝胶中进行电泳。使用Bio-Rad凝胶成像仪检测条带并进行灰度分析。计算各组IL-8、IL-12的相对表达量。②荧光实时定量PCR反应:引物、大小和反应条件见表1。按SYBRP remixExTaq(Perfect Real Time)试剂盒要求进行实时荧光定量PCR反应,反应体系总体积为20 μL。反应条件:95℃预变性30 s,95℃变性15 s,各目的基因相应退火温度退火30 s,72℃延伸34 s,共40个循环。每组设置3个复孔,计算每组IL-8/GAPDH和IL-12/GAPDH比值,取3次平均值比较对照组和实验组2种基因的表达水平。
1.2.6 ELISA法检测上清液中IL-8、IL-12的蛋白含量 收集正常THP-1细胞培养上清液和hucMSCs来源的exosome作用THP-1细胞48 h后的上清液进行实验,具体操作步骤参照IL-8、IL-12的ELISA试剂盒说明书。
1.3 统计学分析

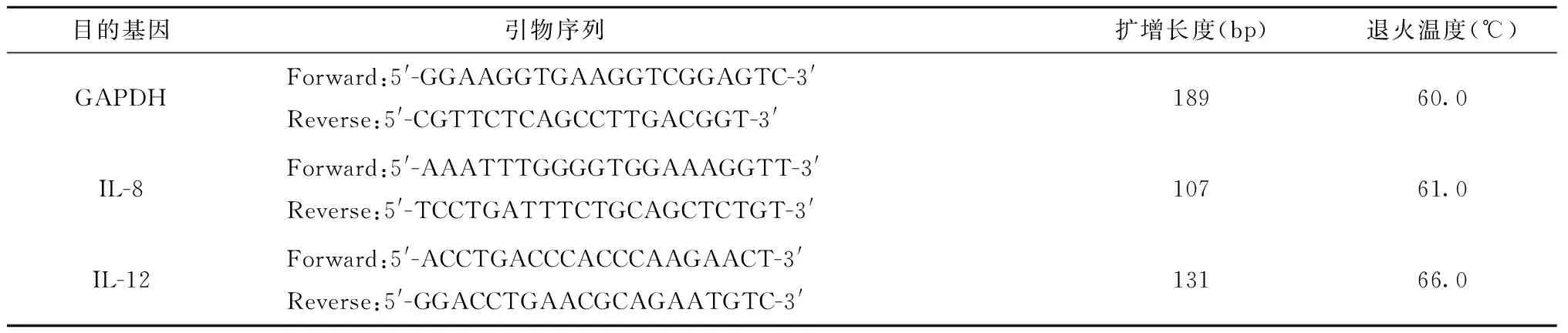
表1 GAPDH、IL-8、IL-12引物序列及退火温度Table 1 Primer sequences and the annealing temperature of GAPDH,IL-8 and IL-12
2 结果
2.1 hucMSCs的原代培养及形态观察
采用组织块培养7~10 d左右,低倍显微镜观察可见,成纤维样细胞从组织块边缘爬出开始呈星点状(如图1A),继续培养2周左右,可消化传代,细胞形态呈长梭状(如图1B)。
2.2 hucMSCs源性的exosome对THP-1细胞增殖的影响
exosome与THP-1细胞共培养,实验设置对照组与实验组,实验组分4组,分别加入浓度为0.1 μg/mL的exosome 10、20、30、45 μL,共培养48~72 h,MTT法检测结果显示,exosome对THP-1细胞的增殖有促进作用,而且与剂量有关。与对照组相比较,随着exosome剂量的增加,THP-1细胞的增殖能力逐渐升高,490 nm处吸光度值(A)分别为,(0.588±0.011)、(0.598±0.009)、(0.721±0.014)、(0.747±0.006),而对照组为(0.539±0.020),且当剂量为30、45 μL时,与对照组相比,差异有统计学意义(均P<0.05,n=4)。

A:组织块培养7~10 d,低倍显微镜观察原代hucMSCs细胞从组织块中爬出;B:继续培养2周左右细胞呈长梭状生长图1 hucMSCs细胞形态Fig.1 The morphology of hucMSCs
2.3 hucMSCs来源的exosome对THP-1细胞凋亡的影响
exosome与THP-1细胞共培养后,THP-1细胞的凋亡减少。如图2所示,加入exosome作用后,实验组与对照组相比THP-1细胞的凋亡率降低,差异具有统计学意义(P<0.05,n=3)。

A:对照组,细胞凋亡图;B:实验组,细胞凋亡图;与对照组比较,*P<0.05图2 hucMSCs来源的exosome对THP-1细胞凋亡率的影响Fig.2 Effects of hucMSCs-derived exosomes on THP-1 cell apoptosis
2.4 hucMSCs来源的exosome对THP-1细胞炎性因子IL-8、IL-12 mRNA表达的影响
普通PCR实验结果显示:加入exosome后,与对照组相比,炎性因子IL-8 mRNA相对表达(图3A)和炎性因子IL-12 mRNA的相对表达(图3B),均有降低趋势。
进一步用荧光定量方法检测,与对照组相比,加入exosome后,炎症因子IL-8和IL-12的mRNA的相对表达均有降低趋势,实验结果与普通PCR一致。加入exosome后,IL-8 mRNA相对表达量RQ值为(0.576±0.029),而对照组RQ值为(1.000±0.078);实验组IL-12 mRNA相对表达量RQ值为(0.512±0.109),而对照组为(1.000±0.089),分别下降,差异具有统计学意义(均P<0.05)。

A:IL-8;B:IL-12;M:Marker;1:对照组内参;2:实验组内参;3:对照组目的mRNA;4:实验组目的mRNA图3 hucMSCs来源的exosome在基因水平对THP-1细胞细胞因子IL-8、IL-12的影响Fig.3 Effect of hucMSCs-derived exosomes on cytokines IL-8 and IL-12 of THP-1 cells
2.5 hucMSCs来源的exosome对THP-1细胞IL-8、IL-12分泌水平的影响
ELISA检测结果经计算,实验组的hucMSCs来源的exosome作用THP-1细胞后,THP-1细胞的炎性因子IL-8分泌为(769.56±117.20)pg/mL,而对照组为(2 531.31±461.03)pg/mL(P<0.01,n=4);IL-12分泌为(201.51±44.34)pg/ mL,而对照组为(347.03±17.63)pg/ mL(P<0.01,n=3)。结果显示,exosome作用后,THP-1细胞炎性因子IL-8、IL-12的分泌均下降,差异均具有统计学意义。
3 讨论
作为重要的炎症免疫调控和中心效应细胞之一的巨噬细胞,可以通过分泌多种活性物质参与炎性反应、维持内环境稳定和损伤组织的修复。由于巨噬细胞具有可塑性[9],在不同信号的刺激下可以发生由M1型向M2型的转变[10],从而在炎症微环境中发挥不同的生物学功能。已有研究表明MSCs具有组织损伤修复及促新生血管生成作用[11],并且有报道指出MSCs在一些动物疾病模型中影响巨噬细胞的表型和功能,从而介导了炎症引起损伤的修复作用。而间充质干细胞与炎症细胞的相互作用往往决定了这一损伤修复过程及转归。Ti等[12]在研究脂多糖处理后的MSCs来源的exosome与巨噬细胞作用中发现,在慢性炎症反应及伤口愈合过程中,MSCs分泌的大量exosome能够促进抗炎细胞因子的分泌及活化M2型巨噬细胞,这进一步说明了,exosome在细胞与细胞之间的交流及维护造血微环境的动态平衡中起到了重要的作用。本课题组前期研究也发现,MSCs在一些疾病模型中确实发挥着重要的修复作用[13]。
本课题组前期研究通过hucMSCs与单核细胞THP-1细胞株共培养,初步发现hucMSCs对单核巨噬细胞THP-1细胞株的生长及炎性因子的分泌有影响。但是具体的机制并不明确。现有研究表明,MSCs的生物效应主要取决于它的旁分泌作用[14],可溶性因子的分泌,如生长因子,细胞因子和趋化因子等;一些囊泡的释放,如exosome等也可以调节细胞间的信息交流,从而诱导细胞分化及自我更新等。细胞与细胞之间的信息交流有多种因素,包括细胞因子,mRNA及miRNA、circRNA等等。近期研究发现,细胞分泌的囊泡样小体[15],尤其是exosome在微环境中的作用不容小视。因此,本课题组通过提取hucMSCs来源的exosome作用于单核巨噬细胞THP-1细胞进行进一步研究,结果发现,其具有促进THP-1细胞生长增殖,并且轻度抑制凋亡的作用,而且普通及实时荧光定量PCR和ELISA检测发现,其具有抑制THP-1炎性因子IL-8、IL-12表达和分泌的作用,此结果提示:间充质干细胞有可能通过分泌exosome参与对单核巨噬细胞的调控。因此,间充质干细胞分泌exosome可能是其调控其它炎性细胞的途径之一,也可能是其参与微环境调控的方式之一。
MSCs对单核巨噬细胞的影响具体通过哪些途径发挥作用,是否可能主要通过分泌exosome这一途径来实现,如果是,那么exosome中是哪些成分及通过哪些信号通路发挥的作用?仍需要进一步的实验研究。本研究还发现,exosome随着作用剂量的不同,对单核巨噬细胞增殖及凋亡影响不同,并且有研究发现,MSCs对T细胞的影响具有剂量依赖性[16]。因此,MSCs源性的exosome在炎症微环境中发挥作用目前仍然存在不清楚的机制,需要我们进一步研究。本研究揭示MSCs对单核巨噬细胞的调控作用可能是MSCs抗炎及损伤修复的重要方式之一,并且分泌exosome可能是其发挥作用途径之一。不仅从微环境角度为炎症性肿瘤发生的预防提供了新的思路,也是对间质干细胞临床应用安全性的一次重要评估,因此具有一定的基础研究和临床实用价值,并且为exosome替代细胞治疗带来了曙光。
[1] Butnor K J,Pavlisko E N,Sporn T A.Malignant peritoneal mesothelioma and Crohn disease[J].J Clin Pathol,2016,doi:10.1136/jclinpath-2016-203945.[Epub ahead of print].
[2] Cheddani H,Dauchet L,Fumery M,et al.Cancer in elderly onset inflammatory bowel disease:A population-based study[J].Am J Gastroenterol,2016,111(10):1428-1436.
[3] Tetta C,Ghigo E,Silengo L,et al.Extracellular vesicles as an emerging mechanism of cell-to-cell communication[J].Endocrine,2013,44(1):11-19.
[4] Lee Y,El Andaloussi S,Wood M J.Exosomes and microvesicles:extracellular vesicles for genetic information transfer and gene therapy[J].Hum Mol Genet,2012,21(R1):R125-R134.
[5] Arslan F,Lai R C,Smeets M B,et al.Mesenchymal stem cell-derived exosomes increase ATP levels,decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J].Stem Cell Res,2013,10(3):301-312.
[6] Camussi G,Deregibus M C,Bruno S,et al.Exosome/micr-ovesicle-mediated epigenetic reprogramming of cells[J].Am J Cancer Res,2011,1(1):98-110.
[7] 谢扬虎,李玉云.人脐带间充质干细胞分离培养建立及其生物学特性观察[J].蚌埠医学院学报,2010,10(35):982-985.
[8] Raposo G,Nijiman H W,Stoorvogel W,et al.Blymphocytes secrete antigen-presenting vesicles[J].J Exp Med,1996,183(3):1161-1172.
[9] Groves A M,Johnston C J,Misra R S,et al.Effects of IL-4 on pulmonary fibrosis and the accumulation and phenotype of macrophage subpopulations following thoracic irradiation[J].Int J Radiat Biol,2016,92(12):754-765.
[10] Zhao G,Liu L,Peek R M,et al.Activation of epidermal growth factor receptor in macrophages mediates feedback inhibition of M2 polarization and gastrointestinal tumor cell growth[J].J Biol Chem,2016,291(39):20462-20472.
[11] LeeJ K,Park S R,Jung B K,et al.Exosomes derived from mesenchymal stem cells suppress angiogenesis by down-regulating VEGF expression in breast cancer cells[J].PLoS One,2013,8(12):e84256.
[12] Ti D,Hao H,Tong C,et al.LPS-preconditioned mesenchymal stromal cells modify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b[J].Transl Med,2015,13(1):308-322.
[13] Li W,Zhang Q,Wang M,et al.Macrophages are involved in the protective role of human umbilical cord-derived stromal cells in renal ischemia-reperfusion injury[J].Stem Cell Res,2013,10(3):405-416.
[14] Chen W,Huang Y,Han J,et al.Immunomodulatory effects of mesenchymal stromal cells-derived exosome[J].Immunol Res,2016,64(4):831-840.
[15] Petrik J,Seghatchian J.Big things from small packages:The multifaceted roles of extracellular vesicles in the components quality,therapy and infection[J].Transfus Apher Sci,2016,55(1):4-8.
[16] Castro-Manrreza M E,Montesinos J.Immunoregulation by mesenchymal stem cells:biological aspects and clinical applications[J].Immunol Res,2015,2015:394917.
(2016-10-15 收稿)
Effects of hucMSCs-derived Exosome on Proliferation of Mononuclear Macrophage and Secretion of Inflammatory Cytokines IL-8,IL-12
Ding Juan1,2,Xu Zhengyang1,Chai Shuo1etal
1DepartmentofClinicalLaboratoryDiagnosisExperimentCenter,BengbuMedicalCollege,Bengbu233000,China2DepartmentofClinicalLaboratoryScience,TheFirstAffiliatedHospitalofBengbuMedicalCollege,Bengbu233004,China
Objective To investigate the effects of human umbilical cord mesenchymal stem cells(hucMSCs)-derived exosome on proliferation of mononuclear macrophage and secretion of inflammatory cytokines.Methods The hucMSCs-derived exosomes were cultured with mononuclear macrophages(THP-1 cell lines)and their effects on proliferation and apoptosis of THP-1 cells were measured by MTT assay and Annexin V-FITC/PI passage.The expression levels of IL-8 and IL-12 mRNA in THP-1 cells were detected by PCR method.The production of IL-8 and IL-12 protein from the co-culture system was assessed by ELISA.Results Both MTT and flow cytometry showed that hucMSCs-exosome could promote proliferation and inhibit the apoptosis of THP-1 cellsinvitro.Additionally,the results of PCR and ELISA methods showed that exosome reduced the mRNA and protein expression levels of IL-8 and IL-12.Conclusion hucMSCs-derived exosome could affect the growth of the mononuclear macrophage and reduce secretion of the inflammatory cytokines IL-8,IL-12,which might be one of the mechanisms by which MSCs regulate mononuclear macrophage.
inflammatory microenvironment; mononuclear macrophage; human umbilical cord mesenchymal stem cells;exosome
*安徽省高校自然科学研究重点项目(No.KJ2016A466);蚌埠医学院科研基金项目(No.BYKY1429ZD);蚌埠医学院研究生科研创新项目(No.Byycx1523)
丁 娟,女,1989年生,硕士研究生,E-mail:dingxiaoman@aliyun.com
△通迅作者,Corresponding author,E-mail:bbyxyzq@163.com(张强);E-mail:bbmcliyuyun@163.com(李玉云)
R364.5
10.3870/j.issn.1672-0741.2017.01.005
