长链非编码核糖核酸Malat-1、p21和GAS5在大肠癌组织中的表达及其诊断价值
2017-03-02刘亮华廖江涛
田 智,刘亮华,廖江涛
湖南省人民医院马王堆院区消化内科,长沙 410005
长链非编码核糖核酸Malat-1、p21和GAS5在大肠癌组织中的表达及其诊断价值
田 智,刘亮华,廖江涛△
湖南省人民医院马王堆院区消化内科,长沙 410005
目的 研究长链非编码核糖核酸肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,Malat-1)、p21和生长停滞特异性转录因子5(growth arrest-specific 5,GAS5)在大肠癌中的表达及诊断价值。方法 选择大肠癌早期和中晚期病变(含癌旁病变)、癌前病变、良性腺瘤和非肿瘤性病变各33例内镜下或手术切除标本,行RT-PCR法检测组织中Malat-1、p21和GAS5的表达水平,ELISA法检测血清癌胚抗原(carcino-embryonic antigen,CEA)和糖链抗原(carbohydrate antigen19-9,CA19-9)的表达水平。结果 RT-PCR法显示大肠癌早期、中晚期和癌前病变组中Malat-1、p21和GAS5的表达水平显著高于癌旁病变、良性腺瘤和非肿瘤性病变,中晚期组最高(P<0.05);非肿瘤性病变组的CEA和CA19-9水平显著低于其他组(均P<0.05),其他5组间比较差异无统计学意义。RT-PCR法检测的Malat-1、p21和GAS5诊断大肠癌的受试者工作曲线(operator characteristic curve,ROC),分析比较曲线下面积(area under the curve,AUC),差异无统计学意义(P>0.05)。病理检测结果显示:大肠癌早期、中晚期和癌前病变组各种病理改变显著多于癌旁病变、良性腺瘤和非肿瘤性病变,中晚期组最明显。结论 非编码核糖核酸Malat-1、p21和GAS5在大肠癌不同时期组织中有差异性表达,可作为诊断大肠癌和癌前病变的重要指标。
长链非编码RNA; Malat-1; p21; GAS5; 大肠癌
非编码RNA(non-coding RNA,ncRNA)约占98%的基因转录产物,包括微小RNA(micro RNA,miRNA)和长链非编码RNA(long non-coding RNA,lncRNA)。microRNA已被证实在多种炎症性疾病、肿瘤性疾病、心脑血管疾病的发病过程中扮演重要角色[1-3]。lncRNA也可以通过多种途径调控基因表达,最近多项研究指出,lncRNA的表达异常可调控细胞的凋亡和自噬机制,在肿瘤增殖、分化和迁移过程中发挥重要作用[4]。大肠癌(colorectal cancer,CC)又称为结直肠癌(colon and rectum carcinoma,CRC),是一种典型的由基因调控、炎症刺激和免疫紊乱导致的癌前病变进展性疾病,全世界每年新发约120万例,成为第3大恶性肿瘤,患者呈逐年增多且年轻化趋势[5-6]。早期识别高危患者,是提高手术切除率,改善5年生存率的关键[7]。既往研究均指出[8],作为lncRNA的成员,肺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,Malat-1)、p21和生长停滞特异性转录因子5(growth arrest-specific 5,GAS5)在结直肠癌中可表达升高或降低,结论不一,有可能成为诊断结直肠癌的特异性分子标志物。基于此,本研究拟采用RT-PCR比较不同病变组织中3种分子的表达水平,并采用受试者工作曲线(operator characteristic curve,ROC)分析用lncRNA诊断大肠癌的可行性。
1 资料与方法
1.1 研究对象
连续选择2015年9月至2016年12月入湖南省肿瘤医院及湘雅三医院、湖南省人民医院(马王堆院区)诊断大肠癌早期和中晚期病变(含癌旁病变,居肿瘤边缘≥5 cm)、癌前病变、良性腺瘤和非肿瘤性病变(Crohn病和溃疡性结肠炎)的病例各33例。
采用染色内镜,或手术切除标本病理诊断大肠的病变,其中染色内镜观察黏膜腺管开口形态判断大肠病变标准:开口为圆形、星芒状或乳头状为非肿瘤性病变;腺管开口为良性腺瘤;开口呈管状、类圆形为癌前病变;分支状、脑回状或沟纹状为大肠癌早期;开口大小不均,排列不规则,甚至消失或无结构为大肠癌中晚期。
各组患者的性别、年龄、肿瘤距肛周距离和最大直径比较,差异均无统计学意义(均P>0.05)。见表1。
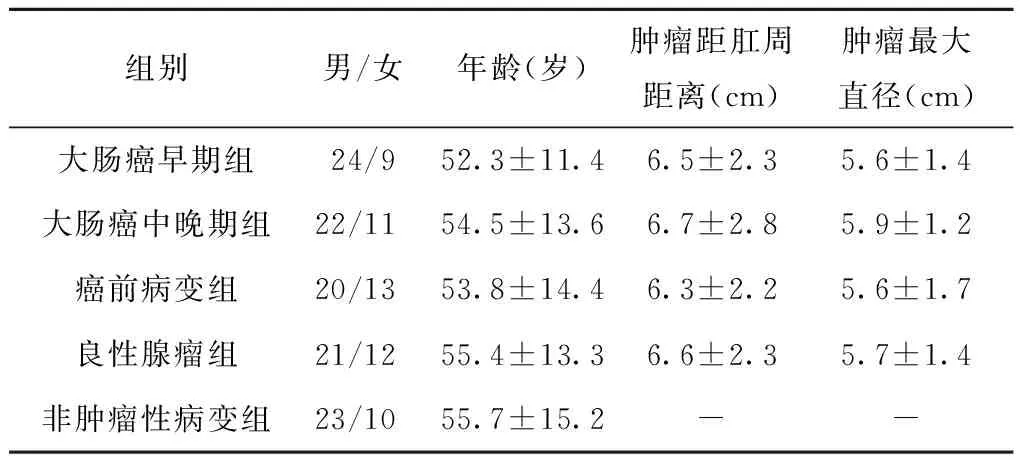
组别男/女年龄(岁)肿瘤距肛周距离(cm)肿瘤最大直径(cm)大肠癌早期组24/952.3±11.46.5±2.35.6±1.4大肠癌中晚期组22/1154.5±13.66.7±2.85.9±1.2癌前病变组20/1353.8±14.46.3±2.25.6±1.7良性腺瘤组21/1255.4±13.36.6±2.35.7±1.4非肿瘤性病变组23/1055.7±15.2--
1.2 主要试剂和仪器
RNA提取试剂Trizol(Invitrogen公司,美国),DEPC溶液(上海生工生物工程有限公司),反转录试剂盒(Invitrogen公司,美国),PCR试剂盒(Invitrogen公司,美国),RT-PCR荧光定量检测试剂盒(北京全式金生物技术有限公司),Malat-1、p21和GAS5引物(Invitrogen公司,美国),癌胚抗原(carcino-embryonic antigen,CEA)和糖链抗原(carbohydrate antigen19-9,CA19-9)试剂盒(ThermoFisher生物科技公司,美国);主要仪器:P2型微量加样器(Gilson,法国),MAX-XP型高速台式离心机(Beackman Coulter Optima,德国);XSP-63 XA型倒置荧光显微镜(上海杲森设备有限公司)。
1.3 检测方法
1.3.1 RT-PCR法检测组织中Malat-1、p21和GAS5的表达水平 Trizol法提取组织总RNA,ND-2000C微量紫外分光光度计测定总RNA浓度,1%琼脂糖凝胶电泳对RNA进行定量分析。cDNA的合成:EP管中加入总RNA 2 μL、随机引物1 μL、10 mmol/L dNTP混合物2 μL、DEPC水加至12 μL,65℃水浴5 min,冰上静置2 min;依次加入5×反应缓冲液4 μL,MDTT 2 μL,RNA酶抑制剂1 μL;37℃水浴2 min,加入1 μL MMLV逆转录酶,25℃水浴10 min,37℃水浴50 min;70℃水浴15 min终止反应,置于冰上。RT-PCR反应的Malat-1、p21和GAS5引物序列参见表2。

表2 Malat-1、p21和GAS5引物序列Table 2 The primer sequences of Malat-1,p21 and GAS5
反应体系:cDNA模板2 μL,10×扩增缓冲液1 μL,25 mmol/L MgCl21.2 μL,10 mmol/L dNTP混合物0.2 μL,10 mmol/L的上下游引物各0.2 μL,双蒸水5 μL,SyberGreen(50×0.1)0.1 μL,TaqDNA聚合酶(5 U/mL)0.1 μL。调整参数:95℃ 30 s,95℃ 5 s,60℃ 20 s,70℃ 20 s,40个循环;95℃ 60 s,60℃ 60 s,95℃ 15 s。采集数据Ct值,所有样品Ct值以内参基因标准化后计算样品的相对表达量,采用2-ΔΔCt法:目的基因相对表达量=level目的基因/levelGAPDH=2(CtGAPDH-Ct目的基因);每次实验每个样本设3个复孔,取其平均值。
1.3.2 ELISA法检测 血清中CEA和CA19-9的表达水平严格按照说明书步骤进行检测。
1.3.3 病理学检查 取各组的组织标本置于10%甲醛溶液中固定、石蜡包埋,苏木精-伊红染色,光镜下观察。
1.4 统计学方法
2 结果
2.1 Malat-1、p21、GAS5和CEA、CA19-9在不同组别的表达比较
大肠癌早期、中晚期和癌前病变组中Malat-1、p21和GAS5表达水平显著高于癌旁病变、良性腺瘤和非肿瘤性病变(均P<0.05);中晚期组高于早期组,癌前病变组次之,组间比较差异有统计学意义(均P<0.05);而癌旁病变、良性腺瘤和非肿瘤性病变比较,差异无统计学意义(P>0.05)。非肿瘤性病变组的CEA和CA19-9水平显著低于其他组(均P<0.05),而其他5组间比较,差异无统计学意义(P>0.05)。见表3。
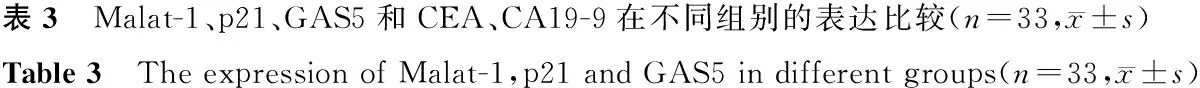
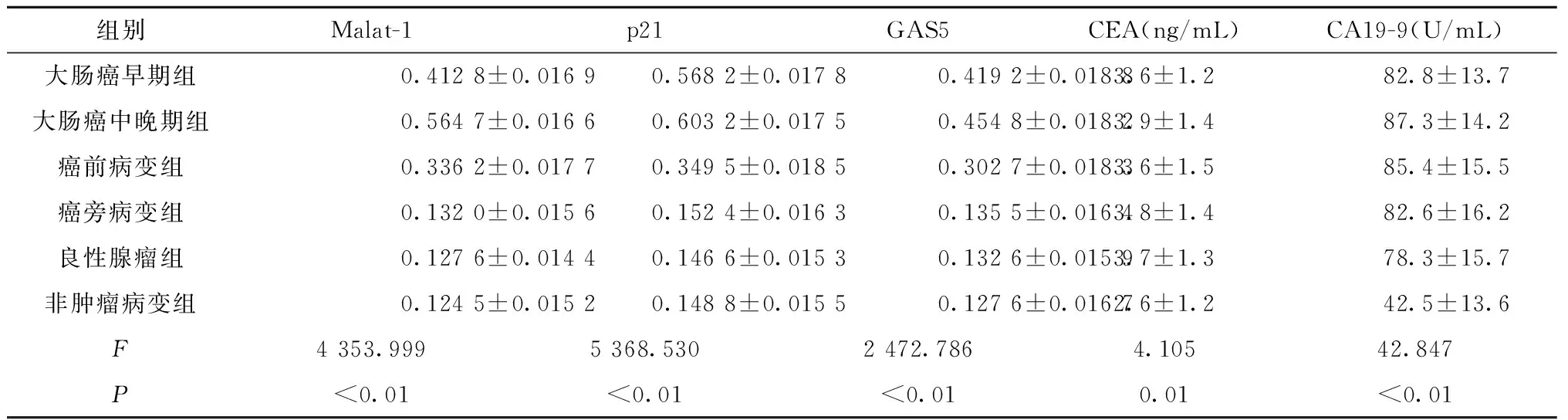
组别Malat-1p21GAS5CEA(ng/mL)CA19-9(U/mL)大肠癌早期组0.4128±0.01690.5682±0.01780.4192±0.01883.6±1.282.8±13.7大肠癌中晚期组0.5647±0.01660.6032±0.01750.4548±0.01823.9±1.487.3±14.2癌前病变组0.3362±0.01770.3495±0.01850.3027±0.01833.6±1.585.4±15.5癌旁病变组0.1320±0.01560.1524±0.01630.1355±0.01643.8±1.482.6±16.2良性腺瘤组0.1276±0.01440.1466±0.01530.1326±0.01593.7±1.378.3±15.7非肿瘤病变组0.1245±0.01520.1488±0.01550.1276±0.01672.6±1.242.5±13.6F4353.9995368.5302472.7864.10542.847P<0.01<0.01<0.010.01<0.01
2.2 Malat-1、p21、GAS5诊断大肠癌的ROC分析
各组大肠组织的Malat-1、p21和GAS5诊断大肠癌的曲线下面积(area under the curve,AUC)相当,敏感度和特异度相似。参见表4和图1。
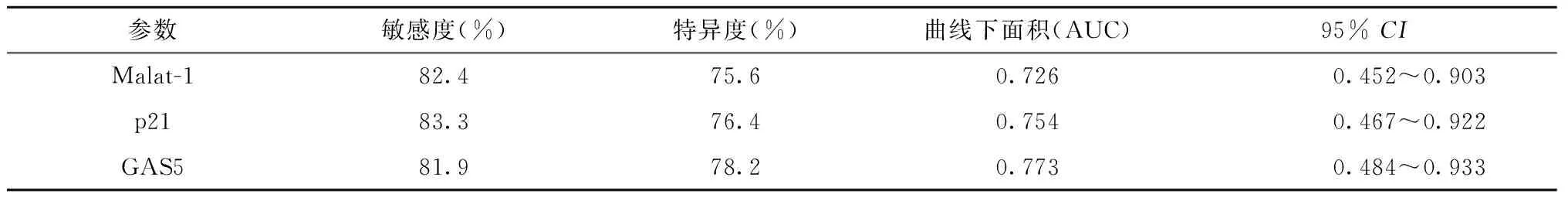
表4 Malat-1、p21、GAS5诊断大肠癌的ROC分析Table 4 ROC analysis of Malat-1,p21 and GAS5 in diagnosis of colorectal cancer

图1 大肠组织中Malat-1、p21和GAS5表达对诊断大肠癌的ROC分析Fig.1 ROC analysis of Malat-1,p21 and GAS5 in diagnosis of colorectal cancer
2.3 不同组别大肠组织的病理学变化
早期组:杯状细胞减少或坏死,存在不典型增生,大量炎性细胞浸润,基底膜不完整;中晚期组:杯状细胞大量消失,细胞形态不规则,极性破坏,染色质分布不均匀,染色质浓,可见异常分裂,大量炎性细胞浸润,从基底膜浸润到固有层;癌前病变组:增生显著,基底膜不完整,细胞排列不整齐;癌旁病变组:杯状细胞减少,细胞核明显增大,基底膜尚完整;良性腺瘤组:杯状细胞减少,细胞极性稍乱,基底膜完整;非肿瘤病变组:杯状细胞正常,增生不显著,基底膜尚完整。参见图2。
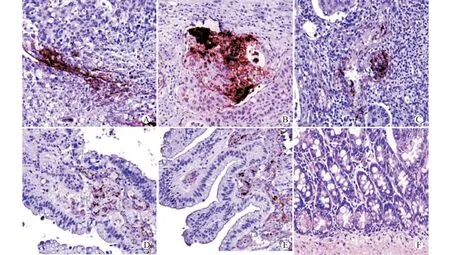
A:早期组;B:中晚期组;C:癌前病变组;D:癌旁病变组;E:良性腺瘤组;F:非肿瘤病变组图2 不同组别大肠组织的病理学变化(苏木精-伊红染色,×200)Fig.2 Pathological changes of colorectal tissue in different groups(HE staining,×200)
3 讨论
在肿瘤研究中,lncRNA Malat-1是首个被发现的与肿瘤转移潜能相关的长链非编码RNA分子,主要存在于细胞核中,在多种人实体肿瘤中异常表达,如乳腺癌、胰腺癌、前列腺癌和肝癌,可能是与肿瘤发生密切相关的长链非编码RNA之一。Malat-1通过调控凋亡基因表达,调节宫颈癌细胞的增殖与侵袭,Malat-1还可影响调控移动性相关的基因增加肺腺癌细胞的转移能力,在肝癌增殖、凋亡和迁移等恶性生物学行为中发挥作用,可作为肝癌移植后肿瘤复发的独立危险因素。本研究结果显示,Malat-1在大肠不同病变中的表达呈现差异性,在中晚期大肠癌、早期大肠癌和癌前病变中表达明显增高,提示Malat-1参与大肠癌的发生发展过程,Malat-1可通过多种机制促进大肠癌的发生[9-13]:①Malat-1与抑癌基因脯氨酸/谷氨酰胺富含性剪接因子(splicing factor proline/glutamine-rich,SFPQ)结合,使原癌基因核糖核酸结合蛋白2(polypyrimidine tract binding protein 2,PTBP2)从SFPQ/PTBP2复合物中释放,PTBP2可发挥促癌作用,加速大肠癌细胞的浸润和转移,同时SFPQ与PTBP2的分离也可促进结直肠癌细胞的增殖和迁移;②Malat-1通过调节丝氨酸/精氨酸剪接因子(Serine/Arginine splicing factor)的磷酸化形式来调节mRNA前体剪接,导致蛋白激酶A锚定蛋白9(A-kinase anchoring protein 9,AKAP9)的高表达,AKAP9具有转移潜能和淋巴结转移的作用,敲除AKAP9的小鼠能阻碍Malat-1介导的大肠癌细胞的增殖、迁移和侵袭;③Malat-1可分为5个片段,其中6918~8441 nt片段可以增强细胞的增殖和侵袭,片段6918~8441 nt能够加快肿瘤的生长,片段5434~6951 nt突变可促进肠癌的发生。
lncRNA GAS5最初在筛选抑制细胞生长的高表达肿瘤抑制基因时发现,作为细胞周期调节因子,当外界环境营养素缺乏时,机体可反馈性地升高GAS5表达,调节糖皮质激素功能,改变细胞生命活动,使细胞适应缺氧环境,本课题中GAS5在大肠癌组织中表达升高,可能与肿瘤组织本身的低氧微环境有关。研究也显示GAS5高表达与大肠癌的大小、组织学分级和TNM分期密切相关,最近研究表明[14-15],GAS5在多种肿瘤组织中呈低表达,表现为抑癌基因,过表达GAS5可抑制肿瘤生长、侵袭和转移,并诱导细胞凋亡,增强细胞对化疗药物的敏感性,提示GAS5可作为大肠癌独立预测存活率的重要因子[16-18],本研究结果也可作为上述结论的佐证。
正常情况下,人体各种细胞均有一定的lncRNA p21蛋白表达,调控细胞基因活动。但在多种恶性肿瘤组织中,p21呈高表达,如大肠癌、乳腺癌和胃癌,p21蛋白表达同大肠癌的分期及淋巴结转移呈正相关,随肿瘤浸润深度增加而增强,与大肠癌的隆起型呈负相关,p21蛋白表达水平越高,患者的预后越差[19-21]。
综上所述,与癌旁病变、良性腺瘤和非肿瘤性病变比较,Malat-1、p21和GAS5三种lncRNA在大肠癌早期、中晚期和癌前病变组均有过度表达现象,但在大肠癌不同阶段及在大肠癌同一阶段的表达也存在不同,在对大肠癌病变的判定同时检测Malat-1、p21和GAS5明显优于单独检测其中一种,因此Malat-1、p21和GAS5具有诊断大肠癌和癌前病变的临床价值。
[1] Bernard D,Prasanth K V,Tripathi V,et al.A long nuclear retained non-coding RNA regulates synaptogenesis by modulating gene expression[J].EMBO J,2010,29(18):3082-3093.
[2] Xu L M,Chen,L,Li F,et al.Over-expression of the long on-coding RNA HOTTIP inhibits glioma cell growth by BRE[J].J Exp Clin Cancer Res,2016,35(1):162-163.
[3] Yin X,Zheng S S,Zhang L,et al.Identification of long noncoding RNA expression profile in oxaliplatin-resistant hepatocellular carcinoma cells[J].Gene,2016,596(16):53-88.
[4] 徐静,徐秋林,郭晓华.长链非编码RNA调控细胞凋亡及自噬的研究进展[J].中国病理生理杂志,2015,31(8):1525-1530.
[5] Bu D,Yu K,Sun S,et al.NONCODE v3.0:integrative annotation of long noncoding RNAs[J].Nucleic Acids Res,2012,40:D210-D215.
[6] Bohorquez M,Sahasrabudhe R,Criollo A,et al.Clinical manifestations of colorectal cancer patients from alarge multicenter study in Colombia[J].Medicine(Baltimore),2016,95(40):e4883-e4888.
[7] Yin D D,He X Z,Zhang E B,et al.Long noncoding RNA GAS5 affects cell proliferation and predicts a poor prognosis in patients with colorectal cancer[J].Med Oncol,2014,31(11):253-255.
[8] 陈沁楠,王朝霞.长链非编码RNA GAS5在肿瘤研究中的进展[J].现代肿瘤医学,2016,24(1):138-140.
[9] Fang D,Yang H,Lin J,et al.17β-estradiol regulates cell proliferation,colony formation,migration,invasion and promotes apoptosis by upregulating miR-9 and thus degrades Malat-1 in osteosarcoma cell MG-63 in an estrogen receptor-independent manner[J].Biochem Biophys Res Commun,2015,457(4):500-506.
[10] Chen S,Ma P,Zhao Y,et al.Biological function and mechanism of Malat-1 in renal cell carcinoma proliferation and apoptosis:role of the Malat-1-Livin protein interaction[J].J Physiol Sci,2016,Sep 21.[Epub ahead of print]
[11] Wang Y,Xue D,Li Y,et al.The long noncoding RNA Malat-1 is a novel biomarker in various cancers:a meta-analysis based on the GEO database and literature[J].J Cancer,2016,7(8):991-1001.
[12] Zhou Y,Xu X,Lv H,et al.The long noncoding RNA Malat-1 is highly expressed in ovarian cancer and induces cell growth and migration[J].PLoS One,2016,11(5):e0155250-e0155255.
[13] Ren D,Li H,Li R,et al.Novel insight into Malat-1 in cancer:Therapeutic targets and clinical applications[J].Oncol Lett,2016,11(3):1621-1630.
[14] Liang W,Lv T,Shi X,et al.Circulating long noncoding RNA GAS5 is a novel biomarker for the diagnosis of nonsmall cell lung cancer[J].Medicine(Baltimore),2016,95(37):e4608-e4612.
[15] Leucci E,Patella F,Waage J,et al.Micro RNA-9 targets the long non-coding RNA Malat1 for degradation in the nucleus[J].Sci Rep,2013,3(8):2535-2540.
[16] Wang Y N,Shan K,Yao M D,et al.Long noncoding RNA-GAS5:A novel regulator of hypertension-induced vascular remodeling[J].Hypertension,2016,68(3):736-748.
[17] Chang L,Li C,Lan T,et al.Decreased expression of long non-coding RNA GAS5 indicates a poor prognosis and promotes cell proliferation and invasion in hepatocellular carcinoma by regulating vimentin[J].Mol Med Rep,2016,13(2):1541-1550.
[18] Cao Q,Wang N,Qi J,et al.Long noncoding RNA GAS5 acts as a tumor suppressor in bladder transitional cell carcinoma via regulation of chemokine(CC motif)ligand 1 expression[J].Mol Med Rep,2016,13(1):27-34.
[19] Kakeji Y,Mizokami K,Sumiyoshi Y,et al.The prognostic impact of hypoxia-inducible factor-1α and VEGF,IGF-2,p21,p53 expression in gastric adenocarcinoma[J].J Clin Oncol,2009,27(Suppl 15):4571-4578.
[20] Han D,Zhang X,Zhang J,et al.Oleanolic acid suppresses vascular smooth muscle cell proliferation by increasing lincRNA-p21 expression[J].Oncol Lett,2016,12(5):3519-3522.
[21] Chillón I,Pyle A M.Inverted repeat Alu elements in the human lincRNA-p21 adopt a conserved secondary structure that regulates RNA function[J].Nucleic Acids Res,2016,44(19):9462-9471.
(2016-09-01 收稿)
Expression and Diagnostic Values of lncRNA-Malat-1,p21 and GAS5 in Colorectal Cancer Tissue
Tian Zhi,Liu Lianghua,Liao Jiangtao△
DepartmentofGastroenterology,HunanProvincialPeople’sHospital,Changsha410005,China
Objective To study the expression and diagnostic values of long non-coding RNA(lncRNA)metastasis-associated lung adenocarcinoma transcript 1(Malat-1),p21 and growth arrest-specific 5(GAS5)in colorectal cancer tissue.Methods Colorectal cancer of early stage and advanced stage(including paracarcinoma tissue),precancerous lesion,benign tumor and non-cancer lesion groups were collected,33 cases in each group.The levels of Malat-1,p21 and GAS5 in colorectal tissue of the 6 groups were detected by reverse transcription-polymerase chain reaction(RT-PCR).Serum carcinoembryonic antigen(CEA)and carbohydrate antigen19-9(CA19-9)were detected by ELISA.Results RT-PCR showed the levels of Malat-1,p21 and GAS5 were significantly higher in colorectal cancer of early and advanced stage and precancerous lesion than in the paracarcinoma lesion,benign tumor and non-cancer lesion(P<0.05).Malat-1,p21 and GAS5 were the highest in the advanced stage group(P<0.05).The levels of CEA and CA19-9 in non-cancer lesion were the least(P<0.05).The AUC of ROC analysis operator characteristic curve(ROC)of Malat-1,p21 and GAS5 was comparable(P>0.05).Pathological changes showed the pathological changes in colorectal cancer of early stage,advanced stage and precancerous lesion were more significant than those in the paracarcinoma lesion,benign tumor and non-cancer lesion(P<0.05),which were the most significant in the advanced stage group.Conclusion The levels of Malat-1,p21 and GAS5 in colorectal cancer tissues could be good indicators for colorectal cancer diagnosis.
lncRNA; Malat-1; p21; GAS5; colorectal cancer
田 智,女,1988年生,住院医师,E-mail:327479153@qq.com
△通讯作者,Corresponding author,E-mail:jt99399@163.com
R734.2
10.3870/j.issn.1672-0741.2017.01.003
