作物硝态氮转运利用与氮素利用效率的关系
2017-03-02张振华
张振华
(南方粮油作物协同创新中心/湖南农业大学资源环境学院,长沙 410128)
作物硝态氮转运利用与氮素利用效率的关系
张振华
(南方粮油作物协同创新中心/湖南农业大学资源环境学院,长沙 410128)
【目的】铵态氮 (NH4+) 和硝态氮 (NO3–) 是作物氮素吸收利用的主要形态,旱作作物 NO3–的累积与利用是氮素营养研究的主要组成部分,关系到理解作物 NO3–的转运和利用关系及作物体内 NO3–含量和氮素利用效率(nitrogen utilization efficiency, NUE) 高低的问题。 【主要进展】作物吸收的 NO3–分为被作物直接利用、分泌到根外、储存在液泡和向地上部分运输四种途径。其中 NO3–短途分配 (液泡 NO3–分配) 和长途转运 (地上、地下部 NO3–的转运) 共同调控着 NO3–的利用效率,进而影响作物的 NUE。液泡 NO3–不能被作物直接利用,只有分配到液泡外细胞质中的 NO3–才能被作物迅速代谢和利用;同时有更大比例的 NO3–分配到地上部分,使得作物可以充分利用太阳光能进行 NO3–代谢和能量转换,从而提高了作物的 NUE。此外,液泡对 NO3–起到分隔作用,储存在液泡中的 NO3–并不能对 NO3–转运相关基因 (如 NR、NO3–长途转运基因 NRT1.5 和 NRT1.8) 起到诱导效果;只有分配在液泡外原生质体中的 NO3–才能对 NO3–诱导基因产生强烈的诱导。因此,作物细胞原生质体中液泡内、外 NO3–的分配不仅影响了 NO3–的同化利用,而且直接影响了 NO3–的长途转运。 【展望】本文对植物原生质体中液泡内、外 NO3–的短途分配和地上、地下部间 NO3–的长途转运机制进行了总结,为进一步深入研究作物地上、地下部 NO3–长途转运和液泡 NO3–短途分配的关系,以及更好地揭示作物 NUE 对 NO3–转运和利用的响应机理提供参考。
硝态氮;氮素利用效率;长途转运;短途分配
我国是氮肥消费大国,氮肥年消耗量位居世界第一,但氮肥利用率却较低,平均只有 35%,远远低于发达国家的40%~60%[1–2]。随着氮肥的大量施用,许多地方出现随氮肥施用量增加作物产量反而减少的现象[1,3]。氮肥利用率低不仅造成资源浪费和环境污染,还威胁到了人体健康[4–5]。2013 年联合国环境规划署全球养分管理合作伙伴 (GPNM,UNEP)组织编写的“Our Nutrient World”就系统分析了养分在粮食安全和环境保护中的作用,明确提出了 20–20计划,即在 20 年内提高养分利用效率 20%[6]。因此,提高氮肥利用率,充分挖掘作物高效利用氮素的遗传潜力具有重要的生态和实际生产意义[7–9]。
NO3–是旱作作物的主要氮源,可以在植物体内大量累积和转运[10]。光照充足时,地上部比根部的同化效率高[10–11]。因此,白天高光照条件下,植株有更多的 NO3–长途转运到地上部分。代谢是一种“节省”代谢能量“成本”的最优方式,可在充分利用太阳光能的同时,有效提高植物的 NUE[11–13]。同时NO3–的长途转运及其在地上、地下部的分配受到两NO3–长途转运基因 (NRT1.5 和 NRT1.8) 的双重调控,且两者表达都受到 NO3–的强烈诱导[14–18]。而植株体内液泡膜转运系统可能通过调控液泡内、外NO3–的分配 (NO3–短途分配) 比例,影响 NO3–长途转运基因的诱导表达和功能发挥[19–22]。
目前的研究表明,氯离子通道蛋白 CLCa 主要负责 NO3–的短途分配 (液泡 NO3–分配),是液泡 NO3–累积的主要通道[23];液泡膜质子泵 (V-ATPase 和 VPPase) 则为液泡 NO3–的累积提供能量和动力[21,24–25]。植物液泡占据了成熟细胞体积的 90% 左右,储存在液泡中的 NO3–不能被植物代谢利用,只有分配到液泡外细胞质中的 NO3–才能被植物代谢利用,而液泡和细胞质中 NO3–的浓度通常分别为 30~50 mol/m3和 3~5 mol/m3[26],因此,液泡是植物 NO3–累积的主要部位,研究植物氮效率就不能忽视液泡 NO3–分配所起的作用[27–29]。通常情况下细胞质用于 NO3–还原的同化力在叶片中是比较充足的,只要 NO3–能分配到液泡外便能迅速同化利用,所以,液泡内、外NO3–的分配比例很大程度上决定着植物对 NO3–的利用效率[1,27–28]。
1 NO3–利用效率及其与氮效率的关系
NO3–在植物体内可大量累积,极端状态下 NO3–累积量可超过植株鲜重的 2%,干重的 17%~24%[28,30]。NO3–作为植株体内的无机氮,如果不能得到及时同化和利用,将会明显影响植株的氮素同化效率和生物量的形成,进而显著影响植物的NUE[1,31]。NO3–被吸收进入根部细胞后有就地同化 (①)、外排 (②)、储存 (③)、以及向地上部分转运 (④) 四种命运 (图 1)[32],大部分 NO3–会通过木质部导管进行长途转运,到达植物地上部分后,在不同组织中进行转运和利用。此外,有人把植物细胞中的 NO3–分成代谢库 (液泡外原生质体中的 NO3–) 和储存库 (液泡中的 NO3–),前者量少但强烈影响着 NO3–诱导基因的表达 (如NR、NRT1.5 和 NRT1.8),而后者量虽大却与 NO3–诱导基因的表达关系不强[19–20]。这些结果都表明,液泡NO3–的积累和 NO3–在地上、地下部的分配都明显的影响着植株 NUE,并且存在着紧密的相关性,是造成植物 NUE 差异的重要生理原因。因此,研究阐明NO3–短途分配与长途转运之间的关系及其对 NUE 的影响,有望为充分利用植物体内的 NO3–以及提高NUE 提供科学依据。
2 NO3–的短途分配及其影响因素
研究养分离子通过细胞膜或液泡膜的过程是厘清植物营养基因型差异的重要方面之一[33]。NO3–的短途分配主要指吸收的 NO3–跨液泡膜转运的过程。NO3–在液泡膜质子泵的动力作用下,通过氯离子通道 (CLC) 蛋白进入到液泡的过程不仅与 NO3–质子泵提供的能量有关[21,24–25],而且与 CLC 蛋白的活性有密切关系[23]。从目前的研究结果来看,唯一确定对液泡NO3–起到累积效果的 NRT 家族基因是 NRT2.7,且仅在种子成熟晚期表达,起到种子中液泡 NO3–累积的作用[34];但真正影响到植株生长过程中整体液泡NO3–累积的主要因素为 CLC 家族蛋白[23]。NO3–在液泡内、外的分配状况不仅影响植株吸收 NO3–的分隔累积和利用[21],而且可能明显影响植物组织中 NO3–诱导基因的表达状况和 NUE[19–20]。
2.2.1 液泡膜氯离子通道 (CLC) 的特性与调控 NO3–在细胞内有相应的独立转运系统。迄今为止,通过荧光标记染料和电生理技术 (如膜片钳技术) 在液泡膜上发现的阴离子通道主要有两类,即氯离子通道(CLC) 和苹果酸通道,两者均属内向整流型通道[35–36]。CLC 主要通透 Cl–和 NO3–等阴离子,也允许苹果酸根离子通过,但谷氨酸盐不能通过,其受胞质 Ca2+激活[37],具体机制是通过 ATP 存在条件下 CDPK (calmodulin domain protein kinase) 的激活,受尼氟灭酸 (niflumic acid,NA) 专性抑制,与一般阴离子通道不同,不受 DIDS (4,4′-dinitrostilbene-2,2′- disulfonic acid) 抑制[38–40]。

图1 NO3–进入根部细胞后的不同去向Fig.1 The pathway for NO3–after entering into root cells
已有研究表明,AtNRT2.7 和 CLCa 是 2 个能将NO3–转入液泡的转运蛋白[27,35],可能具有类似功能的转运蛋白还包括 CLCb、CLCe、AtNRT1.4[41–43]。在CLC 家族中:(1) AtCLCa 是第一个被发现编码NO3–/2H+共转运体的 CLC 家族蛋白,也是唯一有确切证据表明其参与液泡 NO3–累积的氯离子通道(CLC) 蛋白,其突变体液泡中的 NO3–累积量减少50% 左右,且地上、地下部分 NO3–含量均降低[23,44–45];(2) CLC 家族的另一成员 CLCb 定位于液泡膜上,并且也能转运 NO3–,但目前还没有直接的分子证据证明它是否参与 NO3–进出液泡[42]。在 AtNRT 家族中:(1) AtNRT 1.4 特异性表达在富含 NO3–的叶柄,实验证据显示它可能参与叶柄细胞中液泡 NO3–的累积,但一直缺少 AtNRT1.4 定位在液泡膜上的相关实验证据,因此,其实际功能一直存在争议[43];(2) AtNRT 2.7是目前为止唯一被确定参与液泡 NO3–储存的 NRT 家族基因,其表达在种子成熟晚期,定位在液泡膜上,负责将种子的 NO3–从细胞质运往液泡中储存,完成种子中 N 素营养积累的使命[34]。与 NRT 家族相比,CLC 家族蛋白是植物在生长过程中调控液泡NO3–累积的最主要方式,可以明显影响植株 NO3–的利用[23,44–45]。
2.2.2 液泡膜质子泵的特性与调控 植物液泡膜上有两类功能和物理特性完全不同的质子泵 (V-ATPase和 V-PPase),共同致力于跨膜 ∆H+的建立[46]。NO3–从细胞质进入液泡主要靠液泡膜上的 H+/2NO3–逆向转运蛋白来完成;而液泡膜上 NO3–与其它阳离子构成的同向转运蛋白则有利于液泡中 NO3–向细胞质的转移[21,23,47]。以往的研究表明,V-ATPase 和 V-PPase既是液泡膜质子泵的关键酶,也是液泡 NO3–再利用程度的决定因素;但是有关于液泡膜质子泵累积NO3–的机理及其与氮效率的关系却研究较少[1]。因此,在研究液泡膜质子泵活性的基础上,明确液泡NO3–的短途分配机制,对于进一步提高作物 NUE 有重要意义[48]。
Bafilomycin A1是一种具有大环内酯的抗生素,结合于液泡 H+-ATPase 的膜结合区 (V0),堵塞质子跨膜转运通道,从而强烈抑制 V 型 H+-ATPase 的活性,为液泡膜 H+-ATPase 的专一性抑制剂,以纳摩尔的浓度抑制 V-ATPase 的活性,50 nmol/L bafilomycin A1抑制了酶活性的 64%[49–50]。二环已基碳二亚胺(N,N′-dicyclohexylcarbodiimide,DCCD) 是一种质子通道抑制剂,对 V-PPase 活性有强烈的抑制作用,同时也可以较弱的抑制 V-ATPase 活性[51–52]。而 VATPase c 亚基的第四个跨膜 α 螺旋上有一个高度保守的 Glu 残基,该残基是质子通道抑制剂 DCCD 与V-ATPase 唯一的作用位点,硫 (Na2SO3) 引起 DCCD与 V-ATPase 结合位点的变化,使 DCCD 不能接近这一点,有效地拮抗了 DCCD 对 V-ATPase 水解的抑制,而并不保护被 Bafilomycin A1引起的抑制[50,53],因此,DCCD+Na2SO3是 V-PPase 专一性抑制剂。
3 NO3–的长途转运及其影响因素
NO3–一旦吸收进入根中,除了通过液泡膜储存到液泡中,还可以还原为亚硝态氮并分配到质体中进一步被同化为有机氮[54]。此外,大部分 NO3–还可以被装载到木质部并被转运到植物的地上部组织进行代谢[55]。NO3–在地上、地下部分的分配比例分别由向上运输的木质部介导和向下运输的韧皮部介导[56]。近期的研究发现拟南芥中木质部介导的 NO3–长途转运主要由 NRT1 家族的两个成员 NRT 1.5 和 NRT 1.8调控,并且它们的表达受到 NO3–的强烈诱导和激素的强烈调控[16–18]。根部吸收的 NO3–向木质部的装载是向地上部运输的关键环节,也是 NO3–运输分配中的独立控制环节[57],AtNRT1.5 就负责该功能,其功能缺失突变体木质部伤流液中 NO3–含量降低,植物向上转运 NO3–的能力被削弱[14]。而 AtNRT1.8 通过调控 NO3–木质部的卸载也影响 NO3–从根向地上部分的运输,通过增强地上部 NO3–的木质部卸载促进NO3–向地上部的转运[16]。可见,AtNRT 1.5 与 AtNRT 1.8共同影响 NO3–向上运输。而对于韧皮部介导的 NO3–向下运输,目前只鉴定了负责根部韧皮部装载的基因 AtNRT1.9,负责韧皮部卸载的基因尚未找到[58–59]。AtNRT1.9、AtNRT1.8 和 AtNRT1.5 可能一起协同作用,调节 NO3–从地下部分向地上部分的长途转运以及再分配。值得注意的是,作物 NO3–在木质部中的运输浓度通常是韧皮部中的几十到上百倍,因此研究 NO3–在地上、地下部的分配主要关注木质部 NO3–的转运,而不是影响很小的韧皮部 NO3–转运[14,16,59]。目前,其他作物中对于 NRT1 与 NO3–长途转运的关系研究主要集中在小麦和水稻中,但由于非模式植物研究的突变体材料和克隆基因技术的限制,仅仅在小麦中研究了 NRT1.5 和 NRT1.8 基因对氮胁迫的响应[60],以及水稻中 OsNRT1.5 过表达材料的氮素生理特性分析[61],基本明确了 NRT1.5 和 NRT1.8 在其它作物中同样调控了氮素的转运和分配,起到了与拟南芥中相似的作用。因此,有理由相信拟南芥的NO3–长途转运与 NRT1 家族基因的关系可能也适用于其它作物,具有很重要的参考意义。
此外,作物蒸腾作用同样强烈影响着 NO3–的长途转运,装载到木质部中的 NO3–通过蒸腾拉力的作用源源不断的运输到作物地上部分,从而促进 NO3–从地下向地上部分的转运[15–16]。NO3–长途转运不仅决定着 NO3–的组织分配和影响着 NO3–在不同植物组织中的同化比例及利用效率,而且也是植物响应环境变化的重要生理机制[62]。因此,阐明并调控 NO3–长途转运系统对提高养分利用效率有重要作用[55]。在豌豆中的研究表明,蒸腾作用的抑制减少了 NO3–向地上部的转运,使 NO3–累积于根中,从而导致镉胁迫条件下根中有更多的 NO3–累积[15–16,63]。Chen 等[15]和 Li 等[16]的研究结果表明,除了一般认为的蒸腾作用调控着营养元素从根向地上部的转运,逆境胁迫条件下 NRT1.5 和 NRT1.8 对根中 NO3–累积的调控可能是 NO3–分配过程中的主要调控因素,因为逆境胁迫条件下野生型拟南芥比 nrt1.8-1 突变体在根中保持了更高的 NO3–比例,表明 NRT1.8 等转运蛋白对根/地上部 NO3–比例的调控是主动调控机制,而不是由于蒸腾作用受到抑制的被动调节机制。但不同NUE 作物基因型 NRT1.5 和 NRT1.8 的表达差异及其对 NUE 的影响,迄今研究报道较少[15]。
4 NO3–短途分配与长途转运的关系
根部的液泡是作物吸收 NO3–的储存库[1],但是分配在液泡外原生质体中的 NO3–并不能迅速的装载到木质部汁液中,从而得以运输到地上部分高效利用。因为,细胞质中 NO3–装载到木质部汁液中的过程是一个消耗能量的主动运输,需要长途转运基因(NRT1.5 和 NRT1.8) 的协同作用[14,16]。此外,NRT1.5和 NRT1.8 两基因的表达模式相反,且 NRT1.5 的表达受到外界 NO3–的显著诱导[14–15]。因此,有理由相信 NRT1.5 的表达同样受到作物体内细胞质中 NO3–的诱导。最新的研究表明,氮高效作物根系中液泡NO3–储存能力的降低可以促进 NO3–从地下部向地上部的转运 (图 2)。具体表现为氮高效作物根系中液泡膜质子泵和氯离子通道蛋白 (CLCa) 的活性降低,从而有更低比例的 NO3–累积到液泡中,有更高比例的NO3–分配到细胞质中,继而诱导根部 NRT1.5 的表达,同时抑制 NRT1.8 的表达,最终导致更大比例的NO3–装载到木质部汁液中运输到作物的地上部分。这是作物拥有更高 NUE 的重要原因之一。
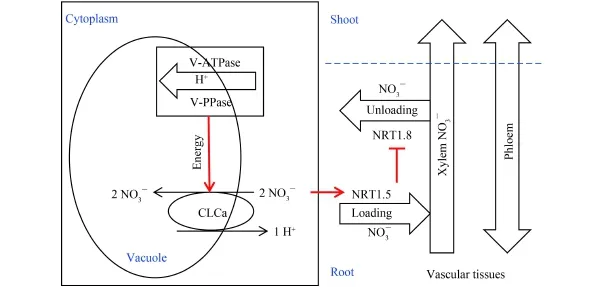
图2 NO3–短途分配对长途转运的调控机理Fig.2 The mechanism for the regulation of NO3–short distribution on NO3–long transportation
5 NO3–利用效率相关研究的发展趋势分析
虽然有关于植物 NO3–利用效率的研究起步较晚,但由于在提高作物 NUE 重要意义的驱使下,通过近年的研究积累,NO3–长途转运和短途分配总体来说已经取得了较好的研究进展,并且随着相关机理的不断揭示,逐渐成为国内外的热点研究领域[14,16,59]。液泡 NO3–的分配不仅直接影响着 NO3–的分配和利用能力[21,24–25],还可能影响着受 NO3–诱导基因的表达及功能发挥[19–20,22],使短途分配和长途转运成为一个有机整体 (图 1),最终调控植株的 NUE[32]。因此,关于液泡 NO3–短途分配机理和长途转运机制的研究,亟需从以下几个方面进一步深入[8,16,64]:1) 液泡储存的 NO3–除了调节渗透功能以外,对 NO3–诱导基因的表达和功能发挥的调节程度如何?2) 液泡 NO3–分配过程中氯离子通道 (CLC) 和质子泵对 NO3–胞内分配的贡献差异还有待研究;3) 尽管 CLCa 主要调控NO3–从细胞质向液泡的累积分隔,但这个过程对NO3–进一步同化利用的影响到底有多大,目前也尚不清楚。
从目前的研究结果看,尽管 NRT 家族基因分别在叶柄 (NRT1.4) 和种子 (NRT2.7) 液泡 NO3–累积过程中发挥了一定的作用,但起主要调控作用的因素仍然为液泡膜上的质子泵系统和 CLC 转运系统[34,43],液泡膜 NO3–转运系统分布在植株组织中的各个部分,是调控 NO3–短途分配的主要过程[21,23]。负责韧皮部 NO3–装载的 NRT1.9 以及负责木质部 NO3–装载(NRT1.5) 和卸载 (NRT1.8) 的 NRT 家族基因共同调控着 NO3–的长途转运;但韧皮部主要负责有机氮的转运,无机态氮 (NO3–) 的运输浓度通常是木质部的几十或几百分之一[14,16,58–59]。因此,短途分配中液泡膜CLC 和质子泵转运系统,以及长途转运中 NRT1.5 和NRT1.8 长距离运输系统是 NO3–长途转运和短途分配的主要调控因子。所以,在前人研究基础上选取在NO3–短途分配起到主要作用的液泡膜 NO3–分配系统,以及在 NO3–长途转运中发挥主要功能的维管束长距离运输系统为突破口,深入研究 NO3–短途分配对其长途转运机制的调控及其对 NUE 的影响机理,可以更好地阐述胞内 NO3–短途分配和 NO3–长途转运的关系及其互相影响的生理机制,为提高作物NUE提供科学理论依据。
参 考 文 献:
[1]沈其荣, 汤利, 徐阳春. 植物液泡中硝酸盐行为的研究概况[J]. 土壤学报, 2003, 40(3): 465–470. Shen Q R, Tang L, Xu Y C. A review on the behavior of nitrate in vacuoles of plants [J]. Acta Pedologica Sinica, 2003, 40(3): 465–470.
[2]田飞. 油菜氮高效种质的筛选及高效机制[M]. 武汉: 华中农业大学硕士论文, 2011. Tian F. Screening of high nitrogen efficient rapeseed and its mechanism [D]. Wuhan: MS Thesis of Huazhong Agricultural University, 2011.
[3]Miller A J, Smith S J. Cytosolic nitrate ion homeostasis, could it have a role in sensing nitrogen status [J]. Annals of Botany, 2008, 101: 485–489.
[4]Xu G H, Fan X R, Miller A J. Plant nitrogen assimilation and use efficiency [J]. The Annual Review of Plant Biology, 2012, 63: 153–182.
[5]Chen X P, Cui Z L, Fan M S, et al. Producing more grain with lower environmental costs [J]. Nature, 2014, 514: 486–489.
[6]Sutton M A, Bleeker A, Howard C M, et al. Our nutrient word, the challenge to produce more food and energy with less pollution[D]. Beijing: Published by the Centre for Ecology and Hydrology (CEH), 2013.
[7]Zhang Z H, Song H X, Liu Q, et al. Nitrogen redistribution characteristics of oilseed rape varieties with different nitrogen use efficiencies during later growth period [J]. Communications in Soil Science and Plant Analysis, 2010, 41(14): 1693–1706.
[8]Schroeder J L, Delhaize E, Frommer W B, et al. Using membrane transporters to improve crops for sustainable food production [J]. Nature, 2013, 497: 60–66.
[9]Wang G L, Ding G D, Li L, et al. Identification and characterization of improved nitrogen efficiency in interspecific hybridized new-type Brassica napus [J]. Annals of Botany, 2014, 114(3): 549–559.
[10]Tang T F, Sun X C, Hu C X, et al. Genotypic differences in nitrate uptake, translocation and assimilation of two Chinese cabbage cultivars [Brassica campestris L. ssp. Chinesnsis (L.)] [J]. Plant Physiology and Biochemistry, 2013, 70: 14–20.
[11]Smirnoff N, Stewart G. Nitrate assimilation and translocation by higher plants: Comparative physiology and ecological consequences [J]. Physiologia Plantarum, 1985, 64: 133–140.
[12]Andrews M. The partitioning of nitrate assimilation between root and shoot of higher plants [J]. Plant Cell Environment, 1986, 9: 511–519.
[13]Tang Z, Fan X R, Li Q, et al. Knockdown of a rice stelar nitrate transporter alters long-distance translocation but not root influx [J]. Plant Physiology, 2012, 160: 2052–2063.
[14]Lin S H, Kou H F, Canivenc G, et al. Mutation of the arabidopsis NRT1.5 nitrate transporter causes defective root-to-shoot nitrate transport [J]. The Plant Cell, 2008, 20: 2514–2528.
[15]Chen C Z, Lv X F, Li J Y, et al. Arabidopsis NRT1.5 is another essential component in the regulation of nitrate reallocation and stress tolerance [J]. Plant Physiology, 2012, 159: 1582–1590.
[16]Li J Y, Fu Y L, Pike S M, et al. The arabidopsis nitrate transporter NRT1.8 functions in nitrate removal from the xylem sap and mediates cadium tolerance [J]. The Plant Cell, 2010, 22: 1633–1646.
[17]Zhang G B, Yi H Y, Gong J M. The arabidopsis ethylene/jasmonic acid-NRT signaling module coordinates nitrate reallocation and the trade-off between growth and environmental adaption [J]. The Plant Cell, 2014, 26(10): 3984–3998.
[18]Leran S, Varala K, Boyer J C, et al. Aunified nomenclature of nitrate transporter 1/peptide transporter family members in plants [J]. Trends in Plant Science, 2014, 19(1): 5–9.
[19]Glass A D M, Britto D T, Kaiser B N, et al. The regulation of nitrate and ammonium transport systems in plants [J]. Journal of Experimental Botany, 2002, 53: 855–864.
[20]Granstedt R C, Huffaker R C. Identification of the leaf vacuole as a major nitrate storage pool [J]. Plant Physiology, 1982, 70: 410–413.
[21]Krebs M, Beyhl D, Gorlich E, et al. Arabidopsis V-ATPase activity at the tonoplast is required for efficient nutrient storage but not for sodium accumulation [J]. PNAS, 2010, 107: 3251–3256.
[22]黄海涛, 荣湘民, 宋海星, 等. 外源硝酸还原酶抑制剂对油菜植株体内NR活性的影响及其与硝酸盐含量的关系[J]. 作物学报, 2013, 39(9): 1668–1673. Huang H T, Rong X M, Song H X, et al. Effects of nitrate reductase (NR) inhibitor on NR activity in oilseed rape and its relation to nitrate content [J]. Acta Agronomica Sinica, 2013, 39(9): 1668–1673.
[23]Angeli A D, Monachello D, Ephritikhine G, et al. The nitrate/proton antiporter AtCLCa mediates nitrate accumulation in plant vacuoles [J]. Nature, 2006, 442: 939–942.
[24]Gaxiola RA, Li J S, Undurraga S, et al. Drought and salt tolerant plants result from over expression of the AVP1 H+-pump [J]. PNAS 2001, 98(20): 11444–11449.
[25]Brux A, Liu T Y, Krebs M, et al. Reduced V-ATPPase activity in the trans-Golgi network causes oxylipin-dependent hypocotyl growth inhibition in arabidopsis [J]. The Plant Cell, 2008, 20: 1088–1100.
[26]Martinoia E, Massonneau A, Frangne N. Transport processes of solutes across the vacuolar membrane of higher plants [J]. Plant Cell Physiology, 2000, 41(11): 1175–1186.
[27]Han Y L, Liao Q, Yu Y, et al. Nitrate reutilization mechanisms in the tonoplast of two Brassica napus genotypes with different nitrogen use efficiency [J]. Acta Physiologia Planturum, 2015, 37: 42.
[28]黄海涛, 张振华, 宋海星, 等.基于液泡膜质子泵的硝态氮再利用研究进展[J]. 生态学杂志, 2012, 31(3): 731–737. Huang H T, Zhang Z H, Song H X, et al. Nitrate nitrogen reutilization based on proton pump of vacuole membrane: A review [J]. Chinese Journal of Ecology, 2012, 31(3):731–737.
[29]Martinoia E, Heck U, Wiemken A. Vacuoles as storage compartments for nitrate in barley leaves [J]. Nature, 1981, 289: 292–294.
[30]黄彩变, 王朝辉, 李生秀. 植物液泡硝态氮累积的营养和生理学意义[J]. 土壤, 2006, 38(6): 820–824. Huang C B, Wang Z H, Li S X. Nutritional and physiological significance of nitrate accumulation in plant vacuolar [J]. Soils, 2006, 38(6):820–824.
[31]Koprivova A, Harper A L, Trick M, et al. Dissection of the control of anion homeostasis by associative transcriptomics in Brassica napus [J]. Plant Physiology, 2014, 166: 442–450.
[32]Crawford N M, Glass A D M. Molecular and physiological aspects of nitrate uptake in plants [J]. Trends in Plant Science, 1998, 3: 389–395.
[33]Leij M V D, Smith S J, Miller A J. Remobilisation of vacuolar stored nitrate in barley root cells [J]. Planta, 1998, 205: 64–72.
[34]Chopin F, Orsel M, Dorbe M F, et al. The arabidopsis ATNRT2.7 nitrate transporter controls nitrate content in seeds [J]. Plant Cell, 2007, 19: 1590–1602.
[35]Wissing F, Smith J A C. Vacuolar chloride transport inMesembryanthemum crystallinum L. measured using the fluorescent dye lucigenin [J]. Journal of Membrance Biology, 2000, 177: 199–208.
[36]屈娅娜, 於丙军. 氯离子通道抑制剂对盐胁迫下野生和栽培大豆幼苗离子含量等生理指标的影响[J]. 南京农业大学学报, 2008, 31(2): 17–21. Qu Y N, Yu B J. Effects of chloride channel blockers on ion contents and other physiological indexes of glycine soja and glycinemax seedlings under NaCl stress [J]. Journal of Nanjing Agricultural University, 2008, 31(2): 17–21.
[37]Berechi G, Varga Z, Van Duijn B, Duijn B. Anion channels in characorallina tonoplast membrane: calcium dependence and rectification [J]. Journal of Membrane Biology, 1999, 172: 159–168.
[38]White P J, Broadley M R. Chloride in soils and its uptake and movement within the plant: a review [J]. Annual Botany, 2001, 88: 967–988.
[39]於丙军, 刘友良. 植物中的氯、氯通道和耐氯性[J]. 植物学通报2004, 21(4): 402–410. Yu B J, Liu Y L. Chlorine, chloride channel and chloride tolerance in plants [J]. Chinese Bulletin of Botany, 2004, 21(4): 402–410.
[40]Qu Y N, Zhou Q, Yu B J. Effects of Zn2+and nuflumic acid on photosynthesis in glycine soja and glycine max seedlings under NaCl stress [J]. Environmental and Experimental Botany, 2009, 65: 304–309.
[41]Barbier-Brygoo H, Angeli A D, Filleur S, et al. Anion channels/transporters in plants: from molecular bases to regulatory networks [J]. Annual Review of Plant Biology, 2011, 62: 25–51.
[42]Fecht-Bartenbach J V D, Bogner M, Dynowski M, Ludewig U. ClC-b-mediated NO3–/H+exchange across the tonoplast of arabidopsis vacuoles [J]. Plant Cell Physiology, 2010, 51(6): 960–968.
[43]Chiu C C, Lin C S, Hsia A P, et al. Mutation of a nitrate transporter, AtNRT1.4, results in a reduced petiole nitrate content and altered leaf development [J]. Plant Cell Physiology, 2004, 45: 1139–1148.
[44]Geelen D, Lurin C, Bouchez D, et al. Disruption of putative anion channel gene AtCLC-a in Arabidopsis suggests a role in the regulation of nitrate content [J]. Plant Journal, 2000, 21: 259–267.
[45]Monachello D, Allot M, Oliva S, et al. Two anion transporters AtClCa and AtClCe fulfil interconnecting but not redundant roles in nitrate assimilation pathways [J]. New Phytology, 2009, 183: 88–94.
[46]Martinoia E, Maeshima M, Neuhaus H E. Vacuolar transporters and their essential role in plant metabolism [J]. Journal of Experimental Botany, 2007, 58: 83–102.
[47]Chen X Y, Nie L L, Bao H, et al. Modified noninvasive microtest electrophysiological technology for vacuolar H+flux detection [J]. Analytical Biochemistry, 2011, 418: 295–297.
[48]Han Y L, Liu Q, Gu J D, et al. V-ATPase and V-PPase at the tonoplast affect NO3-content in Brassica napus by controlling distribution of NO3-between the cytoplasm and vacuole [J]. Journal of Plant Growth Regulation, 2014, 34: 22–34.
[49]王欢, 王廷枝, 董彩华, 王志强. 大豆液泡膜H+-ATPase的纯化和重组[J]. 中国生物化学与分子生物学报, 2000, 16(1): 110–115. Wang H, Wang T Z, Dong C H, Wang Z Q. Tonoplast H+-ATPase analysis in soybean [J]. Chinese Journal of Biochemistry and Molecular Biology, 2000, 16(1): 110–115.
[50]马挺军, 向远寅, 王沙生. 盐胁迫对胡杨液泡膜H+-ATPase水解活性的影响[J]. 新疆农业大学学报, 2003, 26(2): 43–48. Ma T J, Xiang Y Y, Wang S S. Effects of salt stress on the hydrolytic activity of H+ATPase from Populus euphratica [J]. Journal of Xinjiang Agricultural University, 2003, 26(2): 43–48.
[51]Maeshima M, Hara-Nishimura I, Takeuchi Y K, Nishimura M. Accumulation of vacuolar H+-Pyrophosphatase and H+-ATPase during reformation of the central vacuole in germinating pumpkin seeds [J]. Plant Physiology, 1994, 106: 61–69.
[52]Yang S J, Jiang S S, Kuo S Y, et al. Localization of a carboxylic residue possibly involved in the inhibition of vacuolar H+-pyrophosphatase by N,N'-dicyclohexylcarbodi-imide [J]. Biochemical Journal, 1999, 342: 641–646.
[53]Dschida W J A, Bowman B J. The vacuolar ATPase: Sulfite stabilization and the mechanism of nitrate inactivation [J]. The Journal of Biological Chemistry, 1995, 270(4): 1557–1563.
[54]Zhang Z H, Wang W M, Guan C Y, et al. Mechanisms of nitrogen redistribution in response to enzyme activities and the effects on nitrogen use efficiency in Brassica napus during later growth stages [J]. Pakistan Journal of Botany, 2014, 46(5): 1789–1795.
[55]Marschner H, Kirkby E A B C, Engels C. Importance of cycling and recycling of mineral nutrients within plants for growth and development [J]. Botanica Acta, 1997, 110: 265–273.
[56]Dechorgnat J, Nguyen C T, Armengaud P, et al. From the soil to the seeds: the long journey of nitrate in plants [J]. Journal of Experimental Botany, 2011, 62: 1349–1359.
[57]Herdel K, Schmidt P, Feil R, et al. Dynamics of concentrations and nutrient fluxes in the xylem of Ricinus communis-diurnal course, impact of nutrient availability and nutrient uptake [J]. Plant Cell Environment, 2001, 24: 41–52.
[58]Fan S C, Lin C S, Hsu P K, et al. The Arabidopsis nitrate transporter NRT1.7, expressed in phloem, is responsible for source-to-sink remobilization of nitrate [J]. Plant Cell, 2009, 21: 2750–2761.
[59]Wang Y Y, Tsay Y F. Arabidopsis nitrate transporter NRT1.9 is important in phloem nitrate transport [J]. The Plant Cell, 2011, 23: 1945–1957.
[60]轩红梅, 王永华, 魏利婷, 等. 小麦幼苗叶片中硝酸盐转运蛋白NRT1和NRT2家族基因对氮饥饿响应的表达分析[J]. 麦类作物学报, 2014, 34(8): 1019–1028. Xuan H M, Wang Y H, Wei L T, et al. Transcription analysis of the genes encoding nitrate transporter NRT1 and NRT2 families in response to nitrogen starvation in wheat seedling leaves [J]. Journal of Triticeae Crops, 2014, 34(8): 1019–1028.
[61]马翠. 水稻硝酸盐转运蛋白基因 OsNRT1.2 和 OsNRT1.5 超量表达材料的功能鉴定[J]. 南京: 南京农业大学硕士论文, 2011. Ma C. Characteristics of over-expression for nitrate transporter genes OsNRT1.2 and OsNRT1.5 in rice[M]. Nanjing: MS Thesis of Nanjing Agricultural University, 2011.
[62]Zhang Z H, Song H X, Liu Q, et al. Distribution characters of absorption nitrogen in oilseed rape (Brassica napus L.) at different growth stages [J]. Journal of Plant Nutrition, 2014, 37: 1648–1660.
[63]Hernandez L E, Garate A, CarpenaRuiz R. Effects of cadmium on the uptake, distribution and assimilation of nitrate in Pisum sativum [J]. Plant and Soil, 1997, 189: 97–106.
[64]贾莉君. 离子选择微电极测定植物细胞跨膜电位和液泡中硝酸根离子活度的方法研究[M]. 南京: 南京农业大学硕士论文, 2006. Jia L J. The using of microelectrode studying trans-membrane potential and nitrate activity in plant cell [M]. Nanjing: MS Thesis of Nanjing Agricultural University, 2006.
The relationship between nitrate transport and utilization in crop and nitrogen utilization efficiency
ZHANG Zhen-hua
( College of Resource & Environment, Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China/Hunan Agricultural University, Changsha 410128, China )
【Objectives】Ammonia (NH4+) and nitrate (NO3–) are the primary forms for crop nitrogen (N) absorption and utilization. NO3–accumulation and utilization in plant tissues of dry land crops are the main components of N nutrient study, which are related to the NO3–content and N utilization efficiency (NUE) in plant tissues. 【Main advances】 Absorbed NO3–in crop can be assimilated into organic N directly, secreted to the root, accumulated into vacuolar space and transported from roots to shoots. NO3–utilization efficiency and NUE were regulated by NO3–short distribution (vacuole NO3–distribution) and NO3–long transportation (between roots and shoots). Vacuole NO3–can not be assimilated into organic N, but the NO3–outside of the vacuole in protoplast can be utilized by crop directly. The higher proportion of NO3–in shoots has higher NUE, because the NO3–assimilation in shoots will take full advantage of the solar energy. In addition, NO3–is separated by vacuole, NO3–assimilation genes (NR) and transportation genes (NRT1.5 and NRT1.8 for long transport of NO3–) can not be induced by vacuole NO3–, but can be stimulated by the cytosolic NO3–. Consequently, not only NO3–assimilation is regulated by NO3–short distribution, but also affected the NO3–long transport between roots and shoots.【Prospective】We summarized the mechanisms of NO3–short distribution and long transportation in thisreview, and provided some implications for further study on the relationship between NO3–long transportation and vacuole NO3–short distribution, and the response of crop NUE to NO3–transportation and utilization.
nitrate; nitrogen utilization efficiency; long transportation; short distribution
2015–08–17接受日期:2015–11–07
国家自然科学基金项目(31101596);湖南省高校创新平台开放基金项目(13K062);湖南省百人计划项目资助。
张振华(1982—),男,湖南怀化人,博士,副教授,主要从事植物营养生理研究。E-mail:zhzh1468@163.com
