蚕豆增加直径为 0.3~0.7 mm 的中等根系根长适应土壤异质养分供应
2017-03-02廖晗茹李春杰李海港张福锁
廖晗茹,李春杰,李海港,张福锁
(中国农业大学资源与环境学院,北京 100193)
蚕豆增加直径为 0.3~0.7 mm 的中等根系根长适应土壤异质养分供应
廖晗茹,李春杰,李海港*,张福锁
(中国农业大学资源与环境学院,北京 100193)
【目的】土壤养分通常呈异质分布。蚕豆根系具有很强的养分活化能力,苗期蚕豆的生物量积累对土壤养分供应不敏感,研究蚕豆根系形态对异质养分供应的响应,为挖掘作物高效利用土壤养分的生物学潜力提供理论依据。 【方法】采用盆栽试验,设四个处理:均质供应低量氮磷钾养分;异质供应低量氮磷钾养分;均质供应高量氮磷钾养分;异质供应高量氮磷钾养分。测定蚕豆生物量、根系形态特征、根际过程和地上部养分吸收。 【结果】蚕豆地上部生物量在 3.0~4.0 g/pot 之间,根系生物量是地上部生物量的 20% 左右,四个处理间没有显著差异。在低养分土上,异质养分供应处理的蚕豆总根系长度比均质养分供应高 46.0%。异质养分供应诱导了中等根系 (0.3~0.7 mm) 的增生,增加了根系总长度。在高养分土上,未供应养分一侧的蚕豆根系长度为1.7 m/pot,明显高于供应养分的一侧 54.5%,后者与均质养分供应的根系长度无明显差异。无论低养分还是高养分土处理,直径为 0.3~0.7 mm 的中等根系都是蚕豆根系的主体,分别占总根长的 67.5% 和 73.1%。蚕豆比根长在 40.0~65.0 m/g 之间。在低养分土上,异质养分供应蚕豆两侧的比根长显著高于均质养分供应处理41.4% 和 43.8%,但两侧比根长并无明显差异,说明异质养分供应能够减少根系的直径,增加根系的表面积。蚕豆根际酸性磷酸酶活性在 PNP 0.22~0.53 μmol/(g·h)(干土)之间。在低养分土中,均质与异质供应养分两侧的根际磷酸酶活性并无显著性差异。蚕豆根系分泌的有机酸阴离子种类有苹果酸阴离子、柠檬酸阴离子和琥珀酸阴离子,每种有机酸阴离子浓度在处理间无明显差异。所有处理蚕豆地上部养分浓度均在养分亏缺临界浓度之上。养分供应方式和强度对蚕豆地上部的氮磷钾浓度和吸收量没有显著影响。 【结论】蚕豆根系能够感知土壤养分供应的状况,改变不同直径根系的比例和 0.3~0.7 mm 直径根系的长度,增强吸收土壤养分的能力。
异质养分供应;蚕豆;根系长度
土壤中植物残体的分解,降雨和土壤水分蒸发,人为耕作措施 (施肥、翻耕、灌溉等) 及其他土壤生化过程,导致了土壤养分呈现异质性分布。在长期进化过程中,植物根系具有了利用异质性分布的土壤养分的能力[1–4]。大麦在局部施用硝态氮(NO3–)、铵态氮 (NH4+) 和磷 (HPO42–) 的区域大量增生根系,增加了养分富集区的总根长、比根长、侧根长度和密度,对养分的吸收速率增大[4]。丛生草(Agropyron desertorurn) 仅一天内就可以在施肥区增生 2~4 倍的根系[5]。养分富集区的特性会影响到根系增生的效果[5–10]。根系增生的幅度与养分区养分供应的强度紧密相关,并且持续供应等量养分比一次性供应更能促进根系的增生[6–7]。养分富集区根系形成的速率增加,死亡的速率也增加,增生是两种速率平衡的结果[8]。根系增生会受养分富集区的大小的影响,但菌根对其没有显著影响[9]。
在之前根系响应土壤异质养分供应的研究中,往往采用氮磷钾养分单独施用或氮磷配施,但是实际生产中往往将氮磷钾养分混合施用。因此,研究作物根系形态对异质氮磷钾养分的响应及其对作物生物量的贡献,对于提高养分利用效率具有重要的农学和生态学意义。
蚕豆是我国重要的豆科作物,广泛种植于西北和西南地区。蚕豆具有庞大的根系,与大多数禾本科作物相比,根系较粗[10]。蚕豆根系具有很强的养分活化能力[11],是生理适应型的作物。植株生长和养分吸收对土壤的养分供应不敏感[12]。但是,蚕豆根系形态响应土壤异质养分供应的研究较少。
在本研究中,通过土培试验模拟均质和异质氮磷钾养分供应的土壤环境,探索蚕豆根系形态在低和高养分供应的背景下对异质环境的响应,为理解蚕豆高效利用养分的机制提供理论依据。
1 材料与方法
1.1 试验设计
试验在中国农业大学温室中进行,供试材料为蚕豆 (临蚕 5 号),供试土壤取自中国农业大学昌平长期定位试验站 (40°01′N,116°16′E) 的长期不施用养分的空白处理土壤 (低养分土)。土壤理化性状:土壤有机质 12.3 g/kg、Nmin 8.51 mg/kg、Olsen-P 2.59 mg/kg、NH4OAc-K 101.3 mg/kg、pH 8.16、容重1.38 g/cm3。土壤风干后过 2 mm 筛,除去植物残体备用。培养盆直径 17 cm,高 20 cm,每盆装 2.0 kg风干土。在每盆土壤中加入 MgSO4·7H2O 86.7 mg/pot、Fe-EDTA 8.7 mg/pot、MnSO4·H2O 13.3 mg/pot、ZnSO4·7H2O 20 mg/pot、CuSO4·5H2O 4.0 mg/pot、H3BO31.3 mg/pot、(NH4)6Mo7O24·4H2O 0.247 mg/pot。
试验设 4 个处理 (图 1):1) 均质供应低量氮磷钾养分 (Low-Ho);2) 异质供应低量氮磷钾养分 (Low-He);3) 均质供应高量氮磷钾养分 (High-Ho);4) 异质供应高量氮磷钾养分 (High-He)。供试氮素为CO(NH2)2,磷、钾为 KH2PO4。低量氮磷钾养分为CO(NH2)2429 mg/pot、KH2PO4878 mg/pot,均匀施入低量氮磷钾养分的低养分土定义为高养分土,高量氮磷钾是高养分土再加入一倍的低量氮磷钾养分。处理 3 将高养分土再均匀施入一倍的低量氮磷钾养分,处理 4 则在高养分土的基础上,按标记在盆一侧的一半土壤中再施入低量氮磷钾养分 CO(NH2)2429 mg/pot、KH2PO4878 mg/pot。每个处理 5 个重复,共计 20 盆。试验采用完全随机设计。
蚕豆种子在通气的饱和 CaSO4溶液浸泡 24 小时,然后整齐摆放在铺有吸水纸托盘 (酒精消毒)上,用饱和 CaSO4溶液湿润后盖上滤纸,并放置在25℃ 培养箱中培养 48 小时。选取发芽程度相似的种子播种。每盆 4 颗,并在播种时接种固氮菌(Rhizobium sp. Strain NM533)。每隔 2~3 天以称重法按 70% 最大田间持水量通过毛细管作用从底部补充水分,最大程度上减小浇水导致的土壤养分在盆中移动的影响。待植株长至 2~3 片叶时,每盆保留两株长势相似苗,种植 31 天后收获。
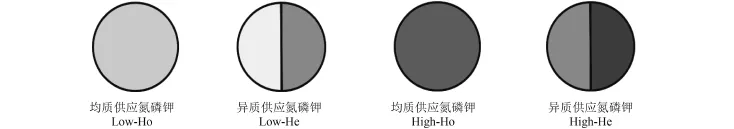
图1 试验处理图示 (俯视图)Fig.1 Digram of treatments (plan view)
1.2 测定项目与方法
1.2.1 生物量的测定 用剪刀从植株的茎基部剪断地上部,装入信封中,在 105℃ 下杀青 30 分钟后,在70℃ 下烘干 48 小时至恒重后称重。同时将根系从土壤中分侧取出,回收土壤中的断根,用去离子水冲洗干净,扫描后烘干至恒重称重。
1.2.2 根系形态的测定 按照土壤装盆前标记在完成植株地上部取样后用刀将盆带土切为两半,分别收集两侧根系,尽量避免根系损失。将收集根系洗净后,用根系扫描仪 (Epson Expression 1600 pro,ModelEU-35,Japan) 进行扫描得到根系扫描图。然后用 WinRHIZO 图像分析系统 (WinRHIZO Pro2004b,version 5.0,Canada) 进行分析后获得根系总根长和比根长参数。
1.2.3 根际酸性磷酸酶活性及有机酸浓度的测定 收获地上部植株后,根据播种时的记号,将盆用刀切割为两半,分别收集根系,轻轻抖掉根系上的疏松土壤,没有掉落紧紧附着在根系上的土壤定义为根际土壤。将带有根际土壤的新鲜根系浸入到 50 mL 0.02 mmol/L CaCl2溶液中 (保证根系刚好全部浸入液面下且时间 60 s),并轻轻摇动,然后将根系取出。取上清液 2 份分别用于测量根际酸性磷酸酶活性和有机酸阴离子浓度;将剩余溶液自然风干后,收集根际土并烘干至恒重后记录烘干土质量。
1.2.4 养分含量的测定 地上部和根系称重后,用粉碎机粉碎为粉末。取部分样品用 H2SO4–H2O2消煮。取消煮液进行氮 (蒸馏法)、磷 (钒钼黄比色法) 和钾(火焰光度法) 含量测定。
1.3 数据分析
采用 Microsoft Excel 2007 记录并整理数据;用SAS System Program (SAS 2001,USA) 对数据进行方差分析;用 SigmaPlot 10.0 (SigmaPlot 2006,Germany)进行作图。
2 结果与分析
2.1 蚕豆地上部及根系生物量对异质氮磷钾养分供应的响应
蚕豆地上部生物量在 3.0~4.0 g/pot 之间 (图 2a)。养分供应强度和方式并未显著改变蚕豆地上部的生物量。蚕豆根系生物量是地上部生物量的 20% 左右(图 2b),各处理间没有显著差异。
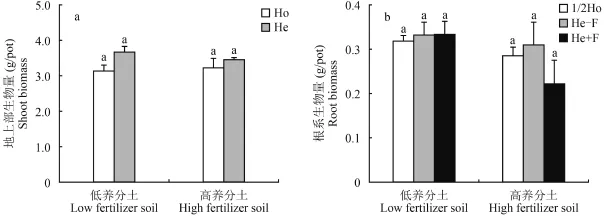
图2 地上部 (a) 和根系 (b) 生物量对异质氮磷钾养分的响应Fig.2 Shoot (a) and root (b) biomass in responses to the heterogeneous nutrients (NPK) supply
2.2 蚕豆根系形态对异质氮磷钾养分供应的响应
在低养分土上,异质养分供应的蚕豆总根系比均质养分供应高 46.0%,但异质养分供应植株在供应养分侧与未供应养分侧的总根长无显著性差异 (图3a)。在高养分土上,异质养分供应的蚕豆与均质养分供应相比并没有增加总根长,但未供应养分一侧的根系长度为 1.7 m,显著高于供应养分侧 54.5%。蚕豆比根长在 40.0~65.0 m/g 之间。在低养分土上,异质养分供应植株两侧的比根长显著高于均质养分供应处理 41.4% 和 43.8%,但两侧比根长并无明显差异 (图 3b)。
在高养分土上,蚕豆比根长在各处理间差异不大。无论在低养分土还是高养分土上,根系直径在0.3~0.7 mm 之间的中等根系是蚕豆根系的主体,平均分别占总根长的 67.5% 和 73.1% (图 3c,d)。粗根系 (直径 > 0.7 mm) 和细根系 (直径 < 0.3 mm) 的根系长度保持相对稳定,各处理间没有显著差异。然而,在低养分土上,异质养分供应蚕豆的中等根系 (0.3~0.7 mm) 根长显著大于均质养分供应处理 58.0%,两侧根长无显著差异 (图 3c)。
在高养分土上,异质养分供应的根系与均质养分供应相比没有显著差异,异质养分处理中未供应养分的一侧的中等根系根长显著高于供应养分一侧(图 3d)。
2.3 蚕豆根际分泌物对异质养分的供应响应
蚕豆根际酸性磷酸酶活性为 PNP 0.22~0.53 μmol/(g·h),干土 (表 1)。在低养分土处理中,均质与异质供应养分两侧的根际磷酸酶活性并无显著性差异。而在高养分土处理中,异质养分供应处理中施用养分侧根际酸性磷酸酶活性显著高于均质养分和异质养分供应处理中不施用养分侧。蚕豆根系分泌的有机酸阴离子种类有苹果酸阴离子、柠檬酸阴离子和琥珀酸阴离子。根际中苹果酸的浓度在1.30~2.52 mmol/g,干土之间,高于琥珀酸 (0.24~0.49 mmol/g,干土) 和柠檬酸 (0.37~0.87 mmol/g,干土) 的浓度。每种有机酸阴离子浓度在处理间无明显差异。
2.4 蚕豆氮磷钾养分的吸收对异质养分的响应
养分供应方式和强度对蚕豆体内的氮磷钾浓度没有显著的影响 (表 2)。蚕豆体内的氮浓度在 18.0~18.7 mg/g 之间,磷浓度在 5.9~6.4 mg/g 之间,钾浓度在 19.1~24.4 mg/g 之间。蚕豆氮磷钾的吸收量各处理间也没有显著差异,高养分土上蚕豆的养分吸收与低养分土相比并没有明显的提高。
3 讨论
蚕豆苗期生长对土壤养分供应反应不明显[12]。本试验中,土壤养分肥力水平和养分供应方式没有影响到蚕豆地上部生物量的积累,这与以前的研究结果一致。所有处理蚕豆地上部氮磷钾的含量均大于缺乏的临界浓度 (氮 10 mg/g、磷 2 mg/g、钾 3 mg/g)[13],因此,蚕豆在生长期没有受到养分缺乏的胁迫。这可能由于蚕豆种子比较大,含有大量的养分 (蚕豆种子的氮含量为 68.05 mg/seed、磷含量为7.05 mg/seed、钾含量为 15.33 mg/seed)。苗期蚕豆的生长所需养分在一定程度上来自种子储存养分再转移,减少了从土壤里获取的养分在蚕豆生长中的作用,所以在一定时期内土壤养分供应可能不会对植物地上部生长产生明显影响。蚕豆具有很强的共生固氮能力。在氮缺乏的条件下,根瘤固氮占植株氮的近 60%[14]。所固定的氮可以补充蚕豆的氮吸收。缺磷蚕豆能够明显的改变根际 pH,并且向根际分泌有机酸阴离子和酸性磷酸酶,从而活化土壤磷,提高对土壤磷的吸收利用[11]。本试验中低养分处理中蚕豆并未提高酸性磷酸酶活性和有机酸阴离子的分泌,可能归因于作物生长没有受到磷缺乏的胁迫。

图3 蚕豆根系形态对异质氮磷钾养分的响应Fig.3 Root morphology responses in heterogeneous nutrients (NPK) supply
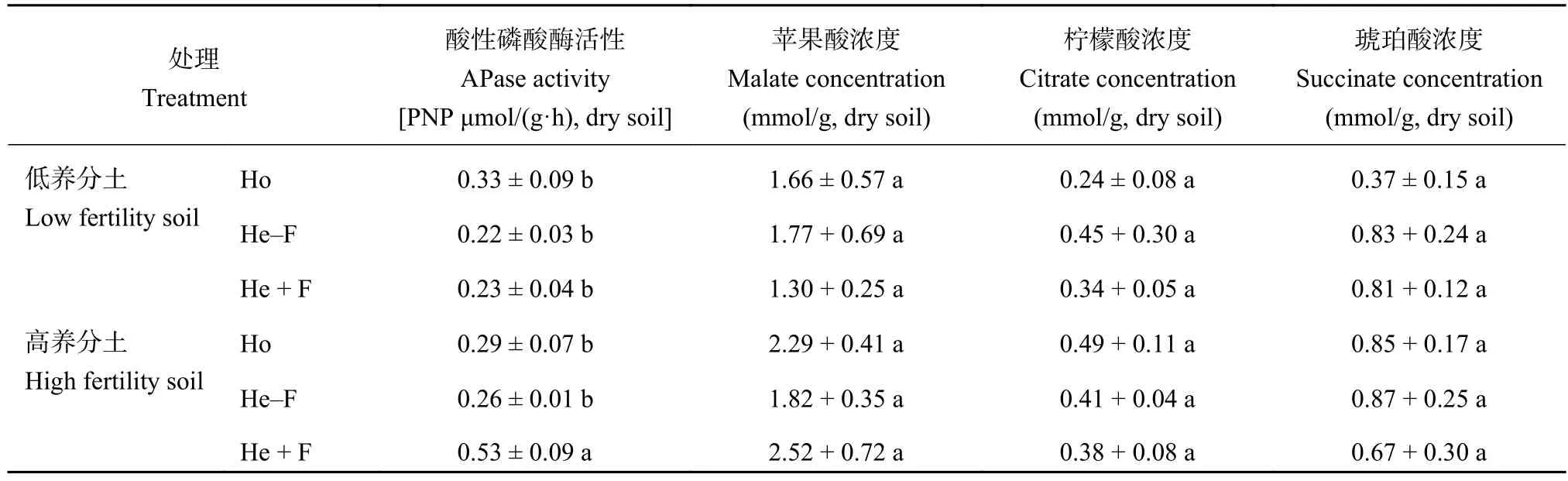
表1 蚕豆根系分泌物对异质氮磷钾养分供应的响应Table 1 Root exudations of fababean in responses to the heterogeneous nutrients (NPK) supply
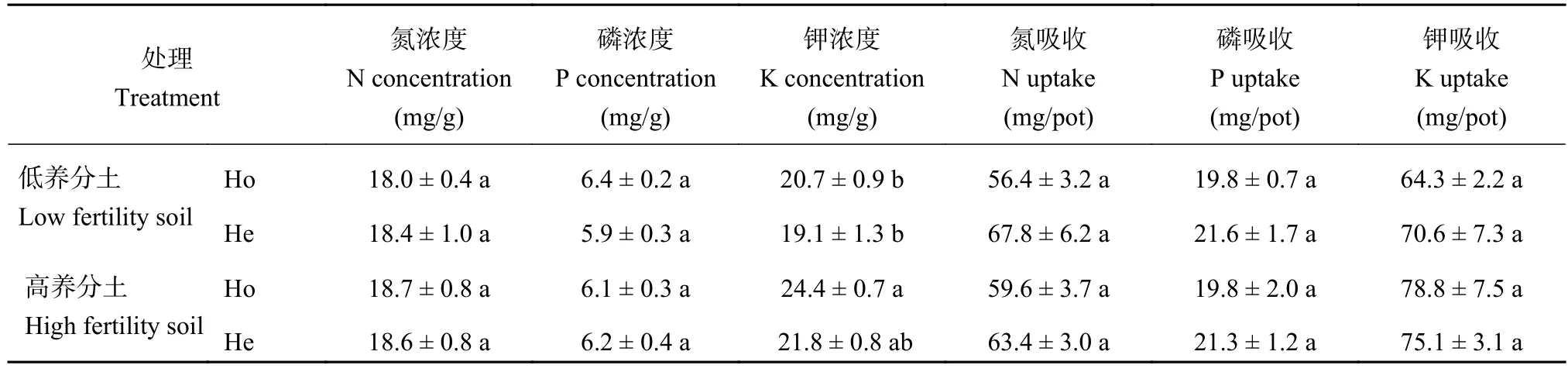
表2 异质氮磷钾养分供应下蚕豆地上部养分浓度与养分吸收Table 2 Shoot nutrients concentrations and uptakes in responses to the heterogeneous nutrients (NPK) supply
植物根系,如棉花、小麦、玉米、鹰嘴豆等,能够感知土壤养分供应的异质性,并做出相应的反应,增加根系对土壤异质性养分的吸收,改善植物的营养状况[15–18]。棉花超过 60% 根系分布在局部供应养分的一侧[16],局部供应硝态氮和磷明显增加施肥区的小麦和玉米根系密度[17–18],同时局部供应铵态氮和磷小麦和玉米根系在施肥区也会大量增生[18]。根系对外部环境可能较地上部更加敏感,牧草 Festuca rubra 根系当遇到邻近作物时会大量增生,增加的幅度超过了地上部的变化[19],地上部营养状况往往能够调控根系对外界养分的响应程度。地上部高浓度的硝酸盐含量抑制了局部硝酸盐供应对拟南芥根系增生的刺激作用[20]。本试验中,蚕豆地上部养分浓度处理间没有明显的差异,表明根系生长所受的地上部营养调控近似,根系生长的差异主要来源于根系对土壤养分供应的反应。
生长在低养分土壤上的蚕豆有养分供应和未供应侧均产生了大量的细根,增加了根系养分的吸收面积,提高了对土壤养分的吸收能力,而生长在高养分土上的蚕豆仅在养分供应侧产生了大量的细根,表明蚕豆在未受到养分胁迫的情况下,根系能够感知土壤养分供应的不足,产生相应适应环境的改变,避免植株生长受到养分缺乏的胁迫。但这些改变并没有增加蚕豆对根系的光合碳投入,不会影响地上部生物量的积累。根系直径的减小,让植物以更小的光合碳投入去探索更多的体积,是植物对土壤养分缺乏的一种有效适应机制[21]。在感知到土壤养分异质性供应后,蚕豆增加中等根系的根长,扩大了养分的吸收面积,同时维持了粗根系和细根系的数量。粗根系具有支撑植物的作用,而细根系虽具有更多的表面积,但周期短,易致使光合碳的损失[21]。蚕豆只改变中等根系的策略,既扩大了根系的吸收面积,保持了根系的支撑能力,又避免了根系过快的周转速率及过多的光合碳的损失。
4 结论
异质氮磷钾养分供应没有改变苗期蚕豆生物量和地上部养分的吸收。根系对异质养分供应的响应受土壤养分水平的调控。在低养分土上,苗期蚕豆在养分供应侧和未供应侧均产生了大量的中等根系,在高养分土上,仅在未供应养分侧有此现象。异质养分供应诱导未受养分胁迫的蚕豆增生中等根系,同时保持粗根和细根的数量,这样既扩大了根系的吸收面积,又能维持植物支撑能力和避免由于根系周转过快而造成光合碳的过多的损失。因此,蚕豆能够根据土壤养分供应状况来改变根系形态,具有高效利用土壤养分的生物特性。
[1]Drew M C, Saker L R. Nutrient supply and the growth of the seminal root system in Barley II. Localized, compensatory increases in lateral root growth and rates of nitrate uptake when nitrate supply is restricted to only part of the root system [J]. Journal of Experimental Botany, 1975, 26(90): 79–90.
[2]Hodge A. The plastic plant: root responses to heterogeneous supplies of nutrients [J]. New Phytologist, 2004, 162(1): 9–24.
[3]王绍辉, 张福墁. 局部施肥对植株生长及根系形态的影响[J]. 土壤通报, 2002, 33(2): 153–155. Wang S H, Zhang F M. Effect of localized supply of fertilizer on growth and morphological of crops [J]. Chinese Journal of SoilScience, 2002, 33(2): 153–155.
[4]Drew M C. Comparison of the effects of a localised supply of phosphate, nitrate, ammonium and potassium on the growth of the seminal root system, and the shoot in barley [J]. New Phytologist, 1975, 75(3): 479–490.
[5]Jackson R B, Caldwell M M. The timing and degree of root proliferation in fertile-soil microsites for three cold-desert perennials [J]. Oecologia, 1989, 81(2): 149–153.
[6]Hodge A, Robinson D, Griffiths B S, et al. Nitrogen capture by plants grown in N-rich organic patches of contrasting size and strength [J]. Journal of Experimental Botany, 1999, 50(336): 1243–1252.
[7]Hodge A, Stewart J, Robinson D, et al. Plant, soil fauna and microbial responses to N-rich organic patches of contrasting temporal availability [J]. Soil Biology and Biochemistry, 1999, 31(11): 1517–1530.
[8]Gross K L, Peters A, Pregitzer K S. Fine root growth and demographic responses to nutrient patches in four old-field plant species [J]. Oecologia, 1993, 95(1): 61–64.
[9]Farley R A, Fitter A H. The responses of seven co-occurring woodland herbaceous perennials to localized nutrient-rich patches[J]. Journal of Ecology, 1999, 87(5): 849–859.
[10]叶茵. 中国蚕豆学[M]. 北京: 中国农业出版社, 2003. Ye Y. Chinese fababean [M]. Beijing: Chinese Agricultural Press, 2003.
[11]Li L, Li S M, Sun J H, et al. Diversity enhances agricultural productivity via rhizosphere phosphorus facilitation on phosphorusdeficient soils [J]. Proceedings of the National Academy of Sciences, 2007, 104: 11192–11196.
[12]Li H G, Shen J B, Zhang F S, et al. Phosphorus uptake and rhizosphere properties of intercropped and monocropped maize, faba bean, and white lupin in acidic soil [J]. Biology and Fertility of Soils, 2010, 46: 79–91.
[13]陆景陵.植物营养学(上册)[M]. 北京: 北京农业大学出版社, 1994. Lu J L. Plant nutrition [M]. Beijing: Beijing Agricultural University Press, 1994.
[14]Fan F L, Zhang F S, Song Y N, et al. Nitrogen fixation of faba bean (Vicia faba L.) interacting with a non-legume in two contrasting intercropping systems [J]. Plant and Soil, 2006, 283: 275–286.
[15]Brouder S M, Cassman K G. Cotton root and shoot response to localized supply of nitrate, phosphate and potassium: Split-pot studies with nutrient solution and vermiculitic soil [J]. Plant and Soil, 1994, 161(2): 179–193.
[16]Weligama C, Tang C, Sale P W G, et al. Localised nitrate and phosphate application enhances root proliferation by wheat and maximises rhizosphere alkalisation in acid subsoill [J]. Plant and Soil, 2008, 312(1–2): 101–115.
[17]Yano K, Kume T. Root morphological plasticity for heterogeneous phosphorus supply in Zea mays L. [J]. Plant Production Science, 2005, 8(4): 427–432.
[18]Li H B, Ma Q H, Li H G, et al. Root morphological responses to localized nutrient supply differ among crop species with contrasting root traits [J]. Plant and soil, 2014, 376(1–2): 151–163.
[19]Padilla F M, Mommer L, de Caluwe H, et al. Early root overproduction not triggered by nutrients decisive for competitive success belowground [J]. PloS one, 2013, 8: e55805.
[20]Zhang H, Forde B. G. An Arabidopsis MADS box gene that controls nutrient-induced changes in root architecture [J]. Science, 1998, 279: 407–409.
[21]Forde B, Lorenzo H. The nutritional control of root development [J]. Plant and Soil, 2001, 232: 51–68.
Increment of root length of 0.3–0.7 mm in diameter in fababean contributes to the adaptation to heterogeneous soil nutrients supply
LIAO Han-ru, LI Chun-jie, LI Hai-gang*, ZHANG Fu-suo
( College of Resources and Environmental Sciences, China Agricultural University, Beijing 100193, China )
【Objectives】Soil nutrients are distributed heterogeneously along soil profile. Fababean has been found a strong capacity to mobilize soil nutrients, and fababean seedlings are insensitive to soil nutrients supply. Studying the responses of fababean root morphology to heterogeneous and low nutrients supply will help exploring biological potential of crops to use soil nutrients efficiently. 【Methods】A pot experiment was carried out inside greenhouse with four treatments including homogenous and heterogeneous nutrients supply in low and high fertility soils. Biomass, root properties, rhizosphere processes and nutrients uptakes were determined.【Results】The shoot biomass ranged from 3.0 to 4.0 g/pot in all the treatments, and the root biomass were only about 20% of the shoot biomass. There were no significant differences on biomass accumulation among treatments. Fababean grown in the low fertility soil had a higher total root length, and the total root length withheterogeneous nutrients supply was 46.0% higher than that with the homogeneous nutrients supply. The heterogeneous nutrients supply significantly stimulated proliferation of roots with middle root diameter (0.3–0.7 mm), which was the main contribution to the increment of the total root length. In the high fertility soil, the root length of the no nutrient supply side was 1.7 m/pot, which was higher than that in the nutrients supply side by 54.5%. The latter was similar with the root length in the treatments of homogeneous nutrients supply. The proportions of root length with middle diameter (0.3–0.7 mm) were 67.5% and 73.1% of the total root length in the low and high fertility soils, respectively. The specific root length of fababean was between 40.0–65.0 m/g in all the treatments. In the low fertility soil, the specific root lengths in both sides of the treatments with heterogeneous nutrients supply were higher than that in the treatments with homogenous nutrients supply by 41.4% and 43.8%, respectively. There were no significant differences on the specific root length between two sides of the treatments with heterogeneous nutrients supply. The results indicated the heterogeneous nutrients supply reduced the diameter of roots and increased root surface. The activity of acid phosphatase (APase) in rhizosphere ranged from PNP 0.22 to 0.53 μmol/(g·h), dry soil. There were no significant differences on the activity of APase between two sides of the treatments with heterogeneous nutrients supply in low fertility soil. Malate, citrate and succinate were found in rhizosphere of fababean. The types of nutrients supply did not affect the concentrations of carboxylates in rhizosphere. The nutrients concentrations of shoot were higher than the critical levels for maximal growth in all the treatments. The nutrients concentration in shoots had no response to the nutrients supply. 【Conclusions】Roots of fababean without nutrients deficiency can modify the proportion of roots with different diameters based on soil nutrients status to improve absorption of soil nutrients.
heterogeneous nutrients supply; fababean; root length
2016–01–25接受日期:2016–06–01
国家重点基础研究发展计划(973-2013CB127402)资助。
廖晗茹(1994—),女,江西省新余市人,硕士研究生,主要从事根际研究。E-mail:liaohanru@163.com
* 通信作者 E-mail:haigangli@cau.edu.cn
