西门子法三氯氢硅氢还原Si-CVD本征动力学模型
2017-03-02刘晓瑞
吴 永,王 伟,刘晓瑞
(银川能源学院,银川 750105)
西门子法三氯氢硅氢还原Si-CVD本征动力学模型
吴 永,王 伟,刘晓瑞
(银川能源学院,银川 750105)
联系生产实际对西门子法三氯氢硅氢还原反应体系的反应做了归类分析,选用可靠适用的热力学基础数据,设计合理计算方案,计算分析16个反应在反应温度区及附近温度区的吉布斯自由能和标准平衡常数数值,利用反应耦合理论提供了将SiHCl3(g)+H2(g)=Si(s)+3HCl(g)作为主反应的热力学依据,确认该主反应与关键组分SiHCl3(g)的两个热分解生成有Si(s)和SiCl4(g)的反应构成的平行反应为生成Si-CVD的主要反应。在此基础上,应用L-H均匀表面吸附理论,借助非均相气-固相催化反应模型方法,导出该还原Si-CVD过程的本征速率方程,进而线性化变换为等价的拟一级不可逆反应动力学模型(简写为,便于动力学参数测定和后续建立宏观动力学模型。
反应工程;多晶硅;西门子法;三氯氢硅氢还原反应;化学气相沉积;热力学分析;本征动力学模型
有关西门子法三氯氢硅(SiHCl3,即三氯甲硅烷)氢还原生成Si并化学气相沉积(CVD )在硅芯基体过程(记作Si-CVD)的研究,国内在热力学研究方面报道不少,但动力学研究成果较少。
20世纪80年代,沈华生[1]在吸收国外研究成果的基础上,对西门子法制备多晶硅反应体系的有关反应和Si-Cl-H三元系统的反应机理等做过系统研究,并在半工业性装置(三对硅芯、四对硅芯还原炉)上进行过实验,其中对该反应体系可能发生的反应和物质组成方面的研究在国内具有开创性、奠基性。徐宝琨等[2]在1981年曾就高温条件下四氯化硅氢还原制半导体硅做过研究,提出按独立组元法研究复杂化学反应体系平衡状态,为研究西门子法反应体系及构成提供了重要方法。进入新世纪以来,由于国内多晶硅产业的迅猛发展,推动了西门子法生产多晶硅的理论研究,一些年轻学者借鉴、吸纳国外研究成果,对该反应体系的热力学研究卓有成效。涉及三氯氢硅氢还原反应体系发生的化学反应,业内比较认同的反应有15~18个,比较重要反应有15个。对体系内(1080~1100 ℃)相对公认的15个反应可按反应物和生成物特点及反应类型归类分列如下。
关键组SiHCl3的热分解反应:


苗军舰等[3-5]对西门子法Si-H-Cl三元系统内可能发生的化学反应做过系统全面的热力学分析计算,并给出了反应的和计算公式和变化图,数据翔实;侯彦青等[6-8]、何恩等[9]借鉴国外学者研究成果,对该体系做了全面系统的热力学分析,还分析了有关操作条件(因素)对多硅硅产率的影响及气相平衡组成;李国栋等[10]对SiHCl3法生产电子级多晶硅3个子系统进行了平衡计算,对SiHCl3还原反应子系统进行了热力学分析;康启宇[11]对硅和四氯化硅耦合加氢制备三氯氢硅工艺做过深入系统的研究;苗军舰等[3-5]和康启宇等[11]也采用独立组元法对反应体系进行了分析。
有关三氯氢硅氢还原生成Si-CVD的主要反应说法尚不一致。梁俊吾[12]认为是反应式(5)和(1);杨德仁[13]认为是反应式(5)或(1)、王樟茂等[14]只提到反应式(5);李汉[15]认为主要反应是反应式(1)和3SiHCl3(g)=Si(s)+ 2SiCl4(g)+HCl(g)+H2(g)及反应式(2);李国栋等[10]认为是反应式(5)和(1)(并建议采用Cl2部分氧化放热:H2+Cl2=2HCl,使SiHCl3还原体系实现能量耦合工艺);苗军舰等[3-5]、侯彦青等[6-8]、康启宇[11]属于认同反应式(5)为主反应并在文中列出,龙桂花[16]将反应式(5)列为主反应、反应式(1)为副反应;邓丰等[17]列出反应式(5)、(2)和(12),但又认为是反应式(3)、(8)及SiCl2+H2→SiH2Cl2→Si(s)+ 2HCl(g)依次或并列进行。上述文献对主要反应的认定均未提供必要的热力学理论依据。
对涉及还原生成Si-CVD过程的重要中间产物,李汉[15]认为是SiH2Cl2(DCS)的生成及分解;邓丰等[17]认为中间产物主要是SiCl2及SiH2Cl2。王友承[18]采用密度反函数理论方法(DFD)研究了三氯氢硅氢还原多晶硅的能量变化,通过Materials Studio 5.0分子模拟软件对SiHCl3还原反应过程中活化能垒进行了计算,利用LST/QST方法搜索到多晶硅还原反应中可能出现的过渡态及其活化能垒,通过比较确定反应能否进行及进行的难易程度,其结论是反应式(6)的活化能垒为939.819 kJ/mol,主反应式(5)为354.986 kJ/mol,约为主反应式(5)的2.65倍,故反应式(6)可忽略[18]。
本文作者对上述分析有两点看法:1) 因SiCl4(TB=3345 K)和SiHCl3(TB=305 K)常温(即298 K)、标准压力时为液态,故凡涉及有SiHCl3(g)、SiCl4(g)的反应,相关标准摩尔生成函数基础数据仍然采用298 K和标压下的数据以及在求或过程中确定积分常数时参考温度取T0=298 K,显然不妥,其逻辑矛盾和偏差必然影响可信度;2) 对通常所说的主反应与利用法估计反应可能性近似规则不符[19]。如苗军舰[5]给出的7×10-3是属于不可能进行的反应。
本文作者取用500 K、标压下的标准摩尔生成焓和生成吉布斯自由能等基础数据,设计规范合理的计算方案,提供8种主要物质的一套可靠适用的热力学数据,计算16个反应的有关热力学函数数值;通过热力学综合分析及反应耦合分析,破解在“主反应”认定上的理论困惑;遵循抓主要矛盾的思想,判定生成Si-CVD的主要反应,进而应用反应工程学经典方法,借助非均相气-固相催化反应模型,导出本征速率方程,为建立宏观动力学模型奠定了基础。
1 西门子法三氯氢硅氢还原反应体系分析
西门子法即三氯氢硅氢还原制备高纯多晶硅工艺,从1954年德国西门子(Siemens)公司获得发明专利,到1965年工业化,此后针对尾气主要成分H2、SiHCl3、SiCl4和HCl的回收及循环利用技术,经过几十年的发展与完善,先后经历了西门子法第一代、第二代和当今的第三代即全闭路循环的改良西门子法,成为生产高纯多晶硅(SG,EG)的主流技术[12,20]。尽管各厂家的工艺流程起点不尽相同,但其核心工艺即在高温钟罩还原炉内用高纯氢气还原高纯三氯氢硅,生成的Si以CVD方式沉积在由高纯硅细棒构成、兼作电加热体和晶种基体的一对对“Π”形硅芯(架棒)表面的过程是相同的,换言之,三代西门子法钟罩炉内还原动力学方程是一致的。
1.1 三氯氢硅氢还原反应体系分析
有关钟罩炉内三氯氢硅氢还原反应体系发生的反应尚无明确的定论,相对公认如前言中的15个反应式。中外众多学者[1-11]研究表明,该反应体系有Si、H2、HCl、SiHCl3、SiCl4、SiH2Cl2、SiH3Cl、SiCl2、SiCl、Si2Cl6等十余种物质,其中前8种为主要物种,其他物质因含量非常少而不加考虑,故一般考察由H、Cl、Si 3种元素、包括Si(s)和H2(g)、HCl(g)、SiCl4(g)、SiHCl3(g)、SiH2Cl2(g)、SiH3Cl(g)、SiCl2(g)等7种气体即8种物质组成的反应体系。生产厂家还原炉尾气在线检测一般只检上列7种气体中的前5种(大多不测SiH3Cl和SiCl2)。如宁夏某多晶硅厂2010年10月10台还原炉正常生产时尾气在线检测报告(注:按操作规程在尾气汇总管取样口取样,具有平均性;如个别炉况异常则单独取样),限于篇幅从50组数据中随机取连续10 d的10组数据(见表1)。
改良西门子法每生产1 kg的Si,一般要产生约10 kg的SiCl4,除了二者摩尔质量比相差大(MSTC/MSi=170/28≈6.1)的原因外,说明生成SiCl4的反应不可忽视。

表1 某厂钟罩炉(改良西门子法)还原尾气分析统计表Table 1 Statistical tables about analyzing reduced exhaust gas in bell furnace (improved Siemens method) for some factory
联系生产实际,本文作者对体系内(1080~1100 ℃)可能发生的,中外学者相对公认的前言中所提及的15个反应,按反应物和生成物的特点大致归纳为以下5类:
1) 关键组分SiHCl3的热分解(含歧化反应)。按生成物(含自由基,下同)分为热分解生成Si和其他产物的反应如(1)、(2);不生成Si而生成SiCl2(g)、SiH2Cl2(g)和SiCl4(g)等的反应(3)、(4);
2) 关键组分氢还原,其中分为还原生成Si的反应(5),即通常所说的主反应;不生成Si而生成氯硅烷(SiH2Cl2(g)和SiH3Cl (g))等的反应(6)、(7);
3) 主要中间产物SiCl2(g)、SiH2Cl2(g)和SiH3Cl (g)再分解生成物有Si的反应(8)、(9)、(10);
4) 中间产物(SiCl2(g)、SiCl4(g))氢还原生成Si的反应,如反应式(11)、(12);
5) 中间产物氢还原生成SiCl2(g)、SiH3Cl (g),SiHCl3(g)和HCl(g)(不生成Si)的反应式(13)、(14)及(15)。
还有反应生成的副产物HCl(g)与关键组分的反应(16):
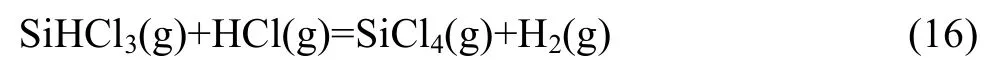
16个反应式中涉及生成物有Si的反应共4类8种,即反应(1)、(2);(5);(8)、(9)、(10);(11)、(12)。
此外,还可能存在Si的腐蚀反应,如反应(9)、(11)、(12)和(5)的逆反应,有些是可控的,故可忽略;还有杂质硼、磷氯化物的H2还原(B,P)反应,因不属于本文研究重点故未列。
仔细分析上列反应,不难发现,反应(5)就是西门子法工艺中用硅粉和氯化氢合成三氯氢硅(280~320℃)反应的逆反应,而反应⑿便是该过程副反应的逆反应(≥350 ℃);反应(2)就是尾气回收处理SiCl4(g)的低温氢化(400~800 ℃)制备SiHCl3(g)的逆反应;而反应(15)是SiCl4(g)高温热氢化(1100~1250 ℃)制备SiHCl3(g)的反应[11],其逆反应(16)可能与尾气中SiCl4(g)高含量有一定关系。
上述反应有的属于简单反应,有些反应可视为复合反应,有的又可视作耦合或串联组合。
1.2 反应体系有关反应的热力学分析
经分析一些权威化学手册,为选用可靠适用的热力学基础数据,采用500 K和标压下的数据(无SiHCl3和SiCl4参与的反应(9)、(10)、(11)、(14)亦可采用298 K(为简化计,下文298.15 K、1373.15 K分别用298 K、1373 K),设计规范合理的计算方案。对H2(g)、HCl(g)、SiCl4(g)、SiHCl3(g)和SiH2Cl2(g)采用文献[21]提供的数据,对cp(T)经验公式“适用温度范围”中Tmin的不妥处做了修正;SiH3Cl(g)和Si(s)的cp,m选用文献[22]的数据;对SiCl2(g)的cp(T)采用文献[23]提供的SiCl2(g)在298 K和300~2200 K间每隔100 K的cp-T离散数据、利用MATLAB软件[24]进行最小二乘法曲线拟合(四次多项式,取小数点后15位,以便与卡尔手册cp(T)经验公式一致),经验算比较满意:

涉及该反应体系8种主要物质的热力学数据汇总如表2所列。
利用表2,先求各反应的Δcp,m(T)及基尔霍夫不定积分式,求得后直接求范特霍夫方程积分式及标准平衡常数,再反求[19],并分别算出和KΘ(T)在3个温度点(即反应温度1100 ℃即1373 K,高温段取1500 K,低温段取900 K)标准压力下的数值,加上500 K时的数值。具体运算时借助于MATLAB软件[24]求得16个反应的相关热力学函数数值(具体运算过程未列出),汇总如表3。
通过热力学综合分析,确定该Si-CVD过程的主要反应,做到“确定有理、忽略有据”。 利用法,结合表3所列有关反应的标准摩尔反应吉布斯自由能和标准平衡常数数值不难看出:
1) 对于通常所说的主反应(5),从该反应的吉布斯自由能和平衡常数值看,属于不能向生成Si方向进行的反应,至少在还原炉反应温区发生还原反应的趋势很小,即使提高到1300 ℃,效果也有限(KΘ(1573 K)5=0.0689)。所以,单将这一反应认定为三氯氢硅氢还原生成Si-CVD的主反应,显然热力学理论依据不足,还应当有其他理由给西门子法50年生产实践以合理的理论解释。
2) 反应(6)和(14)基本属于不可能进行,一般可忽略((6)与文献[18]一致)。反应(13)属于中间产物氢还原,因该反应不生成目标产物硅且吉布斯自由能为很大的正值,平衡常数很低,也可忽略。
3) 前已述及,该体系16个反应中生成物有Si的共4类、8个(参见表3):其中SiHCl3热分解(1)和(2)不可忽视;中间产物(SiCl2、SiH2Cl2、SiH3Cl)再分解即(8)、(9)、(10) 3个反应的标准平衡常数都比较大:,再分别联系其生成(源)反应(3)、(4)、(7)(包括(6)),通过分析反应(10)和(7)与反应(5)的关系,以及(9)和(6)、(9)和(4)、(8)和(3)等类似情况,可发现认定主反应的突破口以及确定主要反应的范围。
4) 反应(16)在还原炉内因高温和原料气中H2(g)大过量而受抑制,但在低温段趋势很大。联系生产实际,每台还原炉外排热尾气经套层预热器(预热入炉原料气)降温后汇合进入车间的尾气输出总管线(上设尾气汇总取样口)送至分离车间。这样,高温尾气经历预热器降温、继而在输出总管至汇总取样口途中继续降温到低温段,促成反应(16)的发生使尾气中SiCl4(g)含量增加(H2(g) 因配比大过量而忽略)。这样,尾气检测中SiCl4(g)含量高于炉内全混流气相之含量就得到合理的热力学解释(与表3热力学数值基本相符)。同理,由反应(8)可知,尾气中残余的SiCl2(g)在低温段剧烈反应转化为SiCl4(g)。至于尾气中未列检物质还不能否认其生成反应,因生成的中间产物可能较快地被分解或被还原,以致尾气中其含量少可忽略,SiH3Cl (g)和SiCl2(g)应属此列。

表2 有关物质在500 K、298.15 K和101 325 Pa下的热力学数据表Table 2 Thermodynamic data of relevant materials at 500 K, 298.15 K and 101 325 Pa
表3 三氯氢硅氢还原反应系统有关反应的、和计算数值汇总表Table 3 Numerical summary table of,andin trichlorosilane hydrogen reduction reaction system

表3 三氯氢硅氢还原反应系统有关反应的、和计算数值汇总表Table 3 Numerical summary table of,andin trichlorosilane hydrogen reduction reaction system
1) Various chemical reaction equation are gas except for that Si is solid. Therefore, phase state markers is omitted for reaction; 2) Number can be got from value of T0=298 K (T0is 298 K or 500 K in reactions (9), (10), (11) and (14)); 3) lnKΘ(1573 K)5=-2.6749, KΘ(1573 K)5=0.0689. Temperature of elevating reaction is limited for improving effect of reduction in reaction (5); 4) Low temperature reaction is severe and completed from KΘ(900 K)8=5.5423×107and lnKΘ(500 K)8=51.5372⇒KΘ(500K)8= exp(51.5372)=2.4122×1022→∞ in reaction (8); 5) High temperature reaction is very severe in reaction (10); 6) Low temperature reaction is very severe from lnKΘ(500 K)11=1.4377; KΘ(500 K)11=exp(1.4377)=4.2110; lnKΘ(298.15 K)17=4.3124, KΘ(298.15 K)11=74.6194 in reaction (11); 7) Low temperature reaction is very severe from lnKΘ(500 K)17=8.0173, KΘ(500 K)17=exp(8.0173)=3.033×103=3033 in reaction (16).
Reaction No.1)500 K2)1373 K 1500 K 900 K 500 K2)1373 K 1500 K 900 K 1373 K 1500 K 900 K Δ/(kJ…mol-1) ln(KΘ/T) KΘ/TrGm(T)Θ (1) 135.640 50.626 38.832 95.851 -32.6273 -4.4342 -3.1136 -12.8091 0.0119 0.0444 2.7358×10-6(2) 68.980 30.873 25.390 51.911 -16.5927 -2.7041 -2.0358 -6.9372 0.0669 0.1306 9.7098×10-4(3) 174.947 45.585 27.432 114.64 -42.0824 -3.9927 -2.1995 -15.3198 0.0184 0.1109 2.2218×10-7(4) 53.860 51.285 50.881 52.746 -12.9557 -4.4920 -4.0797 -7.0487 0.0112 0.0169 8.6854×10-4(5) 168.970 58.847 43.661 117.060 -40.6447 -5.1543 -3.5008 -15.6431 0.0058 0.0302 1.6080×10-73)(6) 87.190 61.165 57.613 74.715 -20.9730 -5.3577 -4.6195 -9.9846 0.0047 0.0099 4.6104×10-5(7) 103.861 1.757 -12.649 55.965 -24.9831 -0.1539 1.0142 -7.4789 0.8574 2.7572 5.6488×10-4(8) -214.254 -40.544 -16.034 -133.43 51.5374 3.5512 1.2856 17.8305 34.8551 3.6168 5.5423×1074)(9) 81.780 -0.659 -12.049 43.015 -19,6717 0.0577 0.9661 -5.7604 1.0594 2.6277 0.0031 (10) 53.650* -50.423 -62.447 -4.4838 -21.6421 4.4165 5.0071 0.5992 82.8060 149.4706 1.82075)(11) -5.977 9.247 10.468 1.6081 1.4377 -0.8099 -0.8393 -0.2149 0.4449 0.4320 0.80666)(12) 202.300 56.742 35.019 136.41 -48.6620 -4.9699 -2.8079 -18.2298 0.0069 0.0603 1.2103×10-8(13) 208.277 55.478 34.176 136.61 -50.0997 -4.8592 -2.7403 -18.2563 0.0078 0.0646 1.1787×10-8(14) 50.680* 61.819 63.486 55.785 -20.2440 -5.4146 -5.0904 -7.4549 0.0045 0.0062 5.7860×10-4(15) 33.330 9.886 6.7360 21.971 -8.0173 -0.8659 -0.5401 -2.9361 0.4207 0.5827 0.0531 (16) -33.330 -9.887 -6.7372 -21.971 8.0173 0.8660 0.5402 2.9361 2.3774 1.7164 18.84227)
1.3 反应耦合分析及生成Si-CVD的主要反应
由反应耦合理论知,通过反应间的耦合设计,某一反应可影响另一反应的平衡位置,甚至可使原本不能单独进行的反应得以通过另外的途径而进行[19]。可以设想,西门子还原反应体系中也可能存在反应间的耦合而使不可能变为可能。仔细分析上列反应看出,有几组反应通过耦合或串联组合(统称作耦合),形式上可以变为反应(5)。为此,按照耦合后新反应能生成目标产物Si和能使吉布斯自由能显著降低或标准平衡常数显著增大来分析有效的反应耦合。
1) 以反应(7)与(10)为例,耦合后的化学反应方程式与原反应(5)相同,不妨记作(51),原反应记作(50)。为简化计,忽略同时化学平衡的影响即不考虑体系内存在多个反应同时发生,同时达到化学平衡对所讨论反应的平衡影响,由

还有其他几组耦合后的反应方程式与反应(5)相同,记作(5i);也有耦合为反应(1),参见表4。
综合表3和4可知,有8个反应相互耦合(包括个别交互耦合)为5组形式等同于反应(5)的反应,其中“反应(7)+反应(10)”的耦合效果最显著,其他几组效果不太明显。虽然上述耦合反应不是绝对的、但属于可能的。所以,有理由认为除了“反应(7)+反应(10)”对反应(5)的耦合强化外,其他4组之中的某几组可能对反应(5)起到综合强化效果,故将反应(5)视作综合表观反应式,确认反应(5)的主反应地位,前述理论困扰得以破解。同理,有两组即(4)+(9)和2×(3)+(8)耦合为形同反应(1)而使反应(1)得到强化。
2) 关于反应(1)和(2),属于生成Si(s)和SiCl4(g)的反应且系SiCl4(g)的主要来源,其中反应(1)本身加上耦合增效应视为主要副反应之一;反应(2)因其KΘ数值较大,应列为主要副反应之一。

表4 几组反应耦合后新反应的标准摩尔自由能和标准平衡常数比较表Table 4 Comparison table of Gibbs free energy and standard equilibrium constant in several new co-hydrogenation reduction
3) 反应(8)的标准平衡常数值很大(34.8551),但2×(3)+(8)耦合后的(11)仅与反应(1)持平;同理,反应(9)之标准平衡常数值较大(1.0594),但与反应(4)耦合后亦等同于反应(1),故反应(8)和(9)均不再单列为主要反应而纳入反应(1)更合理。
综合以上分析,可以把主反应(5)视为包括了反应(7)与(10)的耦合反应以及其他几组耦合反应在内的表观反应,将它与副反应(1)、(2)构成的平行反应视为该反应体系生成Si-CVD的主要反应如下:

通过上述热力学综合分析,特别是反应耦合分析可以设想,倘若能优化调控还原炉内有利于反应(7)和(10)进行的工艺条件,则提高Si的收率是可能的、可观的。为此,加强对SiH3Cl及反应(7)和(10)等的基础理论研究,探求优化工艺条件,其理论意义和潜在工业价值不容忽视。
2 三氯氢硅氢还原反应生成Si-CVD的本征速率方程
CVD技术与非均相气-固相催化反应过程极为相似,故可借助非均相气-固相催化反应模型方法导出其本征动力学方程。气态的三氯氢硅和氢在高温下具有活性的硅芯棒表面发生了吸附、反应,被还原的Si(s)沉积(CVD)在作为晶种基体的硅芯棒表面,而气体产物HCl则汇入混合气体中随尾气排出,随着反应-CVD的持续进行,硅芯不断长粗。
2.1 主反应的速率方程
主反应(式(17))即

主反应的反应机理可应用L-H均匀表面吸附理论分析[27-29]。气体反应组分中SiHCl3(记作A)和H2被硅芯表面活性点σ吸附(H2属于解离吸附),还原产物Si沉积在硅芯表面的活性位σ上,又成为新的活性位(即属于再生活性位),这样,活性位总数不仅没有减少,而且随着CVD、硅芯直径张大、硅棒表面愈来愈大,活性位愈来愈多。假定反应按下列机理进行:
气态SiHCl3被吸附,

H2发生解离吸附,

H2发生解离吸附,

式中:*Si(s,σ)表示在硅芯基体活性位上沉积的Si占据原有活性位后本身成为一个新生活性位,被占的原有活性位只空出两个,故表面看方程式(23)左右活性点数σ不相等,实际上相等。
上述表面反应之所以假定为不可逆反应:1) 考虑到在由Si粉与HCl(g)合成SiHCl3过程中,反应温度要控制在280~320 ℃,因为SiHCl3(g)在400 ℃就开始分解,550 ℃时加剧分解,故炉内反应温度区(1080~1100 ℃)逆反应即新生Si(s)被HCl(g)侵蚀的反应可以忽略;2) 考虑到SiHCl3转化率比较低,反应产生的HCl(g)浓度也低,故可忽略新生Si(s)被HCl(g)侵蚀的逆反应。
对主反应的表面反应机理式,文献[14]按下式处理:

原有的3个活性位,一个吸附了SiHCl3,其余两个吸附了解离后的H,CVD的Si并未腾出所占的活性位(尽管自己又新生了一个活性位),两个解离吸附态的H…σ在所占的两个活性位上不可能生成3个吸附态的HCl…σ。本文作者以为这种假设欠妥,至少在逻辑上存在矛盾。对此,文献[28]和[29]中有关锗膜CVD过程机理分析及所附示意图可供参考借鉴。
假定在硅芯表面的不可逆反应属于控制步骤(忽略HCl(g)的吸附),其余过程达到吸附平衡。

从反应装置和生产实际过程出发考虑,作如下假设和简化:
1) 还原剂H2的配比属于大过量,故可视为常量(见表1)。
2) 由于原料气的吸附是属于高温条件下的物理吸附过程,基体硅芯表面总的吸附量不大,即KApA、远小于忽略)。加上Si的CVD系可再生活性点沉积,等于顶替了SiHCl3即A的吸附占位,故吸附项θA对θv的影响以忽略,则方程(25)的分母部分可简化归1。这样,非线性速率方程(25)就可简化为一级不可逆反应型速率式,采用面积基准,即

为了便于后续应用,将式(26)表作摩尔浓度式:

2.2 按主反应与副反应构成的平行反应作为生成Si-CVD的总速率方程
主反应(17)的速率方程(-rAs,1)同前,令副反应(18)和(19)的速率方程分别为(-rAs,2)和(-rAs,3)。
对于反应(18),与反应(17)类似,可忽略新生硅的腐蚀反应即忽略逆反应。假设反应机理如下:
气态SiHCl3被吸附,

吸附态的SiHCl3发生热分解反应(假定该热分解反应为不可逆反应,且为控制步骤),

吸附态的SiCl4发生脱附,



对于反应(19),考虑到SiCl4热氢化所需压力、催化剂等条件及其SiHCl3收率较低的实际,故在还原炉生产条件下可忽略反应(19)的逆反应,故反应机理假设如下:
气态SiHCl3被吸附,

吸附态的SiHCl3发生热分解反应(假定为不可逆反应且为控制步骤,H2的吸附量可忽略),

吸附态的SiCl4发生脱附,



这样,由反应(17)~(19)所构成的平行反应的总速率方程(压力型)为

表示作浓度型:

2.3 对反应总速率方程作线性化变换——拟一级不可逆近似处理
为了方便后续求解三氯氢硅氢还原生成Si-CVD过程宏观动力学模型,对于上述非线性总速率方程(采用浓度型式(39))作线性化变换,可按泰勒级数展开法在cA=cA+0处展开(在扩散程度不大时可近似地视作cA+0=cA0),联系实际,舍去二阶以上项,取,即按来作线性化。由,有则线性化变换后的拟一级不可逆反应速率方程模型表作

式中:该一级不可逆反应的等价速率常数

关键组分的等价浓度

为方便计,可略去式(42)中的“dj”下标简写作(浓度型):

压强型即

式(43)或(44)即所求的本征动力学数学模型。
3 结论
1) 设计了严谨合理的计算分析方案。顾及SiHCl3和SiCl4在298 K、标压下为液相,故对所涉及反应相关物质的标准摩尔生成焓和生成自由能等基础数据取用500 K、标压下的数据,提供了8种主要物质的可靠适用的基础热力学数据;在求和或的积分常数时参考温度采用T0=500 K;提供该反应体系16种反应的翔实系统的有关热力学函数数值,保证了计算结果与分析判断的可信度。
2) 通过热力学综合分析及反应耦合分析,破解通常所说的主反应热力学认定上的理论困惑,认定由

构成的平行反应为生成Si-CVD的主要反应。
3) 在联系生产实际、合理简化基础上,应用反应工程学方法导出该平行反应的总速率方程(压强型),(浓度型);经线性化变换为拟一级不可逆反应速率模型(浓度型),其中等价速率常数,等价浓度;为方便计,简写作[或压强型]。
4) 通过对该反应体系的热力学综合分析及反应耦合分析看出,重视SiH3Cl及反应(7)和(10)的基础理论研究,探索还原炉内有利于反应(7)和(10)的优化工艺条件是提高Si的收率是可能途径。
REFERENCES
[1] 沈华生. SiHCl3氢还原法生产超纯硅化学反应机理及工业实践经验[J]. 稀有金属, 1987, 11(6): 421-426. SHEN Hua-sheng. Reduction of SiHCl3hydrogen production of ultra pure silicon chemical reaction mechanism and industrial practice experience[J]. Rare Metals, 1987, 11(6): 421-426.
[2] 徐宝琨, 赵慕愚. 低压硅外延生长的热力学研究[J]. 半导体学报, 1982, 3(5): 343-350. XU Bao-kun, ZHAO Mu-yu. Thermodynamic study of low pressure epitaxy of silicon[J]. Chinese Journal of Semiconductors, 1982, 3(5): 343-350.
[3] 苗军舰, 陈少纯, 丘克强. 西门子法生产多晶硅的热力学[J].无机化学学报, 2007, 23(5): 795-801. MIAO Jun-jian, CHEN Shao-chun, QIU Ke-qiang. Thermodynamic study on production of the multicrystalline silicon by Siemens process[J]. Journal of Inorganic Chemistry, 2007, 23(5): 795-801.
[4] 苗军舰, 丘克强, 顾 珩, 陈少纯. 西门子体系中SiHCl3和SiCl4的热力学行为[J]. 中国有色金属学报, 2008, 18(10): 1937-1944. MIAO Jun-jian, QIU Ke-qiang, GU Heng, CHEN Shao-chun. Thermodynamic behavior of SiHCl3and SiCl4in Siemens system[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(10): 1937-1944.
[5] 苗军舰. 西门子法生产多晶硅的热力学[D]. 长沙: 中南大学, 2007: 21-44. MIAO Jun-jian. Thermodynamic study on production of the multicrystalline silicon by Siemens process[D]. Changsha: Central South University, 2007: 21-44.
[6] 侯彦青. 改良西门子法制备多晶硅过程的理论分析及建模[D].昆明: 昆明理工大学, 2013: 39-40, 83-114. HOU Yan-qing. Theoretical analysis and modeling Siemens preparation of polysilicon process improvement[D]. Kunming: Kunming University of Science and Technology, 2013: 39-40, 83-114.
[7] 侯彦青, 谢 刚, 俞小花, 李荣兴, 宋东明. 以SiHCl3和SiCl4的混合物为原料制备多晶硅热力学[J]. 中国有色金属学报, 2010, 20(7): 1907-1914. HOU Yan-qing, XIE Gang, YU Xiao-hua, LI Rong-xing, SONG Dong-ming. Thermodynamic simulation of polysilicon production with mixture of SiHCl3and SiCl4as precursor[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(7): 1907-1914.
[8] 侯彦青, 谢 刚, 陶东平, 俞小花, 李荣兴, 宋东明. SiCl4氢化转化为SiHCl3过程的热力学[J]. 中国有色金属学报, 2011, 21(12): 3202-3210. HOU Yan-qing, XIE Gang, TAO Dong-ping, YU Xiao-hua, LI Rong-xing, SONG Dong-ming. Thermodynamics of transformation process from SiCl4to SiHCl3[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(12) : 3202-3210.
[9] 何 恩, 谢 刚, 侯彦青, 林 艳, 俞小花. SiHCl3氢还原过程的热力学分析[J]. 化学工程, 2011, 39(11): 39-43. HE En, XIE Gang, HOU Yan-qing, LIN Yan, YU Xiao-hua. Thermodynamic analysis of SiHCl3hydrogen reduction process[J]. Chemical Engineering, 2011, 39(11): 39-43.
[10] 李国栋, 张秀玲, 胡仰栋. 电子级多晶硅生产工艺的热力学分析[J]. 过程控制学报, 2007, 7(3): 520-525. LI Guo-dong, ZHANG Xiu-lin, HU Yang-dong. Thermodynamic analysis of electronic grade polysilicon production technology[J]. Journal of Process Control, 2007, 7(3): 520-525.
[11] 康启宇. 硅和四氯化硅耦合加氢反应制备三氯氢硅的工艺研究[D]. 上海: 上海交通大学, 2011. KANG Qi-yu. Study on the co-hydrogenation of silicon tetrachloride and silicon to produce trichlorosilane[D]. Shanghai: Shanghai Jiao Tong University, 2011.
[12] 梁俊吾. 电子级多晶硅的生产工艺[J]. 中国工程科学, 2000, 2(12): 34-39. LIANG Jun-wu. The production technology electronic crade polycrystalline silicon[J]. Engineering Sciences, 2000, 2(12): 34-39.
[13] 杨德仁. 太阳电池材料[M]. 北京: 化学工业出版社, 2011: 80-85. YANG De-ren. Solar cell materials[M]. Beijing: Chemical Industry Press, 2011: 80-85.
[14] 王樟茂, 吴兴松, 赵炳辉, 阙端麟. 在喷动流化床中应用SiHCl3制聚颗粒硅的动力学研究[J]. 浙江大学学报(工学版), 2000, 34(3): 233-238. WANG Zhang-mao, WU Xing-song, ZHAO Bing-hui, QUE Duan-ling. Kinetic study of Si- particles preparation from SiHCl3in spouted-fluidized-bed[J]. Journal of Zhejiang University (Engineering Science Edition), 2000, 34(3): 233-238.
[15] 李 汉. 西门子法多晶硅还原炉气相沉积反应探讨[J]. 新材料产业, 2011(10): 77-79. LI Han. Siemens method for polysilicon reducing furnace gas phase deposition reaction study[J]. New Material Industry, 2011(10): 77-79.
[16] 龙桂花. 西门子法四氯化硅尾气处理新工艺的探索研究[D].长沙: 中南大学, 2009: 3. LONG Gui-hua. Exploration research on the new technology about the treatment of silicom tetrachloride by Siemens process[D]. Changsha: Central South University, 2009: 3.
[17] 邓 丰, 唐正林. 多晶硅生产技术[M]. 北京: 化学工业出版社, 2009: 7-12, 152-160. DENG Feng, TANG Zheng-lin. The manufacturing technique polycrystalline silicon[M]. Beijing: Chemical Industry Press, 2009: 7-12, 152-160.
[18] 王友承. 从反应活化能垒角度探讨多晶硅还原机理[J]. 化学工程师, 2012(5): 24-25, 33. WANG You-cheng. Mechanism of polycrystalline silicon reduction from the standpoint of activation energy[J]. Chemical Engineer, 2012, 5: 24-25, 33.
[19] 傅献彩, 沈文霞, 姚天扬, 侯文华. 物理化学(上册)[M]. 5版.北京: 高等教育出版社, 2005: 356-357, 371-376. FU Xian-cai, SHEN Wen-xia, YAO Tian-yang, HOU Wen-hua. Physical chemistry (Volume 1)[M]. 5th ed. Beijing: Higher Education Press, 2005: 356-357, 371-376.
[20] 龙桂花, 吴 彬, 韩 松, 丘克强. 太阳能级多晶硅的生产技术发展及展望[J]. 中国有色金属学报, 2008, 18(S1): s386-s392. LONG Gui-hua, WU Bin, HAN Song, QIU Ke-qiang. Development status and prospect of solar grade silicon production technology[J]. The Chinese Journal of Nonferrous Metals, 2008, 18 (S1): s386-s392.
[21] 卡尔.L.约斯. Metheson 气体数据手册[M]. 第7版. 陶鹏万,黄建彬, 译. 北京: 化学工业出版社, 2003. JAWS C L. Metheson gas data book[M]. 7th ed. TAO Peng-wan, HUANG Jian-bin, transl. Beijing: Chemical Industry Press, 2003.
[22] YAWS C L. Chemical properties handbook[M]. New York: Mcagaraw-Hill, 1999: 20-50.
[23] 伊赫桑…巴伦. 纯物质热化学数据手册(下册)[M]. 程乃良, 牛四通, 徐桂英, 译. 北京: 科学出版社, 2003: 1480-1520. EHSAN Baron. Thermochemical data of pure substances[M]. CHENG Nai-liang, NIU Si-tong, XU Gui-ying, transl. Beijing: Science Press, 2003: 1480-1520.
[24] 张德丰, 雷晓平, 周 燕. MATLAB 基础与工程应用[M]. 北京: 清华大学出版社, 2011. ZHANG De-feng, LEI Xiao-ping, ZHOU Yan. MATLAB basis and engineering application[M]. Beijing: Tsinghua University Press, 2011.
[25] J.A.迪安. 兰氏化学手册[M]. 13版. 尚久方, 操时杰, 译. 北京: 科学出版社, 1991. DEAN J A. LAN’s handbook of chemistry[M]. 13th ed. SHANG Jiu-fang, CAO Shi-jie, transl. Beijing: Science Press, 1991.
[26] LANGE N A, DEAN J A. Handbook of lange chemistry[M]. 15th ed. New York: Mcagaraw-Hill, 1999.
[27] 陈甘棠. 化学反应工程[M]. 3版. 北京: 化学工业出版社, 2007: 117-144. CHEN Gan-tang. Chemical reaction engineering[M]. 3rd ed. Beijing: Chemical Industry Press, 2007: 117-144.
[28] 福格勒 H 斯科特. 化学反应工程[M]. 3版. 李术元, 朱建华,译. 北京: 化学工业出版社, 2005: 489-490. FOGLER H S. Chemical reaction engineering[M]. 3rd ed. LI Shu-yuan, ZHU Jian-hua, transl. Beijing: Chemical Industry Press, 2005: 489-490.
[29] FOGLER H S. Elements of chemical reaction engineering[M]. 4th ed. Pearson Education Inc, 2006: 701-702.
Intrinsic kinetics model of trichlorosilane hydrogen reducing Si-CVD by Siemens method
WU Yong, WANG Wei, LIU Xiao-rui
(Yinchuan Energy Institute, Yinchuan 750105, China)
In order to identify the main reactions that effect the formation of silicon in the hydrogen reduction reaction system of Trichlorosilane by the Siemens method and derive the intrinsic-kinetics equation, some classified analysis of all the possible reactions by choosing the appropriate and reliable thermal chemical data were made, the reasonable calculation plan was designed, and the Gibbs free energy and Standard equilibrium constant between the reaction temperature zone and the nearby temperature zone were contrasted. Coupling reaction theory being used and coupling effect through related reactions being analyzed, the theoretic confusion about the lack of basis in the main reaction of SiHCl3(g)+H2(g)=Si(s)+3HCl(g) is confirmed as the main reaction, and also determined that these two thermal reactions which break down and produce Si(s) and SiCl4(g) shouldn’t be ignored and should be regarded as significant reactions. On the basis of this, the intrinsic-kinetics equationof reduction-CVD was derived by applying the L-H uniform surface adsorption theory and heterogeneous gas-solid-phase catalytic reaction model approach. This linearized transformation is simplified into equivalent irreversible kinetic model, Simple plan writingwhich is not only good for the determination of kinetic parameters, but also for the subsequent establishment of the macro-dynamics model.
reaction engineering; polysilicon; Siemens method; hydrogen trichlorosilane reduction reaction; chemical vapor deposition; thermodynamic analysis; intrinsic kinetics model
WU Yong; Tel: +86-17752310681; E-mail: wuyong@nxu.edu.cn
TQ013.1;TQ013.2;O613.72
A
1004-0609(2017)-01-0215-10
Foundation item: Project(NZ15284) supported by the National Natural Science Foundation of Ningxia, China; Project(2012348) supported by the Institutions of Higher Learning Advantages and Characteristics of Professional in Ningxia, China
(编辑 李艳红)
宁夏自然科学基金资助项目(NZ15284);宁夏高等学校优势特色专业项目基金(2012384)
2015-03-10;
2016-06-06
吴 永,教授;电话:0951-8409381;E-mail:wuyong@nxu.edu.cn
Received date: 2015-03-10; Accepted date: 2016-06-06
