快速Wright液与改进的Wright液染色比较分析*
2017-03-01臧贵勇张祥令杨燕平
臧贵勇,张祥令,杨燕平
(1.贵州省黔南民族医学高等专科学校解剖与组织胚胎学教研室,贵州黔南 558000; 2.贵州医科大学组织学与胚胎学教研室,贵阳 550004)
快速Wright液与改进的Wright液染色比较分析*
臧贵勇1,张祥令2△,杨燕平2
(1.贵州省黔南民族医学高等专科学校解剖与组织胚胎学教研室,贵州黔南 558000; 2.贵州医科大学组织学与胚胎学教研室,贵阳 550004)
目的 提高血涂片的制作质量,评价两种方法镜下观察细胞形态的效果。方法 取人耳垂血液,改进Wright染色,光学显微镜下观察染色效果。结果 改进Wright染色,血涂片300张,各种血细胞结构清晰。结论 该方法可提高血涂片染色质量,利于长时间保存和使用。
教学;血液病;血涂片;改进Wright染色;制作
血涂片常用于解剖组织学实验教学和临床医学检验工作,应用极其广泛,特别是对各种血液病的诊断、治疗有很大价值。血细胞具有重要的生理功能,其形态结构和功能是学习重点[1]。为了使医学生在组织学实验教学中能够观察到染色效果好、结构清晰、层次分明、不易褪色,长时间保存和使用的教学血涂片,使医学生将来更好地服务于临床和科研奠定基础[2],作者对其改进制作教学血涂片方法进行了研究,现将结果报道如下。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 Wright干粉、甲醇、甘油、甲醛液、磷酸二氢钾、磷酸氢二钾、快速Wright液等试剂均为国产分析纯;显微镜为LEICA DFC公司产品;医用采血针、75%乙醇棉球、洗耳球、染色架、特制蜡笔,清洁的载玻片和盖玻片(将新玻片用洗洁精浸泡,自来水反复冲洗,载玻片置95%乙醇浸泡2 h,擦干备用)。
1.1.2 试剂的配制 改进Wright配制配方:Wright粉剂0.1 g加甲醇60 mL充分研磨,直至溶解过滤,加入优质甘油1 mL,临用前加甲醛液1 mL,常温保存,配制周期1个月。磷酸盐缓冲液pH 6.8:磷酸二氢钾(KH2PO4)0.3 g加磷酸氢二钠(Na2HPO4)0.2 g加蒸馏水1 000 mL稀释[3]。
1.2 方法 采血部位和涂血膜部位常为耳垂或左手指尖采血,通常以耳垂取血较好,因该处采血不易感染,先轻揉耳垂部位使血流通畅,再用75%乙醇棉球消毒局部皮肤,待乙醇干后快速刺破耳垂下缘,使血自然流出,第1滴血弃之不用(因为含单核细胞较多)。取米粒大小血滴在干净的载玻片15~20 mm处,将接有血滴的载玻片平托于左手拇食指间,右手取另一洁净而边缘无破痕的玻片,然后将右手玻片在玻片面上推向前方。推好片后手持玻片在空气中挥动,使血膜自然风干,以免血细胞皱缩。天气寒冷潮湿时,应放于37℃温箱中保温促干,以免细胞变形缩小[4]。
1.3 固定染色 血膜干后,用特制蜡笔划出染色区,以防染液滴加后溢流,将血膜平放在染色架上,一批血涂片滴加快速Wright氏染液,另一批血涂片滴加改进Wright氏染液,分别滴加2~3滴在血膜上,至染液淹没血膜全部,加入等量磷酸盐缓冲液pH 6.8,用洗耳球轻轻吹,使之混匀。吹动染液及缓冲液,这样不仅可使染液与血膜充分接触,还可防止杂质的沉降[5]。染色3~5 min,冲洗前在低倍镜下观察有核细胞是否染色清楚,核着色是否分明。倾去涂片的染液,自来水细流水充分冲洗,至血膜呈淡红色,待自然干燥后,经二甲苯Ⅰ和二甲苯Ⅱ各透明10 min,进行封固。
1.4 封固 用中性树胶封固,即于显微镜下进行镜检或直接镜检,待树胶干燥后可长期保存使用。
2 结 果
改进Wright染色,血涂片300张,各种血细胞结构清晰。快速Wright染色法,血细胞染色颗粒不明显,颜色对比度不强(图1);改进Wright染色,血膜外观为淡紫红色,在显微镜下红细胞橘红色圆盘状;中性粒细胞核颗粒紫红色,染色质清楚,粗细松紧可辨;嗜酸性粒细胞颗粒橘红色;嗜碱性粒细胞核蓝紫色,颗粒呈深蓝紫色;淋巴细胞核深蓝紫色,胞质淡蓝色;单核细胞核蓝紫色,胞质灰蓝色;血小板为不规则小体,成簇成堆分布,周边浅蓝色,中央细小的紫红色颗粒。见图2、3。
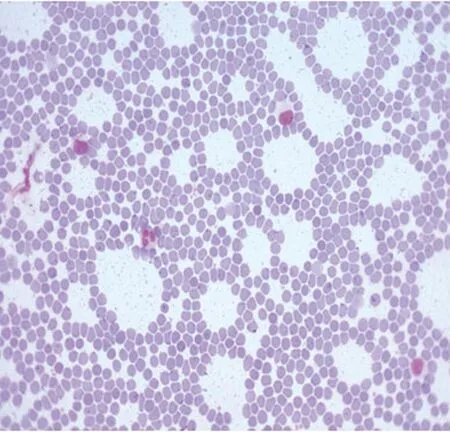
图1 血涂片(快速Wright染色法×400)
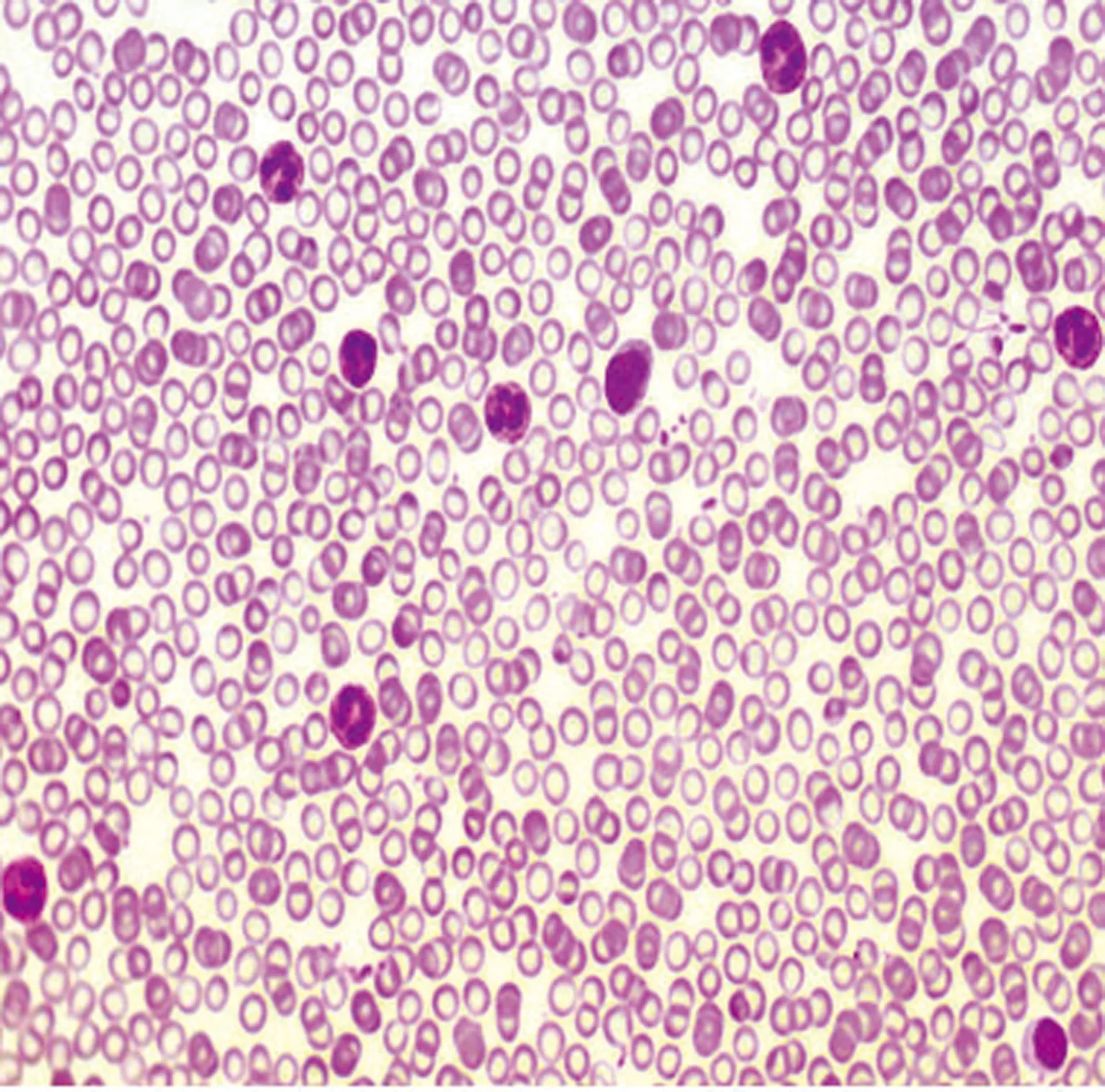
图2 血涂片(改进Wright染色法×400)

A:红细胞;B:中性粒细胞;C:嗜碱性粒细胞;↑:血小板。
图3 血涂片(改进Wright染色法×1 000)
3 讨 论
3.1 改进Wright氏染液的优点 改进Wright氏染液加入丙三醇,以增加表面张力,可防止甲醇挥发及被氧化成甲酸,可密封长期保存,临用前加甲醛液,对细胞固定较好,特别适于显示细胞特殊颗粒。因此染色后的血涂片各种血细胞在镜下形态结构清晰、典型。特别是血小板形态结构明显,血涂片中血小板的形态学及数量的改变对血小板病的诊断有重要意义。改进的Wright染色血涂片通过近三年教学标本的使用,未见褪色现象,得到指导老师和实习学生的好评。而快速Wright染色法,血片中血细胞的形态学不典型,不利于教学片的使用。
3.2 血涂片的要求及注意事项 合格外周血涂片厚薄适宜,头体尾分明,边缘整齐,细胞分布均匀,两侧留空隙,染色效果好,细胞清晰可辨。因此血涂片制作好坏有以下影响因素:(1)载玻片的清洁是必要因素,经过处理的载玻片既干净又无脂痕,否则染色后玻片可见杂物或圆形空白区。(2)血滴大小是影响血涂片厚薄及大小的关键因素之一;若血滴过大,血涂片过厚,使细胞重叠缩小、不易观察形态;血液堆积在载玻片末端,使一些体积较大的细胞遗漏,若血滴过小,血膜太薄,白细胞多集中在边缘,易导致细胞分布不均。(3)推片速度不可太快或太慢,应一次推成,不可中断或抖动[6]。(4)未干透血膜不能立即染色,否则染色时血膜易脱落;染色时间的长短与染液的浓度、室温高低和有核细胞数量有关[7]。(5)加染液量应适当,涂片在加染液后勿使其干固,否则将发生不易去掉的沉淀;冲洗时不能先倒掉染液,应以自来水细流水充分冲洗;冲洗好的血涂片应立放于支架上晾干;(6)染色偏酸偏碱时应更换缓冲液;染色颜色偏深时,可用95%乙醇分色。
3.3 优质血涂片的意义 作为教学片使用的标本,要求较高,显示血细胞形态结构要典型,胞质内嗜酸嗜碱性颗粒清晰。显示血细胞中颗粒是识别和判断及其功能状态提供的研究方法,以便医学生能够更好的辨认各类细胞,为以后学习其他医学科打下基础,也为科学研究提供了较好的方法。
[1]张立新,尚宏伟,路欣,等.血涂片制作与观察在医学形态学实验教学中的应用[J].中国医学装备,2013,9(9):37-38.
[2]黄健,麦婕,陈森洲.加强基础医学实践教学 提高大学生创新能力[J].中国高等医学教育,2009(6):6-7,59.
[3]张志梅,孙辉.两种血涂片染色方法在教学和临床应用的比较[J].中国医药指南,2010,8(17):173-174.
[4]李璐.血涂片染色方法的改良[J].华夏医学,2011,24(3):351-352.
[5]郭自力,李汉全.血涂片瑞氏染色的影响因素和解决方法[J].高等函授学报(自然科学版),2001,14(4):48-49.
[6]杜卓民.实用组织学技术[M].北京:人民卫生出版社,1998:92-94.
[7]陈纡,陈大美.血涂片制作的几点体会[J].中国组织化学与细胞化学杂志,2008,17(4):386.
�验交流·
10.3969/j.issn.1671-8348.2017.05.031
贵州省科技厅联合基金项目(M2011-28)。 作者简介:臧贵勇(1971-),副教授,硕士,主要从事神经及组织学技术研究。
R331.1
B
1671-8348(2017)05-0676-02
2016-07-11
2016-09-09)
