人牙髓干细胞和根尖乳头干细胞体外分化能力的对比研究*
2017-03-01谭小兵徐静舒戴青原
谭小兵,郭 宇,刘 佳,徐静舒,戴青原
(1.云南省第一人民医院口腔内科,昆明 650032;2.昆明医科大学第一附属医院心内科,昆明 650032)
人牙髓干细胞和根尖乳头干细胞体外分化能力的对比研究*
谭小兵1,郭 宇1,刘 佳1,徐静舒1,戴青原2△
(1.云南省第一人民医院口腔内科,昆明 650032;2.昆明医科大学第一附属医院心内科,昆明 650032)
目的 对比研究人牙髓干细胞(DPSCs)和根尖乳头干细胞(SCAP)的体外生长特性、增殖及矿化能力。方法 采用酶消化法体外培养人DPSCs和SCAP,诱导分化培养基诱导细胞成骨/成牙本质向分化,流式细胞仪检测特异性标记物,茜素红染色检测矿化程度,逆转录PCR(RT-PCR)检测分化标记物表达。结果 人DPSCs和SCAP为成纤维细胞样贴壁生长,SCAP增殖率较高;两种细胞表达特异性间充质干细胞(MSCs)标记物:CD34、CD45(-),CD90、CD105、CD146(+),基质细胞抗原1(STRO-1)、八聚体转录因子4(OCT-4)(+),SCAP特异性标记物CD24(+)。成骨诱导3周可形成明显钙化结构,SCAP钙化能力较强。成骨诱导2周2种细胞均可表达分化标记物:骨涎蛋白、骨钙素、牙本质涎磷蛋白,且随诱导时间表达逐渐增加。结论 人DPSCs和SCAP均具有间充质干细胞典型特征,可分化为成牙本质样细胞,是牙源性组织工程的可靠干细胞来源。
牙髓;干细胞;牙根尖;牙再矿化;组织工程
间充质干细胞(mesenchymal stem cells,MSCs)具有自我更新能力和多向分化潜能,能分化为成骨细胞、脂肪细胞、软骨细胞等[1]。MSCs能进入生物材料内部生长、分化,可修复缺损组织[2]。骨髓MSCs(BMMSCs)是组织工程最为可靠的干细胞,但获取困难,细胞数量及增殖能力有限,限制了其进一步应用[3]。最近人们成功从牙组织中分离出多种MSCs:首先是牙髓干细胞(dental pulp stem cells,DPSCs)[4];其后又发现另一种特性的MSCs:根尖乳头干细胞(stem cell from apical papilla,SCAP)[5]。与BMMSCs相比,牙源性MSCs易于获取,增殖速率高,体外蛋白表达模式相似,有多向分化潜能,牙源性MSCs(包括DPSCs、SCAP)均可在体外分化为成牙本质细胞,植入免疫缺陷小鼠皮下可形成牙髓-牙本质样复合体组织[6-7]。
DPSCs和SCAP来源组织结构相似、位置相邻,即牙髓和根尖乳头组织。两种细胞虽然有相同特征,但二者遗传特性不同,有不同基因和蛋白表达模式,在不同微环境中功能也不同[8]。本研究通过体外对比研究DPSCs和SCAP成骨/成牙本质分化能力,以了解不同牙源性MSCs的生物特性,为进一步牙髓再生研究提供研究基础和理论依据。
1 材料与方法
1.1 主要试剂 基础培养基(α-MEM)、Ⅰ型胶原酶、FITC结合CD24/34/45/基质细胞抗原1(STRO-1)(小鼠抗人单抗)购自美国Invitrogen公司,FBS购自美国Hyclone公司,Ⅱ型中性蛋白酶购自瑞士Roche公司,70 μm细胞滤网购自美国BD公司,成人MSCs成骨诱导分化培养基购自广州赛业生物科技公司,PE结合CD90/105/146/八聚体转录因子4(OCT-4)(小鼠抗人单抗)购自美国eBioscience公司,总RNA提取试剂盒购自德国Qiagen公司,c-DNA合成试剂盒/iTaq DNA聚合酶/dNTP混合物购自美国BIO-RAD公司。
1.2 方法
1.2.1 细胞分离培养 收集阻生拔除的下颌第三磨牙(<20岁),无菌工作台内切取根尖孔外乳头组织;釉牙骨质界处做一环形切口,分离暴露髓腔,30# k锉取出牙髓组织。充分剪碎,37 ℃、Ⅰ型胶原酶(3 mg/mL)与Ⅱ型中性蛋白酶(4 mg/mL)混合液内振荡孵育60 min,离心,弃上清液,加入α-MEM完全培养基(α-MEM + 15% FBS+1%谷氨酰胺+1%青/链霉素),过70 μm细胞滤器得到单细胞悬液,加入适量完全培养基,37 ℃、5% CO2恒温箱内常规培养。第2天换液,常规培养,每日倒置相差显微镜下观察。细胞90%融合后传代培养,第2~5代细胞用于实验。细胞计数:两种细胞接种于6孔板(2×105/孔),每24小时计数细胞,共培养96 h,绘制细胞生长曲线。本实验所有操作均符合云南省第一人民医院伦理委员会标准,并取得患者书面同意。
1.2.2 成骨/成牙本质诱导 第3代DPSCs、SCAP接种于6孔板(2×104/cm2),第2天换为成骨诱导分化培养基(α-MEM完全培养基+10 mmol/L β-磷酸甘油+0.1 μmol/L地塞米松+50 μmol/L抗坏血酸),37 ℃、5% CO2常规培养,每2~3天换液,共诱导3周。每周处理:弃原液,PBS清洗,4%甲醛室温固定15 min,1%茜素红(美国Sigma公司)室温染色20 min,PBS清洗,倒置相差显微镜(Olympus CKX-4,日本)下,观察矿化情况,计算矿化比例。同等数量的DPSCs和SCAP接种于6孔板内常规培养,作为正常对照。
1.2.3 细胞特异性标志物检测 收集第3代DPSCs、SCAP,D-PBS冲洗,加入流式缓冲液吹打,再加入10 μL相应抗体(CD24、CD34、CD45、CD90、CD105、CD146、STRO-1),室温避光孵育30 min;加入1% PFA,上机检测。OCT-4、IgG2ak-PE抗体处理:4% PFA-磷酸盐缓冲液(PBS)固定液、室温避光孵育20 min,1 500 r/min离心5 min,弃上清液,加入1×细胞打孔液,室温避光孵育10 min,同样条件离心、弃上清液,加入对应抗体10 μL,再加入D-PBS混匀,室温避光孵育30 min,加入1% PFA 液,流式细胞仪(美国贝克曼)检测,Summit 5.1软件分析数据。
1.2.4 细胞成骨诱导分化标志物检测 成骨诱导2周后收集两种细胞,总RNA试剂盒提取RNA,取5μL RNA,紫外分光光度机(美国Thermo公司)测量浓度,20 μL体系逆转录试剂盒合成单链cDNA,反应条件:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保存。检测3个相关基因:骨涎蛋白(bone sialoprotein,BSP)、骨钙素(osteocalcin,OCN)、牙本质涎磷蛋白(dentin sialophosphopretein,DSPP),GAPDH为管家基因。根据目的基因设计引物(表1)。PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,循环35次;72 ℃ 7 min,4 ℃保存。电泳检测、成像。
1.3 统计学处理 SPSS12.0软件进行分析,两两比较用t检验,检验水准α=0.05。以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞形态和生长特性 分离培养1 d即可看到单个细胞贴壁生长,第4天形成克隆生长,SCAP需5~6 d铺满培养瓶,DPSCs要10 d形成单细胞层铺满。 DPSCs细胞为纺锤形、多角形或长梭形,形态较大,而SCAP细胞形态较小,多为成纤维细胞样或星形,有许多胞质突或伪足,很快形成致密单细胞层。结果显示DPSCs和SCAP表现有不同增殖率,相应细胞生长曲线也说明这一点(图1)。

A、B、C:下颌第三磨牙牙髓和根尖乳头组织;D:细胞生长曲线;E:DPSCs第4天(P0,100×);F:DPSCs第10天(P0,100×);G:SCAP第4天(P0,100×);G:SCAP第10天(P0,100×)。
图1 人DPSCs和SCAP原代培养(Olympus CKX-41倒置相差显微镜)
2.2 细胞体外矿化 成骨/成牙本质诱导1周即观察到单层细胞边缘开始聚集并形成高密度团,SCAP主要从周边向中央迁移形成细胞团,DPSCs整层细胞卷曲形成细胞团,同时有明显矿化结构形成。随着诱导时间延长,矿化结构逐渐增多,3周后两种细胞都观察到大量棕红色钙化物,诱导分化早期DPSCs矿化结构形成较多,后期二者矿化比例相似,但SCAP钙化物密度明显要高,同时对照组内也出现极少量钙化结构(见图2、表2)。
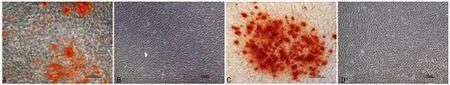
A:DPSCs诱导3周后(200×);B:DPSCs对照组(100×);C:SCAP诱导3周(200×);D:SCAP对照组(100×)。

图2 人DPSCs和SCAP诱导矿化组织染色(Olympus CKX-41倒置相差显微镜)

表2 DPSCs和SCAP不同时间矿化组织比例分析(%)
2.3 细胞特异性标志物 流式细胞检测结果显示DPSCs、SCAP均不表达CD34、CD45,几乎100%DPSCs、SCAP均为CD90、CD105阳性,CD146染色均为强阳性(分别为28.4%、54.8%)。细胞多潜能标记物STRO-1(分别为28.3%、12.4%),OCT-4(分别为43.6%、58.0%)染色均为阳性。SCAP表达特异性标记物CD24(10.9%),而DPSCs没有表达(图3)。

图3 人DPSCs和SCAP特异性标志物流式检测
2.4 细胞分化标记物表达 DPSCs、SCAP诱导第1周两种细胞即均有分化标记物的表达:BSP(322 bp左右)、OCN(140 bp左右)和DSPP(226 bp左右)。随着诱导时间的延长,各标记物表达量明显增加。DPSCs未诱导组第1和2周时也见BSP、DSPP和OCN 的少量表达,SCAP未诱导组的DSPP有少量表达(图4)。

图4 RT-PCR 检测DPSCs和SCAP 诱导不同时间后BSP、DSPP及OCN的表达
3 讨 论
本研究采用酶消化法进行人DPSCs和SCAP的原代分离,酶消化法理论上会释放组织内包含的所有细胞,来自于血管周围微环境中的成纤维样细胞、不成熟干/祖细胞、内皮细胞和周细胞会贴壁生长,血细胞和碎屑则随细胞换液而去除[9]。牙髓组织属于疏松结缔组织,牙根尖乳头组织是根部牙髓组织的前体组织,两种组织之间有一层富集细胞层,酶消化法得到的DPSCs和SCAP均可形成具有不同特征的克隆形成单位——成纤维细胞(colonyforming unit-fibroblasts,CFU-Fs),在同一克隆内有不同大小和形态的细胞,其重要特性之一就是成牙本质细胞分化潜能[10]。因此有必要指出,与其他研究者相同[11-12],本研究中人DPSCs和SCAP也非纯干细胞培养,主要混杂有血干/祖细胞及少量其他成纤维样细胞,但两种细胞均取自同一个牙齿,在同样环境下培养,将同样的细胞混杂因素考虑在内,对本实验对比结果并无影响。目前仍没有一个或几个标记物可以特异性鉴定人DPSCs和SCAP,主要参照BMMSCs的鉴定标准,并结合细胞多向分化潜能及牙源性特异性标记物DSPP的表达。两种牙源性MSCs的具体定位尚不十分清楚,可能位于血管周及神经鞘周[13]。
本研究结果显示,SCAP细胞为小圆形、纺锤形,体外矿化能力强,可能是由于根尖乳头组织尚未完全发育,与DPSCs相比,SCAP表现为更高的增殖率。CD34和CD45选择性表达于哺乳动物造血干/祖细胞或所有白细胞表面。本研究DPSCs和SCAP均不表达CD34、CD45,说明无血细胞污染。CD90、CD105为人MSCs特异性标记物,本实验DPSCs和SCAP几乎均为CD90、CD105阳性,纯度很好。CD24是人根尖乳头干细胞特异性标记物,表达率为3.2%~15.3%,在其他MSCs中没有表达,包括DPSCs,本研究SCAP的CD24表达率为10.9%,与Bakopoulou等[14]研究结果一致。CD146、STRO-1均为MSCs表面标志物,与细胞分化潜能有关,本实验两种牙源性MSCs细胞CD146、STRO-1均为阳性,说明DPSCs和SCAP有良好的自我更新能力和分化潜能,与Bakopoulou等[15]研究结果一致。本研究还检测了与干细胞维持自我更新能力有关的胞内标记物OCT-4的表达情况,结果进一步说明了两种细胞的自我更新能力。
DPSCs和SCAP成骨/成牙本质诱导3周后均能形成矿化小节及三维矿化结构。成骨/成牙本质诱导液中添加成分在胞外基质矿化过程中发挥重要作用。地塞米松与β-磷酸甘油、抗坏血酸体外协同作用可促进MSCs分化为成骨/成牙本质系,其适宜浓度为10~100 nmol/L[16]。β-磷酸甘油在矿化过程及成骨细胞活性调整方面起到重要作用,其功效与成骨/成牙本质细胞高碱性磷酸酶(ALP)活性密切相关,β-磷酸甘油与KH2PO4同时提供有机和无机磷酸根离子以促进生物矿化[17]。细胞迁移和矿化结构形成也出现在正常对照组中,但数量非常少,因为缺乏有机和无机磷酸根离子的来源。
DPSCs和SCAP诱导1周和2周后,成骨/成牙本质系分化标记物检测均有表达,包括BSP、OCN、DSPP,且随着诱导时间延长,各标记物表达量明显增加,与文献[18-19]研究结果一致。BSP是主要的骨胞外基质涎蛋白,其表达与基质沉积同时出现,与矿化过程密切相关;OCN是成骨细胞分化晚期标志物,其出现提示基质沉积的开始[18]。DSPP是DSPP mRNA初始翻译产物,随后分为牙本质磷蛋白和牙本质涎蛋白,是牙源性组织的特异性标记[19]。DSPP在牙本质形成过程中起关键作用,是成牙本质分化的相对特异性标记物。
本研究得到的DPSCs和SCAP能分化为成牙本质样细胞,具有迁移和矿化能力,可在体外形成有序矿化结构,为了解牙源性MSCs生物特性提供了实验证据,有助于牙源性干细胞用于牙髓再生等方面的研究。如何联合应用牙源性MSCs、生物可吸收性支架(如聚乳酸-羟基乙酸共聚物、多肽凝胶等)、生长因子(如骨形态发生蛋白家族、趋化因子等)诱导牙髓再生是下一步的研究方向。
[1]Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41-49.
[2]Kang R,Luo Y,Zou L,et al.Osteogenesis of human induced pluripotent stem cells derived mesenchymal stem cells on hydroxyapatite contained nanofibers[J].RSC Adv,2014,4(11):5734-5739.
[3]Han G,Jing Y,Zhang Y,et al.Osteogenic differentiation of bone marrow mesenchymal stem cells byadenovirus-mediated expression of leptin[J].Regul Pept,2010,163(1):107-112.
[4]Davies OG,Cooper PR,Shelton RM,et al.A comparison of the in vitro mineralization and dentinogenic potential of mesenchymal stem cells derived from adipose tissue,bone marrow and dental pulp[J].J Bone Miner Metab,2015,33(4):371-382.
[5]Sonoyama W,Liu Y,Yamaza T,et al.Characterization of the apical papilla and its residing stem cells from human immature permanent teeth:a pilot study[J].J Endod,2008,34(2):166-171.
[6]Lei M,Li K,Li B,et al.Mesenchymal stem cell characteristics of dental pulp and periodontal ligament stem cells after in vivo transplantation[J].Biomaterials,2014,35(24):6332-6343.
[7]Tran HLB,Doan VN.Human dental pulp stem cells cultured onto dentin derived scaffold can regenerate dentin-like tissue in vivo[J].Cell Tissue Bank,2015,16(4):559-568.
[8]Syed-Picard FN,Du Y,Lathrop KL,et al.Dental pulp stem cells:a new cellular resource for corneal stromal regeneration[J].Stem Cell Transl Med,2015,4(3):276-285.
[9]Garg A,Houlihan DD,Aldridge V,et al.Non-enzymatic dissociation of human mesenchymal stromal cells improves chemokine-dependent migration and maintains immunosuppressive function[J].Cytotherapy,2014,16(4):545-559.
[10]Huang GT,Gronthos S,Shi S.Mesenchymal stem cells derived from dental tissues vs.those from other sources:their biology and role in regenerative medicine[J].J Dent Res,2009,88 (9):792-806.
[11]Abuarqoub D,Awidi A,Abuharfeil N.Comparison of osteo/odontogenic differentiation of human adult dental pulp stem cells and stem cells from apical papilla in the presence of platelet lysate[J].Arch Oral Biol,2015,60(10):1545-1553.
[12]Tatullo M,Marrelli M,Shakesheff KM,et al.Dental pulp stem cells:function,isolation and applications in regenerative medicine[J].J Tissue Eng Regen Med,2015,9(11):1205-1216.
[13]Liu J,Yu F,Sun Y,et al.Concise reviews:Characteristics and potential applications of human dental tissue-derived mesenchymal stem cells[J].Stem Cells,2015,33(3):627-638.
[14]Bakopoulou A,Leyhausen G,Volk J,et al.Comparative characterization of STRO-1(neg)/CD146(pos)and STRO-1(pos)/CD146(pos)apical papilla stem cells enriched with flow cytometry[J].Arch Oral Biol,2013,58(10):1556-1568.
[15]Bakopoulou A,Leyhausen G,Volk J,et al.Comparative analysis of in vitro steo/odontogenic differentiation potential of human dental pulp stem cells (DPSCs)and stem cells from the apical papilla (SCAP)[J].Arch Oral Biol,2011,56(7):709-721.
[16]Ghali O,Broux O,Falgayrac G,et al.Dexamethasone in osteogenic medium strongly induces adipocyte differentiation of mouse bone marrow stromal cells and increases osteoblast differentiation[J].BMC Cell Biology,2015 (1):9.
[17]Tan K,Sim E,Shekaran A,et al.Efficient expansion and osteogenic differentiation of mesenchymal stem cells in microcarrier culture[J].Cytotherapy,2014,16(4):S87.
[18]Paino F,Noce M,Tirino V,et al.Histone deacetylase inhibition with valproic acid downregulates osteocalcin gene expression in human dental pulp stem cells and osteoblasts:evidence for HDAC2 involvement[J].Stem Cells,2014,32(1):279-289.
[19]Guo S,Lim D,Dong Z,et al.Dentin sialophosphoprotein:a regulatory protein for dental pulp stem cell identity and fate[J].Stem Cells Dev,2014,23(23):2883-2894.
Comparative characterization of osteo/odontogenic differentiation capability of human dental pulp stem cells and stem cells from apical papilla in vitro*
TanXiaobing1,GuoYu1,LiuJia1,XuJingshu1,DaiQingyuan2△
(1.DepartmentofCariologyandEndodontics,theFirstpeople′sHospitalofYunnanProvince,Kunming,Yunnan650032,China;2.DepartmentofCardiology,theFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming,Yunnan650032,China)
Objective To compare the growth characteristics,proliferation and osteo/odontogenic differentiation capability of stem cells from human dental pulp (dental pulp stem cells,DPSCs)and apical papilla (stem cells from apical papilla,SCAP)in vitro.Methods Human dental pulp and apical papilla tissues were separated from impacted third molars of young healthy donors at the age of root development and digested by collagenase type Ⅰ and dispase type Ⅱ to derive primitive DPSCs and SCAP.Cells were then induced for osteo/odontongenic differentiation by medium containing β-glycerophosphate,dexamethasone and KH2PO4.Flow cytometry was utilized to test the expression of specific markers of stem cells,including CD24,CD34,CD45,CD90,CD105,CD146,STRO-1 and OCT-4.AR-S was used to display the mineralization structure and RT-PCR was applied to analyze the expression of bone sialoprotein (BSP),osteocalcin (OCN)and dentine sialophosphoprotein (DSPP).Results Both DPSCs and SCAP were positive for CD90,CD105,CD146,STRO-1 and OCT-4,in percentages varying according to cell type,without expression of CD34 or CD45.Only SCAP expressed CD24 positively.Both cells formed organized mineralization structure after 2 weeks of induction in time-dependent manner,with more mineralization by SCAP and expressed differentiation markers,including BSP,OCN and DSPP.Conclusion Human DPSCs and SCAP possess the characteristics of MSCs and could be differentiated into odontonblast-like cells in vitro.Both cells are approachable stem cell sources for dental tissue engineering.
dental pulp;stem cells;tooth apex;tooth remineralization;tissue engineering
��·基础研究
10.3969/j.issn.1671-8348.2017.05.004
国家自然科学基金资助项目(81360161);云南省教育厅基金资助项目(2015Y153)。 作者简介:谭小兵(1974-),副主任医师,硕士,主要从事干细胞在牙髓再生中的作用研究。△
,E-mail:dqy0823@163.com。
R781.3
A
1671-8348(2017)05-0586-04
2016-07-09
2016-09-07)
