携目的基因的靶向超声微泡对肝癌HepG2细胞增殖活性的影响
2017-03-01顾海涛
李 炯,顾海涛,孙 勇
(1.重庆市渝北区人民医院外科 401120;2.重庆医科大学附属第二医院普通外科 400010; 3.重庆市巴南区中医院 401320)
携目的基因的靶向超声微泡对肝癌HepG2细胞增殖活性的影响
李 炯1,顾海涛2△,孙 勇3▲
(1.重庆市渝北区人民医院外科 401120;2.重庆医科大学附属第二医院普通外科 400010; 3.重庆市巴南区中医院 401320)
目的 制备一种靶向肝癌HepG2细胞的载单纯疱疹病毒胸腺嘧啶核苷激酶(HSV-TK)基因超声微泡,并考察其体外寻靶能力及对HepG2细胞的增殖抑制作用。方法 用机械振荡法制备超声微泡,生物素-亲和素桥连方式构建靶向载HSV-TK超声微泡。检测其一般特性,并进行体外实验检测其对HepG2细胞增殖的影响。结果 靶向载HSV-TK超声微泡可较多地聚集在HepG2细胞表面,通过检测增殖细胞核抗原(PCNA)及噻唑蓝(MTT)法,发现载基因靶向微泡组的增殖能力明显下降,细胞凋亡明显增加,细胞侵袭实验表明载基因靶向微泡组(22.18±2.01)较对照组及载基因非靶向微泡组明显减少,对HepG2细胞增殖及侵袭能力有较好的抑制作用。结论 携目的基因靶向超声微泡对肝癌HepG2细胞在体外有较好抑制效果。
肝肿瘤;细胞增殖;超声微泡;GPC3;HepG2细胞
肝癌在全球发病率呈逐年上升趋势,并逐步年轻化,其危害性大,治愈率低,病情进展较快,被称为“癌中之王”。外科手术虽然能够提供较好的治疗效果,但受制于较多其他因素,适合并接受手术者仅为20%。随着超声分子显像技术的不断发展,靶向超声造影剂的设计及制备已得到极大的进步。靶向超声造影剂可以作为治疗药物或基因的载体,通过血液循环特异性地聚集于靶组织,从而达到靶向治疗的目的。已有研究发现,脂酰肌醇蛋白聚糖3(GPC-3)特异性地在肝癌细胞中表达,以此作为靶点进行载药或载基因靶向治疗有较好的临床应用前景。
1 材料与方法
1.1 材料与仪器 抗人GPC-3单克隆抗体(美国R&D systems);二棕榈酰磷脂酰乙醇胺(DSPE-PEG)(2000)Biotin(美国Avanti);二棕榈酰磷脂酰胆碱(DPPC)、二棕榈酰磷脂酰乙醇胺(DPPE)、叠氮磷酸二苯酯(DPPA)(德国Lipoid);单纯疱疹病毒胸腺嘧啶核苷激酶(HSV-TK)质粒(重庆医科大学附属第二医院超声影像研究所惠赠);链酶亲和素(美国Sigma);N-羟基琥珀酰亚胺生物素酯(美国Sigma);荧光染料DiI(美国Sigma);THZ-C恒温振荡器(江苏太仓实验设备厂);高速离心机(德国Eppendorf);倒置荧光显微镜(日本Olympus);肝癌HepG2细胞株(重庆医科大学生物工程研究所惠赠)。
1.2 方法
1.2.1 超声微泡的制备 称量成膜磷脂材料DSPE-PEG(2000)Biotin、DPPC、DPPE、DPPA,按一定比例混合,加入少量荧光染料,溶于定量的甲醛和三氯甲烷混合溶液中,甲醛和三氯甲烷挥发完全后,加入甘油和磷酸盐缓冲液(PBS),在45 ℃水浴箱中孵育30 min,再次使用氟碳气体置换空气,在振荡器中振荡50 s得到脂质超声微泡。
1.2.2 携带GPC-3抗体及HSV-TK基因的靶向超声微泡的制备 取适量(约含3.0×108微泡)已制备好的微泡,将其加入2 mL EP管中;加入90 μg 链霉亲和素,轻轻反复颠倒摇匀,置于4 ℃冰箱,孵育30 min;然后在4 ℃环境下离心,弃下清液,PBS轻轻漂洗后离心2次,弃下清液、去除过量的链霉亲和素;加入20 μg 生物素化GPC-3抗体轻轻颠倒摇匀,4 ℃孵育30 min;4 ℃ 500 r/min离心4 min,PBS漂洗离心2次,弃下清液,去除过量的GPC-3抗体,即可得到携GPC-3抗体的靶向超声微泡。取适量异硫氰酸荧光素(FITC)标记的山羊抗兔IgG作为二抗,携GPC-3抗体的超声微泡中,4 ℃孵育30 min;4 ℃ 500 r/min离心4 min,弃下清液,PBS漂洗离心2次,弃下清液,去除过量的二抗;取出提取的HSV-TK质粒20 μg,加入上述已连接GPC-3抗体的微泡溶液共孵育,去除下清液得到靶向携基因超声微泡。将微泡涂片,荧光显微镜下观察。
1.2.3 荧光显微镜下观察靶向载基因超声微泡对肝癌HepG2细胞的结合情况 取对数生长期HepG2细胞,在6孔板底部以1×104/孔进行接种,细胞培养贴壁后,继续培养,制备细胞爬片,设置对照组和靶向微泡组,每组各5张,对照组加入非靶向微泡200 μL,靶向组加入靶向载基因超声微泡200 μL,于5% CO2、37 ℃培养箱中共孵育2 h,取出爬片,PBS反复冲洗5次,在荧光显微镜下观察结合情况。
1.2.4 逆转录聚合酶链反应(RT-PCR)及Western blot 检测肝癌HepG2细胞中增殖细胞核抗原(PCNA)表达情况 将靶向超声微泡与对数生长期HepG2细胞在5% CO2、37 ℃培养箱中共孵育30 min,给予超声辐射(1 MHz,2 W/cm2,间隔30 s,持续5 min),基因转染完成后,加入羟甲基无环鸟苷(GCV)溶液100 μL(浓度为10 mg/L)。超声辐照后,再次孵育48 h,收集细胞,分别提取总RNA和蛋白,RT-PCR及Western blot 检测肝癌HepG2细胞中PCNA表达情况。
1.2.5 噻唑蓝(MTT)法检测各组细胞凋亡 HSV-TK质粒在超声作用下转染进入细胞后,加入GCV,继续培养72 h,进行MTT实验,每孔加入MTT溶液20 μL,继续孵育4 h,终止培养,吸取上清液,每孔加入150 μL二甲基亚砜(DMSO),振荡10 min,使晶体充分降解,然后进行比色,在490 nm波长下测定各组细胞光吸收值并记录实验结果。
1.2.6 细胞侵袭实验 将冰冻BD matrigel置于4 ℃,待其变成液体后,将其与无血清1640培养基按1∶2比例稀释,transwell置于24孔板中,加入稀释后的matrigel(每孔100 μL)于transwell上室,置于37 ℃孵箱中4 h;HepG2细胞重悬于含1%胎牛血清(FBS)的RPMI-1640培养基中,调整浓度为5×105/mL,每孔200 μL接种于预先铺好matrigel的transwell上室中;HepG2细胞转染后72 h,收集各组培养液,按照分组以每孔600 μL加入transwell下室中,继续在37 ℃、5% CO2孵箱中培养24 h;棉签拭去上室残留未侵袭细胞,transwell小室中加入0.1%结晶紫,置于37 ℃孵箱中30 min,倒置显微镜下(200×)观察肿瘤细胞侵袭能力,随机选择5个视野进行计数。
2 结 果
2.1 超声微泡特征 白光下观察超声微泡大小均一,分布均匀,见图1。
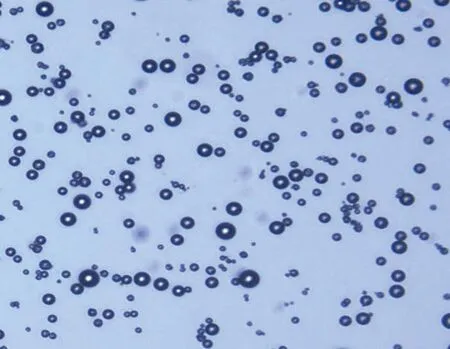
图1 微泡在激光共聚焦显微镜下成像特征(白光,×1 000)
2.2 微泡造影剂粒径及表面电位特征 微泡造影剂粒径(Diameter)为(512.57±25.18)nm,其表面电位(Zeta-potential)为(-2.54±0.75)mV。
2.3 超声微泡与GPC-3抗体连接情况 超声微泡与GPC-3抗体结合后在激光共聚焦显微镜下成像情况,白光下观察大小一致,分布均匀,激光激发后,周围呈现绿色荧光,表明靶向载基因微泡成功构建(图2)。
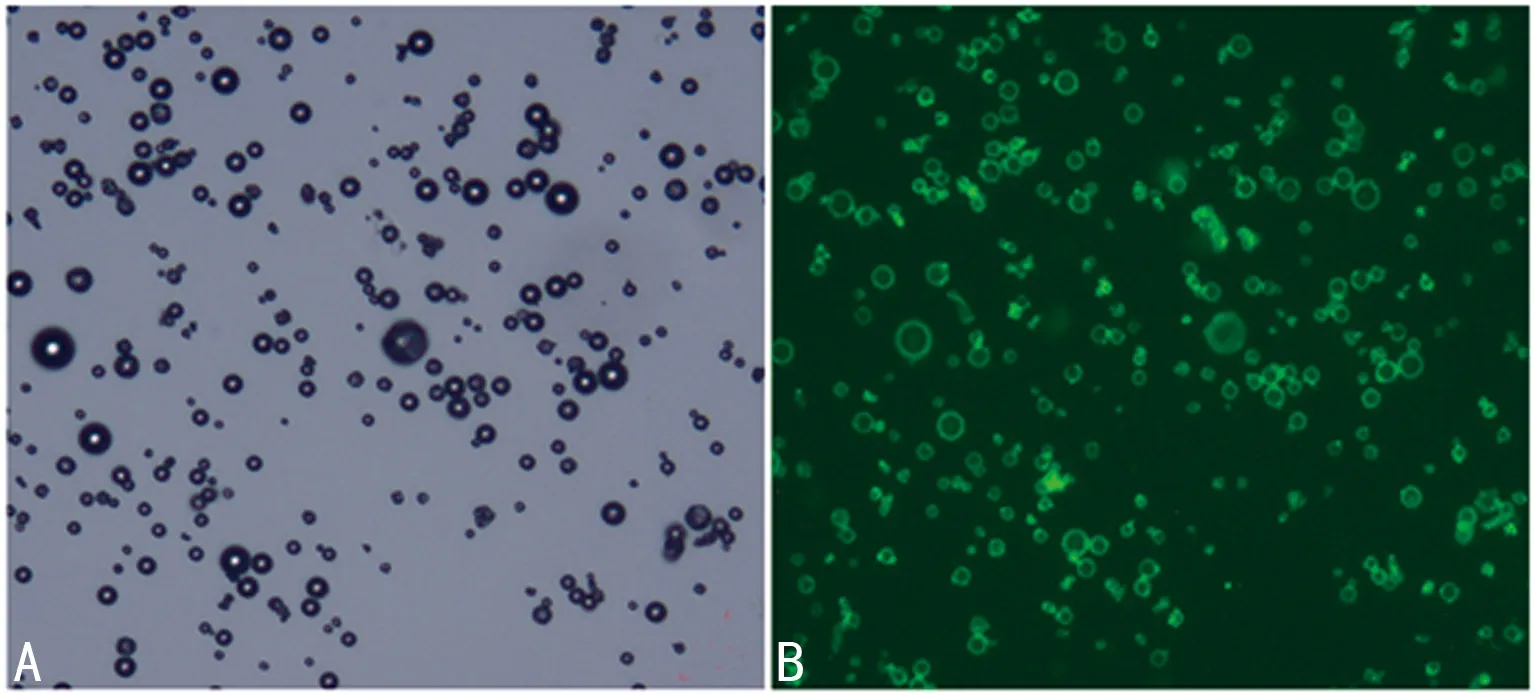
A:MB的白光图像;B:MB-GPC-3与二抗连接后在激光激发下呈现绿色荧光。
图2 超声微泡在激光共聚焦显微镜下成像(×1 000)
2.4 靶向载基因超声微泡体外寻靶 400倍光镜下观察到:(1)载基因靶向微泡组(MB-GPC-3组),较多量载基因靶向微泡造影剂与肝癌HepG2细胞紧密结合,主要分布在细胞周边及细胞壁游离面上(图3B);(2)载基因非靶向微泡组(MB组),在PBS 的反复冲洗下,细胞周围观察不到或仅见少量造影剂黏附(图3A)。
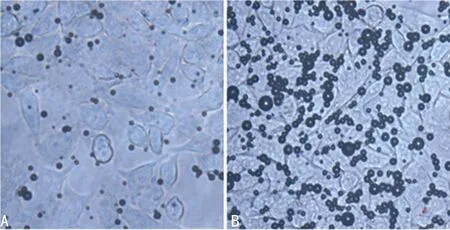
A:MB组;B:MB-GPC-3组。
图3 体外寻靶实验(白光,×400)
2.5 携HSV-TK质粒的不同微泡的转染效率 由于构建质粒是已将绿色荧光蛋白(GFP)连接进入质粒,因此当HSV-TK质粒成功转染进入细胞后,荧光显微镜下会见到绿色荧光,此时就可表明质粒转染成功。转染24 h后,荧光显微镜下观察见对照组无荧光表达,MB组和MB-GPC-3组荧光表达较多,其中MB-GPC3组表达最高。各组转染效率分别为(0.26±0.05)%、(2.73±0.34)%、(20.53±2.15)%,MB-GPC3组转染效率最高,差异有统计学意义(P<0.01),见图4。
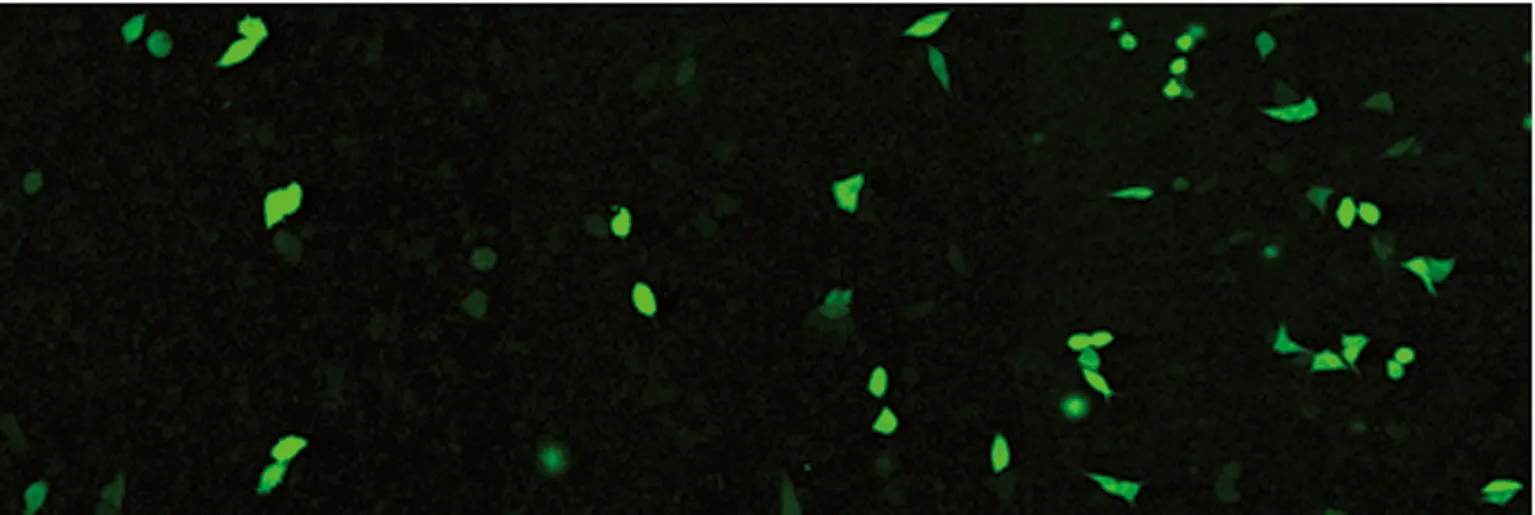
图4 转染质粒后各组细胞荧光表达(×400)
2.6 RT-PCR及Western blot 检测靶向转染HSV-TK质粒后HepG2细胞中PCNA表达 转染后48 h测PCNA mRNA和蛋白表达情况,对照组mRNA和蛋白表达最高,MB组和MB-GPC3组表达水平降低,其中MB-GPC3组表达水平最低,见图5、6。
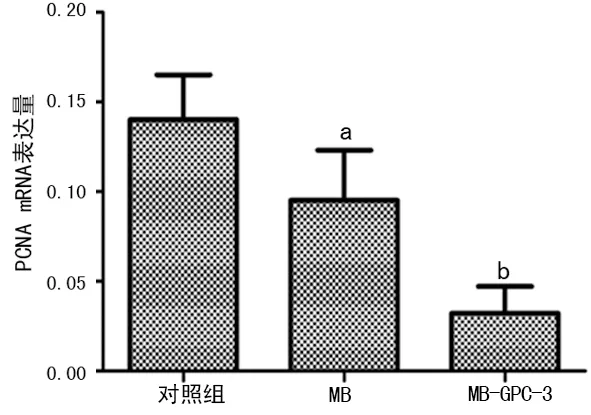
a:P<0.05,与对照组比较;b:P<0.01,与对照组和MB组比较。
图5 PCNA mRNA表达情况
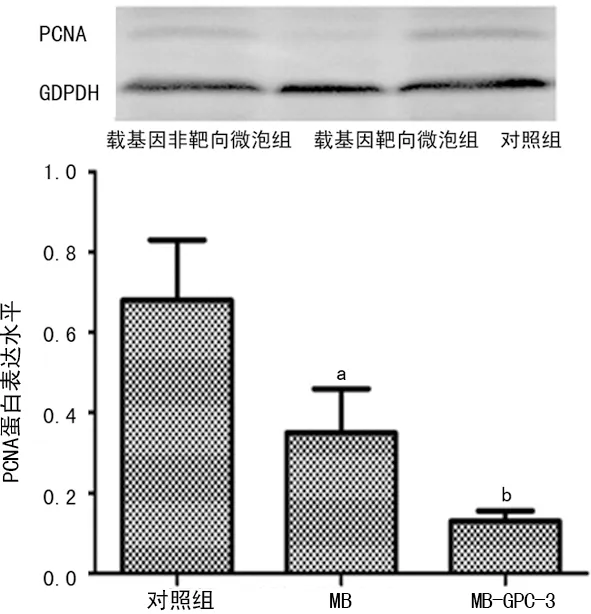
a:P<0.05,与对照组比较;b:P<0.01,与对照组和MB组比较。
图6 PCNA蛋白表达情况
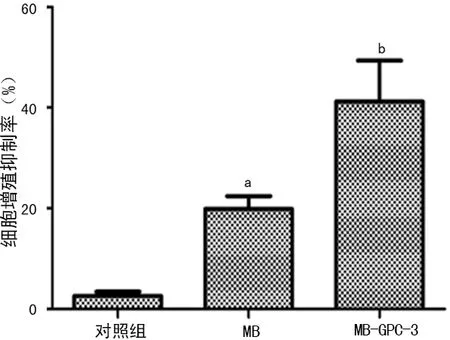
a:P<0.05,与对照组比较;b:P<0.01,与对照组和MB组比较。
图7 细胞增殖抑制率
2.7 MTT检测细胞增殖抑制 MTT法检测转染HSV-TK质粒对HepG2细胞的增殖抑制作用,结果显示,各实验组对HepG2细胞均有不同抑制,MB组和MB-GPC-3组抑制最为明显,与对照组比较差异有统计学意义(P<0.01),见图7。
2.8 Transwell法检测转染HSV-TK质粒后对HepG2细胞侵袭力的影响 各组经过相应处理的HepG2细胞穿过transwell上下室之间聚碳酸酯膜的结果如下,对照组(57.63±4.61)及MB组(49.16±3.89)穿过室膜的细胞数量较多,而MB组和MB-GPC-3组穿过的细胞数量较少,其中MB-GPC-3组穿过的细胞数最少(22.18±2.01)。两组与对照组相比,差异均具有统计学意义(P<0.05),而MB-GPC-3组侵袭细胞数量最低,差异有统计学意义(P<0.05),见图8。

A:对照组;B:MB组;C:MB-GPC-3组。
图8 Transwell法检测HepG2细胞侵袭力(伊红染色×400)
3 讨 论
随着科学技术发展,人们对肿瘤研究的逐步深入,发现从分子水平对肿瘤进行特异性杀伤成为新的治疗策略[1],但如何将用于治疗的基因高效、安全地转染进入细胞是目前研究的热点和难点。就目前而言,病毒载体是最高效的转染方式,但其本身会引起机体的免疫反应及不确定的致瘤性也限制了它的发展和应用。于是结合当前研究热点,选择非病毒载体来携带目的基因进行转染,但它们普遍存在携载率低等缺陷[2]。超声微泡靶向破坏技术是利用超声辐照破坏微泡时产生的空化效应及声孔效应使内皮细胞间隙扩大,细胞膜产生可逆性的小孔,有利于胞外的物质进入细胞,由此提供新的思路[3-6]。
超声微泡作为超声造影剂被广泛应用于超声诊断[7],其同时也具备携载基因及药物的功能,因其具备安全、高效、简单便捷等优点[8],已被众多研究者用于体内、体外靶向转染,并在多种疾病的诊断及治疗方面展现出极好的优势[9-10]。超声微泡是有被膜及核心气体构成小的气泡[11],目前以脂质微泡为主,脂质微泡较其他微泡比较具有稳定性好、持续时间长、制备工艺简单等优势,但也存在携载率低、靶向性差等缺点[12-14]。因此如何提高其携载率及改变其靶向性成为研究目标。普通超声微泡由DSPE-PEG(2000)、DPPC、DPPE及DPPA等按一定比例混合后,在机械振荡作用下构建而成[15]。由于其膜性成分决定了其表面为负电荷或中性,多肽、抗体等有机成分均为负电荷,因此二者之间结合较为困难,目前最常用的连接方法为通过多聚赖氨酸转化电荷进行桥连。携载质粒的靶向微泡在体外可顺利达到靶标,并与靶标通过抗原抗体反应进行特异性结合,然后在超声作用下爆破微泡释放HSV-TK质粒,进而促进转染。
本实验中证实转染后有TK蛋白表达,在MB-GPC3组呈现高表达,高于其他各组,说明靶向微泡可以明显地促进基因转染。HSV-TK质粒进入细胞后并没有直接杀伤肿瘤细胞作用,在给予前药GCV后,HSV-TK可以将无毒的GCV转化成细胞毒性药物从而进行杀伤。MTT实验证实MB及MB-GPC3组细胞凋亡较多,其中MB-GPC3组凋亡细胞最多,高达49%;与此同时细胞的侵袭能力得以降低。
综上所述,本研究成功制备了可以携带目的基因的靶向超声微泡,并在体外可特异性地与靶细胞结合,在超声辐射下靶向释放目的基因,从而提高了转染效率,为肿瘤靶向治疗提供了新思路。
[1]Marukawa Y,Nakamoto Y,Kakinoki K,et al.Membrane-bound form of monocyte chemoattractant protein-1 enhances antitumor effects of suicide gene therapy in a model of hepatocellular carcinoma[J].Cancer Gene Ther,2012,19(5):312-319.
[2]Taniyama Y,Azuma J,Kunugiza Y,et al.Therapeutic option of plasmid-DNA based gene transfer[J].Curr Top Med Chem,2012,12(15):1630-1637.
[3]Porter TR,Iversen PL,Li S,et al.Interaction of diagnostic ultrasound with synthetic oligonucleotide-labeled perfluorocarbon-exposed sonicated dextrose albumin microbubbles[J].J Ultrasound Med,1996,15(8):577-584.
[4]Greenleaf WJ,Bolander ME,Sarkar G,et al.Artificial cavitation nuclei significantly enhance acoustically induced cell transfection[J].Ultrasound Med Biol,1998,24(4):587-595.
[5]Miller DL,Pislaru SV,Greenleaf JE.Sonoporation:mechanical DNA delivery by ultrasonic cavitation[J].Somat Cell Mol Genet,2002,27(1/6):115-134.
[6]Nomikou N,Tiwari P,Trehan T,et al.Studies on neutral,cationic and biotinylated cationic microbubbles in enhancing ultrasound-mediated gene delivery in vitro and in vivo[J].Acta Biomater,2012,8(3):1273-1280.
[7]Nomikou N,Mchale AP.Exploiting ultrasound-mediated effects in delivering targeted,site-specific cancer therapy[J].Cancer Lett,2010,296(2):133-143.
[8]张清凤,王志刚,冉海涛,等.一种载基因阳离子微泡超声造影剂的制备及特性研究[J].中国超声医学杂志,2012,28(6):485-488.
[9]Dang SP,Wang RX,Qin MD,et al.A novel transfection method for eukarotic cells using polythylenimine coated albumin microbubbles[J].Plasmid,2011,66(1):19-25.
[10]Frenkel V.Ultrasound mediated delivery of drugs and genes to solid tumors[J].Adv Drug Deliv Rev,2008,60(10):1193-1208.
[11]张清凤,王志刚,李攀,等.超声联合阳离子微泡造影剂体外增强基因转染[J].中国医学影像技术,2012,28(2):211-215.
[12]Wang DS,Panje C,Pysz MA,et al.Cationic versus neutral microbubbles for ultrasound-mediated gene delivery in cancer[J].Radiology,2012,264(3):721-732.
[13]Sun L,Huang CW,Wu J,et al.The use of cationic microbubbles to improve ultrasound-targeted gene delivery to the ischemic myocardium[J].Biomaterials,2013,34(8):2107-2116.
[14]Chung DJ,Cho SH,Lee JM,et al.Effect of microbubble contrast agent during high intensity focused ultrasound ablation on rabbit liver in vivo[J].Eur J Radiol,2012,81(4):519-523.
[15]Kiessling F,Huppert J,Palmowski M.Functional and molecular ultrasound imaging:concepts and contrast agents[J].Curr Med Chem,2009,16(5):627-642.
Effect of targeted ultrasound microbubble carrying target gene on the proliferation of HepG2 cells in human hepatocellular carcinoma
LiJiong1,GuHaitao2△,SunYong3▲
(1.DepartmentofSurgery,thePeople′sHospitalofYubeiDistrict,Chongqing401120,China; 2.DepartmentofSurgery,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China; 3.TranditionalChineseMedicineHospitalofBananDistrict,Chongqing401320,China)
Objective To prepare a targeted ultrasound micro bubble,which carried the HSV-TK gene,and investigate the in vitro target searching ability of the micro bubbles and inhibitory effect on the proliferation of HepG2 cells.Methods Ultrasonic micro bubbles were prepared by mechanical vibration method,construction of targeted HSV-TK ultrasound micro bubbles by biotin affinity bridge construction.To detect the general characteristics of ultrasound micro bubbles,and to test its effect on the proliferation of HepG2 cells in vitro.Results HSV-TK targeted ultrasound microbubbles more gathered on the surface of HepG2 cells,through detection of PCNA and MTT,it was found that the proliferation of gene targeting microbubble group was obviously decreased,cell apoptosis increased significantly,Cells invade experiments showed that the number of cells in genetic microbubble group (22.18±2.01)decreased significantly compared with the control group and the nontargeted group,can effectively inhibit the proliferation and invasive ability of HepG2 cells.Conclusion Targeted ultrasound microbubble carrying target gene have better inhibitory effect on HepG2 cells in vitro.
liver neoplasms;cell proliferation;ultrasound micro bubble;GPC3;HepG2 cell
李炯(1981-),主治医师,硕士,主要从事肝胆胸外科的研究。△
,E-mail:664186632@qq.com。▲共同通信作者,E-mail:404818126@qq.com。
��·基础研究
10.3969/j.issn.1671-8348.2017.05.008
R735.7
A
1671-8348(2017)05-0600-04
2016-07-09
2016-09-07)
