利妥昔单抗治疗难治性肝脏移植物抗宿主病3例
2017-03-01李含
李 含
(广西壮族自治区人民医院血液内科,南宁 530022)
利妥昔单抗治疗难治性肝脏移植物抗宿主病3例
李 含
(广西壮族自治区人民医院血液内科,南宁 530022)
移植物抗宿主病(GVHD)是异基因造血干细胞移植后的重要并发症和主要死因之一。其中,肝脏是主要累及的靶器官之一。肝脏GVHD的病理表现为肝小胆管阶段性破裂、胆管上皮细胞损伤、胆管萎缩、细胞变性,出现胆汁淤积[1]。临床表现为黄疸、高胆红素血症,通常伴有碱性磷酸酶、谷氨酰转肽酶(GGT)的升高。一般认为,供者效应T淋巴细胞是导致GVHD的“元凶”,这些T淋巴细胞一方面通过细胞毒作用及释放炎症因子等攻击靶器官,另一方面促进B淋巴细胞活化和抗体的生成[1-2]。因此,目前GVHD的预防和治疗手段主要在于抑制供者T淋巴细胞功能,包括糖皮质激素、环孢素A等。然而,约有40%的患者对这些一线治疗耐药,这些患者的长期存活率仅有5%~30%[1]。近年来发现,B淋巴细胞在移植物抗宿主病中有重要作用,并有学者将利妥昔单抗(CD20单抗)应用在GVHD的预防和治疗中,但目前我国尚少见利妥昔单抗治疗肝脏GVHD的相关报道。对3例异基因造血干细胞移植后发生肝脏GVHD并对一线治疗无效的患者给予利妥昔单抗治疗,观察利妥昔单抗治疗难治性肝脏GVHD的疗效。
1 临床资料
1.1 一般资料 2007-2015年本院血液科治疗的3例异基因造血干细胞移植后发生肝脏GVHD并使用利妥昔单抗治疗的患者,3例患者均为男性,移植前后肝炎病毒(HAV-Ab、HBV-Ag、HCV-Ab)及CMV、EBV均为阴性,患者一般资料见表1。肝脏GVHD的诊断参照NIH专家共识[3-4],血清胆红素、碱性磷酸酶(ALP)高于正常上限值2倍,天门冬氨酸氨基转移酶(AST)或丙氨酸氨基转氨酶(ALT)高于正常上限值2倍,排除由于药物反应、感染、肿瘤及其他疾病导致的肝功能损害,即可临床诊断肝脏GVHD,肝脏组织病理有助于确诊。患者1为病理诊断(表现为肝细胞肿胀、气球样变,胆小管上皮变性坏死,汇管区可见淋巴细胞浸润),另2例均为临床诊断。3例患者先后经甲泼尼龙1~2 mg/kg及环孢素A、他克莫司、吗替麦考酚酯、甲氨蝶呤、环磷酰胺等免疫抑制剂治疗无效,被判断为一线治疗无效的难治性肝脏GVHD。
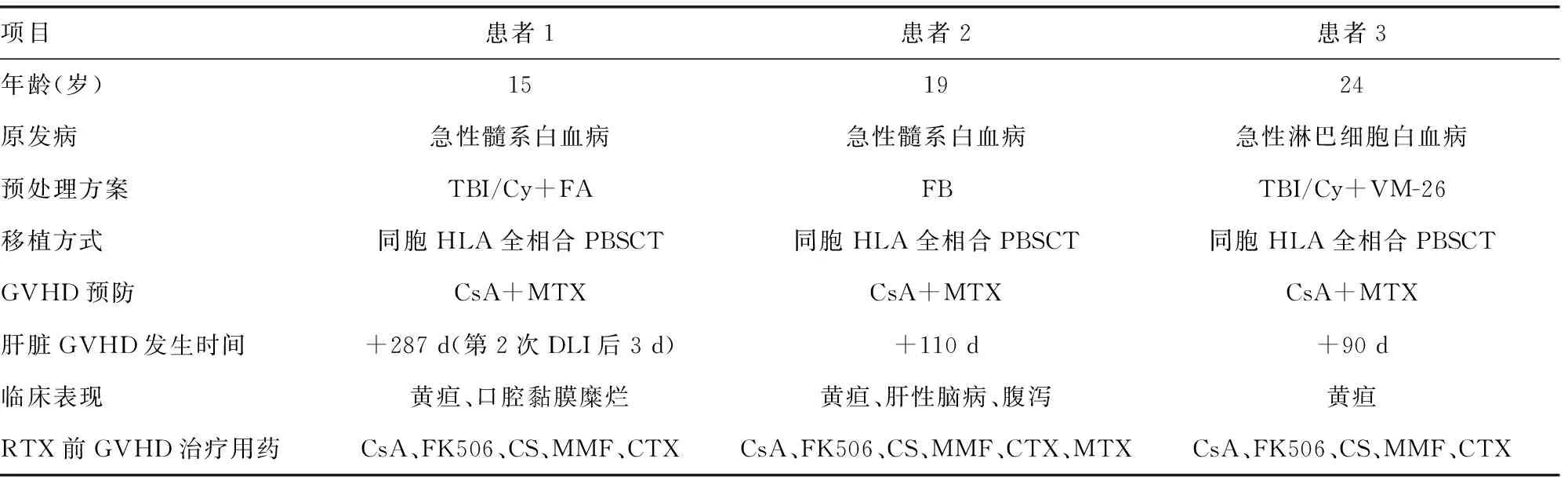
表1 患者一般资料
CsA:环孢素A;FK506:他克莫司;CS:糖皮质激素;MMF:吗替麦考酚酯;CTX:环磷酰胺 MTX:甲氨蝶呤;PBSCT:外周血造血干细胞移植;DLI:供者淋巴细胞输注。
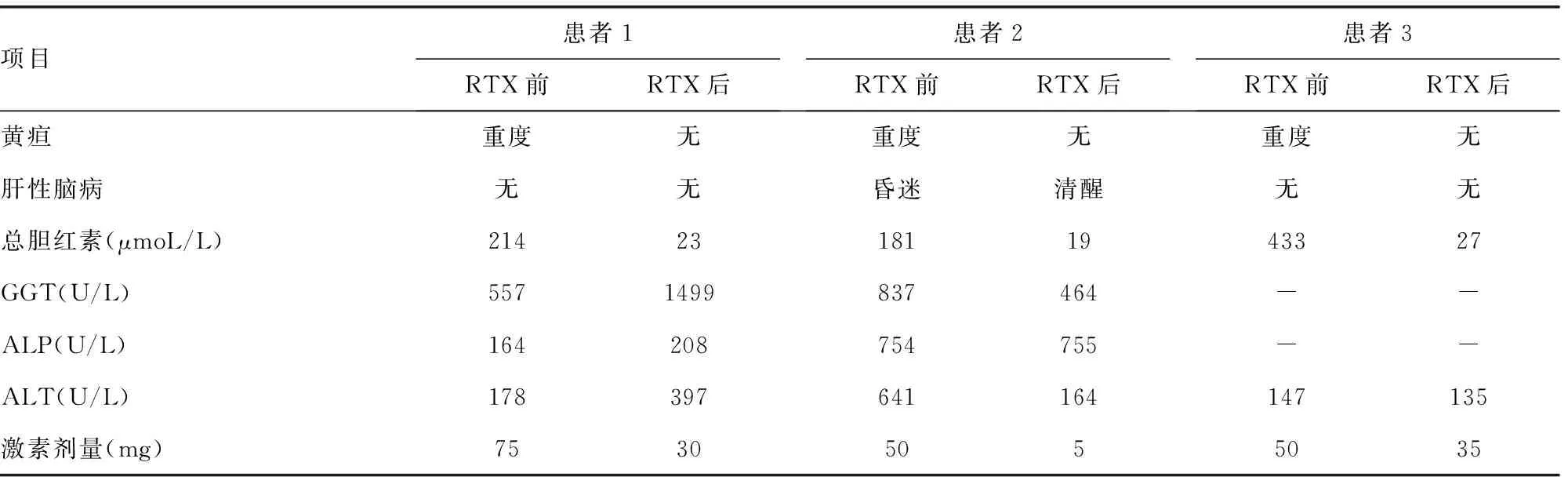
表2 利妥昔单抗治疗效果
-:表示无数据。
1.2 治疗方案 利妥昔单抗(RTX)375 mg/m2,每周1次,共4周,治疗前已充分向患者告知并签署知情同意书。治疗期间糖皮质激素、环孢素A或他克莫司、吗替麦考酚酯使用继续同前。
1.3 效果评价 治疗效果判断标准为:完全缓解(临床症状、实验室指标恢复正常)、部分缓解(临床症状、实验室指标有所改善),其中血清总胆红素为主要实验室评判指标。经利妥昔单抗治疗前后临床症状、实验室指标、激素剂量等方面评价其治疗效果(表2)。3例患者GVHD发生至第1次RTX时间分别为62、70、51 d;RTX后胆红素开始下降时间分别为26、3、9 d;第1次RTX后随访时间分别为243、320、305 d;肝脏GVHD发生后总随访时间分别为305、390、356 d。
2 讨 论
一直以来,供者T淋巴细胞被认为是介导GVHD病理机制的主要效应细胞。然而,近年来人们在GVHD患者体内检测到大量自身抗体以及活性升高的B淋巴细胞[5-9]。Iori等[10]发现外周造血干细胞中B淋巴细胞的含量会影响急性GVHD的发病率。有不少学者在临床应用中发现,预处理方案含有利妥昔单抗的患者急性GVHD发病率较低[11-13],而B淋巴细胞肿瘤的患者在移植前6个月内曾使用过利妥昔单抗化疗的其急性GVHD发生率也明显下降[14-16]。由此认为B淋巴细胞在移植物抗宿主病中可能有重要作用。进一步的理论研究发现,B淋巴细胞在移植物抗宿主病中通过抗原递呈作用、抗体依赖的细胞毒作用(ADCC)以及B淋巴细胞活化因子(BAFF)发挥作用[17]。在GVHD发病过程中,由于CD4+T淋巴细胞的刺激,记忆B淋巴细胞增殖并产生自身抗体,而活化的B淋巴细胞亦可以促进T淋巴细胞活化和增殖[18]。B淋巴细胞和T淋巴细胞互相作用促进GVHD的发生发展。在此理论基础上,人们尝试将利妥昔单抗应用在GVHD的预防和治疗中,期望通过去除B淋巴细胞,切断免疫循环链达到防治GVHD的目的。有研究发现,移植后预防性输注利妥昔单抗能有效减少GVHD的发生,降低病死率,提高总生存率[19-21]。Arai等[22]将利妥昔单抗用于治疗移植后出现皮肤硬化的病人,有效率为27%,14%的患者得到完全缓解,并发现在这些患者体内活化的B淋巴细胞比率显著升高。一些前瞻性或回顾性研究显示,利妥昔单抗在GVHD治疗的有效率为50%~83%,最高甚至可达100%,其中对皮肤GVHD的治疗效果最好,有效率约60%,但在肝脏、肺、眼睛等靶器官的治疗效果并不确切,在肝脏GVHD中的治疗有效率在0~66.7%[17,23-29]。Clavert等[30]对18例慢性GVHD患者使用利妥昔单抗,总有效率为55%,3例肝脏GVHD有1例患者有效,71%的患者激素剂量得到明显减少。Solomon等[31]在初发广泛cGVHD患者中不使用激素,而仅给予利妥昔单抗联合免疫抑制剂治疗,有效率达88%,77%的患者可完全停用免疫抑制剂。
因肝脏急性和慢性GVHD在临床表现、实验室检查及组织病理活检上均极为相似,因此本文中并未将3例患者的肝脏GVHD进行急性或慢性的界定。本文中3例一线治疗耐药的肝脏GVHD的患者,使用利妥昔单抗治疗后均获得了部分缓解,血总胆红素含量均下降至正常上限值2倍以下,激素剂量分别减少30%、60%、90%。治疗后随访8~10个月,3例患者病情均保持稳定,未出现肝脏GVHD复发、进展或加重。3例患者均未发现利妥昔单抗相关的药物不良反应。3例患者用药后起效时间差异较大,病情最严重的患者2(合并肝性脑病)用药后起效最快,激素剂量减少最显著,而病情相对较轻的患者1起效最慢,转氨酶甚至有所上升,推测这可能是因为在GVHD发病早期,更多的是T淋巴细胞起作用。而随着疾病的发展,T淋巴细胞刺激B淋巴细胞产生抗体后,B淋巴细胞在GVHD中的致病作用逐渐显现并占有越来越多的比重,进一步加重病情。所以在GVHD后期、病情较重时使用利妥昔单抗,将B淋巴细胞去除后,有可能更明显的减轻病情,反之,在相对早期时采用利妥昔单抗,由于B淋巴细胞的作用权重尚较轻,效果相对来说可能不那么明显。但关于GVHD不同严重程度时各种淋巴细胞及相关免疫学指标的比例有无不同,目前国内外均少见相关研究,而本研究中,亦未在发病早期、加重时、利妥昔单抗治疗前后进行相关免疫学检测,因此暂无有力证据证明上述推测,这可能是今后研究工作的重点方向。
综上所述,利妥昔单抗有利于一线治疗耐药的肝脏GVHD的治疗,主要表现在降低血胆红素水平及减少激素用量,这将减少由于长期服用大剂量激素控制GVHD所带来的众多不良反应。尽管本研究病例数仅有3例,且由于各种原因只有1例行肝脏穿刺活检病理确诊GVHD,当时并未对其中浸润汇管区的淋巴细胞进行免疫组化检查,否则这将成为证明B淋巴细胞是肝脏GVHD中重要效应细胞的有力证据,并为使用利妥昔单抗治疗提供依据。但从治疗效果上来看,笔者认为利妥昔单抗对一线治疗无效的肝脏GVHD疗效显著,这也从一定程度上映证了B淋巴细胞可能在肝脏GVHD的发生发展中发挥着重要的作用,在今后工作中,还需要更多的基础研究及前瞻性研究以证明。
[1]黄晓军.血液病学[M].北京:人民卫生出版社,2009:309-322.
[2]曹履先,陈虎.骨髓移植学[M].北京:军事医学出版社,2008:129-136.
[3]Filipovich AH,Weisdorf D,Pavletic S,et al.National institutes of health consensus development project on criteria for clinical trials in chronic graft-versus-host disease:I.diagnosis and staging working group report[J].Biol Blood Marrow Transplant,2005,11(12):945-956.
[4]Pavletic SZ,Martin P,Lee SJ,et al.Measuring therapeutic response in chronic graft-versus-host disease:National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease:Ⅳ.Response Criteria Working Group report[J].Biol Blood Marrow Transplant,2006,12(3):252-266.
[5]Patriarca F,Skert C,Sperotto A,et al.The development of autoantibodies after allogeneic stem cell transplantation is related with chronic graft-vs-host disease and immune recovery[J].Exp Hematol,2006,34(3):389-396.
[6]Abrahamsen IW,Somme S,Heldal D,et al.Immune reconstitution after allogeneic stem cell transplantation:the impact of stem cell source and graft-versus-host disease[J].Haematologica,2005,90(1):86-93.
[7]Fujii H,Cuvelier G,She K,et al.Biomarkers in newly diagnosed pediatric-extensive chronic graft-versus-host disease:a report from the Children′s Oncology Group[J].Blood,2008,111(6):3276-3285.
[8]Svegliati S,Olivieri A,Campelli NA,et al.Stimulatory autoantibodies to PDGF receptor in patients with extensive chronic graft-versus-host disease[J].Blood,2007,110(1):237-241.
[9]Kuzmina Z,Gounden V,Curtis L,et al.Clinical significance of autoantibodies in a large cohort of patients with chronic graft-versus-host disease defined by NIH criteria[J].Am J Hematol,2015,90(2):114-119.
[10]Iori AP,Torelli GF,De Propris MS,et al.B-Cell concentration in the apheretic product predicts acute graft-versus-host disease and treatment-related mortality of allogeneic peripheral blood stem cell transplantation[J].Transplantation,2008,85(3):386-390.
[11]Christopeit M,Schuettee V,Theurich S,et al.Rituximab reduces the incidence of acute graft-versus-host disease[J].Blood,2009,113(13):3130-3131.
[12]Khouri IF,Mclaughlin P,Saliba RM,et al.Eight-year experience with allogeneic stem cell transplantation for relapsed follicular lymphoma after nonmyeloablative conditioning with fludarabine,cyclophosphamide,and rituximab[J].Blood,2008,111(12):5530-5536.
[13]Kebriaei P,Saliba RM,Ma C,et al.Allogeneic hematopoietic stem cell transplantation after rituximab-containing myeloablative preparative regimen for acute lymphoblastic leukemia[J].Bone Marrow Transplant,2006,38(3):203-209.
[14]Van Dorp S,Pietersma F,Woelfl MA,et al.Rituximab treatment before Reduced-Intensity conditioning transplantation associates with a decreased incidence of extensive chronic GVHD[J].Biol Blood Marrow Transplant,2009,15(6):671-678.
[15]Ratanatharathorn V,Logan B,Wang D,et al.Prior rituximab correlates with less acute graft-versus-host disease and better survival in B-cell lymphoma patients who received allogeneic peripheral blood stem cell transplantation[J].Br J Haematol,2009,145(6):816-824.
[16]Crocchiolo R,Castagna L,El-Cheikh J,et al.Prior rituximab administration is associated with reduced rate of acute GVHD after in vivo T-cell depleted transplantation in lymphoma patients[J].Exp Hematol,2011,39(9):892-896.
[17]Alousi AM,Uberti J,Ratanatharathorn V.The role of B cell depleting therapy in graft versus host disease after allogeneic hematopoietic cell transplant[J].Leuk Lymphoma,2010,51(3):376-389.
[18]Shimabukuro-Vornhagen A,Hallek MJ,Storb RF,et al.The role of B cells in the pathogenesis of graft-versus-host disease[J].Blood,2009,114(24):4919-4927.
[19]Shimoni A,Hardan I,Avigdor A,et al.Rituximab reduces relapse risk after allogeneic and autologous stem cell transplantation in patients with high-risk aggressive non-Hodgkin′s lymphoma[J].Br J Haematol,2003,122(3):457-464.
[20]Arai S,Sahaf B,Narasimhan B,et al.Prophylactic rituximab after allogeneic transplantation decreases B-cell alloimmunity with low chronic GVHD incidence[J].Blood,2012,119(25):6145-6154.
[21]Cutler C,Kim HT,Bindra B,et al.Rituximab prophylaxis prevents corticosteroid-requiring chronic GVHD after allogeneic peripheral blood stem cell transplantation:results of a phase 2 trial[J].Blood,2013,122(8):1510-1517.
[22]Arai S,Pidala J,Pusic I,et al.A randomized phase Ⅱ crossover study of imatinib or rituximab for cutaneous sclerosis after hematopoietic cell transplantation[J].Clin Can Res,2016,22(2):319-327.
[23]Kim SJ,Lee JW,Jung CW,et al.Weekly rituximab followed by monthly rituximab treatment for steroid-refractory chronic graft-versus-host disease:results from a prospective,multicenter,phase II study[J].Haematologica,2010,95(11):1935-1942.
[24]Von Bonin M,Oelschlaegel U,Radke J,et al.Treatment of chronic steroid-refractory graft-versus-host disease with low-dose rituximab[J].Transplantation,2008,86(6):875-879.
[25]Teshima T,Nagafuji K,Henzan H,et al.Rituximab for the treatment of corticosteroid-refractory chronic graft-versus-host disease[J].Int J Hematol,2009,90(2):253-260.
[26]Cutler C,Miklos D,Kim HT,et al.Rituximab for steroid-refractory chronic graft-versus-host disease[J].Blood,2006,108(2):756-762.
[27]Mohty M,Marchetti N,El-Cheikh J,et al.Rituximab as salvage therapy for refractory chronic GVHD[J].Bone Marrow Transplant,2008,41(10):909-911.
[28]Gutiérrez-Aguirre CH,Cantú-Rodríguez OG,Borjas-Almaguer OD,et al.Effectiveness of subcutaneous low-dose alemtuzumab and rituximab combination therapy for steroid-resistant chronic graft-versus-host disease[J].Haematologica,2012,97(5):717-722.
[29]Canninga-Van Dijk MR,Van Der Straaten HM,Fijnheer RA,et al.Anti-CD20 monoclonal antibody treatment in 6 patients with therapy-refractory chronic graft-versus-host disease[J].Blood,2004,104(8):2603-2606.
[30]Clavert A,Chevallier P,Guillaume T,et al.Safety and efficacy of rituximab in steroid-refractory chronic GVHD[J].Bone Marrow Transplant,2013,48(5):734-736.
[31]Solomon SR,Sizemore CA,Ridgeway MA,et al.Corticosteroid-Free primary treatment of chronic extensive Graft-versus-Host disease incorporating rituximab[J].Biol Blood Marrow Transplant,2015,21(9):1576-1582.
李含(1986-),主治医师,硕士,主要从事自身免疫相关的血液系统疾病研究。
�篇及病例报道·
10.3969/j.issn.1671-8348.2017.05.049
R593.9
C
1671-8348(2017)05-0716-04
2016-07-31
2016-09-29)
