Akt和mTOR在脑缺血再灌注大鼠皮质区的表达
2017-03-01王一超
王一超
华北理工大学临床医学院 河北唐山 063000
Akt和mTOR在脑缺血再灌注大鼠皮质区的表达
王一超
华北理工大学临床医学院 河北唐山 063000
①目的 观察蛋白激酶B(Akt)和哺乳动物雷帕霉素靶蛋白(mTOR)在脑缺血再灌注大鼠皮质区的表达及变化情况。②方法 66只SD大鼠随机分为假手术组(Sham组)、脑缺血再灌注组(MCAO组)、PI3K抑制剂组(LY294002组),将后两组按缺血再灌注时间分为3、6、24、48、72小时共5个观察点,每个观察点6只,Sham组6只大鼠。参照改良的Longa线栓方法制作动物模型。按照Zea-Longa量表法进行大鼠神经功能评分。采用HE染色法观察皮质区神经细胞结构变化。免疫组化检测Akt和mTOR蛋白的表达。③结果 与Sham组比较,其他两组神经元存活数目明显减少。与MCAO组比较,LY294002组只有小部分神经细胞变性、坏死。Sham组未见神经功能缺损,与MCAO组比较,LY294002组各时间点神经功能缺损评分减少。与Sham组比较,MCAO组各时间点的Akt、mTOR蛋白表达均明显增高(P<0.05或P<0.01);与MCAO组比较,LY294002组各时间点的Akt和mTOR表达均明显降低(P<0.05或P<0.01)。④结论Akt和mTOR蛋白在脑缺血再灌注大鼠皮质区过度表达,可能是局灶性脑缺血再灌注发生、发展的重要机制之一。
脑缺血再灌注 皮质区 蛋白激酶B哺乳动物雷帕霉素靶蛋白
脑缺血再灌注损伤(cerebral ischemia/reperfusion injury)在中枢神经系统疾病中较为常见。已有研究表明,脑缺血再灌注后神经元损伤涉及多个分子机制[1~6]。磷酯酰肌醇-3激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB或Akt)是体内重要的抗凋亡、促存活的信号转导途径,可通过激活下游一系列效应因子参与细胞增殖、生长、分化等多种关键事件的调控。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种丝氨酸/苏氨酸蛋白激酶,mTOR受到上游PI3K/Akt激活、磷酸化后,作用于下游的靶蛋白,来调控mRNA翻译,从而促使一系列细胞生长、分化相关蛋白的表达[7]。已知PI3K/Akt/mTOR信号转导通路在脑缺血、脑肿瘤、退行性变中的作用已被广泛研究[8~10]。但PI3K/Akt/mTOR信号转导通路参与脑I/R发病机制中的研究尚少。本研究通过建立大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)再灌注大鼠模型,动态检测PI3K/Akt/mTOR信号通路中Akt和mTOR蛋白,探讨其在脑缺血再灌注中的表达及意义。
1 材料与方法
1.1 动物 SD大鼠,雄性,共78只,重220~260 克,由中国人民解放军医学科学院实验动物研究所供给,合格证号SCXK(军)2009-003。在华北理工大学屏障环境动物实验室饲养,自然光照,喂养2周后行大鼠局灶性脑缺血再灌注造模。
1.2 主要试剂与仪器 脑立体定位仪购于日本Narishige公司,微型牙科钻购于美国Grobet公司,组织切片机购于德国Leitz公司,LY294002购于美国Sigma公司,Akt兔抗鼠多克隆抗体购于美国Bioworld公司,mTOR兔抗鼠多克隆抗体购于北京博奥森生物技术有限公司,PV6001试剂盒、DAB显色盒购于北京中杉金桥生物技术有限公司,图像采集及分析系统购于美国Bio-Rad公司。
1.3 方法
1.3.1 动物分组 应用随机数字表法将试验动物分为假手术组(Sham组)6只、脑缺血再灌注组(MCAO组)30只和PI3K抑制剂LY294002组(LY294002组)30只。MCAO和LY294002组按缺血再灌注时间分为再灌注后3、6、24、48、72小时(n=6只)。
1.3.2 动物模型制备 MCAO组:采用改良Longa法制备MCAO再灌注大鼠模型[11]。术前大鼠禁食12小时,禁水4小时。用10%的水合氯醛(0.3mL/100g)腹腔麻醉,于颈部正中行25~30mm纵形切口,暴露并分离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。将ECA 远端结扎,在ECA近分叉处打一活结,动脉夹夹闭近心端CCA与远心端ICA,于ECA结扎处的近心端剪一小口,于ICA处插入栓线,结扎备用线固定栓线,经ICA(松开此处动脉夹)栓至大脑中动脉起始部,阻断来自同侧颈内动脉、大脑后动脉及由对侧经前交通动脉回流的血液。以分叉处为标记,栓线插入深度为(18.0±0.5)mm,感到阻力时停止插线造成缺血,2小时后拔出栓线,实现缺血再灌注。分别于再灌注3、6、24、48、72小时取材。Sham组步骤同上,但不结扎动脉。LY294002组:大鼠成功麻醉后,固定鼠头,切开头皮并分离皮下组织,过氧化氢擦试颅骨以充分暴露前囟的“十字交叉”。侧脑室立体定位[12]:Bregma点旁开0.9mm,向后1.5mm,微型牙科钻于定位点打孔,有明显突破感后拔出。用10μL微量注射器吸取10μL预先配制好的LY294002溶液,再次定位穿刺部位,用微量注射器沿钻孔缓慢进针,进针深度约3.8mm,在 5分钟内缓慢匀速注入,留针5分钟,然后缓慢拔针,缝合头皮,穿刺完毕。侧脑室注射完毕后行MCAO再灌注手术。术后手术部位均用庆大霉素喷洒以抗感染,然后再缝合伤口。
1.3.3 神经行为学评分 大鼠处死前按照Zea-Longa量表法进行大鼠神经功能评分。0分,正常活动;1分,提尾时左前爪呈内收屈曲位;2分,行走时向左转圈;3分,站立时向左倾倒;4分,不能自发行走,意识障碍。评分1~3分进入本实验,0分和4分剔除,及时补充。
1.3.4 脑组织标本制备 各组大鼠神经缺损评分结束后,立即以水合氯醛(350mg/kg)腹腔麻醉,取仰卧位开胸暴露心脏,从心尖插入灌注针至左心室,同时剪开右心耳快速滴入生理盐水300mL进入体循环,无血污后滴入4%多聚甲醛400mL。待大鼠身体僵硬后迅速断头取右脑组织,浸泡于4%多聚甲醛溶液24小时,取其前囟前1mm至前囟后2mm之间的脑组织切块,切取厚2mm的冠状切片;常规脱水、透明、浸蜡包埋,切片,载玻片捞片,晾干后45℃烤箱中烘烤备用。
1.3.5 HE染色 将备用脑组织切片常规二甲苯脱蜡,各级乙醇,100%乙醇→95%乙醇→80%乙醇→75%乙醇脱水,苏木素染色5分钟及伊红染色2分钟,中性树胶封片。在光学显微镜(×200)下观察神经元结构变化。
1.3.6 免疫组织化学染色 切片常规脱蜡至水;磷酸盐缓冲液(PBS)冲洗3次,5min/次;3% 过氧化氢室温15分钟;PBS冲洗3次,5min/次;枸橼酸盐高压热修复抗原,冷却至室温;PBS冲洗3次,5min/次;滴加Akt抗体(1∶250)、mTOR抗体(1∶300),置湿盒内4℃孵育过夜;PBS冲洗3次,5min/次;PV6001试剂盒37℃孵育50分钟,PBS冲洗3次,5min/次;DAB镜检控制显色。Akt阳性产物呈棕黄色颗粒,主要定位于胞浆,部分定位于胞核;mTOR定位于细胞质和/或细胞核,阳性染色为淡黄色、棕黄色或棕褐色。苏木素复染、脱水、透明、封片。高倍镜下随机分别观察各组大鼠皮质区不重叠的6个视野,进行Akt、mTOR蛋白阳性细胞计数,计算阳性细胞平均数。
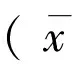
2 结果
2.1 各组大鼠神经行为学评分结果 手术后Sham组大鼠活动正常(评分为0分),未发现神经功能缺损症状。MCAO组和LY294002组在各个时间点均有不同程度神经功能缺损症状(评分1~3分)。与MCAO组比较,LY294002组各时间点神经功能缺损评分减低,缺失症状改善,差异有统计学意义(P<0.05或P<0.01),见表 1。

表1 两组大鼠术后神经功能缺损评分比较±s,分)
注:*P<0.05,**P<0.01
2.2 大鼠脑组织HE染色结果Sham组神经细胞结构基本正常,胞浆被染成红色,细胞核清晰可见,部分可见核仁,被染成蓝色。MCAO组脑组织结构疏松,神经元变性,核固缩、深染,部分胞浆呈空泡样改变,还可见周围毛细血管充血现象。LY29002组只有一小部分神经元变性、坏死,大部分神经元结构完整 ,染色较浅,见图1。

Sham组MCAO组LY294002组
图1 各组大鼠再灌注24h时皮质区HE染色结果
2.3 各组大鼠皮质区Akt和mTOR蛋白表达结果Sham组大鼠皮质区神经细胞可见散在Akt和mTOR阳性表达细胞,MCAO组各时间点Akt、mTOR表达明显增加,且随着时间的延长逐渐增多,24小时达到高峰,48小时表达下降但仍很高。与Sham组比较,MCAO组各时间点Akt和mTOR蛋白阳性细胞均明显增高,差异均有统计学意义(P<0.01);LY294002组Akt和mTOR各个时间点阳性细胞数均低于MCAO组,且均有统计学意义(P<0.05)见表2、表3,图2、图3。

表2 不同时间点各组大鼠皮质区Akt阳性表达比较±s,n=6)
注:与MCAO组比较:*P<0.05;与Sham组比较:**P<0.01
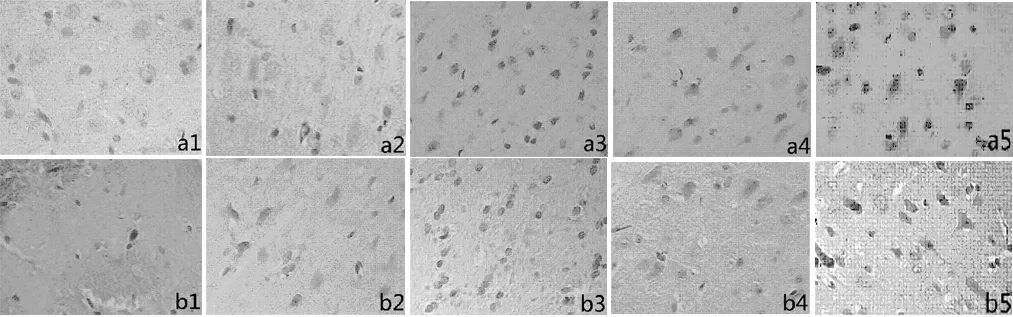
注:a1、a2、a3、a4、a5分别为MCAO组3h、6h、24h、48h、72h;b1、b2、b3、b4、b5分别为LY294002组的3h、6h、24h、48h、72h。

图2 两组大鼠皮质区神经细胞不同时间点Akt表达比较(免疫组化,×400)
注:与MCAO组比较:*P<0.05;与Sham组比较:**P<0.01

注:c1、c2、c3、c4、c5分别为MCAO组3h、6h、24h、48h、72h;d1、d2、d3、d4、d5分别为LY294002组的3h、6h、24h、48h、72h。
图3 各组大鼠皮质区神经细胞不同时间点mTOR表达(免疫组化,×400)
3 讨论
脑缺血可以诱导脑梗死的发生或选择性脑神经元死亡,皮质区发生脑缺血是造成神经功能缺损的主要原因之一。本研究按照改良的Longa法建立大鼠MCAO模型。它可以高度模拟脑I/R发病特点,并且缺血后生理指标较稳定,是目前较理想的脑I/R制备模型。术后我们发现出现了不同程度的左侧肢体瘫痪。HE染色病理学显示右侧大脑中动脉供血区神经细胞水肿、变性、坏死,神经细胞减少等变化。这一结果与Longa叙述的基本吻合,且神经功能缺损评分降低,证明我们的造模是成功的。
PI3K是由一个催化亚基p110和调节亚基p85组成的二聚体,其与细胞增殖、抗凋亡、细胞迁移、细胞癌性转移等众多生理、病理过程有关。正常情况下,PI3K在细胞内含量不多。在生长因子如:血小板源性生长因子、胰岛素样生长因子等刺激下PI3K有不同程度的增加[13]。Akt为PI3K下游重要的蛋白之一,在静息状态细胞中主要存在于细胞浆,PI3K的激活将致Akt磷酸化。活化后的Akt启动通路下游的级联反应,进一步磷酸化下游底物,通过多种途径发挥其促进细胞存活、抗细胞凋亡作用。有大量研究显示,PI3K/Akt通路在缺血性脑损伤中起到保护作用[14~16]。mTOR属于磷脂酰肌醇激酶相关蛋白激酶(phosphatidylinositolkinase-relatedkinase,PIKK)的家族成员,是PI3K信号通路下游分子之一。mTOR在通路中扮演着枢纽作用,既接受上游PI3K/Akt的信息,又将信息进一步传递给下游,影响细胞周期的进展。PI3K/Akt/mTOR信号通路的活化在各类疾病发生、发展过程中起作用。李鹏等[17]报道PI3K、Akt和mTOR在无功能性垂体腺瘤中表达,为NFPAs的靶向治疗提供了更多依据。有研究证实了PI3K/Akt/mTOR通路在胶质瘤发生、发展过程中起重要作用,且该通路抑制剂如LY294002、雷帕霉素等的研究已进入治疗脑胶质瘤的队伍里[18]。本实验结果可以看出,与Sham组相比,MCAO组海马皮质区各时间点的Akt、mTOR阳性细胞表达明显增高(P<0.05),提示脑受到缺血再灌注损伤刺激后,激活了PI3K/Akt/mTOR通路,使Akt、mTOR因子大量表达。应用PI3K特异性抑制剂LY294002进行干预后,LY294002组Akt、mTOR在各时间点表达显著降低(P<0.05),提示LY294002有效抑制PI3K催化活性,阻碍Akt的激活,进一步说明PI3K/Akt/mTOR转导通路在脑缺血再灌注损伤发病过程中发挥了作用,为脑I/R治疗提供了新的靶点。
[1]DongY,ItoT,VelayoC,etal.IntrauterineischemicreperfusionswitchesthefetaltranscriptionalpatternfromHIF-1alpha-toP53-dependentregulationinthemurinebrain[J].PLoSOne,2014,9(10):e110577
[2] 杨佳丹,董 志.脑缺血再灌注损伤的病因学研究进展[J].中国康复医学杂志,2006,21(10):935-938
[3]LiY,SiR,FengY,etal.Myocardialischemiaactivatesaninjuriousinnateimmunesignalingviacardiacheatshockprotein60andToll-likereceptor4[J].JBiolChem,2011,286(36):31308-31319
[4]JinR,YangG,LiG.Inflammatorymechanismsinischemicstroke:roleofinflammatorycells[J].JLeukocBiol,2010,87(5):779-789
[5] 刘 斌,董晓柳.急性脑缺血大鼠海马CA1区细胞凋亡与Caspase-3及Caspase-10蛋白表达的相关性[J].现代预防医学,2012,39(14):275-279
[6]WenYD,ShengR,ZhangLS,etal.Neuronalinjuryinratmodelofpermanentfocalcerebralischemiaisassociatedwithactivationofautophagicandlysosomalpathways[J].Autophagy,2008,4(6):762-769
[7]FosterKC,FincarDC.Mammaliantargetofrapamycin(mTOR):conductingthecellularsignalingsymahony[J].JBiolChem,2010,285(19):14071-14077
[8] 吴苗苗,苑玉和,陈乃宏.mTOR信号通路与神经退行性疾病研究进展[J].中国药理学通报,2011,27(11):1481-1483
[9] 王一超,毛文静,刘 斌,等.靶蛋白信号通路相关蛋白在血管性痴呆大鼠海马CA1区的表达[J].中华老年心脑血管病杂志,2015,17(8):864-867
[10] 陈洪菊,唐彬秩,屈 艺,等.哺乳动物雷帕霉素靶蛋白参与神经系统损伤修复的研究进展及其延伸意义[J].中国修复重建外科杂志,2012,26(5):625-630
[11] 赵 帅,樊小农,孟智宏,等. 线栓法制备大鼠中动脉缺血闭塞模型研究进展[J].山西中医,2012,5(3):56-58
[12]Noshita,N,LewenA,SugawareaT,etal.EvidenceofphosphorylationofAktandneuronalsurvivalaftertransientfocalcerebralischemiainmice[J].JCerebBloodFlowMetab,2001,21(12):p1442-1450
[13]Hanada,M,J.FengandB.A.Hemmings,Structure,regulationandfunctionofPKB/AKT--amajortherapeutictarget[J].BiochimBiophysActa,2004,1697(1-2):p3-16
[14] 马志飞,莫绪明,杨中洲,等.PI3K/Akt在深低温低流量脑保护中的作用[J].中华实验外科杂志,2010,27(7):933-935
[15]Jover-MengualT,MiyawakiT,LatuszekA,etal.AcuteestradiolprotectsCA1neuronsfromischemia-inducedapoptoticcelldeathviathePI3K/Aktpathway[J].BrainRes,2010,1321:1-12
[16]ShiGX,AndresDA,CaiW.RasfamilysmallGTPase-mediatedneuroprotectivesignalinginstroke[J].CentNervSystAgentsMedChem,2011,11(2):114-137
[17] 李 鹏,张庆九,马 法,等.PI3K、Akt和mTOR在无功能性垂体腺瘤中的表达[J].河北医科大学学报,2015,36(9):1064-1068
[18] 梁若飞,刘艳辉.PI3K/Akt/mTOR信号通路靶向治疗胶质细胞瘤研究进展[J].中华神经外科疾病研究杂志,2013,12(4):375-377
(2016-09-02 收稿)(库雪飞 编辑)
Expression of Akt and mTOR in the cortex area of rats with focal cerebral ischemia /reperfusion injury
WangYichao
(NorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
Objective To observe the expression of Akt and mTOR in the cortex area of rats with focal cerebral ischemia /reperfusion injury. Methods A total of 66 SD rats were evenly randomized into 3 groups:sham-operation group(n=6),cerebral ischemia/reperfusion injury model group(MCAO group) and LY294002 group.The rats in the latter two groups subjected to 3,6,24,48 and 72h of I/R(6 in each group).The I/R model was established by referring to the improved Longa thread bolt method.The neurological function score of rats was scored according to the Zea-Longa scale.The structural changes of neurons in the cortical area were observed by HE staining.The expressions of Akt and mTOR were detected by immunohistochemial staining. Results The number of survival neurons in the other two groups was significantly decreased compared with the sham group.Compared with the MCAO group,only a small part of the LY294002 group showed degeneration and necrosis.Neurological function deficit was not found in sham-operation.There was a lower score in LY294002 group compared with the MCAO group.The expressions of Akt and mTOR were obviously increased at all-time points in the I/R group compared with these in the sham-operation group(P<0.05或P<0.01);Compared with MCAO group,LY294002 group showed lower expressions of Akt and mTOR at all-time points(P<0.05或P<0.01). Conclusion PI3K/Akt/mTOR signaling pathway is involved in the pathogenesis of vascular dementia rats.
Cerebral ischemia /reperfusion injury.Cortex area.Akt.mTOR
王一超(1988-),女,硕士,助教。研究方向:脑血管病。
R
A
2095-2694(2017)01-009-6
