重金属锌离子人工抗原的合成及抗体特性
2017-03-01付世杰王亚楠王自良
付世杰, 孙 勇, 王亚楠, 王自良
(河南科技学院动物科学学院,河南新乡 453000)
重金属锌离子人工抗原的合成及抗体特性
付世杰, 孙 勇, 王亚楠, 王自良
(河南科技学院动物科学学院,河南新乡 453000)
研究锌离子人工抗原的合成及其多克隆抗体(pAb)的制备。用异硫氰酸苄基乙二胺四乙酸(ITCBE)螯合Zn2+合成Zn-ITCBE半抗原、异硫氰酯法制备免疫抗原Zn-ITCBE-BSA和包被原Zn-ITCBE-OVA,紫外分光光度法(UV)、SDS-PAGE和电感耦合等离子体原子发射光谱法(ICP-AES)进行鉴定;用Zn-ITCBE-BSA免疫Balb/c小鼠,间接ELISA测定Zn pAb效价,阻断ELISA鉴定其敏感性,交叉反应试验其特异性。结果表明,Zn-ITCBE-BSA偶联成功,Zn-ITCBE和BSA的分子结合比为25 ∶1,Zn pAb效价达到1 ∶(2.56×104),对Zn2+的IC50为9.23,与其他重金属离子的交叉反应率低,获得高价、敏感、特异的Zn pAb,为锌离子残留污染的免疫学检测方法的建立奠定基础。
重金属锌离子;半抗原;人工抗原;抗体;鉴定
土壤和农产品中的重金属与人类健康密切相关。重金属污染主要是指生物毒性显著的汞、铬、镉、铅以及类金属砷,还包括具有毒性的重金属铜、钴、镍、锡等金属污染物[1]。重金属污染不同于其他类型污染,具有隐蔽性、长期性和不可逆转性等特点。随着城市的扩大和大规模工业发展,大量重金属进入环境后,即使浓度很低也可能造成危害,通过饮用水或者通过生物富集以及食物链等方式最终威胁到人体健康。
锌参与体内200多种酶的合成和活化,是机体新陈代谢的重要物质,是动物生长发育及维持正常生理机能所必须的微量元素,参与蛋白质的合成,促进细胞分裂、生长和再生;但环境污染和饲料、药物添加剂的滥用,造成畜禽产品锌的残留不同程度超标[2]。过量锌是一种作用迅速的中枢神经毒素,通过对神经细胞的直接损害以及对体内各种物质的拮抗而影响脑功能,摄入过量会导致机体代谢紊乱[3-4];过量的锌还可明显抑制红细胞的免疫功能,造成雏鸡肝、脾的结构和功能受损[5-7]。许多试验和流行病学调查已证实,如果锌在体内含量过高,将会抑制吞噬细胞的活性和杀菌力,降低人体免疫功能,抵抗力减弱,对疾病易感性增加[5-7]。
同时,锌主要来源于采矿、电镀和冶炼行业污染物的排放,水和土壤中的锌污染已经引起环境科学工作者的广泛关注。土壤中锌超过200 mg/kg时可能对植物生长造成危害,过量锌可直接导致植物发生锌污染中毒,也可能间接影响植物对于重要营养元素Fe的吸收,进而使植物因缺Fe而引起生长障碍、甚至死亡。在重金属污染的预防和治理中,重金属污染物的监测和识别至关重要。
因此,衡量重金属的定性定量分析在食品和环境检测等方面非常重要。传统的重金属离子检测法有无火焰原子吸收光谱法[8]、电感耦合等离子体质谱法[9]、火焰原子吸收光谱法[10-11]、伏安法和离子色谱法[12],以及电热原子化原子吸收光谱法[13-16]等,检测必须在具备大型分析仪器的重点实验室内进行,无法用于现场检测,且受到费用高、处理量有限和检测时间长等限制[17],不利于在生产中推广应用,难以适应环境及市场产品的现场抽查及产品进出口快速通关的要求。
因此,建立快速、简便、经济、大批量筛检的锌免疫检测技术,对于减少环境污染、提高食品质量和保障食品安全具有重要意义。
1 材料与方法
1.1 材料
1.1.1 试剂与溶液 ZnSO4·7H2O,Alfa Aeaser产品,质量分数为99.9%;异硫氰酸苄基乙二胺四乙酸(ITCBE),购于上海同仁化学研究所;4-羟乙基哌嗪乙磺酸,质量分数为99.5%,Sigma产品;牛血清白蛋白(BSA)和鸡卵清蛋白(OVA),Sigma产品;弗氏完全佐剂(complete Freund's adjuvant,CFA)、弗氏不完全佐剂(incomplete Freund's adjuvant,IFA)、四甲基乙二胺(TEMED)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、巯基乙醇(β-mercaptoethanol,β-ME),均为Sigma产品;考马斯亮蓝R-250、30%丙烯酰胺溶液、三羟甲基氨基甲烷(TRIS)、过硫酸铵(ammonium persulfate)、甘氨酸(glycine),均为北京索莱宝科技有限公司;乙酸汞(mercury acetate)、钼酸(molybdic acid)、硫酸钴(cobalt sulfate neptahydrate)、硝酸锶(strontium nitrate)、三氧化二铁(ferric sesquioxide)、氧化镁(magnesium oxide)、碳酸钙(calcium carbonate)、铜粉(copper powder)、铬粉(chromium powder)、铅粉(lead powder),均为国产分析纯;四甲基联苯胺(tetramethyl benzidine,TMB),上海五联化工厂;羊抗鼠酶标二抗(GaMIgG-HRP),上海华美生物工程公司;试验用水为重蒸去离子水(double distilled water,DDW)。其他试剂市售所得,均为AR级。
1.2 溶液
1.2.1 SDS-PAGE所需溶液 电泳染色液:将45 mL甲醇、45 mL DDW和10 mL冰乙酸混匀,然后加入0.25 g考马斯亮蓝,充分溶解后,滤纸过滤后备用。
电泳脱色液:将40 mL甲醇、40 mL DDW和10 mL冰乙酸混匀即可。
分离胶缓冲液:称取18.17 g Tris,加入DDW 100 mL,充分溶解后用盐酸调节pH值至8.8,4 ℃冰箱保存。
浓缩胶缓冲液:称取6.0 g Tris,加入DDW 100 mL,充分溶解后用盐酸调节pH值至6.8,4 ℃冰箱保存。
上样缓冲液:称取SDS 0.2 g、溴酚蓝10 mg,加入浓缩胶缓冲液0.5 mL、甘油1 mL、β-ME 0.25 mL,然后用DDW定溶至5 mL,4 ℃冰箱避光保存。
5×电泳缓冲液:称取7.55 g Tris、47 g甘氨酸,溶解在450 mL DDW中;再加入10% SDS,用DDW定容至500 mL,室温保存,使用时5倍稀释。
1.2.2 ELISA所需缓冲液 0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS):NaCl 8.0 g,KCl 0.2 g,Na2HPO4·12H2O 3.56 g,KH2PO40.2 g,溶于DDW定容至 1 000 mL。
洗涤缓冲液(PBS+Tween20,PBST):PBS+0.05% Tween20。
0.05 mol/L NaHCO3/Na2CO3缓冲液(carbonate buffered saline,CBS):Na2CO31.59 g,NaHCO32.93 g,加DDW定容至1 000 mL。
封闭液(SPBST):5%猪血清+PBST。
TMD底物缓冲液:(1)A液。用0.1 mol/L pH值为5.0醋酸钠/柠檬酸缓冲液加热溶解0.5 g过氧化脲,再与0.08 g非那西丁(预先加热溶于DDW)混合,定容至1 000 mL。(2)B液。TMB 1.27 g溶于500 mL甲醇,再与500 mL甘油混合。
2 mol/L H2SO4终止液:98%浓硫酸(18 mol/L)10 mL稀释至180 mL。
1.3 主要仪器
PHS-3C酸度计,上海雷磁公司;98-1磁力搅拌器,上海司乐仪器有限公司;JY-3000电泳仪,北京君意东方电泳设备有限公司;Optima 2100DV型电感耦合等离子体发射光谱仪(ICP),美国PE公司;WD-9403D型紫外仪,北京六一仪器厂;抗原与佐剂乳化器,本实验室自制;Multiskan MK3酶标仪,美国Thermo公司;SZ-93自动双重纯水蒸馏器,上海雅荣生化仪器设备有限公司;Legend micro 17型离心机,美国Thermo公司;303A1型电热恒温培养箱,北京中兴伟业仪器有限公司。
1.4 试验动物
SPF级6周龄雌性Balb/C小鼠购自郑州大学医学院实验动物中心,本实验室饲养。
1.5 金属螯合物人工抗原的合成
1.5.1 Zn2+-ITCBE-BSA免疫原的合成 采用异硫氰酯法[18],参考Chakra等的方法并加以改进合成免疫原Zn2+-ITCBE-BSA[19]。称取10 mg ITCBE溶于1 mL二甲基亚砜(DMSO)中形成金属螯合剂溶液;称取6.65 mg ZnSO4溶于 1 mL pH值为8.0的HEPES缓冲液(10 mmol/L)中形成Zn2+溶液;将金属螯合剂溶液和Zn2+溶液混合并用NaOH调节pH值至7.0,然后在室温条件下放在摇床上反应12 h,即形成Zn2+-ITCBE螯合物半抗原。称取20 mg BSA溶于 1 mL pH值为8.0的HEPES缓冲液(10 mmol/L)中形成 20 mg/mL 的载体蛋白溶液;取1 mL Zn2+-ITCBE螯合物半抗原溶液加入到1 mL载体蛋白溶液中并用NaOH调节pH值至9.0,室温摇床反应24 h,然后移入透析袋中透析5 d,即形成Zn2+-ITCBE-BSA完全抗原。合成路线见图1。
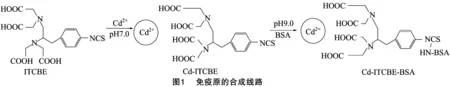
1.5.2 Zn2+-ITCBE-OVA 包被原的合成 合成方法同“2.1.1”节。
1.6 人工抗原的鉴定
1.6.1 人工抗原浓度测定 以HEPES溶液做为空白对照,将免疫抗原Zn2+-ITCBE-BSA和包被抗原Zn2+-ITCBE-OVA用HEPES缓冲液稀释100倍,用蛋白核酸分析仪在 280 nm 波长下测定人工抗原中的蛋白浓度。
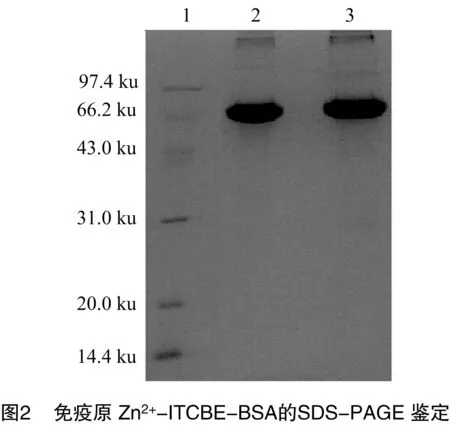
1.6.2 SDS-PAGE鉴定 根据BSA的Mr(6.62×104),选择浓缩胶浓度为5%,分离胶浓度为12%,浓缩胶电压为 120 V,分离胶电压为60 V,点样量10 μg/孔,对BSA、Zn2+-ITCBE-BSA进行垂直SDS-PAGE电泳,用考马斯亮蓝染色,紫外仪照相。
1.6.3 ICP-AES检测抗原中Zn2+的含量 将100 μg/mL的Zn2+标准储备液用2%的硝酸稀释成0、0.25、0.50、1.00、2.00、4.00 μg/mL 的浓度梯度,仪器软件自动绘制标准曲线,并得出线性回归方程;样品溶液50倍稀释,用226 nm波长在最佳优化试验条件下进行测定,仪器软件自动分析结果。
1.6.4 多抗血清(pAb)鉴定
1.6.4.1 Zn2+-EDTA pAb的制备 用Zn2+-ITCBE-BSA免疫6周龄雌性Balb/C小鼠5只,免疫剂量为 50 μg·0.2 mL/只,背部皮下4点注射。首免,用无菌PBS溶解Zn2+-ITCBE-BSA,与等量CFA混合,充分乳化;加强免疫,用无菌PBS溶解Zn2+-ITCBE-BSA,与等量IFA混合,充分乳化,首免后3周进行,共免5次,每次间隔2周,最后1次免疫后10 d断尾采血,5 000 r/min离心10 min,-20 ℃保存备用。
1.6.4.2 效价测定 采用间接ELISA测定pAb效价,基本程序参照Tijssen的方法。第1步,用经pH值为9.6 0.05 moL/L 的碳酸盐缓冲液稀释的Zn2+-ITCBE-OVA包板,包被浓度2 μg/mL,包被量每孔100 μL,37 ℃温育2 h,PBST洗板4次,每次间隔3 min;第2步,用5%猪血清封闭,每孔200 μL,37 ℃温育1 h,PBST洗板4次,每次间隔3 min;第3步,加pAb,每孔50 μL,用封闭液倍比稀释,设阴性对照(negative control,NC)和空白对照(blank control,BC),37 ℃温育15 min,PBST洗板4次,每次间隔3 min;第4步,加RaMIgG-HRP,1 ∶1 000用封闭液稀释,每孔50 μL,37 ℃温育30 min,PBST洗板4次,每次间隔3 min;第5步,加酶底物TMB显色,每孔100 μL,室温反应10 min;第6步,终止显色反应,每孔加入终止液2 mol/L H2SO4100 μL,用酶标仪读D450 nm值;第7步,结果判断,以待测孔D450 nm≥NCD450 nm的2.1倍(P/N≥2.1)判为阳性。
1.6.4.3 敏感性鉴定 用10 mmol/L HEPES缓冲液配制EDTA溶液,将Zn2+标准储备液稀释成0、3.906、7.812、15.625、31.250、62.500、125.000、250.000、500.000、1 000.000 ng/mL 的浓度梯度,用NaOH调节pH值为6.0,室温摇床反应24 h,即形成Zn2+-EDTA螯合物溶液。以此溶液为抑制剂,采用阻断ELISA试验鉴定其敏感性,基本程序参照覃雅丽等的方法,见文献[20]。第1步,用Zn2+-ITCBE-OVA包板,包被浓度2 μg/mL,包被量每孔100 μL,37 ℃温育2 h,PBST洗板4次,每次间隔3 min;第2步,用5%猪血清封闭,每孔200 μL,37 ℃温育1 h,PBST洗板4次,每次间隔 3 min;第3步,加D450 nm为1.0的小鼠血清50 μL和不同浓度的Zn2+-EDTA螯合物溶液50 μL,设NC和BC,37 ℃ 温育15 min,PBST洗板4次,每次间隔3 min;第4步,加RaMIgG-HRP,1 ∶1 000用封闭液稀释,每孔50 μL,37 ℃温育30 min,PBST洗板4次,每次间隔3 min;第5步,加酶底物TMB显色,每孔100 μL,室温反应10 min;第6步,终止显色反应,每孔加入终止液2 mol/L H2SO4100 μL,用酶标仪读D450 nm值;第7步,计算抑制率(B/B0,B0为Zn2+-EDTA 0浓度时的吸光度,B为Zn2+-EDTA不同浓度时的吸光度)。以B/B0为纵坐标,以不同浓度抑制剂的对数值为横坐标,在半对数坐标纸上绘制Zn2+-EDTA对Zn2+-EDTA pAb的抑制曲线,根据曲线趋势推导回归方程,计算pAb对Zn2+-EDTA的50%抑制浓度(IC50),并以IC50做为敏感度。
1.6.4.4 特异性鉴定 采用交叉反应试验鉴定其特异性。交叉反应试验选择汞、铬、铅、锌、铜、铯、钴、钼、铁与EDTA的螯合物(螯合方法同上)和EDTA溶液做为抑制剂,用阻断ELISA测定各抑制物的IC50,以Zn2+-EDTA pAb对Zn2+-EDTA的IC50和Zn2+-EDTA pAb对各竞争物的IC50之比的百分数为其交叉反应率(cross-reactivity,CR%)。计算方法如下:
CR=Zn2+-EDTA的IC50/其他抑制物IC50×100%。
2 结果与分析
2.1 紫外分光光度法测定抗原浓度
利用Pharmacia蛋白质核酸分析仪在280 nm波长下测定透析后的Zn2+-ITCBE-BSA、Zn2+-ITCBE-OVA蛋白的浓度分别为8.48、9.23 mg/mL。
2.2 SDS-PAGE电泳鉴定
由图2可知,BSA的泳动速度大于Zn2+-ITCBE-BSA,说明Zn2+-ITCBE-BSA的分子量大于BSA,证明BSA与Zn2+-ITCBE已成功偶联。
2.3 ICP-AES测定抗原中Zn2+含量
由表1可知稀释50倍后的样品读数,透析后的Zn2+-ITCBE-BSA和Zn2+-ITCBE-OVA 2种抗原中Zn2+的含量分别为197.45、130.80 μg/mL,可以证明金属螯合物人工抗原合成成功。
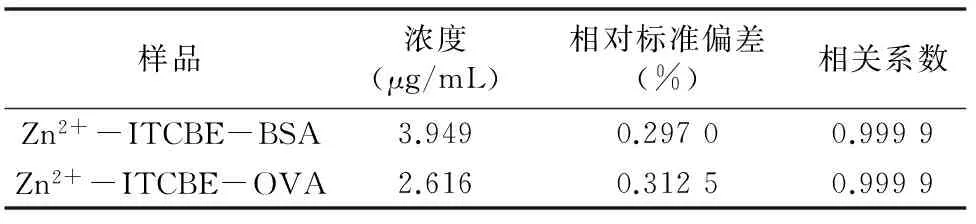
表1 ICP-AES测定样品中Zn2+含量
2.4 Zn2+-EDTA pAb鉴定
2.4.1 间接ELISA效价测定 由表2可知,免疫的5只小鼠血清抗体效价均达到了10-4,说明获得了较好的免疫效果,其中4号小鼠效价最高,为0.597。
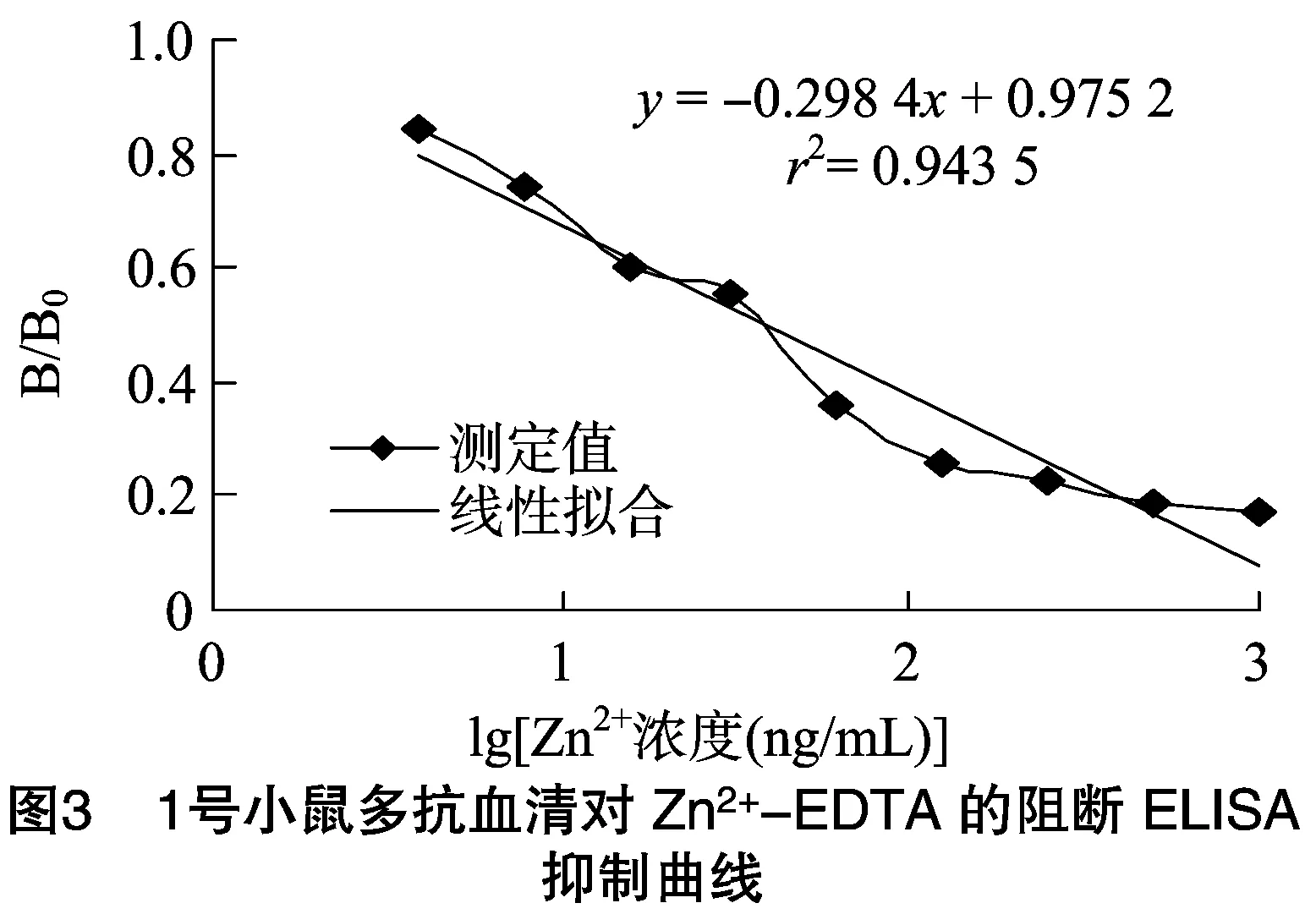
2.4.2 Zn2+-EDTA pAb敏感性鉴定 由表3可知,以Zn2+在3.906~1 000 ng/mL与过量EDTA螯合后形成的螯合物为抑制剂,5只小鼠的抗血清均产生了抑制。其中4号小鼠抑制效果最好,将其D450 nm值转化为B/B0,再对lg[Zn2+-EDTA/100]进行回归分析,4号小鼠的线性回归方程为y=-0.298 4x+0.975 2,r2为0.943 5,IC50为39.26 ng/mL(图3)。
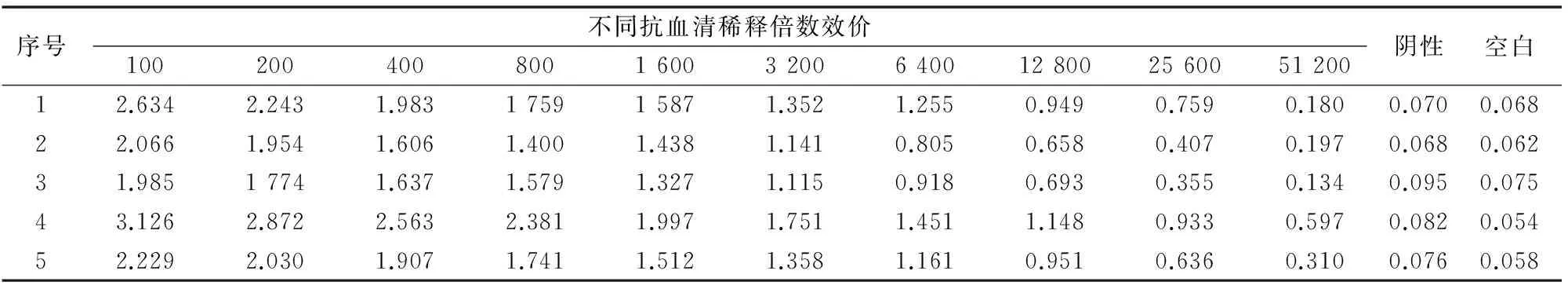
表2 小鼠抗Zn2+-ITCBE血清效价
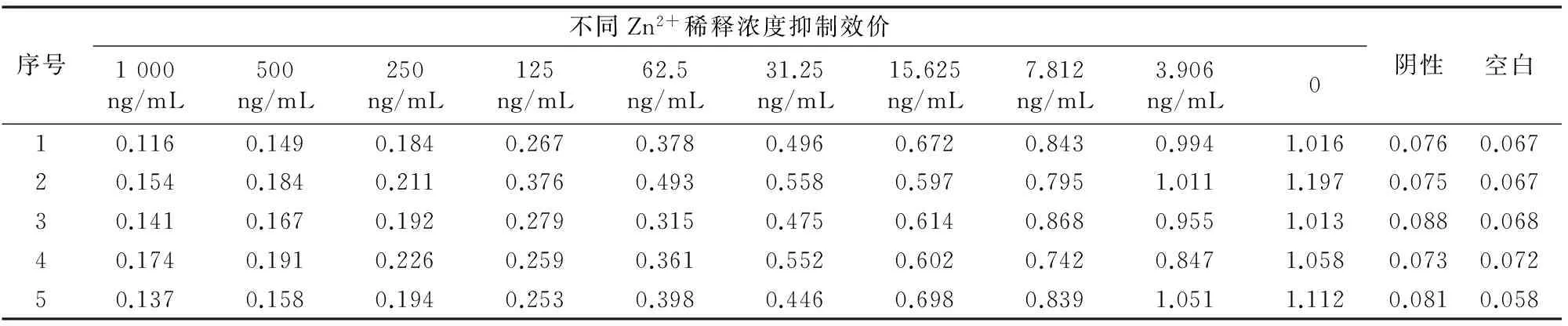
表3 小鼠抗血清对Zn2+-EDTA的抑制效价
2.4.3 Zn2+-EDTA pAb特异性鉴定 由表4可知,Zn2+-EDTA对其pAb结合反应的特异性很强;除与Hg2+-EDTA具有较强的交叉反应外,与EDTA及其他金属离子螯合物无交叉反应。
3 讨论
3.1 关于人工抗原的合成
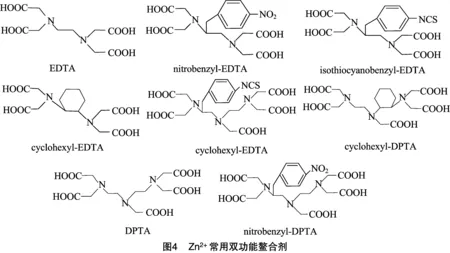
Zn2+结构简单,不具有T、B 2种细胞表位而无法直接诱导机体产生特异性抗体,既无免疫原性,也无反应原性,而且Zn2+带有电荷,能与机体内生物分子发生强烈的不可逆的反应而导致机体中毒。因此,必须将Zn2+通过螯合剂进行螯合,然后再将其连接到载体蛋白合成人工抗原,通过动物免疫制备Zn2+螯合物的特异性抗体。选择合适的偶联剂是人工抗原制备的关键。Meares等的研究结果表明,作为金属离子人工抗原的偶联剂必须满足3个条件,一是能够选择性结合金属离子并减弱金属离子与生物分子之间的反应能力,二是能够与载体蛋白偶联,三是偶联物能够被免疫系统识别,具有免疫原性[21-23]。通过大量筛选对比试验,大分子双功能螯合剂是最为理想的偶联剂(图4)。本试验选择异硫氰酸苄基乙二胺四乙酸(ITCBE)作为螯合剂,Zn2+与ITCBE螯合后,形成一个稳定的六齿状的配位化合物,该化合物具有独特的空间构型和一定的分子量,相当于1个半抗原,然后再用异硫氰酯法将该螯合物偶联到BSA或OVA上制备成人工抗原。笔者认为,在合适的pH值范围内ITCBE才能够充分的螯合金属离子,这是使合成的人工抗原具有较好免疫原性的关键。
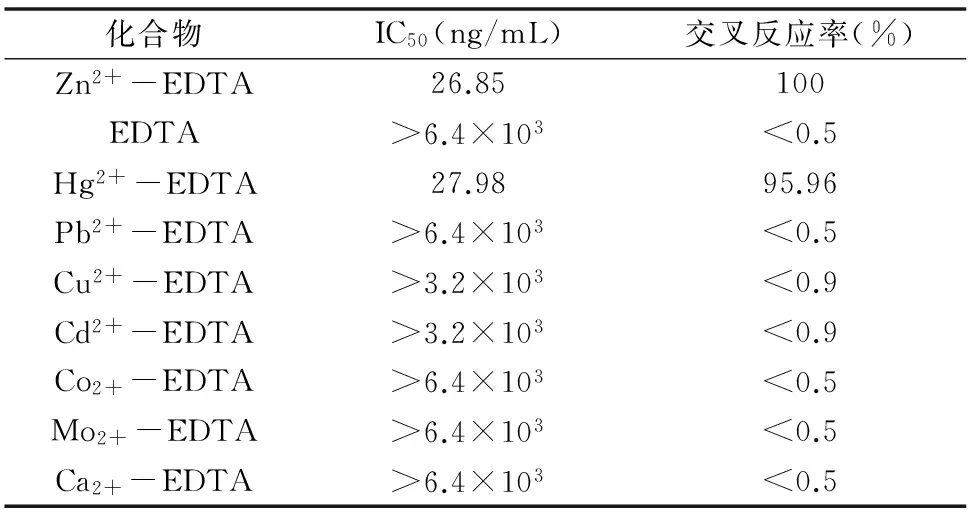
表4 Zn2+-EDTA pAb与其他金属螯合物的交叉反应
3.2 关于载体蛋白的选择
载体蛋白的作用是提供T细胞识别表位,小分子半抗原与载体蛋白结合后,可作为载体蛋白的抗原决定簇,进而诱导B细胞激活、分化、增殖,从而产生针对半抗原小分子的特异性抗体。常用的载体蛋白有牛血清白蛋白(BSA)、鸡卵清蛋白(OVA)、钥孔血蓝蛋白(KLH)、人血清白蛋白(HAS)、兔血清白蛋白(RSA)及人工合成的多聚赖氨酸(PLL)等,本研究选用BSA作载体蛋白,原因是BSA理化性质稳定,不易变性,价廉易得,分子内含自由氨基多,在较大pH范围和不同离子强度下均能保持较大的溶解度,更有利于偶联反应的进行。
3.3 关于人工抗原的鉴定
本试验对合成的金属螯合物抗原进行了SDS-PAGE电泳鉴定、ICP-AES测定抗原中Zn2+含量和抗血清鉴定。在人工抗原的合成中偶联到载体蛋白上的有些螯合剂并未螯合金属离子,即形成ITCBE-BSA无金属人工抗原,这些无金属抗原与金属螯合物抗原在进行紫外扫描和SDS-PAGE电泳鉴定中不容易区别;个别Zn2+可以结合到载体蛋白上,故 ICP-AES所测定的抗原中Zn2+含量不能准确地代表螯合离子的量。鉴于以上原因,本试验没有对所合成的人工抗原进行偶联率的计算。因此,笔者认为,ICP-AES测定抗原中Zn2+含量和SDS-PAGE电泳鉴定只能作为辅助的重金属螯合物人工抗原的鉴定,抗血清鉴定是重金属螯合物人工抗原最为准确、可靠的鉴定方法。
4 小结
利用双功能螯合剂异硫氰酸苄基乙二胺四乙酸通过异硫氰酯法合成了重金属Zn2+的免疫抗原和包被抗原,并对所合成的抗原进行SDS-PAGE电泳、ICP-AES检测其Zn2+含量和小鼠免疫试验,结果证明所合成的人工抗原具有较好的免疫原性,为Zn2+螯合物多克隆抗体(pAb)和单克隆抗体(mAb)的进一步研制奠定了研究基础和技术储备。
[1]陈邦俊. 世界铅锌工业现状与展望[J]. 世界有色金属,1997(5):19-24.
[2]逄瑞玥. 我国畜禽产品质量安全存在的问题及应对策略[J]. 黑龙江粮食,2007(4):20-22.
[3]崔恒敏,赵翠燕,黎得兵,等. 高锌对雏鸡免疫功能影响的研究[J]. 畜牧兽医学报,2005,36(3):240-245.
[4]崔恒敏,彭 西,方 静,等. 实验性雏鸭锌中毒症的病理学研究[J]. 畜牧兽医学报,2004,35(2):217-221.
[5]Pamla J,曹来福. 锌与免疫功能的关系[J]. 国外医学:卫生学分册,1987(6):334-337.
[6]乔德堂. 锌营养作用的研究进展[J]. 山东畜牧兽医,2007,28(5):52-53.
[7]徐 铭,朱丹丹. 锌与动物免疫功能的关系[J]. 畜牧兽医科技信息,2013(4):11-12.
[8]Kloft C,Appelius H,Siegert W,et al. Determination of platinum complexes in clinical samples by a rapid flameless atomic absorption spectrometry assay[J]. Therapeutic Drug Monitoring,1999,21(6):631-637.
[9]Almeida C M,Vasconcelos M T. Lead contamination in Portuguese red wines from the Douro region:from the vineyard to the final product[J]. Journal of Agricultural and Food Chemistry,2003,51(10):3012-3023.
[10]Yaman M. The improvement of sensitivity in lead and cadmium determinations using flame atomic absorption spectrometry[J]. Analytical Biochemistry,2005,339(1):1-8.
[11]Bakircioglu Y,Segade S R,Yourd E R,et al. Evaluation of Pb-Spec® for flow-injection solid-phase extraction preconcentration for the determination of trace lead in water and wine by flame atomic absorption spectrometry[J]. Analytica Chimica Acta,2003,485(1):9-18.
[12]Buldini P L,Cavalli S,Sharma J L. Determination of transition metals in wine by IC,DPASV-DPCSV,and ZGFAAS coupled with UV photolysis[J]. Journal of Agricultural and Food Chemistry,1999,47(5):1993-1998.
[13]Jurado J M,Martín M J,Pablos F,et al. Direct determination of copper,lead and cadmium in aniseed spirits by electrothermal atomic absorption spectrometry[J]. Food Chemistry,2007,101(3):1296-1304.
[14]Freschi G G,Dakuzaku C S,de Moraes M,et al. Simultaneous determination of cadmium and lead in wine by electrothermal atomic absorption spectrometry[J]. Spectrochimica Acta Part B:Atomic Spectroscopy,2001,56(10):1987-1993.
[15]Viitak A,Volynsky A B. Simple procedure for the determination of Cd,Pb,As and Se in biological samples by electrothermal atomic absorption spectrometry using colloidal Pd modifier[J]. Talanta,2006,70(4):890-895.
[16]Vilar M,Barciela J,Garcia-Martin S,et al. Comparison of different permanent chemical modifiers for lead determination in Orujo spirits by electrothermal atomic absorption spectrometry[J]. Talanta,2007,71(4):1629-1636.
[17]刘功良,王菊芳,李志勇,等. 重金属离子的免疫检测研究进展[J]. 生物工程学报,2006,22(6):877-881.
[18]朱育菁,于晓杰,潘志针,等. 生物耦合技术的原理及其应用[J]. 福建农业学报,2010,25(1):118-125.
[19]Chakrabarti P,Hatcher F M,Blake R N,et al. Enzyme immunoassay to determine heavy metals using antibodies to specific metal-EDTA complexes:optimization and validation of an immunoassay for soluble Indium[J]. Analytical Biochemistry,1994,217(1):70-75.
[20]王 颖,任立松,李研东,等. 抗氯霉素单克隆抗体的制备、纯化及其特异性鉴定[J]. 吉林大学学报(医学版),2008,34(2):336-339.
[21]Meares C F,Mccall M J,Reardan D T,et al. Conjugation of antibodies with bifunctional chelating agents:isothiocyanate and bromoacetamide reagents,methods of analysis,and subsequent addition of metal ions[J]. Analytical Biochemistry,1984,142(1):68-78.
[22]Boden V,Colin C,Barbet J,et al. Preliminary study of the metal binding site of an anti-DTPA-indium antibody by equilibrium binding immunoassays and immobilized metal ion affinity chromatography[J]. Bioconjugate Chemistry,1995,6(4):373-379.
[23]Perrin C L,Kim Y J. Symmetry of metal chelates[J]. Inorganic Chemistry,2000,39(17):3902-3910.
10.15889/j.issn.1002-1302.2017.02.055
2015-11-24
国家科技支撑计划(编号:2011BAK10B01-15)。
付世杰(1988—),男,河南新乡人,硕士,主要从事动物性食品安全快速免疫检测技术研究。E-mail:372677205@qq.com。
王自良,博士,教授,硕士生导师,从事动物性食品安全快速检测技术研究。E-mail:15836090463@163.com。
TS201.6
A
1002-1302(2017)02-0185-05
付世杰,孙 勇,王亚楠,等. 重金属锌离子人工抗原的合成及抗体特性[J]. 江苏农业科学,2017,45(2):185-189.
