白菜同源多倍体减数分裂期联会复合体蛋白ZYP1的细胞学分析
2017-03-01韦珍珍毋瑞华魏小春田保明师恭曜曹刚强张晓伟
韦珍珍,毋瑞华,魏小春,杨 妍,田保明,位 芳*,师恭曜,曹刚强,张晓伟
(1.郑州大学 生命科学学院, 河南 郑州 450001; 2.河南省农业科学院 园艺研究所,河南 郑州 450002)
白菜同源多倍体减数分裂期联会复合体蛋白ZYP1的细胞学分析
韦珍珍1,毋瑞华1,魏小春2,杨 妍1,田保明1,位 芳1*,师恭曜1,曹刚强1,张晓伟2
(1.郑州大学 生命科学学院, 河南 郑州 450001; 2.河南省农业科学院 园艺研究所,河南 郑州 450002)
为解析多倍体植物减数分裂期同源染色体的正常配对和联会的细胞学机制,以白菜同源多倍体为研究对象,利用免疫荧光分析技术,解析了联会复合体相关蛋白ZYP1在减数分裂前期I过程中的细胞学行为。结果表明:与二倍体相比,白菜同源多倍体减数分裂期同源染色体联会、配对及分离过程基本正常,联会复合体蛋白ZYP1抗体荧光信号变化趋势基本一致,但ZYP1免疫荧光信号显著增强。因此,与二倍体相比,同源多倍体植物很可能通过增强联会复合体蛋白ZYP1的表达水平,以协调同源染色体的正常联会与配对,进而保证多倍体植物的正常减数分裂过程。
减数分裂; 联会复合体; ZYP1; 同源四倍体; 白菜
多倍体植物在自然界中广泛存在。有研究表明,多倍体化是促使植物进化的重要动力[1]。同源多倍体来自内部一个或单个物种种群之间的多倍化事件,随着基因组加倍的进行,单个或者多个基因的功能会有所改变,调控系统中的一些基因数量也会增加,这就需要一个系统有规律的调控网络[2]。减数分裂过程在有性生殖物种代代相传历程中是一个重要的环节,在整个减数分裂过程中,前期 Ⅰ 相对复杂一些,会发生同源染色体间的相互配对、联会和重组,这个过程的正常进行,对于之后二价体能否正确形成和同源染色体能否精确分离起着非常重要的作用[3]。
与二倍体相比,同源多倍体植物由于染色体数目加倍,减数分裂过程中要维持同源染色体的正常联会、配对及分离,需要在调控机制方面有所改变,以适应由于同源染色体数目增加而引起的紊乱[4]。联会复合体SC 在细线期出现,偶线期逐步组装,粗线期趋于成熟,而从双线期开始解体。若其出现异常,将直接导致减数分裂不能正常进行,甚至不育[5-6]。ZYP1是拟南芥中最早鉴定的参与调控同源染色体配对与联会的横向细丝蛋白,若ZYP1缺失,联会复合体SC则不能正常形成,且减数分裂前期Ⅰ推迟[7-8]。ZYP1蛋白信号出现在细线期,偶线期逐渐增多,粗线期达到最大,终变期几乎消失[9-10]。在拟南芥zyp1突变体中,交叉频率比野生型减少了70%[11];而水稻zep1突变体中,交叉频率较野生型有所增加[12]。在RNA干扰的大麦中,只有不到一半的同源染色体配对形成二价体,同时能观察到许多单价体的出现,导致染色体不分离甚至不育[13-14]。因此,选取白菜二倍体、同源四倍体为研究材料,通过免疫荧光技术,分析了联会复合体蛋白ZYP1在减数分裂过程中的动态变化,并对其细胞学行为进行了研究。将获得的ZYP1蛋白多克隆抗体进行免疫荧光染色,以解析多倍体植物减数分裂期同源染色体的正常配对和联会的细胞学机制,为多倍体植物基因组的遗传稳定性提供细胞学理论依据。
1 材料和方法
1.1 试验材料
白菜品种Yellow sarson二倍体和同源四倍体,由河南省农业科学院园艺研究所提供,种植于河南省农业科学院现代农业示范基地。
1.2 试验方法
1.2.1 拟南芥ZYP1蛋白多克隆抗体的制备 通过克隆拟南芥ZYP1 基因片段,构建重组载体pET-28a(+)- ZYP1 ,优化大肠杆菌(Escherichiacoli)诱导表达体系,将亲和层析纯化后的ZYP1融合蛋白免疫新西兰大白兔(Oryctolaguscuniculus),制备ZYP1蛋白的多克隆抗体,并通过Western blot和酶联免疫吸附试验(ELISA)确定抗血清的特异性和效价。具体方法参考文献[15]。
1.2.2 细胞学制片与观察 将未开放的白菜花蕾置于固定液(V乙醇︰V冰乙酸=3︰1)中固定5~6 h,然后用清水冲洗干净,在解剖镜下用解剖针将花苞剥开挑取花药,放入酶解液(5%的果胶酶与1%的纤维素酶)中37 ℃ 酶解30 min,然后将花药置于干净的玻片上,用解剖针敲碎,滴加100 μL 40%的乙酸,均匀涂布、烘干。滴加10 μL碘化丙啶(PI)染液(50 μg/mL),盖上玻片,镜检。
1.2.3 免疫荧光分析 将镜检过的玻片置于4%多聚甲醛中固定5 min;用PBS缓冲液洗3次,每次5 min;然后取100 μL 0.1%TritonX-100滴加于玻片上,室温下孵育30 min;PBS缓冲液漂洗3次,每次5 min,室温下晾干。每张玻片上滴加200 μL 5%BSA,37 ℃孵育2 h;PBS缓冲液漂洗3次,每次10 min;室温下晾干后滴加一抗工作液4 ℃孵育过夜。次日,PBS缓冲液漂洗3次,每次10 min;滴加荧光二抗工作液,37 ℃孵育2 h。用PBS缓冲液再次重复漂洗3次,每次10 min,避光晾干后滴加PI染液(50 μg/mL),抗荧光淬灭剂封片后观察。
2 结果与分析
2.1 白菜二倍体和同源四倍体减数分裂过程观察
图1所示,白菜二倍体和同源四倍体减数分裂过程中,细线期时,染色体开始凝集(图1A和A′),但仍以细线状形式存在;偶线期时染色质继续凝集(图1B和B′),同源染色体开始发生联会配对;粗线期时已完成联会的2条染色体互相紧靠,缠绕在一起,成为短而粗的染色体(图1C和C′);双线期时同源染色体相互分开,出现交叉现象(图1D和E,图1D′和E′);终变期时,染色体开始向核靠近,紧密凝集(图1F和F′);减数第Ⅰ次分裂后期,同源染色体从赤道板向两极分离开来(图1G和G′);减数第Ⅱ次分裂后期,姐妹染色单体都相互分开,有四分体出现(图1H和H′)。结果表明,白菜二倍体和同源四倍体减数分裂过程中,染色体行为基本一致,同源四倍体白菜减数分裂后期、末期均无异常,能产生包含正常染色体数目的配子。
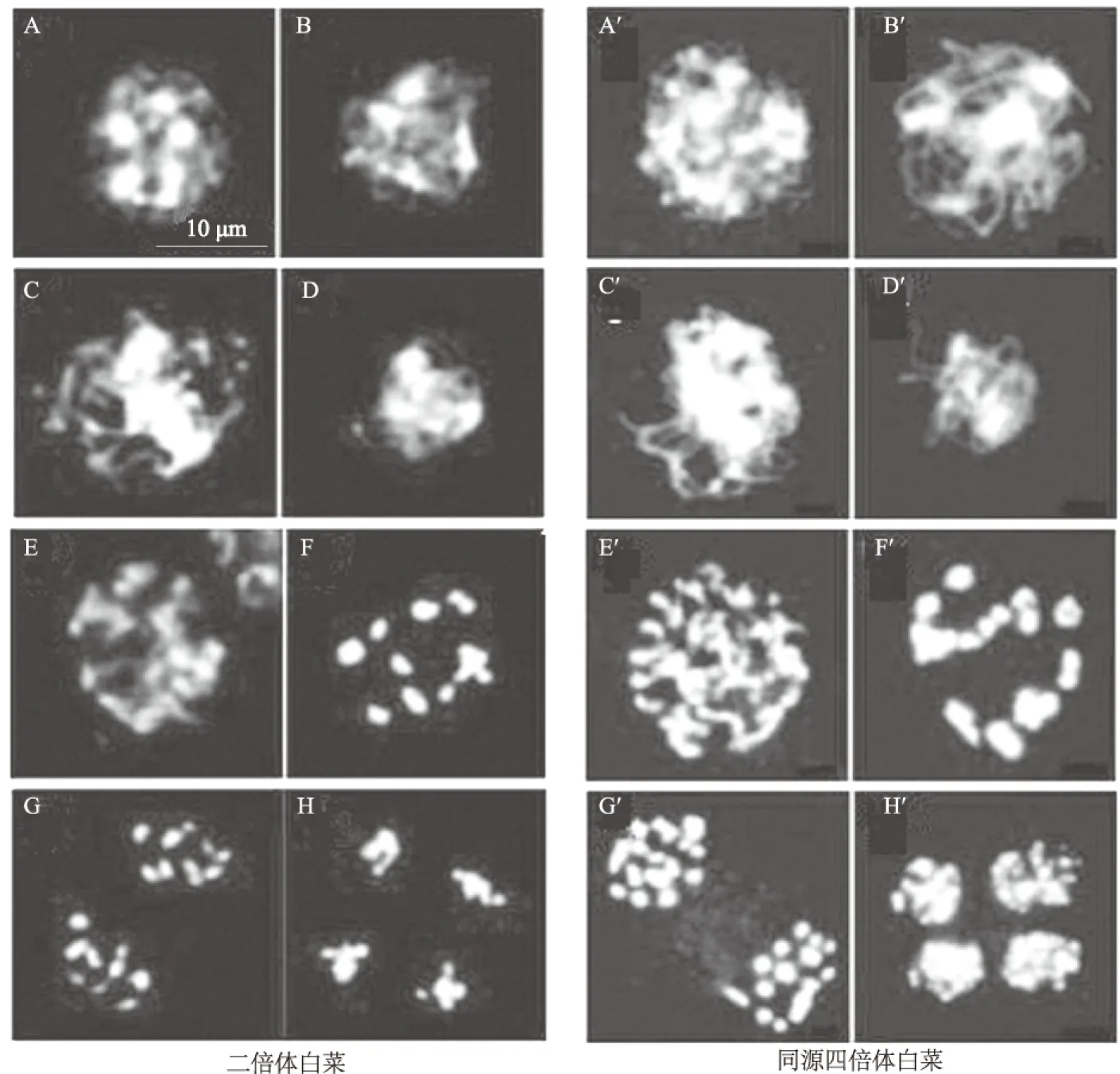
A和A′:白菜二倍体和同源四倍体细线期;B和B′:白菜二倍体和同源四倍体偶线期;C和C′:白菜二倍体和同源四倍体粗线期;D和E,D′和E′:白菜二倍体和同源四倍体双线期;F和F′:白菜二倍体和同源四倍体终变期;G和G′:白菜二倍体和同源四倍体后期Ⅰ;H和H′:白菜二倍体和同源四倍体后期Ⅱ图1 白菜二倍体和同源四倍体减数分裂基本过程
2.2 白菜二倍体和同源四倍体中ZYP1蛋白的免疫荧光分析
本研究使用的材料为二倍体、同源四倍体白菜,用细胞悬液制片法制备处于减数分裂期细胞的玻片,依次孵育抗血清(一抗)和荧光二抗,经充分漂洗之后用PI染液压片观察。红色为PI染液染色后的染色体,绿色代表ZYP1蛋白抗体荧光信号,ZYP1蛋白抗体荧光信号在二倍体、同源四倍体白菜中的变化趋势基本一致,绿色荧光信号均在减数分裂细线期出现,偶线期逐渐增多,其中,部分以线状形式沿染色体轴排布,粗线期时达到最大,双线期逐步减少,到终变期几乎消失。将二倍体及同源四倍体中ZYP1蛋白抗体荧光信号进行比较,如图2所示,ZYP1蛋白抗体绿色荧光信号在细线期开始出现,此时在二倍体及同源四倍体中均较少;到偶线期时,二倍体及同源四倍体中ZYP1蛋白荧光信号均有所增加,但同源四倍体增加更多,比相对应的二倍体中含量多;粗线期时,二倍体及同源四倍体中ZYP1蛋白抗体荧光信号含量均达到最高水平,但同源四倍体中的含量仍比二倍体中的多;双线期时,信号均开始减少,直至消失。同源四倍体中ZYP1蛋白抗体荧光信号的增多代表ZYP1蛋白表达量的增加,由于染色体加倍,联会配对频率提高,同源四倍体减数分裂时期对ZYP1蛋白的需求也相应提高,因此,ZYP1蛋白在同源四倍体减数分裂时期联会配对时的表达量更高。

A和 A′:PI染液染色后处于细线期、偶线期、粗线期、双线期的二倍体白菜和同源四倍体白菜细胞;B和B′:免疫荧光染色后处于细线期、偶线期、粗线期、双线期的二倍体白菜细胞和同源四倍体白菜细胞中的ZYP1蛋白;C和C′:分别为A、B叠加和A′、B′叠加后的细胞图2 白菜二倍体和同源四倍体减数分裂前期Ⅰ过程中ZYP1蛋白动态观察
3 结论与讨论
有关联会复合体蛋白ZYP1在减数分裂中的表达时期及其作用方面的研究已经很多[16-17],本试验将同源多倍体中ZYP1的分子细胞学行为与相对应的二倍体进行比较,这为探究多倍体联会配对调控机制奠定了基础。本研究通过观察二倍体、同源四倍体白菜在减数分裂不同时期染色体的一些变化特征发现,同源四倍体细胞中染色体在加倍后减数分裂仍能正常进行,整个过程与二倍体材料染色体行为变化一致,但前期Ⅰ联会配对频率明显提高。而ZYP1联会配对中起着一定的调控作用,多倍体中ZYP1表达量也会发生相应的变化,因此,对多倍体中ZYP1蛋白的研究有助于探索多倍体联会配对频率提高的内在机制。
同源多倍体由于染色体加倍,与二倍体相比要有更复杂的联会方式,联会频率也会提高,要维持多倍体中同源染色体稳定的联会配对,需要一定的调控机制,而ZYP1蛋白直接参与联会配对这一活动。将二倍体与同源四倍体白菜减数分裂前期Ⅰ各时期的荧光信号进行比较,直接清楚地了解减数分裂前期多倍体中ZYP1蛋白的表达量,并且结合ZYP1蛋白的功能,从而在细胞水平上阐明了同源四倍体白菜中ZYP1蛋白表达量提高的机制,有助于巩固同源染色体的联会和配对过程,以保证多倍体植物减数分裂过程正常,产生有功能的雌雄配子,保证多倍体植物正常繁衍。
[1] 宋灿,刘少军,肖军,等.多倍体生物研究进展[J].中国科学,2012,42(3):173-184.
[2] 孙静贤,丁开宇,王兵益.植物多倍体研究的回顾与展望[J].武汉植物学研究,2005,23(5):482-490.
[3] Da O I,Degroote F,Goubely C,etal.Meiotic recombination inArabidopsisis catalysed by DMC1,with RAD51 playing a supporting role[J].PLoS Genetics,2013,9(9):e1003787.
[4] Grandont L,Jenczewski E,Lloyd A.Meiosis and its deviations in polyploid plants[J].Cytogenetic and Genome Research,2013,140:171-184.
[5] Higgins J D,Sanchezmoran E,Armstrong S J,etal.TheArabidopsissynaptonemal complex protein ZYP1 is required for chromosome synapsis and normal fidelity of crossing over[J].Genes & Development,2005,19(20):2488-2500.
[6] Wijeratne A J,Chen C B,Zhang W,etal.TheArabidopsisthalianapartingdancers gene encoding a novel protein is required for normal meiotic homologous recombination[J].Mol Biol Cell,2006,17(3):1331-1343.
[7] Osman K,Higgins J D,Sanchez-Moran E,etal.Pathways to meiotic recombination inArabidopsisthaliana[J].New Phytol,2011,190(3):523-544.
[8] Szostak J W,Orr-Weaver T L,Rothstein R J,etal.The double-strand-break repair model forrecombination[J].Cell,1983,33(1):25-35.
[9] Higgins J D.Analyzing meiosis in barley[J].Methods in Molecular Biology,2013,990(8):135-144.
[10] 李亚非,程祝宽,植物减数分裂同源染色体重组的分子机理[J].中国科学,2015,45(6):537-543.
[11] Sanchez-Moran E,Armstrong S J.Meiotic chromosome synapsis and recombination inArabidopsisthaliana: New ways of integrating cytological and molecular approaches [J].Chromosome Research,2014,22(2):179-190.
[12] Wang M,Wang K,Tang D,etal.The central element protein ZEP1 of the synaptonemal complex regulates the number of crossovers during meiosis in rice[J].Plant Cell,2010,22(2):417-430.
[13] Barakate A,Higgins J D,Vivera S,etal.The synaptonemal complex protein ZYP1 is required for imposition of meiotic crossovers in barley[J].Plant Cell,2014,26(2):729-740.
[14] Lorenz A,Mehats A,Osman F,etal.Rad51/Dmc1 paralogs and mediators oppose DNA helicases to limit hybrid DNA formation and promote crossovers during meiotic recombination[J].Nucleic Acids Research,2014,42(22):13723-13735.
[15] 毋瑞华,杨妍,刘征,等.拟南芥ZYP1蛋白的原核表达、多克隆抗体制备及细胞学行为分析[J].农业生物技术学报,2015,23(12):1568-1575.
[16] Barakate A,Higgins J D,Vivera S,etal.The synaptonemal complex protein ZYP1 is required for imposition of meiotic crossovers in barley[J].The Plant Cell,2014,26(2):729-740.
[17] Mikhailova E I,Phillips D,Sosnikhina S P,etal.Molecular assembly of meiotic proteins Asy1 and Zyp1 and pairing promiscuity in rye(SecalecerealeL.) and its synaptic mutantsy10[J].Genetics,2006,174(3):1247-1258.
Cytological Analysis of Synaptonemal Complex Protein ZYP1 during Meiosis in Autopolyploid Brassica rapa
WEI Zhenzhen1,WU Ruihua1,WEI Xiaochun2,YANG Yan1,TIAN Baoming1,WEI Fang1*,SHI Gongyao1,CAO Gangqiang1,ZHANG Xiaowei2
( 1.School of Life Sciences,Zhengzhou University,Zhengzhou 450001,China; 2.Institute of Horticulture,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
To understand the cytological mechanism of pairing and synapsis of homologous chromosomes in polyploid plants,the synaptonemal complex protein ZYP1 was cytologically analysed using immunostaining during meiotic prophase Ⅰ in autopolyploidBrassicarapain comparison with diploid counterparts.The results showed that,compared with diploids,autopolyploids showed a regular meiosis course including normal pairing,synapsis and separation of homologous chromosomes,and a similar dynamic behavior of ZYP1 protein.However,the fluorescence signal of ZYP1 revealed by their specific antibody was significantly enhanced in autopolyploids in contrast with diploids.Therefore,the present study indicated that autopolyploids probably increased the expression level of ZYP1 protein to coordinate pairing and synapsis of homologous chromosomes,to ensure a normal meiosis behavior in polyploid plants.
meiosis; synaptonemal complex; ZYP1; autoteraploid;Brassicarapa
2016-10-24
NSFC-河南人才培养联合基金项目(U1204308);河南省教育厅高等学校重点科研项目(13A180437)
韦珍珍(1992-),女,山西长治人,在读硕士研究生,研究方向:植物细胞遗传学。E-mail:1114242391@qq.com
*通讯作者:位 芳(1981-),男,河南项城人,副教授,博士,主要从事植物分子细胞遗传学方面的研究。 E-mail:fangwei@zzu.edu.cn
S634
A
1004-3268(2017)02-0078-05
