富氢水处理对采后番茄果实灰霉病抗性的影响
2017-03-01伍冰倩王伊帆刘妮妮孟凡虹胡振宇赵瑞瑞
卢 慧,伍冰倩,王伊帆,刘妮妮,孟凡虹,胡振宇,赵瑞瑞,赵 珩
(中央民族大学 生命与环境科学学院,北京 100081)
富氢水处理对采后番茄果实灰霉病抗性的影响
卢 慧,伍冰倩*,王伊帆,刘妮妮,孟凡虹,胡振宇,赵瑞瑞,赵 珩**
(中央民族大学 生命与环境科学学院,北京 100081)
以采后番茄果实为试验材料,通过不同浓度富氢水(HRW)浸泡番茄果实,研究氢气对番茄果实抗灰霉病的作用效果。结果表明,与对照组(蒸馏水处理)相比,50%和75% HRW处理降低了损伤接种番茄果实的发病情况,接菌后9 d病斑面积分别是对照组的87.2%和77.9%;HRW处理可以不同程度地提高番茄果实的多酚氧化酶(PPO)活性,其中75% HRW处理组PPO活性在接菌后3 d与对照组差异达到极显著水平(P<0.001),是对照组的1.59倍;HRW处理提高了番茄果实中的一氧化氮含量,其中50% HRW处理组在接菌后3 d和9 d与对照组差异均达到极显著水平(P<0.001),分别是对照组的2.56倍和3.13倍。综上所述,氢气可能作为信号分子参与植物胁迫应答反应,增强了番茄果实对灰霉菌的抗性。
番茄果实; 氢气; 富氢水; 灰霉菌; 抗病性
氢气 (H2) 是一种小分子气体,具有抗氧化、抗炎和抗过敏的作用[1-2],并能选择性地降低生物体内的羟基自由基 (·OH) 和过氧亚硝基 (ONOO-) 含量[3-4],常作为治疗性医疗气体用于临床。H2可以通过直接吸入、以富氢水(hydrogen-rich water,HRW)的形式口服摄入、以富氢水生理盐水注射以及氢浴[5]的形式作用于人体和动物模型,治疗包括帕金森病、糖尿病、神经损伤以及肾损伤等的多种疾病[6-8]。近年来的研究表明,H2能够作为一种新型的信号分子参与植物胁迫应答[9]。H2能够缓解盐胁迫[10],降低盐胁迫和百草枯造成的氧化损伤[11];具有抗氧化、延缓植物衰老的作用[12];能促使植物气孔关闭,增强植物耐旱能力[13];缓解金属离子造成的氧化损伤[14-15];诱导植物不定根的产生[16-17];参与植物激素调控的抗病虫害信号途径[18]。
番茄是研究果实采后生理与病理的一种经典模式材料[19]。番茄灰霉病是由灰霉菌(Botrytiscinerea)引起的,灰霉病发病后传播速度很快,能造成严重的烂果现象,是影响番茄产量和品质的主要病害之一[20-22]。本研究以采后番茄果实为试验材料,通过不同浓度HRW浸泡番茄果实,检测HRW对损伤接种番茄果实发病情况、病斑面积、多酚氧化酶(PPO)活性和一氧化氮(NO)含量的影响,研究H2对番茄抗灰霉菌的作用效果,旨在探索利用小分子气体提高采后番茄果实抗真菌病害的新型方式,对提高番茄自身抗性、保护生态环境、提高经济效益具有十分重要的现实意义。
1 材料和方法
1.1 材料
将番茄(Solanumlycopersicumvs.Messina) 播种于山东滨州番茄种植基地大棚中,标记花期。采摘绿熟期(花期为45 d)番茄果实立即运至实验室,挑选大小均匀、无病虫害和伤痕的完好果实,置于(25±1)℃、相对湿度90%~95%的环境中释放田间热,次日进行处理。
1.2 方法
1.2.1 HRW的制备 参考林玉婷[23]的方法,稍加改动。将H2以150 mL/min的流速通入含5 L蒸馏水的广口瓶中持续4 h,即为饱和HRW。气相色谱测定表明,饱和HRW中H2浓度为0.25 mmol/L,常温下该浓度能够保持12 h。之后立即用蒸馏水按不同体积比将HRW稀释至试验所需浓度。
1.2.2 番茄果实处理 参考Hu等[12]的方法,稍加改动。将番茄果实浸泡在3%次氯酸钠溶液中2 min进行表面消毒,清水洗净后自然晾干。共设5组处理:蒸馏水对照、25% HRW、50% HRW、75% HRW、100% HRW。用不同浓度HRW浸泡番茄30 min后,取出晾干。
接种前,用枪头在番茄果实赤道部位扎2个宽2 mm、深4 mm的孔;取在PDA培养基上25 ℃培养7 d的番茄灰霉菌,在无菌条件下用无菌水(含0.01% Tween-80)配制成1×106cfu/mL的孢子悬浮液;向每个孔中注入10 μL孢子悬浮液。接种后,将果实置于(25±1)℃、相对湿度90%~95%的环境中。分别于0、3、6、9 d进行取样,每个处理分别取30个番茄果实,环灰霉病斑切取1 cm 宽度未发病的果皮,并迅速切成小块,用液氮速冻后,保存于-80 ℃冰箱中。
1.2.3 指标测定 接种灰霉菌后0 d、3 d、6 d和9 d,各处理组随机选取10个番茄进行拍照,记录番茄果实发病情况。果实损伤病斑面积统计参考方中达[24]的方法,于接种灰霉菌后的3 d、6 d和9 d共3个时间点(发病明显、病斑直径适宜统计)统计番茄果实病斑直径,每个处理重复3次,每次统计10个果实,病斑面积计算公式:病斑面积(mm2)=3.14×(病斑直径/2)2。PPO活性的测定参照Zauberman等[25]的方法;组织内NO含量用一氧化氮试剂盒(南京建成生物工程研究所)测定。
2 结果与分析
2.1 不同浓度HRW处理对番茄果实发病情况和病斑面积的影响
对照组番茄果实在接种灰霉菌后3 d开始出现明显病症,9 d发病状况明显,发病果实接种处可见边缘明显的辐射形水浸状病斑。接种灰霉菌后9 d,25% HRW处理组与对照组番茄果实的发病情况相近,与对照组相比,100% HRW处理组番茄果实的发病情况更明显,而50%和75% HRW处理明显降低了损伤接种番茄果实的发病情况(图1A)。此外,75%和100% HRW处理组的番茄果实成熟较为缓慢,变红程度低于对照组,表明H2可能具有抗氧化、延缓果实衰老的作用。
从图1B可以看出,除100% HRW处理组接菌9 d番茄病斑面积较对照组高(为对照组的1.72倍)以外,25%、50%、75% HRW处理组病斑面积均较对照组降低,接菌9 d其病斑面积分别为对照组的84.4%、87.2%、77.9%。上述结果说明,HRW处理可在一定程度上增强番茄果实抗灰霉菌侵染的能力,综合发病情况,初步认为50%和75% HRW 2组处理对番茄果实的保护作用相对其他组更好,而100% HRW预处理则加重了病情。
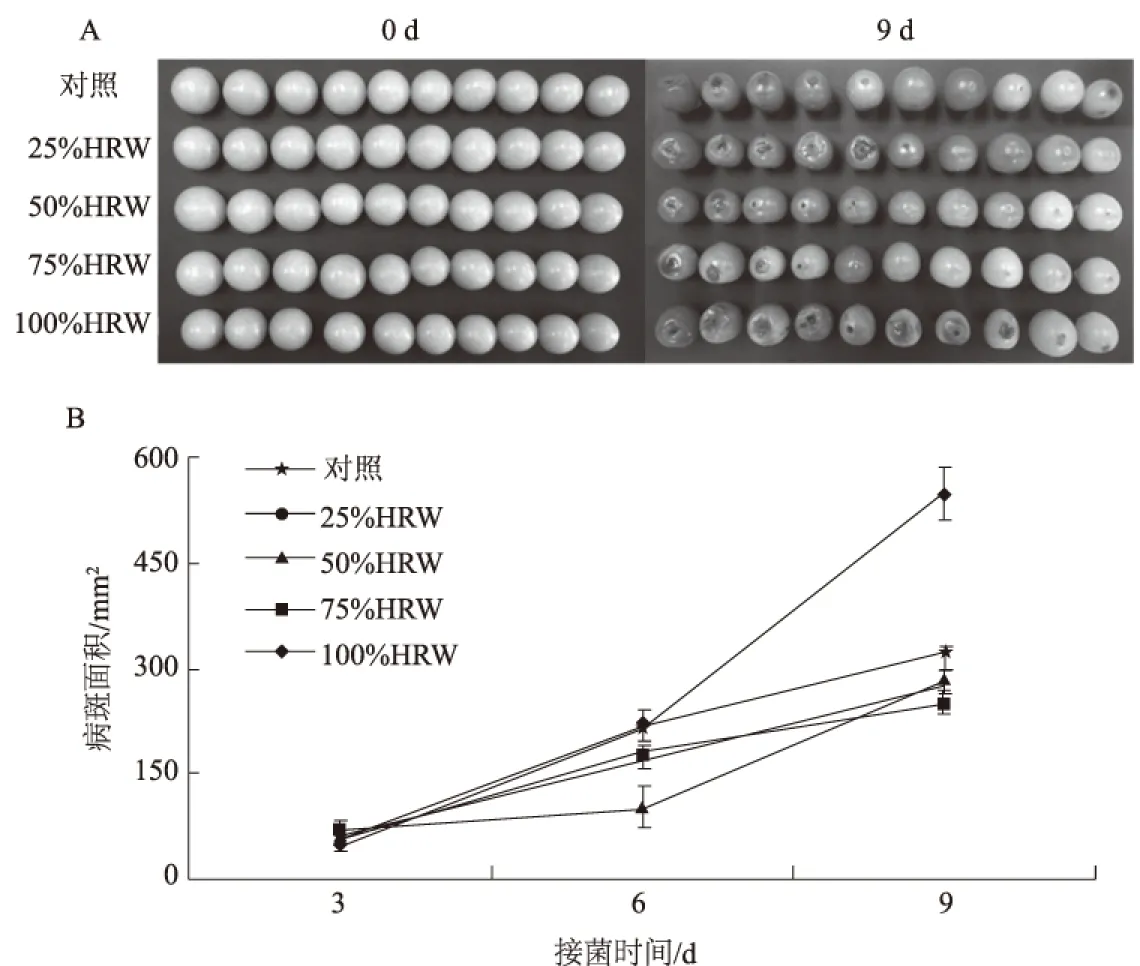
图1 不同浓度HRW处理对接种后番茄果实发病情况(A)和病斑面积(B)的影响
2.2 不同浓度HRW处理对番茄果实PPO活性的影响
PPO是与植物抗病性密切相关的酶,它在植物的防卫反应中起着重要作用[26]。从图2可以看出,HRW处理可以不同程度地提高接菌后番茄果实的PPO活性。25%、50%和75% 3个HRW处理组,随接菌时间延长PPO活性整体表现出先增高后降低的趋势。25% HRW处理组PPO活性仅在接菌后3 d高于对照组,是对照组的1.24倍,差异达到极显著水平(P<0.01),6 d和9 d均低于对照组。50%和75% HRW处理组番茄PPO活性在接菌后3 d和6 d均高于对照组,两组处理在接菌后3 d的PPO活性分别是对照组的1.19倍和1.59倍,其中,75% HRW处理组与对照组差异达到极显著水平(P<0.001);接菌后6 d的PPO活性分别是对照组的1.05倍和1.06倍,差异未达到显著水平;接菌后9 d则低于对照组。100% HRW处理组番茄PPO活性始终高于对照组,接菌后3 d、6 d和9 d分别是对照组的1.74倍、1.07倍和1.11倍,其中,接菌后3 d差异达到极显著水平(P<0.001),接菌后9 d差异达到显著水平(P<0.05)。
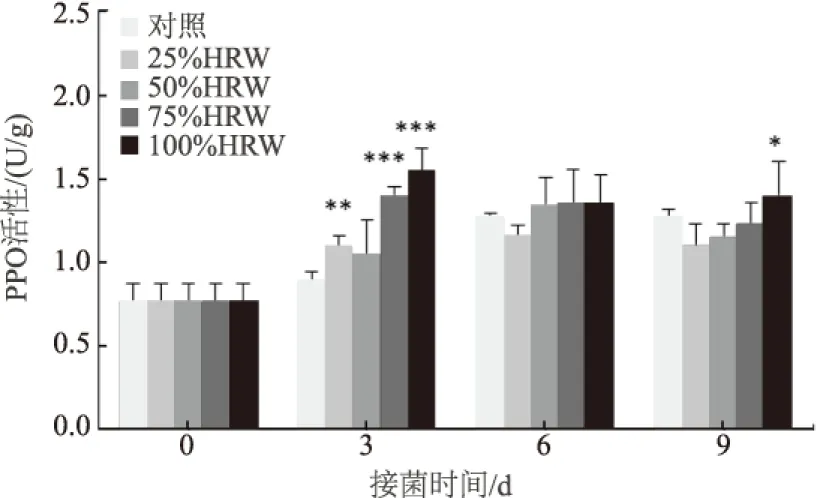
与对照组相比,*表示P<0.05;**表示P<0.01;***表示P<0.001。下同图2 不同浓度HRW处理对接种后番茄果实PPO活性的影响
2.3 不同浓度HRW处理对番茄果实内源NO含量的影响
NO在植物抗病防御反应和胁迫响应中具有至关重要的作用[27-28],能有效诱导采后番茄果实的抗病性[29]。对接种灰霉菌后的番茄果实进行NO含量测定,结果发现,HRW处理提高了番茄体内的NO含量,4个处理组NO含量在接菌后3 d、6 d和9 d均高于对照组(图3)。在接菌后3 d,25%和50% HRW处理组NO含量分别是对照组的2.24倍和2.56倍,25% HRW处理组与对照组差异达到极显著水平(P<0.01),50% HRW处理组与对照组差异更为明显(P<0.001);在接菌后6 d,25%、50%、75% HRW处理组NO含量分别是对照组的2.22、2.16、2.05倍,差异均达到显著水平(P<0.05);在接菌后9 d,25%、50%、75% HRW处理组NO含量分别是对照组的2.30、3.13、1.40倍,其中,25% HRW处理组与对照组差异达到了显著水平(P<0.05),50% HRW处理组与对照组差异达到了极显著水平(P<0.001);100% HRW处理组NO含量在接菌后3 d、6 d和9 d均高于对照组,但均未达到显著水平。以上结果表明,在接种灰霉菌后,50% HRW组番茄果实NO含量升高程度较其他处理组更明显。
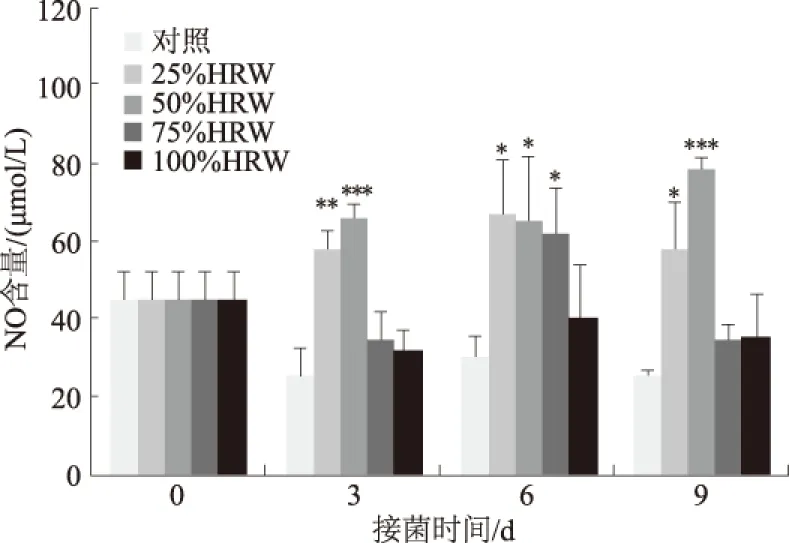
图3 不同浓度HRW处理对接种后番茄果实NO含量的影响
3 结论与讨论
H2作为一种重要的信号分子,参与调节植物的多种非生物胁迫反应[11,18,30],能诱导植物产生对非生物胁迫的抗性,如耐盐、抗百草枯、抗氧化胁迫、抗重金属等[15]。Zeng等[18]以水稻和绿豆种子为试验材料,通过不同浓度的HRW处理,证明H2作为抗氧化剂、种子萌发和植物胁迫反应中的信号分子等多种角色,参与高等植物水杨酸、茉莉酸和乙烯等激素调控的抗病虫害信号途径;H2能调控植物激素受体基因的转录并促使抗氧化基因表达量上调;植物能产生内源H2,其产量也受到茉莉酸和乙烯浓度的影响。
本研究以番茄果实为试验材料,以HRW浸泡番茄果实的方式提供外源H2,通过损伤接种灰霉菌引发番茄果实的灰霉病,研究H2在采后番茄果实抗灰霉菌中的作用。结果显示,25% HRW处理组与对照组发病程度相似,50% 和75% HRW处理明显降低了接种灰霉菌番茄果实的发病情况和病斑面积,而100% HRW处理则加重了病情。PPO参与植物体内酚类物质代谢,它能将植物的酚类物质氧化成毒性更强的醌类物质,毒杀病原菌并限制其扩散,起到抗病的作用[26]。因此,PPO常作为植物抗病的重要生理指标之一。Li等[31]研究发现,过表达PPO的转基因番茄具有更强的抵御病原菌侵染的能力。本研究发现,接菌后3 d和6 d,与对照组相比,50%和75% HRW处理不同程度地提高了番茄果实的PPO活性。郑鄢燕[22]发现,外源NO处理能增强番茄果实的抗病性。本研究发现,与对照组相比,25%和50% HRW处理在接菌后3 d、6 d和9 d可以不同程度地促进番茄果实内源NO含量增加,差异均达到显著水平,75% HRW处理组在接菌后6 d番茄果实内源NO含量也显著增加,总体上50% HRW处理组番茄果实NO含量升高程度较其他处理组更明显。综上所述,中等浓度的HRW处理(50%、75%)在一定程度上增强了番茄果实抗灰霉病侵染的能力,低浓度的HRW处理(25%)没有起到保护作用,而过高浓度的HRW处理(100%)不仅未提高番茄果实的抗病性,而且可能增加灰霉菌对番茄果实的伤害。
与施用农药进行植物病害防治相比,使用适当浓度的HRW处理植物提高其抗病能力是绿色环保、简单易行的。然而,还需要进一步深入研究H2如何参与植物抗病途径,明确H2作为信号分子在植物抗病途径中的作用机制。
[1] Ohsawa I,Ishikawa M,Takahashi K,etal.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J].Nature Medicine,2007,13(6):688-694.
[2] Hong Y,Chen S,Zhang J M.Hydrogen as a selective antioxidant:A review of clinical and experimental studies[J].Journal of International Medical Research,2010,38 (6):1893-1903.
[3] Nakao A,Toyoda Y,Sharma P,etal.Effectiveness of hydrogen rich water on antioxidant status of subjects with potential metabolic syndrome—An open label pilot study[J].Journal of Clinical Biochemistry and Nutrition,2010,46(2):140-149.
[4] Ohta S.Recent progress toward hydrogen medicine:Potential of molecular hydrogen for preventive and therapeutic applications[J].Current Pharmaceutical Design,2011,17(22):2241-2252.
[5] Shen M,Zhang H,Yu C,etal.A review of experimental studies of hydrogen as a new therapeutic agent in emergency and critical care medicine[J].Medical Gas Research,2014,4(1):1-8.
[6] Nagata K,Nakashima-Kamimura N,Mikami T,etal.Consumption of molecular hydrogen prevents the stress-induced impairments in hippocampus-dependent learning tasks during chronic physical restraint in mice[J].Neuropsychopharmacology,2009,34(2):501-508.
[7] Nakashima-Kamimura N,Mori T,Ohsawa I,etal.Molecular hydrogen alleviates nephrotoxicity induced by an anti-cancer drug cisplatin without compromising anti-tumor activity in mice[J].Cancer Chemotherapy and Pharmacology,2009,64(4):753-761.
[8] Fu G,Zhang L,Cui W,etal.Induction of heme oxygenase-1 with β-CD-hemin complex mitigates cadmium-induced oxidative damage in the roots ofMedicagosativa[J].Plant and Soil,2011,345(1/2):271-285.
[9] 刘方,刘勇波,李俊生,等.氢气在植物抗胁迫中的作用[J].植物生理学报,2015,51(2):141-152.
[10] Xu S,Zhu S,Jiang Y,etal.Hydrogen-rich water alleviates salt stress in rice during seed germination[J].Plant and Soil,2013,370(1/2):47-57.
[11] Xie Y,Mao Y,Lai D,etal.H2enhancesArabidopsissalt tolerance by manipulating ZAT10/12-mediated antioxidant defence and controlling sodium exclusion[J].PLoS One,2012,7(11):e49800.
[12] Hu H,Li P,Wang Y,etal.Hydrogen-rich water delays postharvest ripening and senescence of kiwifruit[J].Food Chemistry,2014,156(11):100-109.
[13] Xie Y,Mao Y,Zhang W,etal.Reactive oxygen species-dependent nitric oxide production contributes to hydrogen-promoted stomatal closure inArabidopsis[J].Plant Physiology,2014,165(2):759-773.
[14] Chen M,Cui W,Zhu K,etal.Hydrogen-rich water alleviates aluminum-induced inhibition of root elongation in alfalfa via decreasing nitric oxide production[J].Journal of Hazardous Materials,2013,267(1):40-47.
[15] Cui W,Fang P,Zhu K,etal.Hydrogen-rich water confers plant tolerance to mercury toxicity in alfalfa seedlings[J].Ecotoxicology and Environmental Safety,2014,105:103-111.
[16] Lin Y,Zhang W,Qi F,etal.Hydrogen-rich water regulates cucumber adventitious root development in a heme oxygenase-1/carbon monoxide-dependent manner[J].Journal of Plant Physiology,2014,171(2):1-8.
[17] 朱永超.一氧化氮参与氢气诱导黄瓜和万寿菊不定根的发生[D].兰州:甘肃农业大学,2015.
[18] Zeng J,Zhang M,Sun X.Molecular hydrogen is involved in phytohormone signaling and stress responses in plants[J].PLoS One,2013,8(8):e71038.
[19] 生吉萍,罗云波,申琳.转反义 ACC 合成酶基因番茄与普通番茄果实植物内源激素含量的变化[J].中国农业科学,2000,33(3):43-48.
[20] 赵统敏,余文贵,赵丽萍,等.番茄抗灰霉病育种研究进展[J].江苏农业学报,2011,27(5):1141-1147.
[21] 樊平声,沙国栋,陈益芹,等.番茄灰霉病的防治研究进展[J].江苏农业科学,2012,40(4):133-135.
[22] 郑鄢燕.SlMPK1/2/3在外源NO诱导的采后番茄果实抗病途径中的作用[D].北京:中国农业大学,2015.
[23] 林玉婷.HO-1/CO信号系统参与H2S、β-CD-hemin和H2诱导的黄瓜不定根发生[D].南京:南京农业大学,2012.
[24] 方中达.植病研究方法[M].3版.北京:北京农业出版社,1998.
[25] Zauberman G,Ronen R,Akerman M.Postharvest retention of the red color of litchi fruit pericarp[J].Scientia Horticulturae,1991,47(1):89-97.
[26] Mohammadi M,Kazemi H.Changes in peroxidase and polyphenol oxidase activities in susceptible and resistant wheat heads inoculated withFusariumgraminearum,and induced resistance[J].Plant Science,2002,162(4):491-498.
[27] Camp W V,Montagu M V,Inzé D.H2O2and NO:Redox signals in disease resistance[J].Trends in Plant Science,1998,3(3):330-334.
[28] Neill S,Desikan R,Hancock J.Hydrogen peroxide signalling[J].Current Opinion in Plant Biology,2002,5 (5):388-395.
[29] Fan B,Shen L,Liu K,etal.Interaction between nitric oxide and hydrogen peroxide in postharvest tomato resistance response toRhizopusnigricans[J].Journal of the Science of Food & Agriculture,2008,88(7):1238-1244.
[30] Jin Q,Zhu K,Cui W,etal.Hydrogen gas acts as a novel bioactive molecule in enhancing plant tolerance to paraquat-induced oxidative stress via the modulation of heme oxygenase-1 signalling system[J].Human & Experimental Toxicology,2013,36(5):956-969.
[31] Li L,Steffens J C.Overexpression of polyphenol oxidase in transgenic tomato plants results in enhanced bacterial disease resistance[J].Planta,2002,215(2):239-247.
Effects of Hydrogen-rich Water Treatment on Defense Responses of Postharvest Tomato Fruit to Botrytis cinerea
LU Hui,WU Bingqian*,WANG Yifan,LIU Nini,MENG Fanhong,HU Zhenyu,ZHAO Ruirui,ZHAO Heng**
(Department of Life and Environmental Sciences,Minzu University of China,Beijing 100081,China)
In this study,we used postharvest tomato fruit as experimental materials,which were soaked in different concentrations of hydrogen-rich water(HRW) and then inoculated withBotrytiscinerea,to study the protective effect of HRW in tomato resistance toBotrytiscinerea.Compared with the control group treated by distilled water,50% and 75% HRW treatments reduced the disease injury of inoculated tomato fruit,and the lesion areas at 9 d after inoculation were 87.2% and 77.9% of the control group,respectively.HRW treatment could increase the polyphenol oxidase(PPO) activity in different degree.The PPO activity of 75% HRW treatment group was significantly different from the control group after 3 d (P< 0.001),which was 1.59 times of the control group.The nitric oxide(NO) content of tomato fruit increased after HRW treatment.The NO content of 50% HRW treatment group was significantly different from the control group after 3 d and 9 d (P< 0.001),2.56 and 3.13 times of the control group,respectively.This study indicated that hydrogen might be involved in plant stress responses as a signaling molecule,and enhanced the defense responses of tomato fruit toBotrytiscinerea.
tomato fruit; hydrogen; hydrogen-rich water;Botrytiscinerea; disease resistance
2016-10-21
中共中央组织部“千人计划”项目;中央民族大学学科建设项目(YDZXXK201618)
卢 慧(1985-),女,湖南长沙人,在读博士研究生,研究方向:植物免疫学。E-mail:susanluhui@163.com 伍冰倩(1994-),女,湖南衡阳人,在读硕士研究生,研究方向:免疫学。E-mail:13810471803@163.com。*共同第一作者
**通讯作者:赵 珩(1970-),女,安徽合肥人,教授,博士,主要从事免疫学研究。E-mail:hengzhao2000@gmail.com
S436.412.1
A
1004-3268(2017)02-0064-05
